FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO

Pergunte a um médico sobre a prescrição de FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO

Como usar FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO
Introdução
RESUMO DAS CARACTERÍSTICAS DO PRODUTO: INFORMAÇÃO PARA O UTILIZADOR
FibCLOT 1,5g
Pó e solvente para solução injetável e para perfusão
fibrinogénio humano
Leia todo o folheto informativo atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este folheto informativo, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de efeitos adversos que não aparecem neste folheto informativo. Ver secção 4.
Conteúdo do folheto informativo
- O que é FibCLOT e para que é utilizado
- O que precisa saber antes de começar a usar FibCLOT
- Como usar FibCLOT
- Possíveis efeitos adversos
- Conservação de FibCLOT
- Conteúdo do envase e informações adicionais
1. O que é FibCLOT e para que é utilizado
O que é FibCLOT
É um medicamento que pertence ao grupo dos anti-hemorrágicos. O princípio ativo é o fibrinogénio humano, uma proteína presente de forma natural no organismo. A função desta proteína é assegurar que o sangue coagule normalmente e evitar que o sangramento dure demasiado tempo.
Para que é utilizado FibCLOT
É utilizado em todos os grupos etários para compensar a falta de fibrinogénio humano e, deste modo, tratar o sangramento (hemorragias) nos pacientes com deficiência de fibrinogénio congénita.
A deficiência de fibrinogénio congénita é uma doença hereditária caracterizada por uma quantidade inferior à normal ou a ausência de uma proteína chamada fibrinogénio. Esta falta pode provocar sangramentos prolongados.
2. O que precisa saber antes de começar a usar FibCLOT
Não use FibCLOT
Se é alérgico ao princípio ativo (fibrinogénio humano) ou a algum dos outros componentes deste medicamento (incluídos na secção 6. «Conteúdo do envase e informações adicionais»).
Informa o seu médico se é alérgico a algum medicamento.
Advertências e precauções:
Consulte o seu médico, farmacêutico ou enfermeiro antes de começar a usar FibCLOT.
Trazabilidade
Com o objetivo de melhorar a trazabilidade dos medicamentos biológicos, o nome e o número do lote do medicamento administrado devem estar claramente registados.
Risco de coágulos sanguíneos
Com doses elevadas ou administrações repetidas, este medicamento pode aumentar o risco de coágulos nos vasos sanguíneos.
Por isso, o seu médico deve sopesar os benefícios deste medicamento face ao risco de coágulos sanguíneos, especialmente:
- Se teve um ataque cardíaco (antecedentes de cardiopatia coronária ou infarto do miocárdio).
- Se tem uma doença hepática.
- Se acaba de se submeter a uma intervenção cirúrgica.
- Se vai se submeter em breve a uma intervenção cirúrgica.
- Em recém-nascidos (neonatos).
- Se tem mais probabilidades do que o normal de sofrer coágulos sanguíneos.
O seu médico pode solicitar-lhe exames adicionais para vigiar esse risco.
Risco de alergias
O seu médico informá-lo-á sobre os sinais de advertência de uma reação alérgica ou de uma reação alérgica grave (reação anafilática) (ver secção 4. «Possíveis efeitos adversos»). Se aparecer algum desses efeitos, deve interromper imediatamente a administração deste medicamento.
Segurança viral
Este medicamento é elaborado a partir de plasma humano (a parte líquida do sangue).
Quando se elaboram medicamentos de sangue ou plasma humanos, são adoptadas certas medidas para impedir o contágio de infecções nos pacientes. Algumas dessas medidas são:
- selecção cuidadosa dos doadores de sangue e plasma, para garantir que se descartam aqueles com risco de ser portadores de infecções,
- verificação de cada doação e misturas de plasma para detectar sinais de infecções víricas,
- inclusão de etapas no processamento do sangue ou do plasma que podem inativar ou eliminar os vírus.
Apesar dessas medidas, quando se administram medicamentos derivados do sangue ou do plasma humanos, não pode ser descartada por completo a possibilidade de contágio de uma infecção. Isso também se aplica a vírus desconhecidos ou emergentes e outros tipos de infecções.
As medidas adoptadas são consideradas eficazes para os vírus encapsulados, como o vírus da imunodeficiência humana (VIH ou vírus da SIDA), o vírus da hepatite B e o vírus da hepatite C e para o vírus não encapsulado da hepatite A.
As medidas adoptadas podem ter um valor limitado face aos vírus não encapsulados como o parvovirus B19. A infecção por parvovirus B19 pode ser grave nas mulheres grávidas (infecção do feto) e nas pessoas com o sistema imunológico debilitado ou com alguns tipos de anemia (por exemplo, doença de células falciformes ou anemia hemolítica).
Se recebe de forma periódica/repetida produtos derivados do plasma humano, o seu médico pode recomendar-lhe que considere vacinar-se contra a hepatite A e B.
Risco imunológico
Em caso de terapia substitutiva com factores de coagulação no contexto de outras deficiências congénitas, foram observadas reações imunológicas, mas não se dispõe de dados sobre o fibrinogénio.
Crianças e adolescentes
As advertências e precauções anteriormente indicadas são válidas para as crianças e adolescentes.
Uso de FibCLOT com outros medicamentos
Informa o seu médico ou farmacêutico se está a utilizar, utilizou recentemente ou pode ter que utilizar qualquer outro medicamento, mesmo os adquiridos sem receita.
Não foram observadas interações entre este tratamento e outros medicamentos até à data. No entanto, não deve misturar-se com outros produtos e/ou medicamentos.
Gravidez e amamentação
- Se está grávida ou em período de amamentação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico antes de utilizar este medicamento. Este medicamento só deve ser utilizado durante a gravidez e a amamentação por recomendação do médico.
- Consulte o seu médico se descobre que está grávida durante o tratamento, pois é o único que pode determinar se precisa continuar com ele.
Condução e uso de máquinas
A influência deste medicamento sobre a capacidade para conduzir e utilizar máquinas é nula.
FibCLOT contém sódio.
Este medicamento contém até 3 mmol (ou 69 mg) de sódio (o principal componente do sal de cozinha ou de mesa) por frasco. Esta quantidade é equivalente a 3,45 % da ingestão máxima diária recomendada de sódio para um adulto.
Se está a seguir uma dieta baixa em sal, deve tê-lo em conta.
3. Como usar FibCLOT
O tratamento deve ser iniciado sob a supervisão de um médico com experiência no tratamento da deficiência de fibrinogénio congénita.
Dose
O seu médico será o que determinará a dose e a frequência adequadas, que dependerão dos seguintes factores:
- o seu peso corporal,
- a gravidade do seu distúrbio,
- a localização e alcance do sangramento, ou a natureza da sua intervenção cirúrgica,
- o seu estado de saúde.
O seu médico recomendar-lhe-á que se realize análises de sangue durante o tratamento para comprovar a quantidade de fibrinogénio que tem no organismo.
Dependendo do resultado das análises, o seu médico pode decidir adaptar a dose e a frequência das injeções.
Frequência da administração
O seu médico determinará com que frequência devem ser administradas as injeções.
Além disso, adaptará o número de injeções dependendo da intensidade do sangramento e da eficácia do tratamento.
Na secção reservada aos profissionais de saúde no final deste folheto informativo, é incluída informação sobre a frequência e a duração do tratamento em diversas situações.
Forma de administração:
Este medicamento deve ser injetado numa veia. É obrigatório o uso de um equipamento de perfusão com filtro de 15 µm, como o fornecido com o envase.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico, farmacêutico ou enfermeiro.
Se usar mais FibCLOT do que deve
Para evitar o risco de sobredose, o médico realizar-lhe-á análises de sangue periódicas para comprovar a quantidade de fibrinogénio que tem no organismo.
Em caso de sobredose, não pode ser descartado o risco de formação anormal de coágulos no sangue.
4. Possíveis efeitos adversos
Como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Os efeitos adversos mais graves são:
- Reações alérgicas:como com qualquer produto proteico intravenoso, podem produzir-se reações alérgicas. Em alguns casos, estas reações agravaram-se até se converterem numa reação alérgica grave, por vezes com um descenso acentuado da pressão arterial (choque anafiláctico).
Os sinais de advertência das reações alérgicas são:
- sensação de ardor e formigueiro no local de injeção,
- formigueiro,
- vermelhidão, picazón e erupção,
- urticária,
- inflamação cutânea,
- palidez,
- inchação da face ou da garganta,
- tosse,
- sibilação (semelhante à do tipo asmático),
- opressão no peito,
- frequência cardíaca rápida,
- pressão arterial baixa,
- cansaço extremo (letargia),
- inquietude,
- arrepio,
- sensação de doença (náuseas), vómitos,
Se produzir algum desses efeitos, contacte imediatamente um médico, que suspenderá o tratamento com este medicamento e/ouiniciará o tratamento oportuno dependendo do tipo e da intensidade da reação. |
- Coágulos sanguíneos: podem formar-se coágulos sanguíneos no torrente circulatório. Estes podem produzir:
- um ataque cardíaco, cujos sinais de advertência são dor repentina no peito ou respiração difícil;
- um acidente vascular cerebral, cujos sinais de advertência são aparecimento repentina de fraqueza muscular, perda das sensações e/ou do equilíbrio, diminuição do estado de alerta ou dificuldade para falar;
- uma doença grave chamada embolia pulmonar (coágulo sanguíneo que obstrui uma artéria dos pulmões), cujos sinais de advertência são dor no peito, dificuldade para respirar ou tosse com sangue;
- um coágulo numa veia (trombose venosa), cujos sinais de advertência são vermelhidão, sensação de calor, dor, dor à palpação ou inchação numa ou nas duas pernas.
Se produzir algum desses efeitos, contacte imediatamente um médico, que suspenderá o tratamento com este medicamento e/ouiniciará o tratamento oportuno dependendo do tipo e da intensidade da reação. |
Os seguintes efeitos adversos são frequentes(podem afetar até 1 em cada 10 perfusões):
- cefaleia.
Os seguintes efeitos adversos são pouco frequentes(podem afetar até 1 em cada 100 perfusões):
- reação alérgica (como choque anafiláctico, palidez, vómitos, tosse, pressão arterial baixa, arrepio, habão urticarial [urticária]; ver também a secção «Reações alérgicas»),
- tontura,
- vómitos (associados com cefaleia)
- zumbido nos ouvidos,
- distúrbios da circulação sanguínea (trombose venosa profunda, flebotrombose superficial),
- dificuldade para respirar (asma),
- erupção cutânea, vermelhidão da pele, irritação da pele, suores noturnos,
- sensação de calor.
Crianças e adolescentes
A frequência, o tipo e a gravidade dos efeitos adversos são semelhantes nos pacientes pediátricos (desde o nascimento até aos 17 anos incluídos) e adultos, salvo no que respeita às reações de tipo alérgico ou anafiláctico, que se produziram com mais frequência na população pediátrica.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico, farmacêutico ou enfermeiro, mesmo que se trate de possíveis efeitos adversos que não aparecem neste folheto informativo. Também pode comunicá-los directamente através do Sistema Português de Farmacovigilância de Medicamentos de Uso Humano: www.infarmed.pt. Mediante a comunicação de efeitos adversos, pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de FibCLOT
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na etiqueta e na caixa. A data de validade é o último dia do mês que se indica.
Não conserve a uma temperatura superior a 25 °C. Não congele.
Conserva o frasco no embalagem exterior para protegê-lo da luz e da humidade.
O produto deve ser utilizado imediatamente após a reconstituição. Não conserve o produto reconstituído.
Não utilize este medicamento se a solução reconstituída estiver turva ou contiver sedimento.
Os medicamentos não devem ser jogados fora pelo esgoto nem para o lixo. Pergunte ao seu farmacêutico como se livrar dos envases e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do envase e informação adicional
Composição de FibCLOT
O princípio ativo é fibrinogênio humano (1,5 g por frasco). Após a reconstituição com 100 mL de água para preparações injetáveis, FibCLOT contém 15 mg/mL de fibrinogênio humano.
Os demais componentes são cloreto de arginina, isoleucina, cloreto de lisina, glicina, citrato de sódio diidratado e solvente (água para preparações injetáveis).
Aspecto do produto e conteúdo do envase
Este medicamento apresenta-se sob a forma de pó acompanhado de solvente para solução para preparações injetáveis em frascos de vidro, um equipamento de transferência e um equipamento de perfusão com um filtro de 15 µm.
A solução reconstituída deve ser praticamente incolor, ligeiramente opalescente (deve ter um brilho perlado).
Título da autorização de comercialização:
Laboratoire français du Fractionnement et des Biotechnologies
Tour W – 102 Boieldieu 19ème Étage, 92800 Puteaux, FRANÇA
Tel.: +33(0) 1 69 82 70 10
Fax: +33(0) 1 69 82 19 03
Responsável pela fabricação:
LFB BIOMEDICAMENTS
59 rue de Trévise, 59000 Lille, FRANÇA
Podem solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
LFB BIOTERAPIAS HISPANIA
C/ Diego de León 47
28006 Madrid
(ESPANHA)
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Alemanha, Áustria, Espanha, Grécia, Reino Unido: FibCLOT
Dinamarca, Finlândia, Hungria, Luxemburgo, Noruega, Países Baixos, Suécia: FibclotBélgica: Fibclot 1,5 g, pó e solvente para solução injetável/para perfusão
Itália: Fibriclotte
Data da última revisão deste prospecto: 06/2024
---------------------------------------------------------------------------------------------------------------------------
Esta informação está destinada apenas a profissionais do setor sanitário:
O tratamento deve ser iniciado sob a supervisão de um médico com experiência no tratamento dos distúrbios da coagulação.
Posologia
A dose e a duração da terapia substitutiva dependem da gravidade do distúrbio, da localização e da magnitude da hemorragia, bem como do estado clínico do paciente.
Deve ser determinada a concentração de fibrinogênio (funcional) para calcular a dose individual; além disso, a quantidade e a frequência da administração devem ser calculadas para cada paciente concreto mediante a determinação periódica da concentração de fibrinogênio no plasma e a supervisão contínua do estado clínico do paciente e das demais terapias substitutivas empregadas.
A concentração normal de fibrinogênio no plasma oscila entre 1,5 e 4,5 g/L. Na hipo ou afibrinogenemia congênita, a concentração crítica de fibrinogênio no plasma abaixo da qual podem ocorrer hemorragias é aproximadamente de entre 0,5 e 1,0 g/L.
Em caso de intervenção cirúrgica maior, é essencial supervisionar a terapia de substituição por meio de ensaios de coagulação.
Tratamento das hemorragias e profilaxia perioperatória em pacientes com hipo ou afibrinogenemia congênita e tendência ao sangramento conhecida.
Para o tratamento dos episódios hemorrágicos não cirúrgicos, recomenda-se aumentar a concentração de fibrinogênio para 1 g/L e manter essa concentração até que a hemostasia esteja controlada, e acima de 0,5 g/L até que a cicatrização tenha finalizado.
Para evitar o sangramento excessivo durante os procedimentos cirúrgicos, recomenda-se um tratamento profilático para aumentar a concentração de fibrinogênio para 1 g/L e manter essa concentração até que a hemostasia esteja controlada, e acima de 0,5 g/L até que a cicatrização tenha finalizado.
Em caso de procedimento cirúrgico ou tratamento de uma hemorragia não cirúrgica, a dose deve ser calculada do seguinte modo:
Dose (g) = [concentração desejada (g/L) - concentração basal (g/L)] x 1/recuperação (g/L) (g/kg) x peso corporal (kg),
O «ratio 1/recuperação» está definido pela recuperação* do paciente (ver seção 5.2 da ficha técnica), ou se a recuperação for desconhecida:
- 0,053 (g/kg)/(g/L) para crianças e adolescentes <40 kg de peso corporal
- 0,043 (g/kg)/(g/L) para adultos e adolescentes ≥40 kg de peso corporal.
- Exemplo para a recuperação do paciente e o cálculo da dose
Para um paciente de 60 kg com uma concentração basal de fibrinogênio indetectável e um aumento de fibrinogênio para 1,20 g/L 1 hora após a perfusão de 0,060 g por kg de FibCLOT:
- Cálculo da recuperação do paciente:
1,20 (g/L) / 0,060 (g/kg) = 20,0 (g/L)/(g/kg)
- Cálculo da dose para um aumento para 1,0 g/L:
1,0 g/L x 1 / 20,0 (g/L)/(g/kg) [ou 0,050 (g/kg)/(g/L)]x 60 kg = 3 g
Em caso de produzir-se uma situação de urgência em que se desconheça a concentração basal de fibrinogênio, a dose inicial recomendada é de 0,05 g por kg de peso corporal administrada por via intravenosa em adultos e adolescentes ≥40 kg de peso corporal, e de 0,06 g/kg de peso corporal nos pacientes pediátricos < 40 kg de peso corporal.
A posologia posterior (dose e frequência das injeções) deve ser adaptada em função do estado clínico e dos resultados analíticos do paciente.
A meia-vida biológica do fibrinogênio é de entre 3 e 4 dias. Portanto, se não existir consumo, não costuma ser necessário o tratamento repetido com fibrinogênio humano. Tendo em conta a acumulação que se produz com a administração repetida com fins profiláticos, a dose e a frequência devem ser determinadas em função dos objetivos terapêuticos do médico para cada paciente concreto.
População pediátrica
A recuperação e a meia-vida em crianças e adolescentes ≥40 kg de peso corporal são inferiores às dos adultos e adolescentes ≥40 kg de peso corporal (ver seção 5.2 da ficha técnica). Portanto, devem ser usadas recuperações adaptadas para calcular a dose de FibCLOT nos grupos de peso corporal respectivos quando não se conheça a recuperação individual do paciente. Cabe supor que um peso corporal de < 40 kg cubra o intervalo de idade desde o nascimento até os 12 anos de idade aproximadamente. A posologia (dose e frequência das injeções) deve ser adaptada segundo a resposta clínica individual do paciente.
Reconstituição:
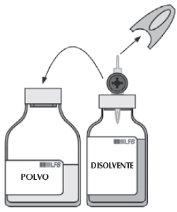
Siga as diretrizes vigentes para procedimentos assépticos.
| Em caso necessário, aqueça os dois frascos (pó e solvente) até que atinjam a temperatura ambiente. |
| Retire a cápsula protetora do frasco de solvente e a do frasco de pó. Desinfete a superfície de ambos os tampões. |
| Retire a capa protetora translúcida do equipamento de transferência e, com um movimento giratório, introduza completamente o punção que fica à vista no centro do tampão do frasco de solvente. |
| Retire a segunda capa protetora gris do outro extremo do equipamento de transferência. Gire o frasco de solvente e introduza rapidamente o extremo livre do punção no centro do tampão do frasco de pó para permitir que o solvente chegue até o pó. Certifique-se de que o punção permaneça submerso em todo momento no solvente, para evitar que o vácuo desapareça antes do tempo. |
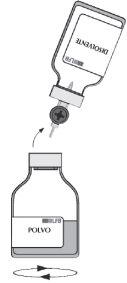
| Durante a transferência, realize um movimento giratório horizontal para que o jato de solvente se distribua por toda a superfície do pó e a parede do frasco. Certifique-se de que se transfere todo o solvente. O vácuo é eliminado automaticamente ao final do procedimento de transferência pelo ar estéril que atravessa o respiradouro do equipamento de transferência. |
| Retire o frasco vazio (solvente) com o equipamento de transferência. Para evitar que se forme espuma, agite suavemente durante alguns minutos, com um movimento rotatório, até que o pó esteja completamente dissolvido. |
Antes de administrar o produto reconstituído, deve ser examinado visualmente para verificar que não contenha partículas. A solução reconstituída deve ser praticamente incolor e ligeiramente opalescente. Não utilize as soluções turvas ou com sedimentos.
Administração:
FibCLOT deve ser administrado unicamente por via intravenosa, como dose única, imediatamente após a reconstituição e a uma velocidade que não supere os 4 mL/min.
É obrigatório o uso de um equipamento de perfusão com filtro de 15 µm, como o fornecido com o envase.
A eliminação do medicamento não utilizado e de todos os materiais que tenham estado em contato com ele será realizada de acordo com a normativa local.
Este medicamento não deve ser misturado com outros e deve ser administrado com um catéter de injeção/perfusão diferente.
- País de registo
- Disponibilidade em farmáciasProblema de disponibilidade reportado
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃOForma farmacêutica: INJETÁVEL, 1 gSubstância ativa: fibrinogen, humanFabricante: Octapharma S.A.Requer receita médicaForma farmacêutica: INJETÁVEL, 1 g (20 mg/mL)Substância ativa: fibrinogen, humanFabricante: Csl Behring GmbhRequer receita médicaForma farmacêutica: INJETÁVEL, 1.000 UISubstância ativa: coagulation factor VIIIFabricante: Takeda Manufacturing Austria AgRequer receita médica
Alternativas a FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO em Польща
Alternativa a FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO em Україна
Médicos online para FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de FIBCLOT 1,5 g PÓ E SOLVENTE PARA SOLUÇÃO INJETÁVEL E PARA PERFUSÃO – sujeita a avaliação médica e regras locais.