
Riastap

Pergunte a um médico sobre a prescrição de Riastap

Como usar Riastap
FOLHETO INFORMATIVO: INFORMAÇÕES PARA O DOENTE
Riastap, 1 g
Pó de reconstituição para solução injectável/para infusão.
Fibrinogénio humano
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer possível efeito não desejado não mencionado no folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é Riastap e para que é utilizado
- 2. Informações importantes antes de tomar Riastap
- 3. Como tomar Riastap
- 4. Efeitos não desejados
- 5. Como conservar Riastap
- 6. Conteúdo da embalagem e outras informações
1. O que é Riastap e para que é utilizado
O que é Riastap?
Riastap contém fibrinogénio humano, que é uma proteína importante para a coagulação do sangue
(coagulação). A falta de fibrinogénio significa que o sangue não coagula tão rapidamente como deve, o
que causa uma maior tendência para sangrar. A substituição do fibrinogénio humano com o medicamento
Riastap corrige os mecanismos de coagulação.
Para que é utilizado Riastap?
Riastap é utilizado no tratamento de sangramentos em doentes com falta congénita de fibrinogénio
(hipo- ou afibrinogenemia) com tendência para sangrar.
2. Informações importantes antes de tomar Riastap
As informações fornecidas nesta secção devem ser consideradas pelo médico antes de administrar
o medicamento Riastap.
Quando não tomar o medicamento Riastap:
- se o doente tiver alergia ao fibrinogénio humano ou a qualquer outro componente deste medicamento (listados no ponto 6.).
Em caso de alergia a qualquer medicamento ou alimentos, deve informar o médico.
Precauções e advertências:
- se ocorreram reacções alérgicas ao Riastap no passado. Neste caso, deve tomar medicamentos antihistamínicos e corticosteroides, se forem prescritos pelo médico.
- quando ocorrerem reacções alérgicas ou reacções do tipo anafiláctico (reação alérgica grave que causa dificuldades respiratórias ou tonturas). Administração
Riastap deve ser interrompido imediatamente (por exemplo, parando a injeção).
- devido ao risco aumentado de formação de coágulos sanguíneos nos vasos sanguíneos (trombose), em particular:
- em caso de administração de uma dose elevada ou de doses repetidas
- quando ocorreu doença cardíaca (doença coronária ou ataque cardíaco no histórico)
- em caso de doença hepática
- imediatamente após uma operação cirúrgica (doentes pós-operatórios)
- próximo a uma operação cirúrgica (doentes pré-operatórios)
- em recém-nascidos (recém-nascidos)
- se houver uma tendência aumentada para formar coágulos sanguíneos (doentes com risco de distúrbios tromboembólicos ou coagulação intravascular disseminada)
O médico deve considerar a relação entre os benefícios da terapia com Riastap e o risco associado
às complicações acima.
Segurança viral
No caso de produtos medicinais obtidos a partir de sangue ou plasma humano,
são tomadas medidas para prevenir infecções transmitidas aos doentes.
Estas incluem:
- selecção rigorosa dos doadores de sangue e plasma para excluir pessoas infectadas e
- testes de doações e pools de plasma para detectar a presença de vírus / infecções.
Os fabricantes destes produtos também incluem etapas no processo de tratamento do sangue ou plasma
que podem inativar ou eliminar vírus. No entanto, não é possível excluir completamente a possibilidade
de transmissão de agentes infecciosos durante a administração de produtos medicinais obtidos a partir de
sangue ou plasma humano. Isso inclui vírus desconhecidos e recém-descobertos, bem como outros tipos de
infecções.
Estes procedimentos são considerados eficazes contra vírus envelopados, como o vírus da imunodeficiência
humana (HIV, vírus que causa a AIDS), vírus da hepatite B e C (inflamação do fígado) e contra vírus não
envelopados, como o vírus da hepatite A (inflamação do fígado) e parvovirus B19.
O médico pode recomendar considerar a vacinação contra a hepatite A e B em caso de administração
regular/repetida de produtos obtidos a partir de plasma humano.
Recomenda-se que o médico registe a data de administração do medicamento, o número de série e o volume
injetado.
Riastap e outros medicamentos
- Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar.
- O medicamento Riastap não deve ser misturado com outros produtos medicinais, com exceção dos casos descritos na secção "Informações destinadas apenas ao pessoal médico/ Reconstituição".
Gravidez e amamentação
- Se a paciente estiver grávida ou a amamentar, suspeitar que possa estar grávida ou planeie ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
- Durante a gravidez ou amamentação, o medicamento Riastap deve ser administrado apenas em caso de necessidade clara.
Condução de veículos e utilização de máquinas
Riastap não tem influência ou tem influência insignificante na capacidade de conduzir veículos e utilizar máquinas.
Informações importantes sobre alguns componentes de Riastap
Riastap contém até 164 mg (7,1 mmol) de sódio por frasco. Isso corresponde a 11,5 mg (0,5 mmol) de sódio
por kg de peso corporal do doente, se a dose inicial recomendada de 70 mg/kg de peso corporal for administrada. Deve ser considerado durante a administração a doentes com dieta controlada de sódio.
3. Como tomar Riastap
A terapia deve ser iniciada e supervisionada por um médico experiente no tratamento desta
doença.
Dosagem
A quantidade necessária de fibrinogénio humano e o tempo de tratamento dependem de:
- gravidade da doença
- localização e intensidade do sangramento
- estado clínico do doente. Uso de uma dose maior do que a recomendada de RiastapO médico deve verificar regularmente o estado de coagulação do sangue durante a terapia. Em caso de sobredosagem, o risco de complicações tromboembólicas é aumentado.
Método de administração
Em caso de dúvidas sobre a utilização deste produto, deve consultar o médico ou farmacêutico (ver secção "Informações destinadas apenas ao pessoal médico」).
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Deve contactar imediatamente o médico:
- em caso de ocorrência de qualquer efeito não desejado
- em caso de ocorrência de efeitos não desejados não mencionados neste folheto.
As seguintes reacções não desejadas foram observadas muito frequentemente(podem ocorrer em mais de 1
em 10 pessoas):
- Aumento da temperatura corporal
As seguintes reacções não desejadas foram observadas menos frequentemente(em menos de 1 em 100 pessoas):
- Reacção alérgica súbita (como rubor, erupção cutânea em toda a superfície do corpo, queda da pressão arterial, dificuldades respiratórias).
As seguintes reacções não desejadas foram observadas frequentemente(em menos de 1 em 10 pessoas, embora estes incidentes ocorram mais frequentemente em doentes que não recebem fibrinogénio):
- Risco aumentado de formação de coágulos sanguíneos (ver secção 2. 」Precauções e advertências」).
Notificação de efeitos não desejados
Se ocorrerem qualquer efeitos não desejados, incluindo qualquer possível efeito não desejado não mencionado no folheto, deve informar o médico ou farmacêutico. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Produtos Medicinais da Agência Reguladora de Produtos Medicinais, Dispositivos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Warszawa
tel.: +48 22 49 21 301
fax.: +48 22 49 21 309
Site da Internet: ://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
Graças à notificação de efeitos não desejados, é possível reunir mais informações sobre a segurança do medicamento.
5. Como conservar Riastap
- Manter o medicamento fora do alcance e da vista das crianças.
- Não usar o medicamento Riastap após o prazo de validade impresso na etiqueta e na caixa.
- Não armazenar a uma temperatura superior a 25°C. Não congelar.
- Para proteger da luz, a ampola deve ser armazenada na embalagem exterior.
- A solução reconstituída deve ser usada imediatamente.
- Se a solução preparada não for administrada imediatamente, o período de armazenamento não deve exceder 8 horas à temperatura ambiente (máx. 25 ºC).
- A solução reconstituída não deve ser armazenada no refrigerador.
6. Conteúdo da embalagem e outras informações
O que contém Riastap Substância ativa é:
Fibrinogénio humano (1 g/ampola; após reconstituição em 50 ml de água para injeção, cerca de
20 mg/ml).
Para obter informações mais detalhadas, ver secção "Informações destinadas apenas ao pessoal médico」.
Outros componentes são:
Albumina humana, cloreto de sódio, cloreto de L-arginina, citrato de sódio, hidróxido de sódio (para ajustar o pH),
Ver última secção da parte 2. "Informações importantes sobre alguns componentes de Riastap」.
Como é Riastap e o que contém a embalagem
Riastap tem a forma de pó branco.
Ao reconstituir em água para injeção, a solução deve ser transparente ou ligeiramente opalescente, ou seja, pode brilhar quando observada à luz, mas não deve conter partículas visíveis.
Embalagens
Embalagem contendo 1 g (Fig. 1)
Uma ampola de 1 g de fibrinogénio humano
Filtro: filtro de seringa Pall
Dispositivo de doseamento: dispositivo de doseamento Mini-Spike

Fig.1
Titular da autorização de comercialização e fabricante:
CSL Behring GmbH
Emil-von-Behring-Str. 76
35041 Marburg
Alemanha
Este medicamento é autorizado nos Estados-Membros da EEA sob as seguintes denominações:
Riastap 1g, pó para solução para injeção/infusão
Reino Unido
Riastap 1g, pó para solução injectável/perfusão
França
Riastap 1g, pó para solução para injeção ou infusão
Eslovénia
Riastap 1g
Alemanha, Irlanda
Riastap
Bélgica, Chipre, Dinamarca, Finlândia, Grécia, Islândia, Itália, Luxemburgo,
Malta, Noruega, Polónia, Eslováquia, Espanha, Suécia
Data de aprovação do folheto: Setembro de 2024
Informações destinadas apenas ao pessoal médico Dosagem:
O nível de fibrinogénio (funcional) deve ser medido para calcular a dosagem individual e a quantidade e frequência das doses administradas a cada doente por meio de medições regulares do nível de fibrinogénio no plasma e monitorização contínua do estado clínico do doente, tendo em conta outras terapias substitutivas utilizadas.
O nível normal de fibrinogénio no plasma é de 1,5 – 4,5 g/l. O nível crítico de fibrinogénio no plasma, abaixo do qual podem ocorrer sangramentos, é de cerca de 0,5 - 1
g/l. Em caso de intervenções cirúrgicas graves, é necessário um monitorização rigorosa da terapia substitutiva com testes de coagulação.
Dose inicial
Se o nível de fibrinogénio no doente não for conhecido, a dose recomendada para administração intravenosa é de 70 mg por kg de peso corporal.
Dose seguinte
O nível alvo (1 g/l) em caso de sangramentos leves (por exemplo, sangramento nasal, sangramento muscular ou menstrual) deve ser mantido durante pelo menos três dias. O nível alvo (1,5 g/l) em caso de sangramentos graves (por exemplo, lesão cerebral ou sangramento intracraniano) deve ser mantido durante sete dias.
Dose de fibrinogénio =
[Nível alvo (g/l) – nível medido (g/l)]
(mg/kg de peso corporal)
0,017 (g/l por mg/kg de peso corporal)
Dosagem em recém-nascidos, lactentes e crianças
Existem dados clínicos limitados disponíveis sobre a dosagem de Riastap em crianças.
As recomendações para a dosagem em crianças são as mesmas que para adultos, com base tanto nestes estudos como na experiência clínica de longo prazo com o uso de preparados de fibrinogénio.
Método de administração
Informações gerais
- O processo de reconstituição e retirada do produto deve ser realizado em condições assépticas.
- Os produtos reconstituídos devem ser avaliados visualmente antes da administração para excluir a presença de partículas e descoloração.
- A solução deve ser quase incolor a amarelada, transparente a ligeiramente opalescente, com pH neutro. Não usar soluções turvas ou com sedimento.
Reconstituição
- Aquecer tanto o diluente como o pó a temperatura ambiente ou temperatura corporal (não superior a 37 ), sem abrir as ampolas.
- O medicamento Riastap deve ser reconstituído com água para injeção (50 ml, não fornecida).
- Antes da reconstituição do medicamento, deve lavar as mãos ou usar luvas.
- Remover a tampa da ampola que contém Riastap, para expor a parte central da tampa da injeção.
- Limpar a superfície da tampa da injeção com uma solução antisséptica e deixar secar.
- Introduzir o diluente na ampola usando o equipamento adequado. Certificar-se de que o pó está completamente umedecido.
- Após uma mistura suave com movimento rotativo do conteúdo da ampola até a reconstituição do pó, a solução está pronta para administração. Evitar agitação vigorosa, que pode causar formação de espuma. Geralmente, o pó dissolve-se em cerca de 5 minutos. A dissolução total não deve demorar mais de 15 minutos.
- Abrir a bliste de plástico que contém o dispositivo de doseamento (Mini-Spike ) fornecido com o medicamento Riastap (Fig. 2).

Fig. 2
- Deve introduzir o dispositivo de doseamento fornecido na tampa da ampola após a reconstituição (Fig. 3)

Fig. 3
- Após a introdução do dispositivo de doseamento, remover a tampa. Após a remoção da tampa, não tocar na superfície exposta.
- Deve abrir a bliste com o filtro (filtro de seringa Pall ) fornecido com o medicamento Riastap (Fig.4)

Fig. 4
Aparafusar a seringa no filtro (Fig.5)
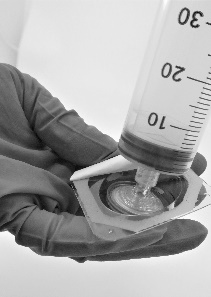
Fig. 5
- Aparafusar a seringa com o filtro acoplado na ponta de doseamento (Fig. 6)

Fig. 6
- Retirar o produto reconstituído para a seringa (Fig.7)
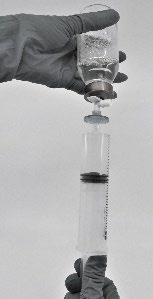
Fig.7
- Após a conclusão, deve remover o filtro, o dispositivo de doseamento e a ampola vazia da seringa e eliminá-los de acordo com as normas locais, e então iniciar a administração do medicamento de acordo com as recomendações. A solução reconstituída deve ser administrada imediatamente usando um conjunto de injeção/infusão separado.
- Deve ter cuidado para não causar aspiração de sangue para as seringas cheias de produto.
Qualquer produto medicamento não utilizado ou resíduos devem ser eliminados de acordo com as normas locais.
Método de administração
Para a administração intravenosa da solução reconstituída à temperatura ambiente, é recomendado usar um conjunto de infusão padrão. A solução reconstituída deve ser injetada ou administrada por infusão lentamente, com uma velocidade adequada para o conforto do doente.
A velocidade de injeção ou infusão não deve exceder cerca de 5 ml por minuto.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorCSL Behring GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a RiastapForma farmacêutica: Pó, 1 gSubstância ativa: fibrinogen, humanNão requer receita médicaForma farmacêutica: Pó, 1000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médicaForma farmacêutica: Pó, 2000 UISubstância ativa: coagulation factor VIIIFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Riastap noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Riastap em Ukraine
Alternativa a Riastap em Espanha
Médicos online para Riastap
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Riastap – sujeita a avaliação médica e regras locais.














