
CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE

Pergunte a um médico sobre a prescrição de CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE

Como usar CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE
Introdução
Prospecto: informação para o paciente
Cequa 0,9 mg/ml colírio em solução em embalagem unidose
ciclosporina
Leia todo o prospecto atentamente antes de começar a usar este medicamento, porque contém informações importantes para si.
- Conserva este prospecto, porque pode ter que voltar a lê-lo.
- Se tiver alguma dúvida, consulte o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si, e não deve dá-lo a outras pessoas, mesmo que tenham os mesmos sintomas que si, porque pode prejudicá-las.
- Se experimentar efeitos adversos, consulte o seu médico ou farmacêutico, mesmo que se trate de efeitos adversos que não aparecem neste prospecto. Ver seção 4.
Conteúdo do prospecto
- O que é Cequa e para que é utilizado
- O que precisa saber antes de começar a usar Cequa
- Como usar Cequa
- Posíveis efeitos adversos
- Conservação de Cequa
- Conteúdo do embalagem e informação adicional
1. O que é Cequa e para que é utilizado
Cequa contém o princípio ativo ciclosporina. A ciclosporina faz parte de um grupo de medicamentos denominados imunodepressores, que são utilizados para reduzir a inflamação.
Ciclosporina é utilizada para o tratamento da doença do olho seco de moderada a grave (queratoconjuntivite seca) em pacientes adultos que não responderam adequadamente às lágrimas artificiais.
Deve consultar um médico se piorar ou se não melhorar.
Deve ir à consulta do seu médico como mínimo cada 3 meses para que avalie o efeito deste medicamento.
2. O que precisa saber antes de começar a usar Cequa
Não use Cequa:
- se é alérgico à ciclosporina ou a algum dos outros componentes deste medicamento (incluídos na seção 6);
- se sofreu ou sofre câncer no ou ao redor do olho;
- se sofre uma infecção ocular.
Advertências e precauções
Utilize este medicamento apenas como colírio para o(s) olho(s).
Consulte o seu médico ou farmacêutico antes de começar a usar este medicamento:
- se teve anteriormente uma infecção ocular por vírus do herpes que possa ter danificado a parte frontal transparente do olho (córnea);
- se está tomando algum medicamento que contenha esteroides;
- se está tomando algum medicamento para tratar o glaucoma.
Deve remover as lentes de contato antes de usar este medicamento; pode voltar a colocá-las 15 minutos após a administração deste medicamento.
Crianças e adolescentes
Não se deve usar este medicamento em crianças e adolescentes menores de 18 anos.
Outros medicamentos e Cequa
Informa ao seu médico ou farmacêutico se está utilizando, utilizou recentemente ou possa ter que utilizar qualquer outro medicamento.
Consulte o seu médico se está usando um colírio que contenha esteroides, pois estes podem aumentar o risco de efeitos adversos.
Deve usar este medicamento pelo menos 15 minutos após utilizar qualquer outro colírio.
Gravidez e lactação
Se está grávida ou em período de lactação, acredita que possa estar grávida ou tem intenção de engravidar, consulte o seu médico ou farmacêutico antes de utilizar este medicamento.
Não deve utilizar este medicamento se está grávida.
Se pode engravidar, deve utilizar anticoncepcionais enquanto usar este medicamento.
É possível que haja quantidades muito pequenas de ciclosporina no leite materno. Se está em período de lactação, consulte o seu médico antes de utilizar este medicamento.
Condução e uso de máquinas
Pode ter visão borrada imediatamente após utilizar este medicamento. Neste caso, espere até que a sua visão seja clara antes de conduzir ou utilizar máquinas.
Cequa contém fosfatos
Este medicamento contém 0,0159 mg de fosfatos em cada gota. Se sofre de dano grave na camada transparente da parte frontal do olho (córnea), o tratamento com fosfatos, em casos muito raros, pode provocar manchas nubladas na córnea devido ao cálcio.
3. Como usar Cequa
Siga exatamente as instruções de administração deste medicamento indicadas pelo seu médico ou farmacêutico. Em caso de dúvida, consulte novamente o seu médico ou farmacêutico.
A dose recomendada é uma gota em cada olho afetado, duas vezes ao dia, com um intervalo aproximado de 12 horas.
Instruções de uso

 Siga atentamente estas instruções e consulte o seu médico ou farmacêutico se houver algo que não entenda.
Siga atentamente estas instruções e consulte o seu médico ou farmacêutico se houver algo que não entenda.
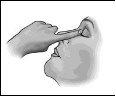
1 2 3
- Lave as mãos.
- Se tiver lentes de contato, remova-as antes de usar o colírio; pode voltar a colocá-las 15 minutos após a administração das gotas.
- Abra a bolsa de alumínio, retire um embalagem unidose, e insira o resto das embalagens unidose de novo no interior da bolsa de alumínio.
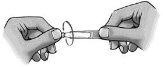
- Gire a tampa (figura 1).
- Desça a pálpebra inferior (figura 2).
- Incline a cabeça para trás e olhe para o teto.
- Suavemente, aperte para ejetar uma gota de medicamento no olho. Certifique-se de não tocar o olho com a ponta da embalagem unidose.
- Piscar várias vezes para distribuir a gota no olho.
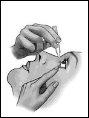
- Após aplicar a gota, pressione com um dedo a comissura do olho junto à nariz e feche suavemente as pálpebras durante 2 minutos (figura 3)(isso favorece o efeito local).
- Se utilizar o colírio em ambos os olhos, repita estes passos no outro olho.
- Jogue a embalagem unidose fora assim que a tiver utilizado, mesmo que ainda reste um pouco de medicamento nela.
- Deve manter as embalagens unidose restantes na bolsa de alumínio.
Se a gota cair fora do olho, tente novamente.
Se usar mais Cequa do que deve, lave o olho com água. Não se aplique mais gotas até que corresponda aplicar a próxima dose.
Em caso de sobredose ou ingestão acidental, consulte imediatamente o seu médico ou farmacêutico ou ligue para o Serviço de Informação Toxicológica, telefone 91 562 04 20 indicando o medicamento e a quantidade ingerida.
Se esquecer de usar Cequa,continue com a próxima dose prevista.
Não se aplique uma dose dupla para compensar as doses esquecidas. Não use mais de uma gota de cada vez no olho(s) afetado(s).
Se interromper o tratamento com Cequa, consulte antes com o seu médico.
Se tiver alguma outra dúvida sobre o uso deste medicamento, pergunte ao seu médico ou farmacêutico.
4. Posíveis efeitos adversos
Assim como todos os medicamentos, este medicamento pode produzir efeitos adversos, embora nem todas as pessoas os sofram.
Foram observados os seguintes efeitos adversos:
Os efeitos adversos mais frequentes ocorrem no e ao redor dos olhos.
Muito frequentes (podem afetar mais de 1 de cada 10 pessoas): dor ou desconforto quando se aplica uma gota pela primeira vez.
Frequentes (podem afetar até 1 de cada 10 pessoas): vermelhidão do olho, irritação do olho, olhos lacrimejantes, irritação no olho.
Pouco frequentes (podem afetar até 1 de cada 100 pessoas): aumento do lacrimejamento do olho, aumento da sensibilidade à luz, dor no olho, inchaço da conjuntiva (pele que recobre a parte branca do olho), inflamação dos cantos da pálpebra, infecções oculares e perioculares, cefaleia e irritação de garganta.
Comunicação de efeitos adversos
Se experimentar qualquer tipo de efeito adverso, consulte o seu médico ou farmacêutico, mesmo que se trate de possíveis efeitos adversos que não aparecem neste prospecto. Também pode comunicá-los diretamente através do Sistema Espanhol de Farmacovigilância de Medicamentos de Uso Humano: www.notificaRAM. Mediante a comunicação de efeitos adversos, você pode contribuir para fornecer mais informações sobre a segurança deste medicamento.
5. Conservação de Cequa
Mantenha este medicamento fora da vista e do alcance das crianças.
Não utilize este medicamento após a data de validade que aparece na caixa, na bolsa de alumínio e nas embalagens unidose após "CAD". A data de validade é o último dia do mês que se indica.
Não conserve acima de 25°C. Não congele. Após abrir as bolsas de alumínio, devem ser mantidas as embalagens unidose nelas para evitar a evaporação. O período de validade após a abertura da bolsa de alumínio: 5 dias. Jogue fora imediatamente após o uso qualquer embalagem unidose individual aberta com restos de solução.
Não utilize este medicamento se observar partículas visíveis.
Os medicamentos não devem ser jogados nos esgotos nem na lixeira. Deposite os embalagens e os medicamentos que não precisa no Ponto SIGRE da farmácia. Pergunte ao seu farmacêutico como se livrar dos embalagens e dos medicamentos que já não precisa. Dessa forma, ajudará a proteger o meio ambiente.
6. Conteúdo do embalagem e informação adicional
Composição de Cequa
- O princípio ativo é ciclosporina. Um mililitro de Cequa contém 0,9 mg de ciclosporina.
- Os outros componentes são: macroglicerol hidroxiestearato, octoxinol-40, dihidrogenofosfato de sódio dihidratado (E339), hidrogenofosfato de sódio anidro (E339), cloreto de sódio, povidona (E1201), ácido clorídrico (para ajuste do pH) (E507), hidróxido de sódio (para ajuste do pH) (E524) e água para preparações injetáveis.
Aspecto do produto e conteúdo do embalagem
Cequa é uma solução clara, incolor em embalagens unidose.
É fornecido em embalagens unidose de polietileno de baixa densidade (LDPE).
Cada embalagem unidose contém 0,25 ml de colírio em solução.
As embalagens unidose são acondicionadas em uma bolsa selada de alumínio com revestimento de polietileno.
Tamanhos de embalagens: embalagens com 60 ou 180 embalagens unidose, ou embalagem múltipla contendo 180 unidades (3 caixas de cartão com 60 embalagens unidose cada uma).
Pode ser que apenas alguns tamanhos de embalagens estejam comercializados.
Titular da autorização de comercialização e responsável pela fabricação
Titular da autorização de comercialização
Sun Pharmaceutical Industries BV
Polarisavenue 87,
2132JH Hoofddorp,
Países Baixos
Responsável pela fabricação
Laboratoire Unither 1 Rue De L’Arquerie Coutances 50200 França |
Pode solicitar mais informações sobre este medicamento dirigindo-se ao representante local do titular da autorização de comercialização:
Sun Pharma Laboratórios, S.L.
Rambla de Catalunya 53-55
08007 Barcelona
Espanha
Tel: +34 93 342 78 90
Este medicamento está autorizado nos estados membros do Espaço Económico Europeu com os seguintes nomes:
Holanda: Cequa 0.9 mg/ml oogdruppels, oplossing in verpakking voor eenmalig gebruik
Áustria: Cequa 0,9 mg/ml Augentropfen, Lösung im Einzeldosisbehältnis
Alemanha: Cequa 0,9 mg/ml Augentropfen, Lösung im Einzeldosisbehältnis
Dinamarca: Sekua 0.9 mg/ml øjendråber, opløsning i enkeltdosisbeholder |
Espanha: Cequa 0,9 mg/ml colírio em solução em embalagem unidose
Finlândia: Cequa 0.9 mg/ml silmätipat, liuos kerta-annospakkauksessa | |
França: Cequa 0,9 mg/mL, collyre en solution en récipient unidose Itália: Cequa
| |
Suécia: Cequa 0.9 mg/ml ögondroppar, lösning i endosbehållare |
Data da última revisão deste prospecto: Março 2024
A informação detalhada deste medicamento está disponível na página web da Agência Espanhola de Medicamentos e Produtos Sanitários (AEMPS) http://www.aemps.gob.es/
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSEForma farmacêutica: COLÍRIO, 1 mg/mlSubstância ativa: ciclosporinFabricante: Santen OyRequer receita médicaForma farmacêutica: COLÍRIO, 1 mg/mlSubstância ativa: ciclosporinFabricante: Santen OyRequer receita médicaForma farmacêutica: COLÍRIO, 5,5 mg cloreto de sódio; 3 mg hipromelose/mlSubstância ativa: artificial tears and other indifferent preparationsFabricante: Alcon Healthcare S.A.Não requer receita médica
Alternativas a CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE em Ukraine
Alternativa a CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE em Polónia
Médicos online para CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de CEQUA 0,9 mg/ml COLÍRIO EM SOLUÇÃO EM EMBALAGEM UNIDOSE – sujeita a avaliação médica e regras locais.














