
Priorix-tetra

Pergunte a um médico sobre a prescrição de Priorix-tetra

Como usar Priorix-tetra
Folheto informativo para o utilizador
Priorix-Tetra, pó e líquido para a preparação de uma solução injetável em seringa-ampola
Seringa-ampola
Vacina contra sarampo, rubéola, rubéola alemã e varicela, viva
Deve ler atentamente o conteúdo do folheto antes de administrar a vacina, pois contém informações importantes para o paciente.
- Deve conservar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico ou farmacêutico.
- Se o paciente apresentar algum efeito indesejado, incluindo quaisquer efeitos indesejados não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Ver secção 4.
O conteúdo deste folheto foi redigido com a suposição de que será lido pela pessoa que vai receber a vacina. No entanto, como a vacina pode ser administrada a adultos e crianças, é possível que o folheto seja lido por um pai ou tutor da criança.
Índice do folheto
- 1. O que é a vacina Priorix-Tetra e para que é utilizada
- 2. Informações importantes antes de administrar a vacina Priorix-Tetra
- 3. Como administrar a vacina Priorix-Tetra
- 4. Efeitos indesejados
- 5. Como conservar a vacina Priorix-Tetra
- 6. Conteúdo do pacote e outras informações
1. O que é a vacina Priorix-Tetra e para que é utilizada
A vacina Priorix-Tetra é utilizada em pessoas com idade a partir de 11 meses para prevenir doenças causadas pelos vírus do sarampo, rubéola, rubéola alemã e varicela. Em certas circunstâncias, a vacina Priorix-Tetra também pode ser administrada a crianças após o nono mês de vida.
Como funciona a vacina Priorix-Tetra
Após a administração da vacina Priorix-Tetra, o sistema imunológico da pessoa vacinada começará a produzir anticorpos que protegem contra a infecção pelos vírus do sarampo, rubéola, rubéola alemã e varicela.
Embora a vacina Priorix-Tetra contenha vírus vivos, estes foram atenuados a um nível tal que não podem causar sarampo, rubéola, rubéola alemã ou varicela em pessoas saudáveis.
Assim como acontece com todas as vacinas, a vacina Priorix-Tetra pode não proteger completamente todas as pessoas vacinadas.
2. Informações importantes antes de administrar a vacina Priorix-Tetra
Quando não administrar a vacina Priorix-Tetra
- se o paciente tiver alergia a qualquer um dos componentes da vacina (listados na secção 6). Os sintomas de uma reação alérgica incluem erupções cutâneas, dificuldades respiratórias, inchaço facial ou lingual,
- se o paciente tiver apresentado uma reação alérgica após a administração anterior de qualquer vacina contra o sarampo, rubéola, rubéola alemã e/ou varicela,
- se o paciente for alérgico à neomicina (um antibiótico). A dermatite de contato causada pela neomicina (erupção cutânea que aparece após o contacto direto da pele com o alérgeno, como a neomicina) não deve ser um problema, mas é necessário consultar um médico antes,
se o paciente tiver uma infecção grave com febre. Nesse caso, a vacinação deve ser adiada até que o paciente se recupere. Uma infecção leve, como um resfriado, não deve ser um contraindicação para a vacinação, mas é necessário consultar um médico antes.
- se o paciente tiver uma doença (como infecção por HIV ou AIDS) ou estiver a tomar medicamentos que possam enfraquecer o sistema imunológico. A decisão de administrar a vacina dependerá do nível de imunidade do paciente.
- se o paciente estiver grávida. Além disso, é importante evitar a gravidez durante um mês após a vacinação.
Precauções e advertências
Deve consultar um médico ou farmacêutico antes de administrar a vacina Priorix-Tetra se:
- o paciente ou um familiar tiver história de convulsões, incluindo convulsões febris. Nesse caso, o paciente deve ser monitorizado de perto após a vacinação, pois a febre associada à vacinação pode ocorrer especialmente entre 5 e 12 dias após a administração da vacina (ver secção 4),
- o paciente tiver apresentado uma reação alérgica grave à proteína do ovo,
- o paciente tiver apresentado efeitos indesejados após a vacinação contra o sarampo, rubéola ou rubéola alemã, incluindo hematomas fáceis ou sangramento prolongado (ver secção 4),
- o paciente tiver um sistema imunológico enfraquecido (por exemplo, devido a uma infecção por HIV). O paciente deve ser monitorizado de perto, pois a resposta à vacina pode não ser suficiente para garantir a proteção contra a doença (ver secção 2, "Quando não administrar a vacina Priorix-Tetra").
Se o paciente for vacinado dentro de 72 horas após o contacto com uma pessoa doente com sarampo ou varicela, a vacina Priorix-Tetra pode fornecer alguma proteção contra a doença.
Após a vacinação, o paciente deve evitar o contacto próximo com:
- pessoas com imunidade diminuída,
- mulheres grávidas que não tenham tido varicela ou não tenham sido vacinadas contra a varicela,
- recém-nascidos de mães que não tenham tido varicela ou não tenham sido vacinadas contra a varicela.
Após ou mesmo antes da administração de qualquer vacina injetável, pode ocorrer uma perda de consciência (especialmente em adolescentes). Nesse caso, é necessário informar o médico ou enfermeiro se o paciente já teve uma perda de consciência após uma injeção.
Assim como acontece com todas as vacinas, a vacina Priorix-Tetra pode não proteger completamente todas as pessoas vacinadas. No entanto, em pessoas vacinadas, o curso da doença é geralmente muito mais leve do que em pessoas não vacinadas.
Interacções com outros medicamentos
Deve informar o médico sobre todos os medicamentos que está a tomar ou planeia tomar, bem como sobre quaisquer vacinas que tenha recebido recentemente.
A vacinação pode ser adiada pelo médico por pelo menos 3 meses se o paciente tiver recebido recentemente uma transfusão de sangue ou imunoglobulina humana.
Se o paciente for submetido a um teste de tuberculose (teste cutâneo para tuberculose), deve ser realizado antes ou simultaneamente com a administração da vacina, ou após 6 semanas após a vacinação.
Deve evitar a ingestão de salicilatos (substâncias presentes em muitos medicamentos anti-inflamatórios e analgésicos) durante 6 semanas após a vacinação.
A vacina Priorix-Tetra pode ser administrada ao mesmo tempo que outras vacinas. Cada vacina deve ser administrada em um local diferente do corpo.
Gravidez e amamentação
A vacina Priorix-Tetra não deve ser administrada a mulheres grávidas.
Em caso de gravidez ou amamentação, ou se a mulher planeia engravidar, deve consultar um médico ou farmacêutico antes de administrar a vacina. Além disso, é importante que a paciente não engravidar durante um mês após a vacinação. Nesse período, deve usar um método anticoncepcional eficaz para evitar a gravidez.
Condução de veículos e utilização de máquinas
Não há dados que sugiram que a vacina Priorix-Tetra afete a capacidade de conduzir veículos ou operar máquinas.
Priorix-Tetra contém sorbitol, ácido para-aminobenzoico, fenilalanina, sódio e potássio
Cada dose da vacina contém 14 mg de sorbitol.
A vacina Priorix-Tetra contém ácido para-aminobenzoico. Pode causar reações alérgicas (possíveis reações tardias) e, raramente, broncoespasmo.
A vacina contém 583 microgramas de fenilalanina por dose. A fenilalanina pode ser prejudicial a pacientes com fenilcetonúria (PKU), uma doença genética rara, na qual a fenilalanina se acumula no organismo, pois o organismo não a elimina corretamente.
A vacina contém menos de 1 mmol (23 mg) de sódio por dose, ou seja, a vacina é considerada "livre de sódio".
A vacina contém potássio, menos de 1 mmol (39 mg) de potássio por dose, ou seja, a vacina é considerada "livre de potássio".
3. Como administrar a vacina Priorix-Tetra
A vacina Priorix-Tetra é administrada por via subcutânea ou intramuscular, na parte superior do braço ou na coxa externa.
A vacina Priorix-Tetra é destinada a pessoas com idade a partir de 11 meses.
O calendário de vacinação e o número de doses que o paciente receberá serão determinados pelo médico com base nas recomendações oficiais.
A vacina não deve ser administrada por via intravenosa.
4. Efeitos indesejados
Como acontece com qualquer medicamento, efeitos indesejados podem ocorrer após a administração da vacina, embora não em todos os pacientes.
Após a administração da vacina, podem ocorrer os seguintes efeitos indesejados:
♦
Muito frequentes (podem ocorrer em mais de 1 em 10 doses da vacina):
- dor e vermelhidão no local da injeção
- febre 38°C ou superior*
- inchaço no local da injeção, no caso de administração da vacina a jovens e adultos
♦
Frequentes (podem ocorrer em até 1 em 10 doses da vacina):
- inchaço no local da injeção, no caso de administração da vacina a crianças
- febre superior a 39,5°C*
- irritabilidade
- erupção cutânea (manchas e/ou bolhas)
♦
Pouco frequentes (podem ocorrer em até 1 em 100 doses da vacina):
- choro anormal, nervosismo, insônia
- mal-estar geral, letargia, fadiga
- inchaço das glândulas salivares
- diarreia, vômitos
- perda de apetite
- infecção das vias respiratórias superiores
- coriza
- inchaço dos gânglios linfáticos
♦
Raros (podem ocorrer em até 1 em 1.000 doses da vacina):
- infecção do ouvido médio
- convulsões febris
- tosse
- bronquite
* Foi observada uma frequência mais elevada de febre após a administração da primeira dose da vacina Priorix-Tetra em comparação com a administração separada da vacina contra o sarampo, rubéola, rubéola alemã e varicela durante a mesma visita.
Os seguintes efeitos indesejados foram relatados durante o uso rotineiro da vacina contra o sarampo, rubéola e rubéola alemã ou da vacina contra a varicela produzidas pela GlaxoSmithKline Biologicals:
- dor nas articulações e músculos
- reações alérgicas (alergias). Essas reações podem manifestar-se como erupções cutâneas, inchaço dos olhos e face, dificuldades respiratórias ou deglutição, queda súbita da pressão arterial e perda de consciência. Essas reações podem ocorrer antes de deixar o consultório do médico. Se o paciente apresentar algum desses sintomas, deve procurar um médico imediatamente
- infecção ou inflamação do cérebro, medula espinhal e nervos periféricos, resultando em dificuldades transitórias de marcha (ataxia) e/ou perda transitória da coordenação motora, acidente vascular cerebral, inflamação de alguns nervos com possíveis sensações de formigamento ou perda de sensação ou distúrbios motores (síndrome de Guillain-Barré)
- estreitamento ou obstrução dos vasos sanguíneos
- pequenos sangramentos locais ou hematomas fáceis de ocorrer devido à redução do número de plaquetas
- erupção cutânea multiforme (sintomas incluem manchas vermelhas, geralmente pruriginosas, semelhantes à erupção cutânea da varicela, que aparecem nos membros, e ocasionalmente no rosto e outras partes do corpo)
- erupção cutânea semelhante à da varicela
- herpes zóster
- sintomas semelhantes ao sarampo e rubéola (incluindo inchaço doloroso dos testículos e gânglios linfáticos inchados no pescoço)
Notificação de efeitos indesejados
Se ocorrerem qualquer efeitos indesejados, incluindo quaisquer efeitos indesejados não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Os efeitos indesejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Indesejados de Medicamentos do Instituto Nacional de Farmácia e Medicamentos:
Rua do Instituto, 89
1200-459 Lisboa
Telefone: 21 792 53 00
Fax: 21 792 53 01
Sítio da Internet: https://www.infarmed.pt/
Os efeitos indesejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos indesejados pode ajudar a recolher mais informações sobre a segurança do medicamento.
5. Como conservar a vacina Priorix-Tetra
Conservar a vacina em um local não visível e inacessível a crianças.
Não usar a vacina após o prazo de validade impresso na etiqueta após "VAL".
O prazo de validade é o último dia do mês indicado.
A abreviatura "Lote" refere-se ao número da série da vacina.
Conservar e transportar a vacina a uma temperatura de 2°C a 8°C.
Não congelar.
Conservar a vacina no embalagem original para proteger da luz.
Após a reconstituição, a vacina deve ser administrada imediatamente ou conservada na geladeira (2°C - 8°C). Se não for utilizada dentro de 24 horas, deve ser descartada.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais utilizados. Esse procedimento ajudará a proteger o meio ambiente.
6. Conteúdo do pacote e outras informações
O que contém a vacina Priorix-Tetra
Os componentes ativos da vacina são: vírus vivos atenuados do sarampo, rubéola, rubéola alemã e varicela.
Outros componentes da vacina incluem:
Pó: aminoácidos (incluindo fenilalanina), lactose anidra, manitol (E 421), sorbitol (E 420), meio 199 (incluindo fenilalanina, ácido para-aminobenzoico, sódio e potássio).
Diluente: água para injeção.
Como é a vacina Priorix-Tetra e o que contém o pacote
A vacina é fornecida como um pó e um diluente para a preparação de uma solução injetável (o pó está em uma ampola de dose única, o diluente em uma seringa-ampola de 0,5 ml), com agulhas separadas ou sem agulhas, nos seguintes pacotes:
- com 2 agulhas separadas: pacotes de 1 ou 10,
- sem agulhas: pacotes de 1 ou 10.
A vacina Priorix-Tetra tem a forma de um pó branco a ligeiramente rosado, que pode ter uma parte amarelada, e um diluente transparente e incolor (água para injeção) para dissolver o pó.
Nem todos os tamanhos de pacotes podem estar disponíveis.
Titular da autorização de comercialização e fabricante
GlaxoSmithKline Biologicals S.A.
Rue de l’Institut 89
B-1330 Rixensart
Bélgica
Data da última atualização do folheto:março de 2025
Outras fontes de informação
Informações detalhadas sobre esta vacina estão disponíveis no sítio da Internet da Autoridade Central Nacional de Medicamentos e Produtos de Saúde .
-------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
Assim como acontece com todas as vacinas injetáveis, deve sempre estar disponível um tratamento apropriado e supervisão médica para o caso de reações anafiláticas raramente ocorrerem após a vacinação.
O álcool e outros desinfetantes devem ter evaporado da pele antes da administração da vacina, pois podem inativar os vírus atenuados presentes na vacina.
A vacina Priorix-Tetra não deve ser administrada por via intravenosa ou intradérmica.
Como não foram realizados estudos sobre a compatibilidade, não se deve misturar o medicamento com outros medicamentos.
A vacina reconstituída deve ser submetida a uma inspeção visual. Devido a pequenas alterações no pH, a vacina reconstituída pode apresentar uma cor que varia de laranja claro a rosa. A vacina reconstituída pode conter partículas translúcidas. Isso é normal e não afeta a eficácia da vacina.
Se a vacina apresentar uma cor diferente ou contiver outras partículas sólidas, não deve ser administrada.
A vacina deve ser reconstituída adicionando todo o diluente da seringa-ampola à ampola de pó.
Para conectar a agulha à seringa-ampola, deve seguir as instruções apresentadas nas figuras 1 e 2. A seringa-ampola fornecida com a vacina Priorix-Tetra pode ser ligeiramente diferente da apresentada na figura (pode não ter uma rosca para aparafusar a agulha). Nesse caso, a agulha deve ser fixada sem aparafusar.
Agulha
Seringa-ampola
Deve sempre segurar a seringa-ampola pelo corpo, não pelo êmbolo ou pelo adaptador Luer Lock, e a agulha deve ser mantida alinhada com a seringa-ampola (como mostrado na figura 2). Não seguir essas instruções pode causar a torção do adaptador Luer Lock e o vazamento da seringa-ampola.
Se o adaptador Luer Lock se soltar durante a conexão da agulha à seringa-ampola, deve usar uma nova dose da vacina (nova seringa-ampola e ampola de pó).
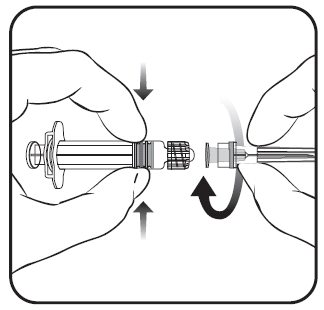
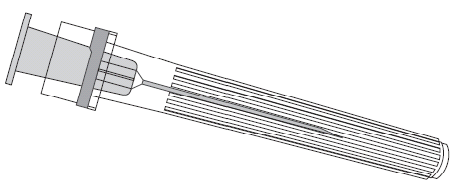
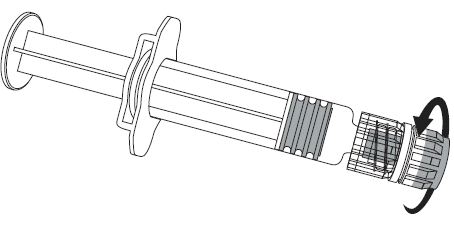
Figura 1. Figura 2.
- 1. Deve remover a tampa da seringa-ampola girando-a no sentido contrário ao dos ponteiros do relógio (como mostrado na figura 1).
Independentemente de o adaptador Luer Lock girar ou não, deve seguir as instruções abaixo:
- 2. Deve conectar a agulha à seringa-ampola fixando suavemente a ponta da agulha ao adaptador Luer Lock e girando-a um quarto de volta no sentido dos ponteiros do relógio, até sentir o bloqueio da agulha (como mostrado na figura 2).
- 3. Deve remover a capa da agulha, que pode oferecer resistência.
- 4. Deve adicionar o diluente ao pó. Em seguida, deve agitar energicamente até que o pó esteja completamente dissolvido.
- 5. Deve aspirar todo o conteúdo da ampola.
- 6. Para administrar a vacina, deve usar uma agulha nova. Para isso, deve remover a agulha da seringa-ampola e conectar uma agulha para injeção, seguindo as instruções da etapa 2.
- 7. Deve seguir as instruções do fabricante para a eliminação de resíduos.
Após a reconstituição, a vacina deve ser administrada imediatamente ou conservada na geladeira (2°C - 8°C). Se não for utilizada dentro de 24 horas, deve ser descartada.
Qualquer resíduo do medicamento não utilizado ou seus dejetos deve ser eliminado de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Priorix-tetraForma farmacêutica: Pó, -Substância ativa: measles, combinations with mumps, rubella and varicella, live attenuatedFabricante: GlaxoSmithKline Biologicals S.A.Requer receita médicaForma farmacêutica: Pó, -Substância ativa: measles, combinations with mumps and rubella, live attenuatedFabricante: GlaxoSmithKline Biologicals S.A.Requer receita médicaForma farmacêutica: Suspensão, 160 unidades antigénicas ELISA do vírus da hepatite A, estirpe GBM/0,5 ml; 1 dose (0,5 ml)Substância ativa: hepatitis A, inactivated, whole virusRequer receita médica
Alternativas a Priorix-tetra noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Priorix-tetra em Espanha
Alternativa a Priorix-tetra em Ukraine
Médicos online para Priorix-tetra
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Priorix-tetra – sujeita a avaliação médica e regras locais.














