

Priorix

Pergunte a um médico sobre a prescrição de Priorix

Como usar Priorix
folheto para o paciente
Folheto anexo ao embalagem: informação para o utilizador
Priorix,pó e solvente para preparar solução injectável
Vacina contra sarampo, rubéola e rubéola, viva
Deve ler atentamente o conteúdo do folheto antes de administrar a vacina, pois contém informações importantes para o paciente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico ou farmacêutico.
- A vacina foi prescrita para uma pessoa específica. Não deve ser transmitida a outros.
- Se o paciente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4. O conteúdo deste folheto foi elaborado com a suposição de que será lido pela pessoa que recebe a vacina. No entanto, como esta vacina pode ser administrada a adultos e crianças, é possível que o conteúdo do folheto seja lido por um pai ou responsável pela criança.
Índice do folheto:
- 1. O que é a vacina Priorix e para que é utilizada
- 2. Informações importantes antes de administrar a vacina Priorix
- 3. Como administrar a vacina Priorix
- 4. Efeitos não desejados possíveis
- 5. Como conservar a vacina Priorix
- 6. Conteúdo do embalagem e outras informações
1. O que é a vacina Priorix e para que é utilizada
Priorix é uma vacina utilizada em crianças após a idade de 9 meses, jovens e adultos para prevenir o sarampo, rubéola e rubéola.
Como funciona a Priorix
O sistema imunológico (sistema natural de defesa do organismo) da pessoa que recebe a vacina Priorix produzirá anticorpos, protegendo o paciente contra a infecção pelos vírus do sarampo, rubéola e rubéola.
Embora a vacina Priorix contenha vírus vivos, são demasiado fracos para causar a doença em pessoas saudáveis.
2. Informações importantes antes de administrar a vacina Priorix
Quando não administrar a vacina Priorix:
- se já ocorreu uma reação alérgica a qualquer componente desta vacina (listado no ponto 6). Os sintomas de alergia incluem erupções cutâneas pruriginosas, dificuldades respiratórias, edema facial ou lingual,
- se já ocorreu uma reação alérgica à neomicina (antibiótico). A dermatite de contato causada pela neomicina (erupção cutânea quando ocorre contato direto com o alérgeno, como a neomicina) não é uma contraindicação para a administração da vacina, mas deve ser comunicado ao médico,
- se ocorre uma doença aguda e grave com febre. Nesse caso, a vacinação será adiada até a recuperação. Uma infecção leve, como um resfriado, não deve ser uma contraindicação para a vacinação, mas deve ser discutido com o médico,
- se ocorre qualquer doença (por exemplo, infecção pelo vírus da imunodeficiência humana (HIV) ou síndrome da imunodeficiência adquirida (AIDS)) ou se o paciente está tomando medicamentos que possam enfraquecer o sistema imunológico. Se o paciente receber a vacina dependerá do nível de imunidade,
- se for detectada gravidez. Além disso, deve-se evitar a gravidez por 1 mês após a vacinação.
Precauções e advertências
Antes de administrar a vacina Priorix, deve-se discutir com o médico ou farmacêutico se:
- o paciente tem distúrbios do sistema nervoso central, convulsões com febre alta ou se já ocorreram convulsões na família. Se ocorrer febre alta após a vacinação, deve-se consultar imediatamente o médico,
- o paciente já teve uma reação alérgica grave ao ovo de galinha,
- o paciente apresentou efeitos não desejados após a vacinação contra o sarampo, rubéola ou rubéola, incluindo hematomas fáceis ou sangramento prolongado (ver ponto 4),
- o paciente tem sistema imunológico enfraquecido (por exemplo, em caso de infecção pelo vírus HIV). O paciente deve ser submetido a uma observação rigorosa, pois a resposta à vacina pode não ser suficiente para garantir a proteção contra a doença (ver ponto 2 "Quando não administrar a vacina Priorix").
Ao ou antes de administrar qualquer vacina por injeção, pode ocorrer uma reação de desmaio (especialmente em jovens). Nesse caso, deve-se informar o médico ou enfermeiro se o paciente já teve um desmaio durante a administração de uma injeção.
Se o paciente for vacinado dentro de 72 horas após o contato com uma pessoa com sarampo, a vacina Priorix pode fornecer alguma proteção contra a doença.
Crianças com menos de 12 meses
Crianças vacinadas no primeiro ano de vida podem não estar totalmente protegidas. Se for necessário administrar doses adicionais da vacina, o médico recomendará.
Vacina Priorix e outros medicamentos
Deve-se informar o médico sobre todas as vacinações e medicamentos que o paciente está tomando atualmente ou recentemente, bem como sobre medicamentos ou vacinas que o paciente planeja tomar.
A vacina Priorix pode ser administrada ao mesmo tempo que outras vacinas, como:
vacina contra a difteria, tétano, coqueluche (acelular), vacina contra a infecção por Haemophilus influenzae tipo b, vacina oral ou inativada contra a poliomielite, vacina contra a hepatite A, vacina contra a hepatite B, vacina contra a varicela, vacina contra a meningite por meningococo do grupo B, e vacina conjugada contra a meningite por meningococo do sorogrupo C, vacina conjugada contra a meningite por meningococo dos grupos A, C, W135 e Y, e vacina conjugada contra a pneumonia. Para obter mais informações, deve-se consultar o médico ou enfermeiro.
Cada vacina deve ser injetada em um local diferente.
Se a Priorix não puder ser administrada ao mesmo tempo que outras vacinas que contenham vírus vivos atenuados, deve-se manter um intervalo de pelo menos um mês entre as vacinações.
A vacinação pode ser adiada por pelo menos 3 meses se o paciente recebeu recentemente uma transfusão de sangue ou imunoglobulina humana.
Se o paciente for submetido a um teste de tuberculina (exame de pele para tuberculose), deve-se realizá-lo antes ou ao mesmo tempo que a administração da vacina, ou após 6 semanas da vacinação.
Gravidez, amamentação e fertilidade
A vacina Priorix não deve ser administrada a mulheres grávidas .
Se a paciente estiver grávida ou amamentando, suspeita que possa estar grávida ou planeja ter um filho, deve consultar o médico ou farmacêutico antes de usar esta vacina.
Além disso, é importante que a paciente não fique grávida durante um mês após a vacinação. Nesse período, deve-se usar um método anticoncepcional eficaz para evitar a gravidez.
A administração não intencional da vacina Priorix a uma mulher grávida não deve ser um motivo para interromper a gravidez.
Priorix contém sorbitol, ácido para-aminobenzoico, fenilalanina, sódio e potássio
Esta vacina contém 9 mg de sorbitol por dose.
Priorix contém ácido para-aminobenzoico. Pode causar reações alérgicas (possíveis reações tardias) e, raramente, broncoespasmo.
A vacina contém 334 microgramas de fenilalanina por dose. A fenilalanina pode ser prejudicial a pacientes com fenilcetonúria (PKU), uma doença genética rara, na qual a fenilalanina se acumula no organismo, pois o organismo não a elimina adequadamente.
Esta vacina contém menos de 1 mmol (23 mg) de sódio por dose, ou seja, a vacina é considerada "livre de sódio".
Esta vacina contém potássio, menos de 1 mmol (39 mg) de potássio por dose, ou seja, a vacina é considerada "livre de potássio".
3. Como administrar a vacina Priorix
A vacina Priorix é administrada por via subcutânea ou intramuscular, na parte superior do braço ou na parte externa da coxa.
Priorix é destinado a ser usado em crianças após a idade de 9 meses, jovens e adultos.
O momento adequado para a vacinação e o número de doses a serem administradas serão determinados pelo médico com base nas recomendações oficiais.
A vacina não deve ser administrada por via intravenosa.
4. Efeitos não desejados possíveis
Como qualquer medicamento, esta vacina pode causar efeitos não desejados, embora não em todos os pacientes.
Após a administração da vacina Priorix durante os estudos clínicos, ocorreram os seguintes efeitos não desejados:
♦ Muito frequentes (podem ocorrer com mais frequência do que 1 em 10 doses da vacina):
- Vermelhidão no local da injeção
- Febre (38°C ou superior)
♦ Frequentes (podem ocorrer com menos frequência do que 1 em 10 doses da vacina):
- Dor e edema no local da injeção
- Febre (superior a 39,5°C)
- Erupção cutânea
- Infecção das vias respiratórias superiores
♦ Não muito frequentes (podem ocorrer com menos frequência do que 1 em 100 doses da vacina):
- Otite média
- Aumento dos gânglios linfáticos (gânglios na região do pescoço, axilas ou inguina)
- Perda de apetite
- Nervosismo
- Choro anormal
- Insônia
- Vermelhidão, irritação ou lacrimejamento dos olhos (conjuntivite)
- Bronquite
- Tosse
- Edema das glândulas salivares (gânglios na região da bochecha)
- Diarréia
- Vômitos
♦ Raros (podem ocorrer com menos frequência do que 1 em 1000 doses da vacina):
- Convulsões com febre alta
- Reações alérgicas
Após a comercialização da vacina, foram relatados muito raramente os seguintes efeitos não desejados:
- Dor nas articulações e músculos
- Sangramento ou hematoma fácil devido à redução do número de plaquetas
- Reações alérgicas graves que ameaçam a vida
- Infecção ou inflamação do cérebro, medula espinhal e nervos periféricos, resultando em dificuldades transitórias de caminhar (ataxia) e/ou perda transitória de coordenação motora, inflamação de alguns nervos com possibilidade de formigamento ou perda de sensação ou distúrbios motores (síndrome de Guillain-Barré)
- Estreitamento ou obstrução dos vasos sanguíneos
- Erupção cutânea multiforme (sintoma são pontos vermelhos, frequentemente pruriginosos, semelhantes à erupção cutânea que ocorre no sarampo, aparecendo primeiro nos membros e às vezes no rosto e outras partes do corpo)
- Sintomas semelhantes ao sarampo e rubéola (incluindo edema doloroso dos testículos e glândulas inchadas no pescoço)
Notificação de efeitos não desejados
Se ocorrerem qualquer efeitos não desejados, incluindo qualquer efeito não desejado não mencionado neste folheto, deve-se informar o médico ou farmacêutico. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Não Desejados de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Produtos Médicos e Produtos Biocidas:
Al. Jerozolimskie 181C
02-222 Varsóvia
Tel.: 22 49 21 301
Fax: 22 49 21 309
Sítio web: https://smz.ezdrowie.gov.pl
Os efeitos não desejados também podem ser notificados ao responsável pelo produto.
A notificação de efeitos não desejados pode ajudar a coletar mais informações sobre a segurança do medicamento.
5. Como conservar a vacina Priorix
A vacina deve ser conservada em um local não visível e inacessível a crianças.
Não use esta vacina após a data de validade impressa na embalagem exterior.
Conservar e transportar em temperatura refrigerada (2°C - 8°C).
Não congelar.
Conservar na embalagem original para proteger da luz.
Após a reconstituição, a vacina deve ser administrada imediatamente. Se não for possível, deve ser conservada em geladeira (2°C - 8°C) e usada dentro de 8 horas após a reconstituição.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve-se perguntar ao farmacêutico como descartar os medicamentos que não são mais usados. Este procedimento ajudará a proteger o meio ambiente.
6. Conteúdo do embalagem e outras informações
O que contém a vacina Priorix
Os componentes ativos da vacina são vírus vivos atenuados: sarampo, rubéola e rubéola.
Os outros componentes da vacina são:
Pó: aminoácidos (incluindo fenilalanina), lactose (anidra), manitol (E 421), sorbitol (E 420),
meio 199 (incluindo fenilalanina, ácido para-aminobenzoico, sódio e potássio).
Solvente: água para injeção.
Como é a vacina Priorix e o que contém a embalagem
A vacina Priorix é apresentada como pó e solvente para preparar solução injectável (pó em frasco de dose única e solvente em ampola de 0,5 ml) em embalagens de:
2 agulhas separadas: embalagens de 1 ou 10 unidades,
sem agulhas: embalagens de 1 ou 10 unidades.
Priorix é fornecido como um pó branco a levemente rosado, que pode ser amarelado a levemente alaranjado, e um solvente transparente e incolor (água para injeção). Estes componentes formam a vacina após a reconstituição.
Nem todos os tipos de embalagens precisam estar disponíveis no mercado.
Responsável e fabricante
GlaxoSmithKline Biologicals S.A.
rue de l’Institut 89
1330 Rixensart, Bélgica
Data da última atualização do folheto:07/2025
Outras fontes de informação
Informações detalhadas sobre este medicamento estão disponíveis no sítio web da Agência Reguladora de Produtos Farmacêuticos, Produtos Médicos e Produtos Biocidas .
------------------------------------------------------------------------------------------------------------------------
Informações destinadas apenas ao pessoal médico especializado:
Assim como no caso de todas as vacinas administradas por injeção, existe a possibilidade de ocorrência de uma reação anafilática rara, por isso deve-se garantir a possibilidade de assistência médica especializada imediatamente após a vacinação.
Álcool e outros meios de desinfecção devem evaporar da pele antes da administração da vacina, pois podem causar a inativação dos vírus atenuados presentes na vacina.
A vacina Priorix não deve ser administrada por via intravenosa.
Devido à falta de estudos de compatibilidade, a vacina não deve ser misturada com outros produtos farmacêuticos.
O solvente e a vacina reconstituída devem ser avaliados visualmente antes da reconstituição e antes da administração, para verificar a presença de partículas estranhas e/ou alterações físicas. Se for detectada qualquer anormalidade no aspecto, não se deve usar o solvente ou a vacina preparada.
A vacina deve ser reconstituída adicionando todo o solvente da ampola ao frasco de pó.
Para conectar a agulha à ampola, deve-se seguir as instruções apresentadas nas figuras 1 e 2. A ampola fornecida com a vacina PRIORIX pode diferir ligeiramente da apresentada na figura (pode não ter rosca para aparafusar a agulha). Nesse caso, a agulha deve ser fixada sem aparafusar.
Agulha
Ampola
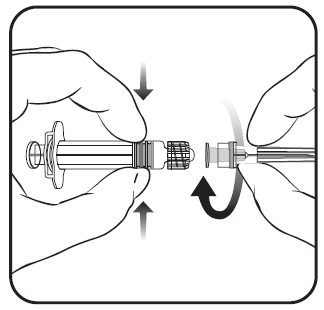
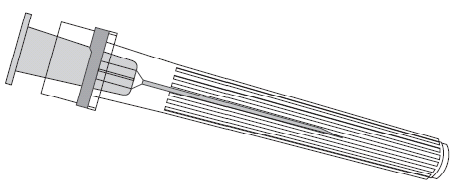
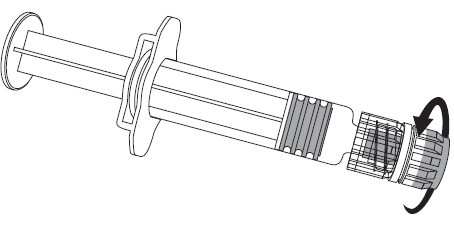
Deve-se sempre segurar a ampola pelo corpo, não pelo êmbolo ou pelo adaptador Luer Lock (ang. Luer Lock Adaptor, LLA), e a agulha deve ser mantida no eixo da ampola (como mostrado na figura 2). Não seguir essas recomendações pode causar a torção do adaptador LLA e o vazamento da ampola.
Se, durante a conexão da agulha à ampola, o adaptador LLA se soltar, deve-se usar uma nova dose da vacina (nova ampola e frasco).
Figura 1. Figura 2.
- 1. Deve-se desrosquear a tampa da ampola girando-a no sentido contrário ao dos ponteiros do relógio (como mostrado na figura 1).
Independentemente de o adaptador LLA girar ou não, deve-se seguir as instruções abaixo:
- 2. Deve-se fixar a agulha à ampola conectando suavemente a ponta da agulha ao adaptador LLA e girando-a um quarto de volta no sentido dos ponteiros do relógio, até sentir o bloqueio da agulha (como mostrado na figura 2).
- 3. Deve-se remover a capa da agulha, que pode oferecer resistência.
- 4. Deve-se adicionar o solvente ao pó. Em seguida, deve-se agitar energicamente até que o pó esteja completamente dissolvido.
Dependendo das pequenas variações de pH, a vacina reconstituída pode ter uma cor que varia de rosa a rosa com tons de fuksia, o que não afeta sua eficácia.
- 5. Deve-se aspirar todo o conteúdo do frasco.
- 6. Para administrar a vacina, deve-se usar uma agulha nova. Para isso, deve-se desrosquear a agulha da ampola e conectar a agulha para injeção, seguindo as instruções contidas no ponto 2.
Após a reconstituição, a vacina deve ser usada imediatamente. Se não for possível, deve ser conservada em temperatura de 2°C a 8°C e usada dentro de 8 horas após a reconstituição.
Todos os resíduos do produto não utilizado ou seus resíduos devem ser eliminados de acordo com as regulamentações locais.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PriorixForma farmacêutica: Pó, -Substância ativa: measles, combinations with mumps, rubella and varicella, live attenuatedRequer receita médicaForma farmacêutica: Pó, -Substância ativa: measles, combinations with mumps, rubella and varicella, live attenuatedFabricante: GlaxoSmithKline Biologicals S.A.Requer receita médicaForma farmacêutica: Suspensão, 160 unidades antigénicas ELISA do vírus da hepatite A, estirpe GBM/0,5 ml; 1 dose (0,5 ml)Substância ativa: hepatitis A, inactivated, whole virusRequer receita médica
Alternativas a Priorix noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Priorix em Espanha
Alternativa a Priorix em Ukraine
Médicos online para Priorix
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Priorix – sujeita a avaliação médica e regras locais.














