
Phingroum
Pergunte a um médico sobre a prescrição de Phingroum

Como usar Phingroum
Folheto informativo para o doente
PHINGROUM, 25 mg, comprimidos revestidos
PHINGROUM, 50 mg, comprimidos revestidos
PHINGROUM, 100 mg, comprimidos revestidos
Sitagliptina
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto
- 1. O que é o medicamento PHINGROUM e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento PHINGROUM
- 3. Como tomar o medicamento PHINGROUM
- 4. Efeitos não desejados
- 5. Como conservar o medicamento PHINGROUM
- 6. Conteúdo do pacote e outras informações
1. O que é o medicamento PHINGROUM e para que é utilizado
O PHINGROUM contém a substância ativa sitagliptina, que pertence a uma classe de medicamentos chamados inibidores da DPP-4 (inibidores da dipeptidilpeptidase-4), que reduzem os níveis de açúcar no sangue em adultos com diabetes do tipo 2.
Este medicamento ajuda a aumentar os níveis de insulina liberados após as refeições e a reduzir a quantidade de açúcar produzida pelo organismo.
O médico prescreveu este medicamento para reduzir os níveis elevados de açúcar no sangue, resultado da diabetes do tipo 2. O medicamento pode ser utilizado sozinho ou em combinação com outros medicamentos (insulina, metformina, derivados de sulfonylureia ou glitazonas) que reduzem os níveis de açúcar no sangue, que podem ser tomados em conjunto com as refeições e um programa de exercícios físicos.
O que é a diabetes do tipo 2?
A diabetes do tipo 2 é uma doença em que o organismo não produz insulina em quantidades suficientes, e a insulina produzida não funciona como deveria. O organismo também pode produzir demasiado açúcar.
Se isso acontecer, o açúcar (glicose) se acumula no sangue. Isso pode levar a problemas de saúde graves, como doenças cardíacas, renais, perda de visão e amputação de membros.
2. Informações importantes antes de tomar o medicamento PHINGROUM
Quando não tomar o medicamento PHINGROUM
- se o doente tiver alergia à sitagliptina ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Advertências e precauções
Em doentes que tomam o medicamento PHINGROUM, foram relatados casos de pancreatite (ver ponto 4).
Se o doente apresentar bolhas na pele, pode ser um sinal de uma doença chamada pemfigoide bolhoso. O médico pode aconselhar o doente a interromper a tomada do medicamento PHINGROUM.
Deve informar o médico se o doente tiver ou tiver tido:
- doença pancreática (por exemplo, pancreatite);
- pedras na vesícula, dependência de álcool ou níveis muito elevados de triglicéridos (uma forma de gordura) no sangue. Nesses casos, pode aumentar o risco de pancreatite (ver ponto 4);
- diabetes do tipo 1;
- acidose cetónica na diabetes (uma complicação da diabetes caracterizada por níveis elevados de açúcar no sangue, perda rápida de peso, náuseas ou vómitos);
- qualquer doença renal atual ou prévia;
- reação alérgica ao medicamento PHINGROUM (ver ponto 4).
Como este medicamento não funciona quando os níveis de açúcar no sangue são baixos, é improvável que cause níveis baixos de açúcar no sangue. No entanto, se este medicamento for tomado em conjunto com um derivado de sulfonylureia ou insulina, pode ocorrer hipoglicemia (nível baixo de açúcar no sangue). O médico pode reduzir a dose do derivado de sulfonylureia ou insulina.
Crianças e adolescentes
Crianças e adolescentes com menos de 18 anos não devem tomar este medicamento. Este medicamento não é eficaz em crianças e adolescentes com idades entre 10 e 17 anos. Não se sabe se este medicamento é seguro e eficaz em crianças com menos de 10 anos.
PHINGROUM e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que o doente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o doente planeia tomar.
Em particular, deve informar o médico se o doente está tomando digoxina (um medicamento utilizado para tratar arritmias cardíacas e outras doenças cardíacas). Ao tomar o medicamento PHINGROUM com digoxina, deve ser monitorado o nível de digoxina no sangue.
Gravidez e amamentação
Se a doente estiver grávida ou amamentando, achar que pode estar grávida ou planejar ter um filho, deve consultar o médico ou farmacêutico antes de tomar este medicamento.
Não deve tomar este medicamento durante a gravidez.
Não se sabe se este medicamento passa para o leite materno. Não deve tomar este medicamento durante a amamentação ou se planeia amamentar.
Condução de veículos e utilização de máquinas
Este medicamento não tem ou tem um efeito insignificante na capacidade de conduzir veículos e utilizar máquinas. No entanto, ao conduzir veículos e utilizar máquinas, deve ter em conta que foram relatados casos de tontura e sonolência.
Ao tomar este medicamento em conjunto com medicamentos chamados derivados de sulfonylureia ou insulina, pode ocorrer hipoglicemia, o que pode afetar a capacidade de conduzir veículos e utilizar máquinas ou trabalhar sem um apoio seguro para os pés.
PHINGROUM contém sódio
O medicamento PHINGROUM contém menos de 1 mmol de sódio (23 mg) por dose, ou seja, o medicamento é considerado "livre de sódio".
3. Como tomar o medicamento PHINGROUM
Este medicamento deve ser sempre tomado de acordo com as instruções do médico. Em caso de dúvidas, deve consultar o médico ou farmacêutico.
A dose usualmente recomendada é:
- um comprimido revestido de 100 mg;
- uma vez por dia;
- tomado por via oral.
Se o doente tiver problemas renais, o médico pode recomendar uma dose menor do medicamento PHINGROUM (por exemplo, 25 mg ou 50 mg).
Este medicamento pode ser tomado com ou sem alimentos e bebidas.
O médico pode recomendar a tomada apenas deste medicamento ou deste medicamento e de certos outros medicamentos que reduzem os níveis de açúcar no sangue.
A dieta e os exercícios físicos ajudam o organismo a utilizar melhor o açúcar no sangue.
Ao tomar o medicamento PHINGROUM, é importante seguir a dieta e os exercícios físicos recomendados pelo médico.
O comprimido de 50 mg e o comprimido de 100 mg do medicamento [Nome de marca] podem ser divididos em duas doses iguais.
Se o médico prescreveu meia dose de 50 mg ou meia dose de 100 mg, deve seguir as instruções abaixo para dividir os comprimidos [Nome de marca].
Instruções para dividir o comprimido
- 1. Colocar o comprimido sobre uma superfície plana e dura (por exemplo, uma mesa, um balcão), com a linha de divisão na superfície superior.
- 2. Quebrar o comprimido ao longo da linha vertical, pressionando-o contra a superfície com dois dedos indicadores, como mostrado nas figuras 1 e 2.
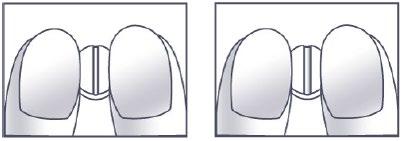
Figuras 1 e 2: Divisão do comprimido do medicamento [Nome de marca] em duas doses iguais.
Tomada de uma dose maior do que a recomendada do medicamento PHINGROUM
Em caso de tomada de uma dose maior do que a recomendada do medicamento, deve contactar imediatamente o médico.
Omissão da tomada do medicamento PHINGROUM
Em caso de omissão da dose, deve tomar a dose o mais rápido possível. Se a próxima dose estiver próxima, deve omitir a dose omitida e continuar a tomar o medicamento de acordo com o esquema usual. Não deve tomar uma dose dupla.
Interrupção da tomada do medicamento PHINGROUM
Para manter o controlo dos níveis de açúcar no sangue, o medicamento deve ser tomado durante o período de tempo recomendado pelo médico. Não deve interromper a tomada do medicamento sem consultar previamente o médico.
Em caso de dúvidas adicionais sobre a tomada do medicamento, deve consultar o médico ou farmacêutico.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Deve interromper a tomada do medicamento PHINGROUM e contactar imediatamente o médico em caso de ocorrência de algum dos seguintes efeitos não desejados graves:
- Dor abdominal forte e persistente (na área do estômago), que pode irradiar para as costas, com ou sem náuseas e vómitos - podem ser sintomas de pancreatite.
Em caso de ocorrência de uma reação alérgica grave (frequência desconhecida), incluindo erupções cutâneas, urticária, bolhas na pele ou descamação da pele, e edema de face, lábios, língua e garganta, que pode causar dificuldades respiratórias ou de deglutição, deve interromper a tomada do medicamento e contactar imediatamente o médico. O médico pode prescrever um medicamento para tratar a reação alérgica e outro medicamento para tratar a diabetes.
Em alguns doentes que tomaram sitagliptina em combinação com metformina, ocorreram os seguintes efeitos não desejados:
Frequentes (podem ocorrer em até 1 em cada 10 doentes): hipoglicemia, náuseas, inchaço, vómitos.
Não muito frequentes (podem ocorrer em até 1 em cada 100 doentes): dor abdominal, diarreia, constipação, sonolência.
Alguns doentes relataram problemas gastrointestinais após o início do tratamento com sitagliptina em combinação com metformina (frequentes).
Em alguns doentes que tomaram sitagliptina em combinação com um derivado de sulfonylureia e metformina, ocorreram os seguintes efeitos não desejados:
Muito frequentes (podem ocorrer em mais de 1 em cada 10 doentes): hipoglicemia.
Frequentes: constipação.
Em alguns doentes que tomaram sitagliptina e pioglitazona, ocorreram os seguintes efeitos não desejados:
Frequentes: inchaço, edema nas mãos ou pés.
Em alguns doentes que tomaram sitagliptina em combinação com pioglitazona e metformina, ocorreram os seguintes efeitos não desejados:
Frequentes: edema nas mãos ou pés.
Em alguns doentes que tomaram sitagliptina em combinação com insulina (com ou sem metformina), ocorreram os seguintes efeitos não desejados:
Frequentes: gripe.
Não muito frequentes: secura na boca.
Em alguns doentes que tomaram sitagliptina sozinha ou em combinação com outros medicamentos antidiabéticos em estudos clínicos ou após a comercialização, ocorreram os seguintes efeitos não desejados:
Frequentes: hipoglicemia, dor de cabeça, infecções do trato respiratório superior, congestão nasal ou sinusite e dor de garganta, artrite, dor no ombro ou perna.
Não muito frequentes: tontura, constipação, prurido.
Raro: redução do número de plaquetas.
Frequência desconhecida: doenças renais (por vezes necessitando de diálise), vómitos, dor nas articulações, dor muscular, dor nas costas, doença pulmonar intersticial, pemfigoide bolhoso (um tipo de bolha na pele).
Notificação de efeitos não desejados
Se ocorrerem algum efeito não desejado, incluindo qualquer efeito não desejado não mencionado no folheto, deve informar o médico ou farmacêutico, ou enfermeira. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos da Agência Nacional de Medicamentos e Produtos de Saúde
Rua [inserir rua]
[inserir cidade]
Telefone: [inserir telefone]
Fax: [inserir fax]
Sítio internet: [inserir sítio internet]
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar o medicamento PHINGROUM
Não há recomendações especiais para a conservação do medicamento.
O medicamento deve ser conservado em um local seguro e fora do alcance das crianças.
Não deve tomar o medicamento após a data de validade impressa no blister e na caixa, após "EXP". A data de validade é o último dia do mês indicado.
A inscrição no pacote após o código "EXP" indica a data de validade, e após o código "Lote/LOT" indica o número do lote.
Os medicamentos não devem ser jogados na canalização ou nos contentores de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são utilizados. Este procedimento ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém o medicamento PHINGROUM
- A substância ativa do medicamento é a sitagliptina. Cada comprimido revestido contém sitagliptina cloridrato monohidratado, correspondente a 25 mg, 50 mg ou 100 mg de sitagliptina.
- Os outros componentes são: Núcleo do comprimido: celulose microcristalina, fosfato de cálcio dibásico, carboximetilcelulose sódica (tipo A), dióxido de silício coloidal anidro, fumarato de sódio. Revestimento do comprimido: álcool polivinílico, macrogol 3350, talco, dióxido de titânio (E 171), óxido de ferro amarelo (E 172), óxido de ferro vermelho (E 172).
Como é o medicamento PHINGROUM e o que contém o pacote
[Nome de marca] 25 mg: comprimido revestido rosa claro, redondo, convexo em ambos os lados; diâmetro do comprimido 5,9-6,3 mm.
[Nome de marca] 50 mg: comprimido revestido laranja claro, redondo, convexo em ambos os lados, com uma linha de divisão de um lado e a inscrição "50" do outro lado; diâmetro do comprimido 7,9-8,3 mm.
O comprimido pode ser dividido em duas doses iguais.
[Nome de marca] 100 mg: comprimido revestido marrom claro, redondo, convexo em ambos os lados, com uma linha de divisão de um lado e a inscrição "100" do outro lado; diâmetro do comprimido 9,9-10,4 mm.
O comprimido pode ser dividido em duas doses iguais.
Blisters de PVC/PVDC/Alumínio, em caixas de cartão. Embalagens de 14, 28, 30, 56, 84, 90, 98 comprimidos revestidos.
Nem todos os tamanhos de embalagem podem estar disponíveis.
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
telefone: + 48 22 364 61 01
Fabricante
FARMAPROJECTS S.A.U.
Parc Cientific de Barcelona
C/ Baldiri Reixac, 4/12 e 15
08028 Barcelona, Espanha
Data da última atualização do folheto: junho de 2024
- País de registo
- Substância ativa
- Requer receita médicaSim
- ImportadorFarmaprojects S.A.U.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a PhingroumForma farmacêutica: Comprimidos, 25 mgSubstância ativa: sitagliptinFabricante: Lek Pharmaceuticals d.d. LEK S.A.Requer receita médicaForma farmacêutica: Comprimidos, 50 mgSubstância ativa: sitagliptinFabricante: Lek Pharmaceuticals d.d. LEK S.A.Requer receita médicaForma farmacêutica: Comprimidos, 100 mgSubstância ativa: sitagliptinFabricante: Lek Pharmaceuticals d.d. LEK S.A.Requer receita médica
Alternativas a Phingroum noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Phingroum em Espanha
Alternativa a Phingroum em Ukraine
Médicos online para Phingroum
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Phingroum – sujeita a avaliação médica e regras locais.










