
Mirtor
Pergunte a um médico sobre a prescrição de Mirtor

Como usar Mirtor
Folheto informativo para o doente
Atenção! Deve conservar o folheto. Informação no embalagem primário em língua estrangeira.
Mirtor, 30 mg, comprimidos de desintegração oral
Mirtazapina
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de dúvidas, deve consultar um médico ou farmacêutico.
- Este medicamento foi prescrito especificamente para si. Não o deve dar a outros. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito adverso, incluindo quaisquer efeitos adversos não mencionados neste folheto, deve informar o seu médico, farmacêutico ou enfermeira. Ver ponto 4.
Índice do folheto:
- 1. O que é o Mirtor e para que é utilizado
- 2. Informações importantes antes de tomar o Mirtor
- 3. Como tomar o Mirtor
- 4. Efeitos adversos
- 5. Como conservar o Mirtor
- 6. Conteúdo do embalagem e outras informações
1. O que é o Mirtor e para que é utilizado
O Mirtor pertence a um grupo de medicamentos conhecidos como antidepressivos.
O Mirtor é utilizado no tratamento da depressão em adultos.
O Mirtor começa a fazer efeito após 1-2 semanas de tratamento, e após 2-4 semanas, pode ocorrer
melhoria do bem-estar. Se após 2-4 semanas de tratamento não ocorrer melhoria ou o doente se sentir
pior, deve consultar um médico. Mais informações estão disponíveis no ponto 3 da seção "Quando pode
esperar melhoria do bem-estar".
2. Informações importantes antes de tomar o Mirtor
Quando não tomar o Mirtor:
- se o doente for alérgico à mirtazapina ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6). Nesse caso, antes de tomar o Mirtor, deve contactar o seu médico o mais rápido possível.
- se atualmente ou recentemente (nos últimos 2 semanas) estiver a tomar medicamentos da classe dos inibidores da monoamina oxidase (IMAO).
Precauções e advertências
Antes de começar a tomar o Mirtor, deve discutir com o seu médico ou farmacêutico.
Antes de começar a tomar o Mirtor, deve informar o seu médico:
Se o doente já teve alguma vez uma erupção cutânea grave ou descamação da pele, bolhas e (ou)
úlceras na boca após a ingestão do Mirtor.
Crianças e adolescentes
Normalmente, o Mirtor não deve ser utilizado em crianças e adolescentes abaixo de 18 anos,
pois não foi demonstrada a sua eficácia nessa faixa etária. Além disso, deve estar ciente de que em
doentes abaixo de 18 anos, há um risco mais elevado de efeitos adversos, tais como tentativas de
suicídio, pensamentos suicidas e hostilidade (principalmente agressividade, comportamento rebelde
e ira), quando tomam medicamentos desta classe. No entanto, o médico pode prescrever o Mirtor a
doentes desta faixa etária, se considerar que está no melhor interesse deles. Se o médico prescrever o
Mirtor a um doente abaixo de 18 anos, e surgirem alguma dúvida, deve consultar o médico. Em
doentes abaixo de 18 anos que tomam o Mirtor, deve informar o médico se algum dos sintomas
mencionados acima se desenvolver ou agravar. O efeito a longo prazo do Mirtor na segurança em
termos de crescimento, amadurecimento e desenvolvimento cognitivo nesta faixa etária também não
foi estabelecido. Além disso, nesta faixa etária, após a administração de mirtazapina, foi mais
freqüentemente observado um aumento significativo de peso.
Pensamentos suicidas e piora da depressão
Doentes com depressão podem, por vezes, ter pensamentos de autolesão ou de suicídio.
Tais sintomas ou comportamento podem agravar-se no início do tratamento com antidepressivos,
pois estes medicamentos geralmente começam a fazer efeito apenas após cerca de 2 semanas, por
vezes mais tarde. Os sintomas acima são mais prováveis em:
- doentes que já tiveram pensamentos de autolesão ou suicídio anteriormente;
- jovens adultos. Os dados dos estudos clínicos mostram um risco aumentado de comportamento suicida em pessoas com menos de 25 anos com distúrbios psiquiátricos que estavam a tomar antidepressivos. Deve contactar imediatamente um médico ou ir ao hospital, se ocorrerem pensamentos de autolesão ou suicídio.
Pode ser útil informar familiares ou amigossobre a depressão e pedir-lhes para lerem este folheto. O doente pode pedir para ser informado se notarem que a depressão ou a ansiedade pioraram ou se ocorrerem mudanças preocupantes no comportamento.
Além disso, deve ter especial cuidado ao tomar o Mirtor
- Se ocorrerem ou tiverem ocorrido: (Deve informar o médico sobre a ocorrência das seguintes doenças antes de começar a tomar o Mirtor, se o doente não o fez anteriormente.)
- convulsões. Se ocorrerem convulsões ou aumento da frequência das convulsões durante o tratamento, o medicamento deve ser descontinuado e deve contactar imediatamente um médico;
- doenças do fígado, incluindo icterícia. Se ocorrer icterícia, o medicamento deve ser descontinuado e deve contactar imediatamente um médico;
- doenças renais;
- doenças cardíacasou baixa pressão arterial;
- esquizofrenia. Deve contactar imediatamente um médico, se os distúrbios psicóticos, tais como sintomas paranoides, se agravarem ou aumentarem de frequência;
- depressão maníaca(períodos alternados de humor elevado/excitação e depressão). Se ocorrer um sentimento de excitação excessiva, o medicamento deve ser descontinuado e deve contactar imediatamente um médico;
- diabetes(pode ser necessário ajustar a dose de insulina ou de outros medicamentos hipoglicemiantes);
- doenças oculares, tais como pressão intra-ocular elevada (glaucoma);
- dificuldades para urinar, que podem resultar de uma próstata aumentada;
- certos distúrbios cardíacosque podem causar alterações no ritmo cardíaco, ataque cardíaco recente, insuficiência cardíaca ou uso de certos medicamentos que podem causar alterações no ritmo cardíaco.
- Se ocorrerem sintomas de infecção, tais como febre de causa desconhecida, dor de garganta, úlceras na boca, deve descontinuar o medicamento, consultar imediatamente um médico e realizar um exame de sangue. Em casos raros, esses sintomas podem ser um sinal de distúrbios da produção de glóbulos vermelhos pela medula óssea. Esses sintomas são raros, geralmente ocorrem após 4-6 semanas de tratamento.
- Doentes idosos são frequentemente mais sensíveis, especialmente aos efeitos adversos dos antidepressivos.
- Foram relatados reações cutâneas graves, incluindo síndrome de Stevens-Johnson (SJS), necrólise epidérmica tóxica (TEN), reação a medicamentos com eosinofilia e sintomas sistémicos (DRESS) durante o tratamento com mirtazapina. Se o doente notar algum dos sintomas descritos no ponto 4 relacionados a essas reações cutâneas graves, deve interromper imediatamente o tratamento e consultar um médico. Se o doente já teve alguma vez reações cutâneas graves, não deve reiniciar o tratamento com mirtazapina.
Mirtor e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar.
Não deve tomar o Mirtor em combinação com:
- inibidores da monoamina oxidase (IMAO), nem antes de decorridas 2 semanas após a interrupção do tratamento com IMAO. Não deve iniciar o tratamento com IMAO antes de decorridas 2 semanas após a interrupção do tratamento com o Mirtor. Os inibidores da IMAO incluem moclobeida, tranilcipromina (medicamentos antidepressivos), selegilina (usada no tratamento da doença de Parkinson).
Deve ter cuidado ao tomar o Mirtor em combinação com:
- outros medicamentos antidepressivos, como ISRS, venlafaxina e L-triptofano ou triptanos(usados no tratamento de enxaqueca), tramadol(medicamento analgésico), buprenorfina, linezolida(antibiótico), sales de lítio(usados no tratamento de certos distúrbios psiquiátricos), azul de metileno(usado para reduzir níveis elevados de metemoglobina no sangue) preparações que contenham erva-de-são-joão (Hypericum perforatum)(preparações fitoterápicas usadas no tratamento da depressão). Em doentes que tomam apenas o Mirtor ou em terapia combinada com esses medicamentos, pode ocorrer muito raramente síndrome serotoninérgica. Alguns dos sintomas incluem febre súbita, suor, aumento da frequência cardíaca, diarreia, (movimentos musculares não controlados) espasmos musculares, arrepios, aumento dos reflexos, ansiedade, mudanças de humor, perda de consciência. Deve contactar imediatamente um médico, se ocorrerem vários desses sintomas.
- medicamento antidepressivo, nefazodona. Pode aumentar a concentração do Mirtor no sangue. Deve informar o médico sobre a ingestão deste medicamento. Pode ser necessário reduzir a dose do Mirtor, e após a interrupção do tratamento com nefazodona, aumentar a dose do Mirtor.
- medicamentos usados no tratamento de ansiedade e insônia, como benzodiazepinas.
- medicamentos usados no tratamento da esquizofrenia, como olanzapina.
- medicamentos usados no tratamento de alergias, como cetirizina.
- medicamentos usados no tratamento de dor intensa, como morfina. O Mirtor em combinação com esses medicamentos pode aumentar a sonolência.
- medicamentos usados no tratamento de infecções, como antibióticos (eritromicina), medicamentos antifúngicos (como cetoconazol) e medicamentos usados no tratamento de HIV/AIDS (como inibidores da protease do HIV) e medicamentos usados no tratamento de úlceras gástricas (como cimetidina). Se iniciar o tratamento com esses medicamentos em combinação com o Mirtor, a concentração do Mirtor no sangue pode aumentar. Deve informar o médico sobre a ingestão desses medicamentos. Pode ser necessário reduzir a dose do Mirtor, e após a interrupção do tratamento com esses medicamentos, aumentar a dose do Mirtor.
- medicamentos antiepilépticos, como carbamazepina e fenitoína.
- medicamentos usados no tratamento da tuberculose, como rifampicina. Em combinação com o Mirtor, esses medicamentos podem reduzir a concentração do Mirtor no sangue. Deve informar o médico sobre a ingestão desses medicamentos. Pode ser necessário aumentar a dose do Mirtor, e após a interrupção do tratamento com esses medicamentos, reduzir a dose do Mirtor.
- medicamentos anticoagulantes, como varfarina. O Mirtor pode aumentar o efeito da varfarina. Deve informar o médico sobre a ingestão desses medicamentos. No caso de tratamento combinado com o Mirtor, é recomendável monitorizar o hemograma.
- medicamentos que podem afetar o ritmo cardíaco, como alguns antibióticos e medicamentos antipsicóticos.
Mirtor com alimentos e álcool
O consumo de álcool durante o tratamento com o Mirtor pode causar sonolência. É recomendável evitar o consumo de álcool durante o tratamento com o Mirtor.
O Mirtor pode ser tomado com ou sem alimentos.
Página 3 9Gravidez e amamentação
Se a paciente estiver grávida, amamentando, suspeitar que possa estar grávida ou planejar ter um filho, deve consultar um médico ou farmacêutico antes de tomar este medicamento.
A experiência limitada com o uso do Mirtor em mulheres grávidas não mostrou um aumento do risco. No entanto, deve ter cuidado ao usar o medicamento durante a gravidez.
Se o Mirtor for tomado durante a gravidez ou pouco antes do parto, é recomendável monitorizar o recém-nascido devido ao risco de efeitos adversos.
Medicamentos semelhantes (da classe dos inibidores da recaptação de serotonina - ISRS) usados por mulheres grávidas podem aumentar o risco de ocorrência de uma doença grave chamada hipertensão pulmonar persistente do recém-nascido (PPHN), que causa respiração acelerada e cianose no bebê. Esses sintomas geralmente ocorrem no primeiro dia de vida do bebê. Se ocorrerem, deve contactar imediatamente a parteira e/ou o médico.Condução de veículos e operação de máquinas
O Mirtor pode reduzir a vigilância e a capacidade de concentração. Durante o tratamento com o Mirtor, deve evitar realizar tarefas potencialmente perigosas que requeiram atenção contínua, como conduzir veículos ou operar máquinas. Se o médico prescrever o Mirtor a um doente abaixo de 18 anos, deve certificar-se de que o medicamento não está a perturbar a concentração e a vigilância do doente antes de participar no tráfego rodoviário (por exemplo, ao andar de bicicleta).
- Se o doente tiver menos de 18 anos, deve certificar-se de que o medicamento não está a perturbar a concentração e a vigilância do doente antes de participar no tráfego rodoviário (por exemplo, ao andar de bicicleta).
O Mirtor contém aspartamo, uma fonte de fenilalanina
Este medicamento contém aspartamo, que é uma fonte de fenilalanina. Cada comprimido de desintegração oral de 30 mg contém 6 mg de aspartamo. O aspartamo pode ser prejudicial a doentes com fenilcetonúria. É uma doença genética rara, na qual a fenilalanina se acumula no organismo devido à sua eliminação anormal.
3. Como tomar o Mirtor
Este medicamento deve ser sempre usado de acordo com as recomendações do médico ou farmacêutico. Em caso de dúvidas, deve consultar um médico ou farmacêutico.
O Mirtor está disponível nas seguintes doses: 15 mg, 30 mg e 45 mg.Dosagem
A dose inicial recomendada é de 15 ou 30 mg por dia. Após alguns dias de tratamento, o médico pode recomendar um aumento da dose para a dose mais adequada para o doente (de 15 a 45 mg por dia). Geralmente, a mesma dose do medicamento é usada em doentes de diferentes idades. No entanto, em doentes idosos ou com doenças renais e hepáticas, o médico pode recomendar uma dose diferente do Mirtor.
Quando tomar o Mirtor
Deve tomar o Mirtor todos os dias no mesmo horário, preferencialmente em uma única dose à noite, antes de deitar. O médico pode, no entanto, recomendar a administração de duas doses divididas ao longo do dia - uma de manhã e outra à noite, antes de dormir. A dose maior deve ser tomada à noite, antes de dormir.
Informações sobre a administração de comprimidos de desintegração oral:
Os comprimidos de desintegração oral do Mirtor devem ser tomados por via oral.
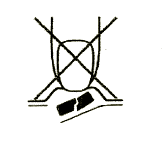
1. Não deve partir o comprimido de desintegração oral
Para evitar partir o comprimido de desintegração oral, não deve pressionar o sachê que contém o comprimido (Figura A).
Figura A
Página 4 9
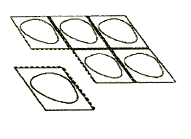
2. Deve separar o sachê com o comprimido
Cada blister contém 6 sachês com comprimidos, separados por uma linha de perfuração. Deve dobrar o blister e separar um sachê ao longo da linha de perfuração (Figura 1).
Figura 1
3. Deve remover a folha
Deve remover cuidadosamente a folha que cobre o comprimido, começando pela ponta marcada com uma seta (Figuras 2 e 3).
Figura 2
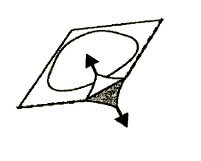
Figura 3
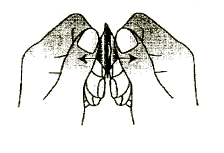
4. Deve remover o comprimido de desintegração oral
Deve remover o comprimido de desintegração oral com a mão seca do sachê e colocá-lo na língua. (Figura 4).
Figura 4
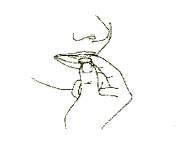
Página 5 9
O comprimido se desintegra rapidamente e pode ser engolido sem água.Quando pode esperar melhoria do bem-estar
Pode esperar os primeiros sinais de efeito do medicamento após 1-2 semanas de tratamento, e após 2-4 semanas, pode ocorrer melhoria do bem-estar.
É importante discutir com o médico os efeitos do Mirtor durante as primeiras semanas de tratamento:- Ao fim de 2 a 4 semanas após o início do tratamento com o Mirtor, deve discutir com o médico os efeitos do tratamento até ao momento. Se não houver resposta clínica adequada, o médico pode aumentar a dose. Ao fim de mais 2 a 4 semanas, deve discutir novamente com o médico os efeitos do tratamento. O tratamento deve ser continuado até que os sintomas desapareçam completamente, o que geralmente dura 4 a 6 meses.
Uso de dose maior do que a recomendada do Mirtor
Se o doente ou alguém tomar uma dose maior do que a recomendada do Mirtor, deve contactar imediatamente um médico.
Os sinais esperados de superdose do Mirtor (sem outros medicamentos e sem álcool) são sonolência,
desorientação e aumento da frequência cardíaca. Os sinais de superdose do medicamento podem incluir alterações do ritmo cardíaco (aumento da frequência cardíaca, ritmo cardíaco irregular) e (ou) desmaio. Esses podem ser sinais de distúrbios cardíacos graves, conhecidos como "torsades de pointes".Esquecimento de tomar o Mirtor
Se esquecer de tomar o medicamento que deve ser tomado uma vez por dia
- não deve tomar uma dose dupla para compensar a dose esquecida. Deve tomar a próxima dose no horário habitual.
Se, no entanto, o medicamento deve ser tomado duas vezes por dia
- se esquecer de tomar a dose da manhã - deve tomá-la com a dose da noite;
- se esquecer de tomar a dose da noite - não deve tomá-la com a dose da manhã; deve continuar o tratamento tomando as doses habituais da manhã e da noite;
- se esquecer de tomar as duas doses - não deve tentar compensá-las; deve continuar o tratamento tomando as doses habituais da manhã e da noite no dia seguinte.
Interrupção do tratamento com o Mirtor
Deve interromper o tratamento com o Mirtor apenas de acordo com as instruções do médico.
Não deve interromper o tratamento com o medicamento demasiado cedo, pois isso pode causar a recorrência da doença. Se ocorrer melhoria, deve discutir com o médico. O médico informará quando pode interromper o tratamento.
A interrupção abrupta do tratamento com o Mirtor, mesmo que os sintomas da depressão tenham desaparecido, pode causar náuseas, tonturas, agitação ou ansiedade e dor de cabeça. Esses sintomas não ocorrerão durante a interrupção gradual do medicamento. O médico informará como reduzir gradualmente as doses do medicamento.
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar um médico ou farmacêutico.4. Efeitos adversos
Como qualquer medicamento, este medicamento pode causar efeitos adversos, embora não ocorram em todos.
Se ocorrerem algum dos seguintes efeitos adversos graves, deve interromper o tratamento com a mirtazapina e contactar imediatamente um médico.Em caso de ocorrência dos seguintes efeitos adversos graves, deve interromper o tratamento com a mirtazapina e contactar imediatamente um médico.
Não muito frequentes(podem ocorrer em até 1 pessoa em 100):
Página 6 9- humor elevado e aumento da atividade psíquica (mania)
Raros(podem ocorrer em até 1 pessoa em 1.000):
- icoloração amarelada da pele e dos olhos; o que pode indicar distúrbios da função hepática (icterícia)
Frequência desconhecida(frequência não pode ser estimada com base nos dados disponíveis):
- sinais de infecção, tais como febre súbita e inexplicável, dor de garganta e úlceras na boca (agranulocitose). Em casos raros, a mirtazapina pode causar distúrbios da produção de glóbulos vermelhos (supressão da medula óssea). Em alguns doentes, pode ocorrer uma redução temporária do número de glóbulos brancos (granulocitopenia). Em casos raros, a mirtazapina pode causar redução do número de glóbulos vermelhos e brancos e plaquetas (anemia aplástica), redução do número de plaquetas (trombocitopenia) ou aumento do número de glóbulos brancos (eosinofilia)
- convulsões (crises epilépticas)
- combinação de sintomas, tais como febre inexplicável, suor, aumento da frequência cardíaca, diarreia, (movimentos musculares não controlados) espasmos musculares, arrepios, aumento dos reflexos, ansiedade, mudanças de humor, perda de consciência e aumento da salivação. Em casos muito raros, esses sintomas podem indicar o desenvolvimento de síndrome serotoninérgica
- pensamentos de autolesão ou suicídio
- reações cutâneas graves:
- manchas vermelhas semelhantes a um alvo ou manchas redondas, frequentemente com bolhas centrais no tronco, descamação da pele, úlceras na boca, garganta, nariz, genitálias e olhos. A ocorrência dessas reações cutâneas graves é frequentemente precedida por febre e sintomas semelhantes aos da gripe (síndrome de Stevens-Johnson, necrólise epidérmica tóxica).
- erupção cutânea generalizada, febre alta e linfonodos aumentados (síndrome de DRESS ou síndrome de hipersensibilidade a medicamentos)
Outros efeitos adversos possíveis incluem:
Muito frequentes(podem ocorrer em mais de 1 pessoa em 10):
- aumento do apetite e ganho de peso
- calma ou sonolência
- dor de cabeça
- secura na boca
Frequentes(podem ocorrer em até 1 pessoa em 10):
- letargia
- tonturas
- convulsões ou tremores
- náuseas
- diarreia
- vômitos
- constipação
- erupções cutâneas ou rash
- dor nas articulações, dor muscular
- dor nas costas
- tonturas ou desmaio ao mudar de posição rapidamente (hipotensão ortostática)
- inchaço (geralmente nos tornozelos ou pés) devido à retenção de líquidos (edema)
- fadiga
- sonhos vívidos
- desorientação
- ansiedade
- distúrbios do sono
- distúrbios da memória, na maioria dos casos revertidos após a interrupção do tratamento
Não muito frequentes(podem ocorrer em até 1 pessoa em 100):
Página 7 9- sensações anormais na pele, como queimadura, formigamento, picadas ou dormência (parestesias)
- síndrome da perna inquieta
- desmaio
- sensação de entorpecimento na boca (anestesia bucal)
- baixa pressão arterial
- pesadelos
- agitação
- alucinações
- necessidade urgente de se mover
Raros(podem ocorrer em até 1 pessoa em 1.000):
- contraturas musculares ou espasmos (crises epilépticas musculares)
- comportamento agressivo
- dor abdominal e náuseas, que podem indicar pancreatite
Frequência desconhecida(frequência não pode ser estimada com base nos dados disponíveis):
- sensações anormais na boca (parestesias bucais)
- edema bucal
- edema generalizado
- edema localizado
- baixo nível de sódio no sangue
- distúrbios da secreção do hormônio antidiurético
- reações cutâneas graves (pênfigo, eritema multiforme)
- sonambulismo (caminar enquanto dorme)
- distúrbios da fala
- nível elevado de creatina quinase no sangue
- dificuldades para urinar (retenção urinária)
- dor muscular, rigidez e (ou) fraqueza
- escurecimento ou descoloração da urina (rabdomiólise)
- nível elevado de prolactina no sangue (hiperprolactinemia, incluindo sintomas de aumento da glândula mamária e/ou secreção de leite nos mamilos)
- ereção prolongada ou dolorosa
Efeitos adversos adicionais em crianças e adolescentes
Os seguintes efeitos adversos foram frequentemente observados em estudos clínicos com crianças abaixo de 18 anos: ganho de peso significativo, urticária e aumento do nível de triglicérides no sangue.
Notificação de efeitos adversos
Se ocorrerem algum efeito adverso, incluindo quaisquer efeitos adversos não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeira. Efeitos adversos podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Adversos de Medicamentos do Instituto de Saúde,
Al. Jerozolimskie 181C
02-222 Varsóvia
Telefone: +48 22 49 21 301
Fax: +48 22 49 21 309
Site da Internet: https://smz.ezdrowie.gov.pl
Ao notificar efeitos adversos, pode ajudar a obter mais informações sobre a segurança do medicamento.5. Como conservar o Mirtor
Deve conservar o medicamento em um local seguro e inacessível às crianças.
Não use este medicamento após a data de validade impressa no embalagem.
A data de validade é o último dia do mês indicado.
Página 8 9
Não há recomendações especiais para a conservação.
Não use este medicamento se notar qualquer descoloração ou outros sinais de deterioração.
Os medicamentos não devem ser jogados na canalização ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são necessários. Esse procedimento ajudará a proteger o meio ambiente.6. Conteúdo do embalagem e outras informações
O que contém o Mirtor
- A substância ativa do medicamento é a mirtazapina. Cada comprimido de desintegração oral contém 30 mg de mirtazapina.
- Os outros componentes do medicamento são crospovidona (tipo B), manitol (E 421), celulose microcristalina, aspartamo (E 951), aroma de morango e guaraná, aroma de hortelã, dióxido de silício coloidal anidro, estearato de magnésio.
Como é o Mirtor e que conteúdo tem o embalagem
Comprimido de desintegração oral de 30 mg: branco, redondo, marcado com "37" em um lado e "A" no outro lado.
30 (5x6) ou 90 (15x6) comprimidos em blisters de PVC/PA/Al/Poliéster em caixa de cartão.
Para obter informações mais detalhadas, deve contactar o titular da autorização de comercialização ou o importador paralelo.Titular da autorização de comercialização na República Checa, país de exportação:
Orion Corporation, Orionintie 1, FI-02200 Espoo, Finlândia
Fabricante:
Orion Corporation Orion Pharma, Orionintie 1, FI-02200 Espoo, Finlândia
Importador paralelo:
Delfarma Sp. z o.o., ul. Św. Teresy od Dzieciątka Jezus 111, 91-222 Łódź
Reembalado por:
Delfarma Sp. z o.o., ul. Św. Teresy od Dzieciątka Jezus 111, 91-222 Łódź
Número da autorização na República Checa, país de exportação: 30/415/06-CNúmero da autorização de importação paralela: 90/23 Data de aprovação do folheto: 19.05.2023
[Informação sobre marca registrada]
Página 9 9
- País de registo
- Substância ativa
- Requer receita médicaSim
- Titular da Autorização de Introdução no Mercado (AIM, MAH)Orion Corporation
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a MirtorForma farmacêutica: Comprimidos, 15 mgSubstância ativa: mirtazapineRequer receita médicaForma farmacêutica: Comprimidos, 30 mgSubstância ativa: mirtazapineRequer receita médicaForma farmacêutica: Comprimidos, 45 mgSubstância ativa: mirtazapineRequer receita médica
Alternativas a Mirtor noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Mirtor em Espanha
Alternativa a Mirtor em Ukraine
Médicos online para Mirtor
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Mirtor – sujeita a avaliação médica e regras locais.









