
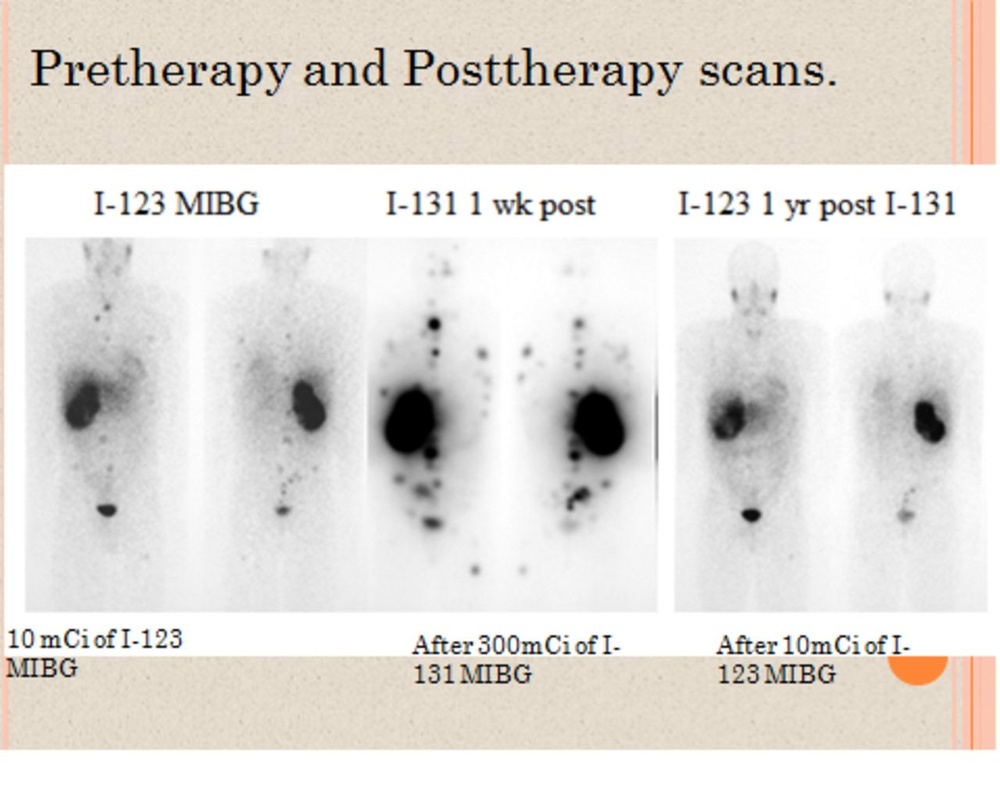
Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapii

Pergunte a um médico sobre a prescrição de Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapii

Como usar Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapii
Folheto informativo para o utilizador
Metajodobenzyloguanidina- I (MIBG- I) para terapia,
- 370 – 740 MBq/ml, solução para injeção
Jobenguana (I)
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o paciente.
- Deve conservar este folheto, para que possa lê-lo novamente se necessário.
- Em caso de dúvidas, deve consultar um médico especialista em medicina nuclear
- Se o paciente apresentar qualquer efeito adverso, incluindo possíveis efeitos adversos não listados no folheto, deve informar o médico especialista em medicina nuclear. Ver ponto 4.
Índice do folheto:
- 1. O que é Metajodobenzyloguanidina- I (MIBG- I) para terapia e para que é usado
- 2. Informações importantes antes de usar Metajodobenzyloguanidina- I (MIBG- I) para terapia
- 3. Como usar o medicamento Metajodobenzyloguanidina- I (MIBG- I) para terapia
- 4. Possíveis efeitos adversos
- 5. Como armazenar o medicamento Metajodobenzyloguanidina- I (MIBG- I) para terapia
- 6. Conteúdo do pacote e outras informações
1. O QUE É METAJODOBENZILGUANIDINA- I (MIBG- I) PARA TERAPIA E
PARA QUE É USADO
Metajodobenzyloguanidina- I (MIBG- I) para terapia é um radiofarmacêutico que contém
substância ativa, o isótopo radioativo de iodo-131. O medicamento é administrado por via intravenosa em
doses de diferentes atividades radioterapêuticas para fins terapêuticos.
O iodo [I] é um radioisótopo de vida curta, com um período de meia-vida de 8,04 dias.
Metajodobenzyloguanidina- I (MIBG- I) para terapia é um radiofarmacêutico usado no
tratamento de câncer. Terapeuticamente, o MIBG- I é usado no tratamento de metástases disseminadas de
feocromocitoma maligno, paraganglioma, neuroblastoma, rabdomiossarcoma e, por vezes, câncer de tireoide.
2. INFORMAÇÕES IMPORTANTES ANTES DE USAR
METAJODOBENZILGUANIDINA- I (MIBG- I) PARA TERAPIA
Quando não usar metajodobenzyloguanidina- I (MIBG- I) para terapia?
Se o paciente tiver alergia ao jobenguana (I)ou a qualquer um dos outros componentes do medicamento
(listados no ponto 6).
Contraindicação absoluta para o uso do medicamento é:
- hipersensibilidade à substância ativa ou a qualquer substância auxiliar,
- gravidez confirmada, suspeita ou não excluída,
- amamentação,
- esperança de vida curta do paciente (menos de 3 meses), exceto em casos de dor óssea devido a câncer que não responde a outros tratamentos,
Gravidez e amamentação.
- insuficiência renal que exija diálise.
Contraindicação relativa é:
- insuficiência renal progressiva,
- danos progressivos à medula óssea e/ou disfunção renal devido a tratamentos anteriores,
- danos ao tecido da medula óssea,
- risco médico inaceitável associado à necessidade de isolamento do paciente,
- casos graves de incontinência urinária.
O produto contém álcool benzílico: 10 mg/ml, portanto, não deve ser administrado a prematuros
ou recém-nascidos.
Precauções e advertências
Devido ao risco de contaminação radiativa, deve-se ter cuidado durante o tratamento com iodo radioativo em pessoas:
- que possam não seguir as instruções do pessoal médico,
- com incontinência urinária.
Alguns pacientes que recebem grandes atividades do isotopo de iodo-131 podem precisar ser hospitalizados devido à necessidade de seguir as regulamentações de proteção radiológica.
A administração de medicamentos que contenham isotopos radioativos cria um risco de exposição a radiação ionizante ou contaminação para outras pessoas.
Por isso, deve-se seguir as normas básicas de higiene.
Para reduzir a dose de radiação absorvida pela bexiga urinária, recomenda-se beber um pouco mais de líquidos do que o normal (cerca de 1 a 1,5 litro por dia a mais) e esvaziar a bexiga com mais frequência.
Metajodobenzyloguanidina- I (MIBG- I) para terapia e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o paciente está tomando atualmente ou
recentemente, bem como sobre os medicamentos que o paciente planeja tomar.
Os seguintes medicamentos podem afetar a retenção ou a absorção do jobenguana:
- Nifedipina (bloqueador de canais de cálcio) - causa a retenção prolongada do jobenguana
A absorção reduzida pode ser causada por:
- medicamentos anti-hipertensivos: reserpina, labetalol, bloqueadores de canais de cálcio (diltiazem, nifedipina, verapamil)
- medicamentos simpaticomiméticos (presentes em medicamentos nasais que restringem a mucosa, como fenilefrina, efedrina ou fenilpropanolamina)
- cocaina
- medicamentos antidepressivos tricíclicos, como amitriptilina e derivados, imipramina e derivados, doksepina, amoxapina e loxapina.
A inibição da absorção do jobenguana pode ser causada por:
- medicamentos anti-hipertensivos que atuam por meio do bloqueio de neurônios adrenérgicos (betanidina, debriozina, bretilio e guanetidina).
- medicamentos antidepressivos, como maprotilina e trazodona.
Deve-se interromper a administração desses medicamentos antes de iniciar o tratamento com Metajodobenzyloguanidina- I (MIBG- I) para terapia.
Esses fatores indicam que o médico deve conhecer a história médica do paciente.
Metajodobenzyloguanidina- I (MIBG- I) para terapia e alimentação
Não são recomendadas precauções especiais.
Gravidez e amamentação
Se a paciente estiver grávida ou amamentando, acredita que possa estar grávida ou planeja ter um filho, deve consultar um médico antes de usar este medicamento.
Contraindicação absoluta para o uso do medicamento é a gravidez e a amamentação.
Antes de receber o medicamento, o paciente deve informar o médico especialista em medicina nuclear se:
- houver suspeita de gravidez,
- a menstruação não ocorrer no prazo previsto,
- a paciente estiver amamentando. Em caso de dúvida, é necessária a consulta com o médico especialista em medicina nuclear que supervisiona o exame.
Em caso de necessidade de administração de radiofarmacêuticos a mulheres em idade reprodutiva, deve-se garantir que a mulher não esteja grávida. Deve-se seguir a regra de administração de iodo-131 até o décimo dia após a menstruação, ou após obter um resultado negativo no teste de gravidez. Após o tratamento, é recomendável evitar a gravidez por 1 ano.
Deve-se interromper a amamentação após a administração da primeira dose do radiofarmacêutico devido ao risco potencial para a saúde da criança. A amamentação pode ser retomada quando a dose de radiação que a criança possa receber durante a amamentação e o contato com a mãe estiver dentro dos limites legais estabelecidos.
Condução de veículos e operação de máquinas
Não foi descrito o efeito na capacidade de conduzir veículos ou operar máquinas.
3. COMO USAR O MEDICAMENTO METAJODOBENZILGUANIDINA- I
(MIBG-I) PARA TERAPIA
Este medicamento deve ser sempre usado de acordo com as instruções do médico. Em caso de dúvida, deve-se consultar um médico.
Dose recomendada:
Metajodobenzyloguanidina- I (MIBG- I) para terapia é um medicamento para administração intravenosa em doses de diferentes atividades radioterapêuticas.
No tratamento de câncer com MIBG- I, a dose única recomendada é de aproximadamente
- 3,7 GBq. A dose terapêutica deve ser diluída com solução salina para um volume de aproximadamente 50 ml e administrada por via intravenosa em 1,5 a 2 horas. A dose recomendada é a mesma para adultos e crianças. A atividade do radiofarmacêutico administrado aos pacientes deve ser sempre considerada em relação aos seus valores diagnósticos e terapêuticos.
Método de administração
Metajodobenzyloguanidina- I (MIBG- I) para terapia é um medicamento para administração intravenosa sob controle de pessoal especializado.
Durante a administração do medicamento, deve-se seguir rigorosamente as normas de segurança para trabalhar com radiação ionizante.
Uso de dose maior do que a recomendada
A superdose é quase impossível, pois a dose do medicamento administrada ao paciente é rigorosamente controlada pelo médico especialista em medicina nuclear. No entanto, em caso de superdose, o médico aplicará o tratamento adequado.
Em caso de dúvida sobre o uso do medicamento, deve-se consultar um médico especialista em medicina nuclear.
Se o medicamento Metajodobenzyloguanidina- I (MIBG- I) para terapia for administrado por engano
O radiofarmacêutico Metajodobenzyloguanidina- I (MIBG- I) para terapia pertence a uma categoria de medicamentos que são administrados sob controle rigoroso de um médico, exclusivamente em departamentos de medicina nuclear, por pessoal qualificado. Portanto, o risco de administração acidental é extremamente baixo.
O medicamento é fornecido em doses de atividade conhecida, o que facilita ao médico controlar a dose a ser administrada ao paciente. Em caso de administração de uma quantidade excessiva de substância radioativa, o risco de radiação pode ser reduzido administrando-se grandes quantidades de líquidos.
4. POSSÍVEIS EFEITOS ADVERSOS
Como qualquer medicamento, este medicamento pode causar efeitos adversos, embora não todos os pacientes os experimentem.
A atividade da dose do radiofarmacêutico administrada aos pacientes deve ser sempre considerada em relação aos seus valores diagnósticos e terapêuticos. Isso se aplica particularmente às doses terapêuticas, que podem ter efeitos colaterais graves.
A administração do medicamento pode causar: náuseas, vômitos, rubor passageiro, lesão por radiação, hipotireoidismo ou hipertireoidismo, supressão da medula óssea, anemia, trombocitopenia, neutropenia, leucemia, tumores malignos secundários, aumento da suscetibilidade a infecções.
Em caso de doses terapêuticas, os efeitos colaterais não graves decorrentes da administração do medicamento são superados pelos efeitos da radiotoxicidade.
A exposição à radiação ionizante pode levar a um aumento do risco de câncer ou defeitos congênitos.
Notificação de efeitos adversos
Se ocorrerem qualquer efeito adverso, incluindo possíveis efeitos adversos não listados no folheto, deve-se informar o médico. Os efeitos adversos podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Adversos de Produtos Farmacêuticos da Agência Reguladora de Produtos Farmacêuticos, Dispositivos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C,
02-222 Varsóvia,
telefone: +48 22 49 21 301,
fax: +48 22 49 21 309,
e-mail: [email protected].
Os efeitos adversos também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos adversos permite coletar mais informações sobre a segurança do medicamento.
5. COMO ARMAZENAR O MEDICAMENTO METAJODOBENZILGUANIDINA- I
(MIBG-I) PARA TERAPIA
O medicamento deve ser armazenado em um local não visível e inacessível a crianças.
O paciente não precisará armazenar este medicamento.
Os produtos radiofarmacêuticos são armazenados exclusivamente por pessoas autorizadas em condições clínicas apropriadas. O armazenamento de radiofarmacêuticos é feito de acordo com as regulamentações locais sobre substâncias radioativas.
As seguintes informações são destinadas exclusivamente ao pessoal médico.
Não use o medicamento após a data de validade impressa no pacote.
O medicamento deve ser armazenado a uma temperatura abaixo de -15°C em um invólucro que forneça segurança radiológica, de acordo com as regulamentações da Lei Atômica. Proteger da luz. Após a descongelação, armazenar por 2 horas a uma temperatura abaixo de 25°C. O transporte deve ser feito em gelo seco.
Siga as recomendações de segurança para trabalhar com radiação ionizante.
Metajodobenzyloguanidina- I (MIBG- I) para terapia, solução para injeção, deve ser administrada dentro de 4 dias após a data de fabricação.
O medicamento não utilizado ou resíduos materiais devem ser eliminados de acordo com as exigências das regulamentações sobre materiais radioativos.
6. CONTEÚDO DO PACOTE E OUTRAS INFORMAÇÕES
O que contém o medicamento Metajodobenzyloguanidina- I (MIBG- I) para terapia
- A substância ativa do medicamento é o sulfato de meta-iodo( I)benzilguanidina com atividade de 370 - 740 MBq/ml.
- Os outros componentes do medicamento são: pirosulfito de sódio, sulfato de cobre (II) pentaidratado, acetato de sódio triidratado, ácido acético, álcool benzílico, cloreto de sódio, água para injeção
Como é o medicamento Metajodobenzyloguanidina- I (MIBG- I) para terapia e o que contém o pacote
A solução de MIBG- I é fornecida em frascos de vidro de 10 ml com possibilidade de retirada estéril múltipla.
O frasco é fechado com uma tampa de borracha e uma cápsula de alumínio e colocado em um recipiente de chumbo protetor.
O pacote externo de transporte é uma lata de metal com preenchimento.
Um certificado de atividade é anexado a cada fonte.
Titular da autorização de comercialização e fabricante
Centro Nacional de Pesquisas Nucleares
Rua Andrzej Sołtana 7
05-400 Otwock
Telefone: 22 718 07 00
Fax: 22 718 03 50
e-mail: [email protected]
Data de aprovação do folheto:
A Característica do Produto Farmacêutico (ChPL) está anexa como um documento separado ao pacote do produto, com o objetivo de fornecer aos profissionais de saúde informações adicionais, científicas e práticas sobre a administração e o uso deste radiofarmacêutico.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorNarodowe Centrum Badań Jądrowych
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapiiForma farmacêutica: Cápsulas, 37 - 7400 MBqSubstância ativa: sodium iodide (131I)Fabricante: Narodowe Centrum Badań JądrowychNão requer receita médicaForma farmacêutica: Solução, Solução de fosfato de sódio (32P) para injeção 37-370 MBq/mlSubstância ativa: sodium phosphate (32P)Fabricante: Narodowe Centrum Badań JądrowychNão requer receita médicaForma farmacêutica: Solução, 37,5 MBq/mlSubstância ativa: strontium (89Sr) chlorideFabricante: Narodowe Centrum Badań JądrowychNão requer receita médica
Alternativas a Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapii noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapii em Espanha
Médicos online para Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapii
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Metaiodobenziloguanidina 131 I (mibg- 131 I) do terapii – sujeita a avaliação médica e regras locais.














