
Ig Vena

Pergunte a um médico sobre a prescrição de Ig Vena

Como usar Ig Vena
Folheto informativo para o utilizador
Ig VENA, 50 g/l, solução para infusão
Imunoglobulina humana normal para administração intravenosa (IVIg)
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
- Deve conservar este folheto para poder reler se necessário.
- Em caso de dúvidas, deve consultar um médico ou enfermeira.
- Se o paciente apresentar algum sintoma indesejado, incluindo qualquer sintoma indesejado não mencionado neste folheto, deve informar o médico ou enfermeira. Ver secção 4.
Índice do folheto:
- 1. O que é o medicamento Ig VENA e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento Ig VENA
- 3. Como tomar Ig VENA
- 4. Efeitos indesejados
- 5. Como conservar Ig VENA
- 6. Conteúdo da embalagem e outras informações
1. O que é o medicamento Ig VENA e para que é utilizado
Ig VENA é uma solução de imunoglobulina humana normal para administração intravenosa.
As imunoglobulinas são anticorpos humanos presentes no sangue.
Ig VENA é utilizado nos seguintes tratamentos:
Tratamento de adultos e crianças e jovens (0-18 anos), quando o paciente não tem quantidade suficiente
de anticorpos (tratamento de substituição) nos seguintes casos:
- 1. Em pacientes com deficiência congénita de produção de anticorpos (síndromes de deficiência imunológica primária).
- 2. Em pacientes com deficiência adquirida de produção de anticorpos (deficiência imunológica secundária), que apresentam infecções graves ou recorrentes causadas por várias condições clínicas (por exemplo, doenças oncológicas ou autoimunes, ou como resultado do tratamento dessas doenças). O tratamento com antibióticos nesses pacientes foi ineficaz e, ou não alcançou um aumento suficiente nos níveis de anticorpos IgG após a vacinação (vacina pneumocócica polissacarídica e vacina que contém antígeno polipeptídico), ou os níveis de IgG no soro sanguíneo são inferiores a 4 g/l.
Tratamento de adultos e crianças e jovens (0-18 anos) com certas doenças inflamatórias (imunomodulação) nos seguintes casos:
- 1. Em pacientes com contagem de plaquetas insuficiente (púrpura trombocitopênica idiopática) e em pacientes com alto risco de sangramento ou antes de uma cirurgia para alcançar uma contagem de plaquetas adequada.
- 2. Em pacientes com síndrome de Guillain-Barré. É uma doença aguda que se manifesta por inflamação dos nervos periféricos, causando fraqueza muscular, principalmente nas pernas e membros superiores.
- 3. Em pacientes com doença de Kawasaki (em combinação com ácido acetilsalicílico). A doença de Kawasaki é uma doença aguda que afeta principalmente crianças pequenas e se manifesta por inflamação dos vasos sanguíneos de todo o corpo
- 4. Em pacientes com polineuropatia desmielinizante inflamatória crônica (CIDP - Doença de Charcot-Marie-Tooth). Esta doença crônica é uma perturbação rara dos nervos periféricos, caracterizada por fraqueza muscular progressiva dos membros inferiores e, em menor medida, dos membros superiores.
- 5. Na neuropatia motora multifocal (MMN). É uma doença rara que afeta os nervos motores e se manifesta por fraqueza muscular progressiva e assimétrica, sem perda de sensibilidade
2. Informações importantes antes de tomar o medicamento Ig VENA
Quando não tomar o medicamento Ig VENA
Se o paciente tiver alergia (hipersensibilidade) à imunoglobulina humana normal ou
a qualquer um dos outros componentes deste medicamento (listados na secção 6).
Se o paciente tiver anticorpos contra a imunoglobulina A (IgA) no sangue,
pois a administração de um medicamento que contém IgA pode levar a uma reação alérgica grave.
Advertências e precauções
Antes de iniciar o tratamento com Ig VENA, deve discutir com o médico ou enfermeira.
Os pacientes devem ser monitorizados e observados atentamente durante a infusão devido ao risco
de ocorrência de efeitos indesejados.
Algumas reações indesejadas podem ocorrer com mais frequência:
- em caso de infusão demasiado rápida;
- em pacientes com sintomas de infecção não tratada (por exemplo, febre) ou condição inflamatória crônica;
- em pacientes que recebem imunoglobulina humana normal pela primeira vez;
- em casos raros, quando o medicamento de imunoglobulina humana normal anteriormente administrado é alterado para outro ou quando decorre um longo período desde a última infusão.
Em certos casos, as imunoglobulinas podem aumentar o risco de ataque cardíaco, acidente vascular cerebral, trombose pulmonar ou agravar a trombose venosa profunda
Por este motivo, o médico deve ter especial cuidado nos seguintes casos:
- em pacientes obesos,
- em pessoas idosas,
- em pacientes com diabetes,
- em pacientes com hipertensão,
- em pacientes com volume de sangue reduzido (hipovolemia),
- em pacientes com doenças vasculares,
- em pacientes com risco de ocorrência de estados de coagulação sanguínea (distúrbios de coagulação adquiridos ou congênitos),
- em pacientes com histórico de estados de coagulação
- em pacientes com doenças que se manifestam por aumento da viscosidade sanguínea,
- em pacientes imobilizados por longo período,
- em pacientes com doenças renais atuais ou anteriores, ou que tomam medicamentos que podem danificar os rins (medicamentos nefrotóxicos), pois foram relatados casos de insuficiência renal aguda. Em caso de lesão renal, deve-se considerar a interrupção da administração de imunoglobulina.
O paciente pode ter alergia (hipersensibilidade) à imunoglobulina (anticorpos) sem saber
Hipersensibilidade pode ocorrer mesmo em pacientes que já receberam anteriormente imunoglobulina humana normal e a toleraram bem. Pode ocorrer especialmente em casos de deficiência de imunoglobulina do tipo IgA (em pacientes com anticorpos anti-IgA). Nesses casos raros, podem ocorrer reações alérgicas (hipersensibilidade) como queda súbita da pressão arterial ou reação anafilática.
Em caso de reação indesejada, deve-se reduzir a velocidade de administração ou interromper a administração de imunoglobulina. O tratamento depende do tipo e gravidade da reação indesejada. Em caso de choque, deve-se proceder de acordo com os padrões médicos atuais para o tratamento de choque. Deve-se informar o médico se algum dos casos acima se aplica ao paciente. O médico tomará as medidas de precaução necessárias ao administrar o medicamento Ig VENA.
Prevenção de infecções virais
Os medicamentos produzidos a partir de sangue ou plasma humano são submetidos a procedimentos específicos para prevenir a transmissão de infecções para os pacientes tratados. Esses procedimentos incluem a seleção de doadores de sangue e plasma, cujo objetivo é excluir doadores que possam ser fonte de infecção; testes para detectar a presença de agentes infecciosos/vírus no plasma. Os fabricantes de medicamentos a partir de sangue ou plasma humano também utilizam processos que inativam ou removem vírus. No entanto, não é possível excluir completamente a possibilidade de transmissão de agentes infecciosos por meio de um medicamento produzido a partir de sangue ou plasma humano. Isso se aplica também a vírus desconhecidos ou recentemente descobertos e outros patógenos.
Considera-se que as medidas de prevenção tomadas são eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV), vírus da hepatite B (HBV) e vírus da hepatite C (HCV), e também contra vírus não envelopados, como o vírus da hepatite A (HAV).
Essas medidas podem ter eficácia limitada contra vírus não envelopados, como o parvovirus B19.
Não foi demonstrado que as imunoglobulinas sejam causa de hepatite A ou infecção por parvovirus B19, pois a presença de anticorpos pode desempenhar um papel importante na proteção contra infecções virais.
Recomenda-se que, a cada vez que Ig VENA for administrado, o nome e o número da série sejam registrados para permitir a identificação do medicamento.
Crianças e jovens
Após a administração de Ig VENA em crianças e jovens, foi observada glicosúria transitória e leve (presença de glicose na urina), sem sintomas clínicos. Isso pode estar relacionado ao conteúdo de maltose no medicamento Ig VENA, que é hidrolisada nos túbulos renais para glicose. A glicose é absorvida e eliminada na urina em pequena quantidade. A absorção de glicose depende da idade do paciente. O aumento transitório da concentração de maltose no soro pode exceder a capacidade renal de absorção de açúcar e afetar o resultado do teste de glicose na urina.
Ig VENA e outros medicamentos
Deve informar o médico sobre todos os medicamentos que o paciente está tomando atualmente ou
recentemente, bem como sobre os medicamentos que o paciente planeja tomar.
Não deve misturar imunoglobulina humana normal para administração intravenosa com outros medicamentos
ou outros medicamentos que contenham imunoglobulina para administração intravenosa (IVIg).
Efeito sobre as vacinas vivas atenuadas
A administração de imunoglobulina pode reduzir a eficácia das vacinas que contenham vírus vivos atenuados, como o vírus da rubéola, da varicela ou da caxumba, por um período de pelo menos 6 semanas a 3 meses
Após a administração deste medicamento, deve-se esperar 3 meses antes de vacinar com uma vacina que contenha vírus vivos atenuados. No caso da rubéola, essa redução pode durar até 1 ano. Por isso, os pacientes que receberam a vacina contra a rubéola devem ter os níveis de anticorpos verificados.
Diuréticos de alça (grupo de medicamentos que aumentam a produção de urina)
Deve-se evitar o uso concomitante com diuréticos de alça.
Efeito sobre os resultados dos exames de sangue
Após a injeção de imunoglobulina, o aumento transitório de anticorpos passivamente transferidos no sangue do paciente pode causar resultados falsos positivos nos testes serológicos.
A transferência passiva de anticorpos contra antígenos eritrocitários, como A, B, D (responsáveis pelo tipo sanguíneo), pode afetar os resultados de alguns testes serológicos para anticorpos para hemácias, como o teste de antiglobulina indireto (DAT, teste de Coombs).
Exame de glicose no sangue
Alguns tipos de exames de glicose no sangue (por exemplo, que utilizam métodos baseados na desidrogenase da glicose - piroloquinolina quinona (GDH-PQQ) ou oxidorredutase da glicose-corante) interpretam mal a maltose (100 mg/ml) contida no medicamento Ig VENA como glicose. Isso pode causar uma leitura falsamente elevada da concentração de glicose durante a infusão e por um período de aproximadamente 15 horas após o término da infusão, o que pode levar à administração inadequada de insulina, resultando em hipoglicemia perigosa para a vida. Além disso, casos de hipoglicemia real podem permanecer sem tratamento se o estado de hipoglicemia for mascarado por leituras falsamente elevadas de glicose. Portanto, ao administrar Ig VENA ou outros medicamentos para administração parenteral que contenham maltose, a medição da glicose no sangue deve ser realizada por um método específico para glicose. Deve-se familiarizar com as informações sobre os testes de glicose no sangue, incluindo as informações sobre as tiras de teste, para determinar se elas podem ser usadas com medicamentos para administração parenteral que contenham maltose. Em caso de dúvida, deve-se contatar o fabricante do dispositivo para determinar se ele pode ser usado com medicamentos para administração parenteral que contenham maltose.
Gravidez, amamentação e fertilidade
- Se a paciente estiver grávida ou amamentando, suspeita que possa estar grávida ou planeja ter um filho, deve consultar um médico antes de tomar este medicamento. O médico decidirá se o medicamento Ig VENA pode ser administrado à paciente grávida.
- Não foram realizados estudos clínicos com Ig VENA em mulheres grávidas. Foi demonstrado que os produtos de imunoglobulina intravenosa atravessam a placenta, com maior intensidade durante o terceiro trimestre. No entanto, a experiência clínica de longo prazo com a administração de imunoglobulinas sugere que não se deve esperar nenhum efeito prejudicial sobre a gravidez, o feto ou o recém-nascido.
- Se a paciente estiver amamentando e receber Ig VENA, os anticorpos deste medicamento podem passar para o leite materno. Isso pode contribuir para a proteção do recém-nascido contra certas infecções.
- A experiência clínica com a administração de imunoglobulinas sugere que não se deve esperar nenhum efeito prejudicial sobre a fertilidade.
Condução de veículos e operação de máquinas
Alguns efeitos indesejados relacionados ao produto Ig VENA podem prejudicar a capacidade de conduzir veículos e operar máquinas. Os pacientes que apresentaram efeitos indesejados durante o tratamento devem esperar até que eles desapareçam antes de conduzir veículos ou operar máquinas.
Ig VENA contém maltose e sódio
O medicamento contém 100 mg de maltose por 1 ml.
Este medicamento contém aproximadamente 69 mg de sódio por 1 litro. Deve-se considerar isso em pacientes com dieta de baixo teor de sódio.
3. Como tomar Ig VENA
Ig VENA pode ser administrado por um médico ou pessoal médico treinado apenas em condições hospitalares ou ambulatoriais.
A dose e o esquema de dosagem dependem das indicações; o médico definirá a dosagem adequada para o paciente específico.
Ig VENA deve ser administrado inicialmente de forma lenta. Se o medicamento for bem tolerado, a velocidade de infusão pode ser gradualmente aumentada.
Administração em crianças e jovens
A dosagem em crianças e jovens (0-18 anos) não difere daquela utilizada em adultos, pois a dosagem em cada indicação é definida com base no peso corporal e no estado clínico do paciente.
Administração de uma dose maior do que a recomendada de Ig VENA
A sobredosagem pode levar a uma sobrecarga circulatória e aumento da viscosidade sanguínea, especialmente em pacientes de grupos de risco, idosos ou com insuficiência cardíaca ou renal.
Em caso de dúvidas adicionais sobre a administração deste medicamento, deve-se consultar um médico ou enfermeira.
4. Efeitos indesejados
Como qualquer medicamento, este medicamento pode causar efeitos indesejados, embora não em todos os pacientes.
Os seguintes efeitos indesejados podem ocorrer após a administração de um medicamento que contenha imunoglobulina:
- calafrios, dor de cabeça, tontura, febre, vômitos, náuseas, reações alérgicas, dor articular, hipotensão e dor lombar leve podem ocorrer raramente;
- casos isolados de redução transitória do número de glóbulos vermelhos (anemia hemolítica reversível/hemólise);
- queda súbita da pressão arterial pode ocorrer raramente, e em casos isolados, pode ocorrer choque anafilático, mesmo em pacientes que não apresentaram hipersensibilidade após administrações anteriores;
- foram observados casos raros de reações cutâneas transitórias;
- complicações tromboembólicas (formação de coágulos) podem ocorrer muito raramente, o que pode levar a ataque cardíaco, acidente vascular cerebral, trombose pulmonar ou trombose venosa profunda;
- foram observados casos raros de meningite asséptica (inflamação das meninges sem infecção);
- aumento da creatinina no soro e/ou insuficiência renal aguda;
- casos de lesão pulmonar aguda relacionada à transfusão (TRALI - Lesão pulmonar aguda relacionada à transfusão).
Nos estudos clínicos e após a comercialização de Ig VENA, foram observados os seguintes efeitos indesejados, listados por ordem de frequência decrescente.
Comum (pode afetar até 1 em 10 pessoas)
- Dor nas costas
- Náuseas
- Sensação de fraqueza, fadiga, febre
- Dor muscular
- Dor de cabeça, sonolência
Frequência desconhecida (não pode ser estimada a partir dos dados disponíveis)
- Meningite asséptica
- Hemólise que causa anemia
- Reações alérgicas e choque anafilático potencialmente fatal
- Confusão
- Acidente vascular cerebral, tontura, movimentos involuntários, formigamento ou dormência da pele ou membros
- Ataque cardíaco, palidez, batimento cardíaco rápido, batimento cardíaco lento, batimento cardíaco irregular
- Trombose venosa profunda e trombose arterial, hipotensão, hipertensão, palidez
- Trombose da artéria pulmonar, edema pulmonar, dificuldade respiratória com respiração ofegante ou tosse
- Vômitos, diarreia, dor abdominal
- Erupção cutânea, urticária, vermelhidão e inflamação da pele, erupção cutânea, coceira, eczema, suor excessivo
- Dor articular e muscular, dor nas costas, dor no pescoço, rigidez muscular
- Insuficiência renal aguda
- Inflamação da veia no local da administração do medicamento, febre, dor ou desconforto no peito, inchaço facial, mal-estar geral
- Aumento da creatinina no sangue
Efeitos indesejados adicionais em crianças e jovens
Deve-se esperar que a frequência, tipo e gravidade dos efeitos indesejados em crianças e jovens sejam semelhantes aos observados em adultos.
Após a administração de Ig VENA em crianças e jovens, foi observada glicosúria transitória e leve (presença de glicose na urina), sem sintomas clínicos.
Informações sobre segurança viral, ver secção 2. "Informações importantes antes de tomar o medicamento Ig VENA".
Notificação de efeitos indesejados
Se ocorrerem algum efeito indesejado, incluindo qualquer efeito indesejado não mencionado neste folheto, deve-se informar o médico ou enfermeira. Os efeitos indesejados podem ser notificados ao Departamento de Monitoramento de Efeitos Indesejados de Medicamentos da Agência Reguladora de Medicamentos (Al. Jerozolimskie 181C, 02-222 Varsóvia),
telefone: 22 4921301,
fax: 22 4921309,
site na internet: https://smz.ezdrowie.gov.pl
Os efeitos indesejados também podem ser notificados ao titular da autorização de comercialização.
5. Como conservar Ig VENA
O medicamento deve ser conservado em um local seguro e fora do alcance das crianças.
Não deve ser utilizado após o término da validade impresso na embalagem e na ampola, após "EXP". O término da validade é o último dia do mês indicado.
Conservar na geladeira (2°C - 8°C).
Antes do uso e durante o período de validade, o medicamento pode ser conservado à temperatura ambiente, não superior a 25°C, por um período máximo de 6 meses consecutivos. Após esse período, o medicamento deve ser descartado.
Não deve ser recongelado se foi armazenado à temperatura ambiente. A data inicial de armazenamento à temperatura ambiente deve ser registrada na embalagem.
Após a abertura da ampola, o conteúdo deve ser utilizado imediatamente.
As ampolas devem ser conservadas na embalagem externa. Não congelar.
6. Conteúdo da embalagem e outras informações
O que contém o medicamento Ig VENA
O princípio ativo do medicamento é a imunoglobulina humana normal.
1 ml de solução contém 50 mg de imunoglobulina humana normal.
A solução contém proteína humana 50 g/l, incluindo pelo menos 95% de IgG (imunoglobulina G).
A distribuição das subclasses de IgG é a seguinte:
IgG1
62,1%
IgG2
34,8%
IgG3
2,5%
IgG4
0,6%
O teor máximo de IgA é de 50 microgramas/ml.
O medicamento foi produzido a partir de plasma de doadores de sangue.
Os outros componentes do medicamento são maltose, água para injeção.
Como é o medicamento Ig VENA e o que o conteúdo da embalagem
A solução para infusão Ig VENA está disponível em ampolas individuais de 50 ml, 100 ml ou 200 ml com um suporte (ampola + suporte). A solução é transparente ou ligeiramente opalescente, incolor ou amarelo claro.
Tamanhos da embalagem:
Embalagens individuais:
1 ampola contendo 2,5 g/50 ml
1 ampola contendo 5 g/100 ml
1 ampola contendo 10 g/200 ml
Embalagens coletivas:
Embalagem coletiva contendo 2 embalagens individuais de 1 ampola de 10 g/200 ml
Embalagem coletiva contendo 3 embalagens individuais de 1 ampola de 10 g/200 ml.
Nem todos os tamanhos de embalagem podem estar disponíveis no mercado.
Titular da autorização de comercialização:
Kedrion S.p.A.
Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), Itália
Fabricante:
Kedrion S.p.A.
55027 Bolognana, Gallicano (Lucca), Itália
Este medicamento está autorizado para comercialização nos países membros da Área Econômica Europeia sob os seguintes nomes:
| Áustria | Ig Vena 50g/l Solução para Infusão |
| Alemanha | Ig Vena 50 g/l Solução para Infusão |
| Grécia | Ig VENA |
| Itália | IG VENA |
| Polônia | Ig VENA |
| Portugal | Ig Vena |
Para obter informações mais detalhadas, deve-se contatar o representante local do titular da autorização de comercialização:
MB&S Medical Business and Science, ul. Chełmska 30/34, 00-725 Varsóvia
Telefone/fax: 22 851 52 08
Data da última atualização do folheto: 11/2020
Informações destinadas exclusivamente ao pessoal médico especializado:
Instruções para uso adequado
- Antes do uso, o produto Ig VENA deve ser trazido à temperatura ambiente ou corporal.
- Antes do uso, a solução deve ser avaliada visualmente quanto à presença de partículas sólidas e coloração. Não deve ser utilizado se a solução estiver turva ou contiver depósitos.
- A imunoglobulina humana normal deve ser administrada por via intravenosa com uma velocidade inicial de infusão de 0,46 - 0,92 ml/kg/h (10 - 20 gotas por minuto) durante 20 - 30 minutos. Em caso de reação indesejada, a velocidade de infusão deve ser reduzida ou a administração interrompida. Se for bem tolerado, a velocidade de infusão pode ser gradualmente aumentada até um máximo de 1,85 ml/kg/h (40 gotas por minuto).
- Em pacientes com deficiência imunológica primária que toleram uma velocidade de infusão de 0,92 ml/kg/h, a velocidade de administração pode ser aumentada gradualmente a cada 20-30 minutos para 2 ml/kg/h, 4 ml/kg/h e até 6 ml/kg/h, mas apenas se o paciente tolerar bem a infusão. Em geral, a dosagem e a velocidade de infusão devem ser adaptadas individualmente às necessidades do paciente. Dependendo do peso corporal do paciente, da dosagem e da ocorrência de efeitos indesejados, a velocidade máxima de infusão pode não ser alcançada. Em caso de efeitos indesejados, a infusão deve ser interrompida imediatamente e, em seguida, reiniciada com uma velocidade adequada para o paciente.
Populações específicas
Em crianças e jovens (0-18 anos) e em pessoas idosas (>64 anos), a velocidade inicial de administração deve ser de 0,46 – 0,92 ml/kg/h (10 – 20 gotas por minuto) durante 20 - 30 minutos. Se for bem tolerado, a velocidade pode ser gradualmente aumentada até um máximo de 1,85 ml/kg/h (40 gotas por minuto).
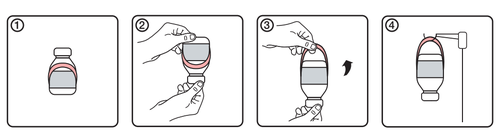
Instruções para o uso do suporte
- 1.Aparência inicial da ampola com o suporte de etiqueta
- 2.Inverter a ampola
- 3.Criar o suporte desenrolando-o da etiqueta
- 4. Pendurar a ampola no suporte de infusão
Precauções
Algumas reações indesejadas graves podem estar relacionadas à velocidade de infusão.
Pode-se evitar muitas complicações garantindo que:
- os pacientes não sejam alérgicos à imunoglobulina humana normal, administrando inicialmente o produto a uma velocidade lenta (velocidade de administração 0,46 - 0,92 ml/kg/h);
- os pacientes sejam monitorados atentamente durante a infusão quanto a efeitos indesejados. Pacientes que recebem imunoglobulina humana normal pela primeira vez, pacientes que receberam anteriormente um produto IVIg diferente ou quando decorre um longo período desde a última infusão devem ser monitorados durante a primeira infusão e por pelo menos 1 hora após a primeira infusão, para detectar sinais de possíveis efeitos indesejados. Os outros pacientes devem ser observados por pelo menos 20 minutos após a infusão.
Em todos os pacientes, a administração intravenosa de Ig exige:
- hidratação adequada antes do início da infusão de Ig
- monitoramento da diurese
- monitoramento dos níveis de creatinina no soro
- evitar o uso concomitante de diuréticos de alça. Em caso de efeito indesejado, a velocidade de administração deve ser reduzida ou a administração interrompida. O tratamento depende do tipo e gravidade do efeito indesejado. Em caso de choque, deve-se proceder de acordo com os padrões médicos atuais para o tratamento de choque.
Reação à infusão
Algumas reações indesejadas (por exemplo, dor de cabeça, ondas de calor, calafrios, dor muscular, respiração ofegante, taquicardia, dor lombar e náuseas) podem estar relacionadas à velocidade de infusão.
Deve-se seguir rigorosamente a velocidade de infusão recomendada. Os pacientes devem ser monitorados e observados atentamente durante a infusão devido ao risco de ocorrência de efeitos indesejados.
Algumas reações indesejadas podem ocorrer com mais frequência:
- em pacientes que recebem imunoglobulina humana normal pela primeira vez, ou em casos raros, quando o medicamento de imunoglobulina humana normal anteriormente administrado é alterado para outro ou quando decorre um longo período desde a última infusão
- em pacientes com infecção não tratada ou condição inflamatória crônica.
Crianças e jovens
Não há recomendações especiais para precauções ou monitoramento em crianças e jovens. Não se deve esperar nenhuma diferença em crianças e jovens (de 0 a 18 anos).
Doença tromboembólica
Existem evidências clínicas de uma relação entre a administração intravenosa de Ig e casos de doença tromboembólica, como ataque cardíaco, acidente vascular cerebral (incluindo acidente vascular cerebral), trombose pulmonar e trombose venosa profunda, que são considerados relacionados ao aumento relativo da viscosidade sanguínea após a administração de imunoglobulina em pacientes de grupos de risco.
Deve-se ter cuidado ao prescrever e administrar o produto a pacientes obesos e pacientes que têm risco de ocorrência de estados de coagulação (como idade avançada, hipertensão, diabetes e doenças vasculares ou histórico de estados de coagulação, distúrbios de coagulação adquiridos ou congênitos, imobilização prolongada, pacientes com hipovolemia grave, pacientes com doenças que se manifestam por aumento da viscosidade sanguínea).
Em pacientes com risco de efeitos indesejados tromboembólicos, as imunoglobulinas para administração intravenosa devem ser administradas com a velocidade mínima de infusão e na menor dose possível.
Insuficiência renal aguda
Foram relatados casos de insuficiência renal aguda em pacientes tratados com imunoglobulinas para administração intravenosa. Na maioria desses casos, foram identificados fatores de risco, como insuficiência renal pré-existente, diabetes, redução grave do volume de sangue circulante, excesso de peso, uso concomitante de medicamentos nefrotóxicos ou idade superior a 65 anos.
Deve-se avaliar os parâmetros renais antes da administração da infusão de IVIg e novamente em intervalos adequados, especialmente em pacientes com risco potencialmente aumentado de insuficiência renal aguda. Em pacientes com risco de insuficiência renal aguda, as imunoglobulinas intravenosas devem ser administradas com a velocidade mínima de infusão e na menor dose possível.
Em caso de lesão renal, deve-se considerar a interrupção da administração de Ig.
Meningite asséptica
Durante o tratamento com imunoglobulinas intravenosas, foram relatados casos de síndrome de meningite asséptica (AMS). A síndrome geralmente começa dentro de algumas horas a 2 dias após a administração de IVIg.
Nos exames do líquido cefalorraquidiano, frequentemente são encontradas pleocitose (até vários milhares de células por mm3), principalmente granulócitos, e níveis elevados de proteína.
A meningite asséptica pode ocorrer com mais frequência em relação ao tratamento com doses altas de IVIg (2 g/kg).
Pacientes com sintomas objetivos e subjetivos devem ser submetidos a um exame neurológico detalhado, incluindo exame do líquido cefalorraquidiano, para excluir outras causas de meningite.
A interrupção do tratamento com IVIg levou à remissão da AMS dentro de alguns dias, sem sequelas.
Anemia hemolítica
Os produtos de imunoglobulina intravenosa podem conter anticorpos contra os grupos sanguíneos, que podem atuar como hemolisinas e induzir, in vivo, a formação de uma camada de imunoglobulina nos glóbulos vermelhos, causando uma reação de antígeno-anticorpo positiva (teste de Coombs) e, raramente, hemólise.
A anemia hemolítica pode se desenvolver durante o tratamento com IVIg como resultado da sequestro aumentado de glóbulos vermelhos. Os pacientes que recebem imunoglobulina intravenosa devem ser monitorados para detectar sinais clínicos de hemólise.
Neutropenia/leucopenia
Após o tratamento com IVIg, foram relatados casos de redução transitória do número de neutrófilos e/ou episódios de neutropenia, às vezes graves. Isso geralmente ocorre dentro de algumas horas ou dias após a administração de IVIg e resolve espontaneamente dentro de 7 a 14 dias.
Lesão pulmonar aguda relacionada à transfusão (TRALI, Lesão pulmonar aguda relacionada à transfusão)
Em pacientes que receberam produtos de IVIg, foram relatados casos de edema pulmonar agudo não cardiogênico (lesão pulmonar aguda relacionada à transfusão - TRALI). O TRALI é caracterizado por hipóxia grave (falta de oxigênio), insuficiência respiratória, distúrbios respiratórios, cianose, febre e hipotensão. Os sintomas do TRALI geralmente ocorrem dentro de 6 horas após a administração do produto de IVIg, frequentemente dentro de 1-2 horas. Portanto, é necessário monitorar os pacientes; em caso de efeitos indesejados respiratórios, a infusão de IVIg deve ser interrompida imediatamente. A ocorrência de TRALI pode ser fatal e requer tratamento imediato na unidade de cuidados intensivos.
Este medicamento contém 100 mg de maltose por 1 ml como excipiente.
A presença de maltose no sangue pode afetar o resultado do exame de glicose, fornecendo uma leitura falsamente elevada da concentração de glicose no sangue, o que pode levar à administração inadequada de insulina, resultando em hipoglicemia perigosa para a vida. Além disso, casos de hipoglicemia real podem permanecer sem tratamento se o estado de hipoglicemia for mascarado por leituras falsamente elevadas de glicose. Portanto, ao administrar Ig VENA ou outros medicamentos para administração parenteral que contenham maltose, a medição da glicose no sangue deve ser realizada por um método específico para glicose. Deve-se familiarizar com as informações sobre os testes de glicose no sangue, incluindo as informações sobre as tiras de teste, para determinar se elas podem ser usadas com medicamentos para administração parenteral que contenham maltose. Em caso de dúvida, deve-se contatar o fabricante do dispositivo para determinar se ele pode ser usado com medicamentos para administração parenteral que contenham maltose.
Dosagem
O tratamento de substituição deve ser iniciado e monitorizado por um médico especialista em imunodeficiência.
Dosagem
A dose e o esquema de dosagem dependem das indicações. A dose deve ser estabelecida individualmente para cada paciente com base na resposta clínica. A dose baseada no peso corporal pode precisar ser ajustada em pacientes com baixo peso ou sobrepeso.
Os seguintes esquemas de dosagem são fornecidos como orientação.
Tratamento de substituição para imunodeficiências primárias
A dose deve ser estabelecida para alcançar um nível de IgG (medido antes da próxima infusão) de pelo menos 6 g/l ou dentro do intervalo normal para a idade da população. Desde o início do tratamento até a estabilização dos níveis, são necessários de três a seis meses (nível estável de IgG). Recomenda-se uma dose inicial de 0,4 a 0,8 g/kg administrada uma vez, seguida de uma dose de manutenção de pelo menos 0,2 g/kg administrada a cada três a quatro semanas. A dose necessária para alcançar um nível mínimo de IgG de 6 g/l é de 0,2 a 0,8 g/kg/mês. Após a estabilização, os intervalos entre as infusões são de três a quatro semanas. Deve-se medir e avaliar o nível de imunoglobulina em relação à frequência de infecções. Para reduzir a frequência de infecções bacterianas, pode ser necessário aumentar a dose para alcançar um nível mais alto.
Imunodeficiências secundárias
A dose recomendada é de 0,2 a 0,4 g/kg a cada três a quatro semanas.
Deve-se medir e avaliar o nível mínimo de IgG em relação à frequência de infecções. A dose deve ser ajustada conforme necessário para alcançar a proteção adequada contra infecções; pode ser necessário aumentar a dose em pacientes com infecção persistente; a redução da dose pode ser considerada se o paciente não tiver infecção.
Púrpura trombocitopênica idiopática
Dois esquemas de tratamento alternativos:
- dose de 0,8 a 1,0 g/kg no primeiro dia; a dose pode ser repetida uma vez em um período de 3 dias
- 0,4 g/kg por dia durante dois a cinco dias. O tratamento pode ser repetido se houver recorrência da doença.
Síndrome de Guillain-Barré
0,4 g/kg/dia durante mais de 5 dias (pode ser necessário repetir a dose em caso de recorrência).
Doença de Kawasaki
Deve ser administrada uma dose única de 2,0 g/kg. Os pacientes devem receber ácido acetilsalicílico concomitantemente.
Polineuropatia desmielinizante inflamatória crônica (CIDP)
Dose inicial: 2 g/kg durante 2-5 dias consecutivos.
Dose de manutenção: 1 g/kg durante 1-2 dias consecutivos a cada 3 semanas.
A eficácia do tratamento deve ser avaliada após cada ciclo; se não houver eficácia após 6 meses, o tratamento deve ser interrompido.
Se a terapia for eficaz, o médico deve decidir sobre o tratamento de longo prazo, considerando as reações do paciente e a resposta ao tratamento de manutenção. A dosagem e os intervalos de tratamento podem precisar ser ajustados com base no curso individual da doença.
Neuropatia motora multifocal (MMN)
Dose inicial: 2 g/kg administrada durante 2-5 dias consecutivos.
Dose de manutenção: 1 g/kg a cada 2-4 semanas ou 2 g/kg a cada 4-8 semanas.
A eficácia do tratamento deve ser avaliada após cada ciclo; se não houver eficácia após 6 meses, o tratamento deve ser interrompido.
Se a terapia for eficaz, o médico deve decidir sobre o tratamento de longo prazo, considerando as reações do paciente e a resposta ao tratamento de manutenção. A dosagem e os intervalos de tratamento podem precisar ser ajustados com base no curso individual da doença.
A dosagem recomendada é apresentada na tabela a seguir:
| Indicações | Dose | Frequência de administração |
| Tratamento de substituição | ||
| Imunodeficiências primárias | dose inicial: 0,4-0,8 g/kg; dose de manutenção: 0,2-0,8 g/kg | a cada 3-4 semanas |
| Imunodeficiências secundárias | 0,2-0,4 g/kg | a cada 3-4 semanas |
| Tratamento imunomodulador | ||
| Púrpura trombocitopênica idiopática | 0,8-1 g/kg ou 0,4 g/kg/dia | no primeiro dia, com possível repetição após 3 dias; durante 2-5 dias |
| Síndrome de Guillain-Barré | 0,4 g/kg/dia | durante 5 dias |
| Doença de Kawasaki | 2 g/kg | em uma dose única, combinada com ácido acetilsalicílico |
| Polineuropatia desmielinizante inflamatória crônica (CIDP) | dose inicial: 2 g/kg; dose de manutenção: 1 g/kg | em doses divididas durante 2-5 dias; a cada 3 semanas, durante 1-2 dias |
| Neuropatia motora multifocal (MMN) | dose de manutenção: 1 g/kg ou 2 g/kg | a cada 2-4 semanas ou a cada 4-8 semanas, durante 2-5 dias |
Uso em crianças e adolescentes
A dosagem em crianças e adolescentes (0-18 anos) não difere daquela utilizada em adultos, pois a dosagem para cada indicação é baseada no peso corporal e no estado clínico do paciente, conforme descrito anteriormente.
Pacientes com insuficiência hepática
Não há dados disponíveis sobre a necessidade de ajuste da dosagem.
Pacientes com insuficiência renal
Não há necessidade de ajuste da dose, a menos que seja clinicamente justificado.
Pacientes idosos
Não há necessidade de ajuste da dose, a menos que seja clinicamente justificado.
CIDP
Devido à raridade da polineuropatia desmielinizante inflamatória crônica e, consequentemente, ao pequeno número de pacientes, a experiência no uso de imunoglobulina intravenosa em crianças com CIDP é limitada; portanto, apenas dados da literatura estão disponíveis.
No entanto, os dados publicados são consistentes e mostram que o tratamento com IVIg em adultos e crianças é igualmente eficaz, como nos casos de indicações aprovadas anteriormente.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Fabricante
- ImportadorKedrion S.p.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Ig VenaSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Baxalta Belgium Manufacturing S.A.Requer receita médicaForma farmacêutica: Solução, 100 mg/mlSubstância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Solução, 50 g/l (50 mg/ml)Substância ativa: immunoglobulins, normal human, for intravascular adm.Fabricante: Biotest Pharma GmbHRequer receita médica
Alternativas a Ig Vena noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Ig Vena em Spain
Alternativa a Ig Vena em Ukraine
Médicos online para Ig Vena
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Ig Vena – sujeita a avaliação médica e regras locais.














