
Haemate P 250 i.m. Fviii/600 i.m. Vuf
Pergunte a um médico sobre a prescrição de Haemate P 250 i.m. Fviii/600 i.m. Vuf

Como usar Haemate P 250 i.m. Fviii/600 i.m. Vuf
FOLHETO INFORMATIVO - INFORMAÇÃO PARA O UTILIZADOR
HaemateP 250 UI FVIII/600 UI VWF
HaemateP 500 UI FVIII/1200 UI VWF
HaemateP 1000 UI FVIII/2400 UI VWF
Pó e solvente para solução injetável ou infusão
Fator VIII humano e fator de von Willebrand humano
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder reler-lo se necessário.
- Em caso de dúvidas, deve consultar o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si. Não o deve dar a outros. O medicamento pode prejudicar outros, mesmo que os sintomas da sua doença sejam os mesmos.
- Se ocorrerem efeitos secundários, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é Haemate P e para que é usado
- 2. Informações importantes antes de usar Haemate P
- 3. Como usar Haemate P
- 4. Efeitos secundários possíveis
- 5. Como conservar Haemate P
- 6. Conteúdo da embalagem e outras informações
1. O QUE É HAEMATE P E PARA QUE É USADO
O que é Haemate P
Haemate P é fornecido sob a forma de pó e solvente. A solução reconstituída é administrada por via intravenosa, em injeção ou infusão.
Haemate P é produzido a partir de plasma humano (a parte líquida do sangue) e contém fator de von Willebrand humano e fator VIII humano de coagulação do sangue.
Para que é usado Haemate P
Haemate P contém tanto fator VIII humano de coagulação do sangue (FVIII) como fator de von Willebrand (VWF), o que é muito importante, pois o doente precisa mais de um ou de outro fator. Se o doente tiver hemofilia A, o médico prescreverá Haemate P com o número de unidades de fator VIII indicado. Se o doente tiver doença de von Willebrand, o médico prescreverá Haemate P com o número de unidades de fator VWF indicado.
Doença de von Willebrand (VWD)
Haemate P é usado na prevenção e tratamento de hemorragias, incluindo hemorragias durante procedimentos cirúrgicos, causadas pela falta de fator de von Willebrand, quando a terapia com desmopressina (DDAVP) é ineficaz ou contraindicada.
Hemofilia A (deficiência congênita de fator VIII)
Haemate P é usado na prevenção ou controle de hemorragias causadas pela falta de fator VIII no sangue.
Pode ser também usado no tratamento de deficiência adquirida de fator VIII e no tratamento de doentes com anticorpos contra o fator VIII.
2. INFORMAÇÕES IMPORTANTES ANTES DE USAR HAEMATE P
As seguintes secções contêm informações que deve considerar antes de usar Haemate P
Quando não usar Haemate P:
- em caso de hipersensibilidade (alergia) ao fator de von Willebrand humano ou ao fator VIII humano de coagulação do sangue ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6).
Em caso de alergia a qualquer medicamento ou alimentos, deve informar o seu médico.
Precauções e advertências
Identificabilidade
É especialmente recomendado que, em cada administração de Haemate P ao doente, sejam registados o nome e o número de lote, para manter um registo dos lotes administrados.
Antes de iniciar o tratamento com Haemate P, deve discutir com o seu médico ou farmacêutico:
- em caso de reações alérgicas ou anafilactoides(reação alérgica grave que causa problemas respiratórios graves ou tonturas). Como em qualquer injeção de proteína, é possível ocorrer uma reação de hipersensibilidade do tipo alérgico. O médico deve informar o doente sobre os primeiros sintomas de reação de hipersensibilidade, tais como urticária, erupção cutânea generalizada, compressão no peito, respiração sibilante, queda da pressão arterial e anafilaxia (reação alérgica grave que causa problemas respiratórios graves ou tonturas). Se ocorrerem tais sintomas, deve parar imediatamente a administração do medicamento e contactar o médico.
- A formação de inibidores(anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos que contenham fator VIII. Esses inibidores, especialmente em altas concentrações, interrompem o tratamento eficaz e o doente será monitorizado atentamente para a formação desses inibidores. Se a hemorragia no doente não for controlada adequadamente com Haemate P, deve informar imediatamente o médico.
- em caso de doença cardíaca preexistente ou risco de doença cardíaca, deve informar o médico ou farmacêutico.
- se for necessário usar um dispositivo de acesso venoso central (ang. central venous access device, CVAD) para administrar Haemate P, o médico deve considerar o risco de complicações relacionadas com o CVAD, incluindo infecções locais, bacteremia e trombose no local de inserção do cateter.
Doença de von Willebrand
- Em caso de risco conhecido de formação de coágulos sanguíneos (trombose), especialmente em doentes com fatores de risco clínicos ou morfológicos (por exemplo, períodos pós-operatórios sem profilaxia antitrombótica, imobilização prolongada, obesidade, superdose, cancro). Nesse caso, o doente deve ser monitorizado para detectar sinais precoces de trombose. Deve ser implementada uma profilaxia antitrombótica, de acordo com as diretrizes atuais.
O médico avaliará cuidadosamente os benefícios do tratamento com Haemate P em relação ao risco de complicações.
Segurança do uso em relação à possibilidade de transmissão de vírus
Em caso de medicamentos preparados a partir de sangue ou plasma humano, são tomadas medidas de precaução para evitar a infecção dos doentes. Incluem:
- seleção cuidadosa dos doadores de sangue e plasma, para garantir que os doadores com risco de transmissão de infecção sejam excluídos.
- teste de cada doação e pool de plasma para detectar a presença de vírus/infecção, e
- inclusão no processo de tratamento do sangue ou plasma de procedimentos que possam inativar ou remover vírus.
Apesar da implementação dessas medidas, não é possível excluir completamente a possibilidade de transmissão de infecção quando se usam medicamentos preparados a partir de sangue ou plasma humano. Isso inclui vírus desconhecidos ou recentemente descobertos e outros tipos de infecção.
Os procedimentos implementados são considerados eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV, vírus que causa a AIDS), vírus da hepatite B e vírus da hepatite C (inflamação do fígado) e contra o vírus da hepatite A (inflamação do fígado) não envelopado.
Contra os vírus não envelopados, como o parvovirus B19, os procedimentos implementados podem ter eficácia limitada.
Infecções por parvovirus B19 podem ser graves:
- para mulheres grávidas (infecção do feto) e
- para pessoas com sistema imunológico comprometido ou com produção aumentada de glóbulos vermelhos devido a certos tipos de anemia (por exemplo, anemia falciforme ou hemolítica).
Em caso de administração regular/repetida de produtos produzidos a partir de plasma humano que contenham fator de von Willebrand e fator VIII, o médico pode recomendar considerar a vacinação contra a hepatite A e B.
Haemate P e outros medicamentos
Deve informar o médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou recentemente, incluindo medicamentos disponíveis sem receita médica
- Haemate P não deve ser misturado com outros medicamentos, solventes ou diluentes.
Gravidez, amamentação e fertilidade
- Se estiver grávida, a amamentar ou a planeiar uma gravidez, deve consultar o médico ou farmacêutico antes de usar este medicamento.
- Como a hemofilia A é rara em mulheres, não há dados disponíveis sobre o uso de fator VIII durante a gravidez e amamentação.
- No caso da doença de von Willebrand, as mulheres estão mais expostas do que os homens devido ao risco adicional de hemorragias relacionadas com a menstruação, gravidez, parto e complicações ginecológicas. Com base na experiência adquirida a partir de estudos pós-comercialização, a substituição de fator de von Willebrand (VWF) é recomendada para prevenção e tratamento de hemorragias agudas. Estudos clínicos sobre a terapia de substituição de VWF em mulheres grávidas e lactantes não estão disponíveis.
- Durante a gravidez e amamentação, Haemate P deve ser usado apenas se houver indicações médicas para isso.
Condução de veículos e uso de máquinas
Não há relatos de que Haemate P afete a capacidade de conduzir veículos ou usar máquinas.
Haemate P contém sódio
Haemate 250 UI FVIII/600 UI VWF contém menos de 1 mmol de sódio (23 mg) por frasco, pelo que pode ser considerado "sem sódio".
Haemate 500 UI FVIII/1200 UI VWF contém 26 mg de sódio (principal componente do sal de cozinha) por frasco, o que corresponde a 1,3% da dose diária máxima recomendada de sódio para um adulto.
Haemate 1000 UI FVIII / 2400 UI VWF contém 52,5 mg de sódio (principal componente do sal de cozinha) por frasco, o que corresponde a 2,6% da dose diária máxima recomendada de sódio para um adulto.
3. COMO USAR HAEMATE P
O tratamento deve ser iniciado e supervisionado por um médico com experiência no tratamento dessas condições.
Dosagem
A quantidade necessária de fator de von Willebrand e fator VIII e a duração do tratamento dependem de vários fatores, tais como peso corporal, gravidade da condição, local e intensidade da hemorragia ou necessidade de prevenção de hemorragia durante procedimentos cirúrgicos ou exames (ver secção "Informações destinadas apenas ao pessoal médico").
Se Haemate P for prescrito para uso em casa, o doente será instruído pelo médico sobre como administrar a injeção e a dosagem.
Deve seguir as instruções fornecidas pelo médico ou enfermeiro do centro de tratamento de hemofilia.
Uso de uma dose maior do que a recomendada de Haemate P
Os sintomas de superdose de VWF ou FVIII não são conhecidos. No entanto, o risco de formação de coágulos sanguíneos (trombose) não pode ser excluído em caso de administração de doses excepcionalmente altas, especialmente com produtos VWF com alto teor de FVIII.
Reconstituição e administração Informações gerais
- O pó deve ser misturado (reconstituído) com o solvente (parte líquida) e retirado do frasco em condições assépticas.
- A solução deve ser transparente ou ligeiramente opalescente. Após a filtração/retirada (ver abaixo), o produto reconstituído deve ser verificado visualmente para detectar partículas e descoloração. Mesmo que as instruções para o procedimento de reconstituição sejam seguidas cuidadosamente, a presença de alguns grumos ou partículas não é rara. O filtro fornecido com o dispositivo Mix2Vial remove essas partículas completamente. A filtração não afeta os cálculos de dosagem.
- Não use soluções que sejam visivelmente turvas ou contenham grumos ou partículas após a filtração.
- Qualquer resíduo de produto não utilizado após a administração ou resíduos deve ser eliminado de acordo com as regulamentações nacionais e as recomendações do médico.
Reconstituição
Não abrindo nenhum dos frascos, aqueça o pó e o solvente de Haemate P à temperatura ambiente, deixando os frascos nessa temperatura por cerca de uma hora ou segurando-os por alguns minutos na mão. NÃO exponha os frascos a uma fonte direta de calor. Não aqueça os frascos acima da temperatura corporal (37°C).
Remova cuidadosamente as tampas de proteção dos frascos do solvente e do medicamento Haemate P. Limpe as tampas de borracha expostas com um cotonete embebido em álcool e deixe-as secar. O solvente pode ser então transferido para o frasco do pó usando o conjunto fornecido (Mix2Vial). Siga as instruções abaixo.
1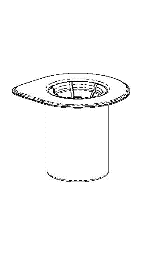 |
|
2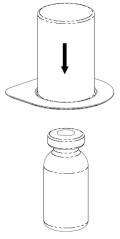 |
|
3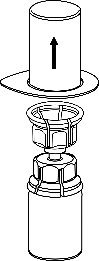 |
|
4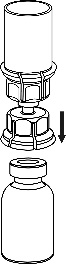 |
|
5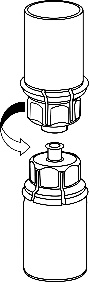 |
|
6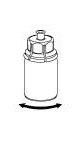 |
|
7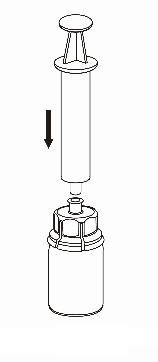 |
|
Retirada e administração
8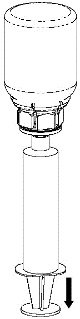 |
|
9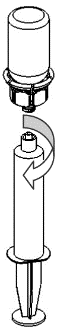 |
|
Modo de administração
Para a injeção de Haemate P, é recomendado o uso de seringas de plástico, descartáveis, pois as soluções deste tipo tendem a aderir à superfície de todas as seringas de vidro.
A solução deve ser administrada lentamente por via intravenosa, a uma taxa não superior a 4 ml por minuto. Deve-se ter cuidado para que o sangue não entre na seringa cheia de produto. Após a retirada do produto para a seringa, deve-se usá-lo imediatamente.
Se for necessário administrar uma quantidade maior de fator, isso também pode ser feito por infusão. Para isso, deve-se transferir a solução reconstituída para um sistema de infusão aprovado. A infusão deve ser realizada de acordo com as instruções do médico. Deve-se estar atento à ocorrência de qualquer reação imediata. Em caso de qualquer reação que possa estar relacionada à administração de Haemate P, a injeção/infusão deve ser interrompida (ver também secção 2).
Em caso de dúvidas adicionais sobre o uso deste medicamento, deve consultar o médico ou farmacêutico.
4. EFEITOS SECUNDÁRIOS POSSÍVEIS
Como qualquer medicamento, Haemate P pode causar efeitos secundários, embora não ocorram em todos.
As seguintes reações adversas ocorreram muito raramente (em menos de 1 em 10.000 doentes):
- Reação alérgica aguda (como angioedema, sensação de queimadura e picada no local da infusão, calafrios, rubor facial, urticária generalizada, dor de cabeça, reação alérgica cutânea, queda da pressão arterial, letargia, náuseas, ansiedade, taquicardia, compressão no peito, formigamento, vômitos, respiração sibilante), que ocorreu muito raramente e, em alguns casos, pode levar a anafilaxia aguda (reação alérgica grave que causa problemas respiratórios graves ou tonturas).
- Aumento da temperatura corporal (febre).
Doença de von Willebrand
- Muito raramente, existe o risco de ocorrência de sintomas trombóticos/tromboembólicos, incluindo trombose pulmonar (risco de formação e deslocamento de coágulos sanguíneos para o sistema vascular),
- Em doentes que recebem produtos VWF que mantêm níveis elevados de FVIII:C no sangue, pode aumentar o risco de formação de coágulos (ver também ponto 2)
- Em doentes com doença de von Willebrand, podem ocorrer muito raramente inibidores (anticorpos neutralizantes) contra o VWF. Se esses inibidores ocorrerem, resultarão em uma resposta clínica inadequada, levando a hemorragias prolongadas. Isso ocorre especialmente em doentes com uma forma específica de doença de von Willebrand, conhecida como tipo 3. Esses anticorpos podem causar reações anafiláticas. Nesse caso, os doentes que apresentarem reação anafilática devem ser submetidos a um exame para detectar a presença de inibidor. Nesses casos, é recomendado entrar em contato com um centro especializado no tratamento de hemofilia.
Hemofilia A
- Em caso de crianças não tratadas previamente com medicamentos que contenham fator VIII, podem ocorrer anticorpos bloqueadores (ver ponto 2) muito frequentemente (em mais de 1 em 10 doentes). No entanto, em doentes que foram tratados previamente com fator VIII (mais de 150 dias de tratamento), o risco é incomum (menos de 1 em 100 doentes). Se ocorrer, os medicamentos do doente podem deixar de funcionar corretamente e o doente pode apresentar hemorragia prolongada. Se ocorrer, deve-se entrar em contato imediatamente com o médico.
Efeitos secundários em crianças e adolescentes
A frequência, tipo e gravidade das reações adversas em crianças são semelhantes às dos adultos.
Notificação de efeitos secundários
Se ocorrerem efeitos secundários, incluindo quaisquer efeitos secundários não mencionados no folheto, deve informar o médico ou farmacêutico, ou enfermeiro. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Nacional de Vigilância Sanitária:
Rua X, nº Y
Cidade, Estado
Telefone: XXXX-XXXX
Fax: XXXX-XXXX
Sítio na Internet: https://www.anvisa.gov.br
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários permite reunir mais informações sobre a segurança do medicamento.
5. COMO CONSERVAR HAEMATE P
- Manter o medicamento fora do alcance e da vista das crianças.
- Não use este medicamento após o prazo de validade impresso na embalagem e no rótulo (após a abreviação Válido até).
- Não armazenar a uma temperatura superior a 25°C.
- Não congelar.
- Manter os frascos na embalagem exterior para proteger contra a luz.
- Haemate P não contém conservante, portanto, a solução reconstituída deve ser usada imediatamente.
- Se a solução reconstituída não for administrada imediatamente, deve ser usada dentro de 3 horas.
- Após a retirada do produto para a seringa, deve-se usá-lo imediatamente.
- O número do lote está impresso no rótulo e na embalagem, após a abreviação (Lote).
6. CONTEÚDO DA EMBALAGEM E OUTRAS INFORMAÇÕES
O que contém Haemate P Substâncias ativas do medicamento:
Fator de von Willebrand humano e fator VIII humano de coagulação do sangue
Outros componentes (excipientes) são:
Albumina humana, glicina, cloreto de sódio, citrato de sódio, hidróxido de sódio ou ácido clorídrico (em pequenas quantidades para ajustar o pH)
Solvente: Água para injeção
Como é Haemate P e que contenha a embalagem
Haemate P é fornecido como um pó branco ou amarelado claro, ou uma massa seca e quebradiça, e água para injeção como solvente. A solução reconstituída deve ser transparente ou ligeiramente opalescente, ou seja, pode brilhar quando segurada contra a luz, mas não deve conter partículas visíveis.
Embalagens disponíveis
A embalagem de Haemate P na dose de 250 UI FVIII/600 UI VWF contém:
1 frasco de pó
1 frasco de 5 ml de água para injeção
1 sistema de transferência 20/20 com filtro,
Conjunto para administração (embalagem interna)
1 seringa de uso único de 5 ml,
1 conjunto para punção,
2 cotonetes embebidos em álcool,
1 adesivo não estéril
A embalagem de Haemate P na dose de 500 UI FVIII/1200 UI VWF contém:
1 frasco de pó
1 frasco de 10 ml de água para injeção
1 sistema de transferência 20/20 com filtro
Conjunto para administração (embalagem interna)
1 seringa de uso único de 10 ml,
1 conjunto para punção,
2 cotonetes embebidos em álcool,
1 adesivo não estéril
A embalagem de Haemate P na dose de 1000 UI FVIII/2400 UI VWF contém:
1 frasco de pó
1 frasco de 15 ml de água para injeção
1 sistema de transferência 20/20 com filtro,
Conjunto para administração (embalagem interna)
1 seringa de uso único de 20 ml,
1 conjunto para punção,
2 cotonetes embebidos em álcool,
1 adesivo não estéril
Nem todos os tamanhos podem estar disponíveis no mercado.
Titular da autorização de comercialização e fabricante
CSL Behring GmbH
Rua Emil-von-Behring, 76
35041 Marburgo
Alemanha
Data de aprovação do folheto:
Informações destinadas apenas ao pessoal médico:
Dosagem Doença de von Willebrand:
É importante calcular a dose usando o número de unidades internacionais (UI) de VWF: RCo
1 UI/kg de VWF:RCo aumenta normalmente o nível de VWF:RCo circulante em 0,02 UI/ml (2%).
A dose necessária é calculada usando a seguinte fórmula:
Dose necessária = peso corporal (kg) x aumento desejado do nível de VWF:RCo (%) x 0,5.
Deve-se tentar alcançar um nível de VWF:RCo > 0,6 UI/ml (60%) e FVIII:C > 0,4 UI/ml (40%).
- 40 – 80 UI/kg de fator de von Willebrand (VWF:RCo) e 20 – 40 UI de FVIII:C/kg de peso corporal são normalmente recomendados para alcançar a hemostase.
Pode ser necessário administrar uma dose inicial de fator de von Willebrand de 80 UI/kg, especialmente em doentes com tipo 3 de doença de von Willebrand, onde a manutenção de níveis adequados pode exigir doses maiores do que em outros tipos de doença.
Prevenção de hemorragia durante procedimentos cirúrgicos ou lesões graves:
Para prevenir hemorragia maciça durante ou após um procedimento cirúrgico, a injeção deve ser iniciada 1 a 2 horas antes do procedimento.
A dose adequada deve ser administrada a cada 12 a 24 horas. A dose e a duração do tratamento dependem do estado clínico do doente, do tipo e da intensidade da hemorragia, bem como dos níveis de VWF:RCo e FVIII:C.
Ao usar produtos que contenham fator de von Willebrand com FVIII, o médico deve estar ciente de que a terapia prolongada pode causar um aumento excessivo do nível de FVIII:C. Após 24 a 48 horas de tratamento, para evitar um aumento excessivo e não controlado do nível de FVIII:C, deve-se considerar a redução das doses e/ou o aumento do intervalo entre as administrações.
Crianças e adolescentes
A dosagem em crianças depende do peso corporal, portanto, o tamanho da dose é determinado da mesma forma que em adultos. A frequência de administração deve ser sempre determinada individualmente com base na eficácia clínica.
Hemofilia A:
Monitorização do tratamento
Durante o tratamento, é importante determinar os níveis de fator VIII para medir a dose adequada a ser administrada ao doente e a frequência das administrações repetidas. As respostas dos doentes ao fator VIII podem variar, devido a diferentes níveis de recuperação e diferentes tempos de meia-vida. A dosagem com base no peso corporal pode exigir ajustes em doentes com sobrepeso ou baixo peso. Especialmente em procedimentos cirúrgicos mais graves, é necessário um monitoramento cuidadoso da terapia de substituição por meio do controle do processo de coagulação (nível de atividade do fator VIII no sangue).
Os doentes devem ser monitorizados para detectar a formação de inibidores do fator VIII. Ver também ponto 2.
A dosagem e a duração do tratamento de substituição dependem da gravidade da deficiência de fator VIII, do local e da intensidade da hemorragia, bem como do estado clínico do doente.
É importante calcular a dose usando o número de unidades internacionais (UI) de FVIII: RCo
A atividade do fator VIII no sangue é expressa como porcentagem (em relação ao sangue humano normal) ou melhor em UI (em relação ao Padrão Internacional para o fator VIII no sangue).
Uma UI de atividade do fator VIII é igual à quantidade de fator VIII contida em 1 ml de sangue humano normal.
Tratamento de emergência
O cálculo da dose necessária de fator VIII baseia-se na observação empírica de que 1 UI de fator VIII por kg de peso corporal aumenta a atividade do fator VIII no sangue em cerca de 2% (2 UI/dl). A dose necessária é calculada usando a seguinte fórmula:
Dose necessária = peso corporal (kg) x aumento desejado do nível de fator VIII (%) x 0,5.
A dose e a frequência de administração do medicamento devem ser sempre determinadas individualmente com base na eficácia clínica em cada doente.
Em caso de hemorragias, a atividade do fator VIII não deve cair abaixo dos valores para a atividade no sangue (% ou UI/dl) no período de tempo correspondente.
A tabela abaixo pode ser usada para determinar a dosagem em caso de hemorragias e procedimentos cirúrgicos:
| Tipo de hemorragia/procedimento cirúrgico | Nível terapêutico de atividade do fator VIII no sangue (% ou UI/dl) | Frequência de dosagem (horas) / duração do tratamento (dias) |
| Hemorragias | ||
| Hemorragia articular leve, hemorragia muscular ou sangramento bucal | 20-40 | Repita a injeção a cada 12 a 24 horas por pelo menos 1 dia até que a dor e o sangramento cessem ou até a recuperação |
| Hemorragia articular extensa; hemorragia muscular ou hematoma | 30-60 | Repita a injeção a cada 12-24 horas por 3 a 4 dias ou mais até que a dor e a disfunção aguda cessem |
| Hemorragias que ameaçam a vida: | 60-100 | Repita a injeção a cada 8 a 24 horas até que o perigo cesse |
| Procedimentos cirúrgicos | ||
| Procedimentos cirúrgicos menores, incluindo extração de dentes | 30-60 | A cada 24 horas, por pelo menos 1 dia, até a recuperação. |
| Procedimentos cirúrgicos maiores | 80-100 (pré e pós-operatório) | Repita a injeção a cada 8 – 24 horas até a cicatrização adequada da ferida, seguida de um nível de 30% a 60% (UI/dl) de atividade do fator VIII por pelo menos 7 dias. |
Prevenção a longo prazo
Em doentes com hemofilia A grave, normalmente são administrados 20 a 40 UI de fator VIII por kg de peso corporal a cada 2 a 3 dias.
Em alguns casos, especialmente em doentes jovens, pode ser necessário administrar o fator com mais frequência ou em doses maiores.
Crianças e adolescentes
Não há dados disponíveis de estudos clínicos sobre a dosagem de Haemate P em crianças.
Precauções e advertências especiais para o uso
Ao usar produtos VWF, o médico deve estar ciente de que a terapia prolongada pode causar um aumento excessivo do nível de FVIII:C. Em doentes que recebem produtos VWF que contenham FVIII, deve-se monitorar os níveis de FVIII:C no sangue para evitar um aumento excessivo e não controlado do nível de FVIII:C, o que pode aumentar o risco de trombose, e também deve-se considerar o uso de medidas antitrombóticas.
Efeitos secundários
Quando for necessário administrar doses muito altas ou repetidas, ou quando estiverem presentes inibidores, ou em caso de cuidados pré e pós-operatórios, todos os doentes devem ser monitorizados para detectar sinais de hipervolemia. Além disso, doentes com grupos sanguíneos A, B e AB devem ser monitorizados para detectar sinais de hemólise intravascular e/ou redução dos valores de hematócrito.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorCSL Behring GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Haemate P 250 i.m. Fviii/600 i.m. VufForma farmacêutica: Pó, 50 UI/ml; 500 UI + 60 UI/ml; 600 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 25 UI/ml; 250 UI + 30 UI/ml; 300 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 100 UI/ml; 1000 UI + 120 UI/ml; 1200 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médica
Alternativas a Haemate P 250 i.m. Fviii/600 i.m. Vuf noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Haemate P 250 i.m. Fviii/600 i.m. Vuf em Ukraine
Alternativa a Haemate P 250 i.m. Fviii/600 i.m. Vuf em Espanha
Médicos online para Haemate P 250 i.m. Fviii/600 i.m. Vuf
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Haemate P 250 i.m. Fviii/600 i.m. Vuf – sujeita a avaliação médica e regras locais.














