

Fanhdi

Pergunte a um médico sobre a prescrição de Fanhdi

Como usar Fanhdi
FOLHETO DA EMBALAGEM: INFORMAÇÃO PARA
USUÁRIOS
FANHDI
500 UI de FVIII + 600 UI de VWF
Pó e pós-solvente para a preparação de uma solução para injeção e infusão
Complexo do fator humano VIII de coagulação e fator humano de von Willebrand
É necessário ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
- É necessário guardar este folheto para que possa ser lido novamente se necessário.
- Em caso de dúvidas, é necessário consultar um médico ou farmacêutico.
- O medicamento foi prescrito para uma pessoa específica. Não deve ser dado a outras pessoas. O medicamento pode ser prejudicial a outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum sintoma indesejado, incluindo qualquer sintoma indesejado não mencionado neste folheto, é necessário informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento FANHDI e para que é usado
- 2. Informações importantes antes de tomar o medicamento FANHDI
- 3. Como tomar o medicamento FANHDI
- 4. Efeitos indesejados
- 5. Como armazenar o medicamento FANHDI
- 6. Conteúdo da embalagem e outras informações
1. O QUE É O MEDICAMENTO FANHDI E PARA QUE É USADO
FANHDI, apresenta-se sob a forma de pó e solvente para a preparação de uma solução para injeção e infusão em frascos contendo nominalmente 500 UI de fator VIII de coagulação humano (FVIII) e 600 UI de fator humano de von Willebrand (VWF).
Após a reconstituição, o produto contém 50 UI/ml de FVIII e 60 UI/ml de VWF.
Grupo farmacoterapêutico: medicamentos antihemorrágicos, combinação de fator VIII de coagulação e fator de von Willebrand.
FANHDI é usado para prevenir e controlar hemorragias em pacientes com hemofilia A (deficiência congênita de fator VIII de coagulação).
- 1.3.1. SPC, rotulagem e folheto da embalagem
O uso de FANHDI também é indicado para prevenir e controlar hemorragias (incluindo hemorragias durante procedimentos cirúrgicos) em pacientes com doença de von Willebrand (VWD), quando o tratamento com desmopressina (DDAVP) é ineficaz ou contraindicado.
O produto pode ser usado para tratar a deficiência adquirida de fator VIII de coagulação humano.
2. INFORMAÇÕES IMPORTANTES ANTES DE TOMAR O MEDICAMENTO FANHDI
Quando não usar o medicamento FANHDI
- Quando o paciente apresenta alergia (hipersensibilidade) ao complexo de fator VIII de coagulação e fator de von Willebrand ou a qualquer um dos outros componentes do medicamento (listados no ponto 6).
É necessário consultar um médico se precisar de aconselhamento ou informações adicionais.
Advertências e precauções
- Em casos raros, podem ocorrer reações anafiláticas (reações alérgicas graves e súbitas). A hipersensibilidade ao FANHDI pode manifestar-se como erupção cutânea, urticária generalizada, sensação de pressão no peito, tontura, mesmo quando em pé. Se ocorrerem esses sintomas, é necessário interromper a administração do medicamento e informar o médico.
- Para determinar a dose de FANHDI que garanta a obtenção e manutenção de um nível adequado de fator VIII, o médico pode solicitar uma série de exames.
- Se a hemorragia não parar, apesar da administração de FANHDI, é necessário informar o médico. Isso pode ser devido à formação de um inibidor do fator VIII, o que requer confirmação por exames. Os inibidores do fator VIII são anticorpos que bloqueiam a ação do fator VIII administrado. Como resultado, ocorre uma redução da eficácia do fator VIII na prevenção de hemorragias.
- Se anteriormente já ocorreu a formação de um inibidor do fator VIII e, subsequentemente, o tratamento foi alterado para outro produto que contenha fator VIII, existe um risco maior de recorrência dessa complicação.
- Durante o tratamento da doença de von Willebrand com fatores de risco clínicos ou laboratoriais conhecidos, existe o risco de ocorrência de complicações trombóticas. Por isso, é necessário realizar exames adequados para detectar precocemente os sintomas causados por essas complicações e aplicar o tratamento recomendado para as complicações tromboembólicas.
- Na doença de von Willebrand, especialmente do tipo 3, podem ocorrer a formação de anticorpos neutralizantes (inibidores) do fator de von Willebrand. Os inibidores do fator de von Willebrand são anticorpos presentes no sangue que podem bloquear o fator administrado. Nesses casos, se o tratamento não alcançar os níveis esperados de atividade do fator de von Willebrand no sangue ou não controlar as hemorragias, apesar da administração de doses adequadas, é necessário realizar exames para detectar a presença de um inibidor do fator de von Willebrand. Em pacientes com níveis altos de inibidor, o tratamento com fator de von Willebrand pode ser ineficaz.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Se for necessário usar um acesso venoso central para a administração de FANHDI, o médico deve estar ciente da possibilidade de ocorrência de infecção local, bacteriemia (infecção do sangue por bactérias) e formação de um trombo na veia no local da inserção do cateter.
- Se anteriormente já ocorreu a formação de um inibidor do fator VIII e, subsequentemente, o tratamento foi alterado para outro produto que contenha fator VIII, existe um risco maior de recorrência dessa complicação.
No processo de fabricação de produtos derivados de sangue ou plasma humano, são aplicadas as seguintes medidas para garantir a segurança contra a transmissão de agentes infecciosos:
- seleção rigorosa dos doadores para excluir portadores de agentes infecciosos,
- exame de cada doação e pool de plasma para detectar a presença de vírus,
- uso de procedimentos de inativação/remoção de vírus do sangue e plasma durante o processo de fabricação.
No entanto, não é possível excluir completamente a transmissão de agentes infecciosos durante o uso de produtos medicinais derivados de sangue ou plasma humano. Isso se aplica também a vírus desconhecidos ou emergentes e outros patógenos.
Os métodos usados são considerados eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV), hepatite B (HBV), hepatite C (HCV) e vírus da hepatite A sem envelope. A eficácia desses métodos contra vírus sem envelope, como o parvovirus B19, pode ser limitada.
A infecção por parvovirus B19 pode ser particularmente grave em mulheres grávidas (infecção do feto) e em pessoas com imunidade reduzida ou certos tipos de anemia (por exemplo, anemia falciforme ou anemia hemolítica).
Em pacientes que recebem regularmente doses repetidas de produtos derivados de plasma que contenham fator VIII, o médico responsável pode recomendar a vacinação contra a hepatite A e B.
É altamente recomendável que, a cada administração do medicamento FANHDI ao paciente, seja registrada a identidade do paciente e o número de série do produto, para que possa ser estabelecida uma conexão entre o paciente e a série do medicamento.
Ver também o ponto 4
Crianças e adolescentes
As advertências e precauções mencionadas se aplicam tanto a adultos quanto a crianças.
- 1.3.1. SPC, rotulagem e folheto da embalagem
FANHDI e outros medicamentos
É necessário informar o médico sobre todos os medicamentos que o paciente está tomando atualmente ou recentemente, bem como sobre os medicamentos que o paciente planeja tomar.
As interações entre o complexo de fator VIII de coagulação e fator de von Willebrand e outros medicamentos não são conhecidas.
Gravidez e amamentação
Devido ao fato de a hemofilia A ser rara em mulheres, não há dados sobre o uso do complexo de fator FVIII/VWF durante a gravidez e amamentação.
É necessário consultar um médico ou farmacêutico antes de iniciar o uso de qualquer medicamento.
Condução de veículos e operação de máquinas
FANHDI não afeta a capacidade de conduzir veículos ou operar máquinas.
3. COMO TOMAR O MEDICAMENTO FANHDI
O medicamento deve ser administrado por via intravenosa. A velocidade de administração não deve exceder 10 ml/min.
É necessário seguir as instruções do médico ou do profissional de saúde do centro de tratamento de hemofilia. Em caso de dúvidas, é necessário consultar um médico ou farmacêutico.
A dose de FANHDI a ser usada depende de vários fatores, como o peso corporal, o estado clínico e o tipo e gravidade da hemorragia. Para alcançar o nível adequado de fator VIII e fator de von Willebrand no sangue, o médico determinará a dose de FANHDI e a frequência de administração.
O médico determinará a duração do tratamento com FANHDI.
Não armazenar o medicamento para uso posterior, mesmo se for armazenado na geladeira.
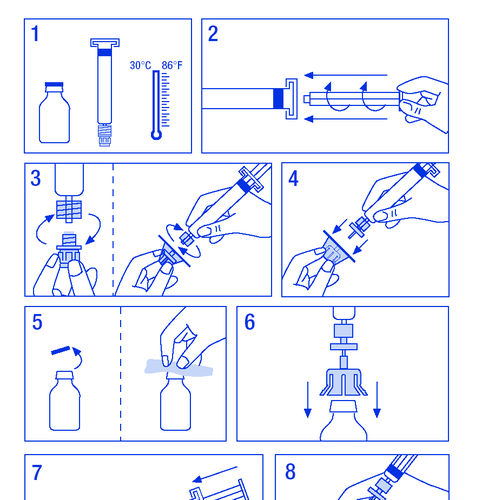
Preparo da solução:
- 1. Aquecer os frascos a uma temperatura não superior a 30 ºC (figura 1).
- 2. Fixar o êmbolo na seringa com o solvente (figura 2).
- 1.3.1. SPC, rotulagem e folheto da embalagem
- 3. Retirar o filtro da embalagem. Retirar a tampa de plástico da extremidade da seringa e fixar o filtro (figura 3).
- 4. Retirar o conector de fixação do frasco e conectar a seringa com o filtro (figura 4).
- 5. Retirar a tampa de plástico do frasco e expor o batoque de borracha, desinfetar com um desinfetante (figura 5).
- 6. Perfurar o batoque do frasco com a agulha do conector (figura 6).
- 7. Injetar todo o solvente no frasco (figura 7).
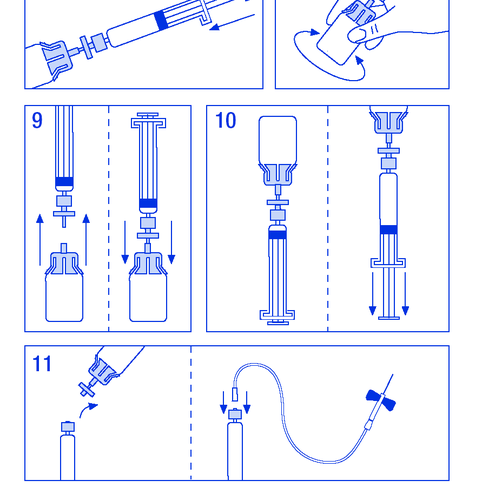
- 8. Agitar suavemente o frasco até que o pó seja completamente dissolvido (figura 8). Assim como no caso de outros produtos para administração intravenosa, não use se o produto não estiver dissolvido ou se houver partículas visíveis.
- 9. Desconectar a seringa com o filtro do frasco por um momento para permitir a entrada de ar (figura 9).
- 10. Inverter o frasco e aspirar a solução para a seringa (figura 10).
- 11. Preparar o local da injeção, desconectar a seringa e injetar o produto por meio de uma agulha de borboleta ou outra agulha estéril. Administrar lentamente por via intravenosa a uma velocidade de 3 ml/min e nunca exceder 10 ml/min para evitar reações vasculares (figura 11).
- 1.3.1. SPC, rotulagem e folheto da embalagem
- 1.3.1. SPC, rotulagem e folheto da embalagem
Não reutilizar o conjunto de administração.
Todas as sobras do produto não utilizado e outros resíduos devem ser eliminados de acordo com as regulamentações locais.
Uso de uma dose maior do que a recomendada de FANHDI
Não foram relatados sintomas de superdose do complexo de fator VIII de coagulação e fator de von Willebrand. Após uma superdose significativa, podem ocorrer complicações tromboembólicas. Independentemente disso, qualquer caso de superdose de FANHDI deve ser discutido imediatamente com um farmacêutico ou médico.
Omissão da administração de FANHDI
- Se uma dose for omitida, é necessário administrar a próxima dose imediatamente e continuar o tratamento regularmente, de acordo com as recomendações do médico.
- Não deve ser administrada uma dose dupla para compensar a dose omitida.
4. EFEITOS INDESEJADOS
Como qualquer medicamento, este medicamento pode causar efeitos indesejados, embora não ocorram em todos.
Hipersensibilidade ou reações alérgicas (eritema, sensação de queimadura ou picada no local da injeção, calafrios, rubor, urticária generalizada, dor de cabeça, erupção cutânea, hipotensão, letargia, náusea, ansiedade, taquicardia, sensação de pressão no peito, suor, vômitos) foram observadas raramente e, em alguns casos, levaram ao desenvolvimento de uma reação anafilática grave (incluindo choque).
Em casos raros, foi observada uma elevação da temperatura corporal.
Em caso de reação anafilática ou alérgica, é necessário interromper a administração do medicamento e informar imediatamente o médico.
Não é possível excluir completamente a possibilidade de ocorrência de reações alérgicas após a administração deste medicamento.
Pacientes com hemofilia A podem desenvolver anticorpos neutralizantes (inibidores) contra o fator VIII.
Na
ocasião
em
que
esses
inibidores
se
desenvolvem,
observa-se
uma
resposta
clínica
insuficiente
ao
tratamento.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Os inibidores podem influenciar o aumento do risco de ocorrência de reações alérgicas (choque anafilático). Em caso de ocorrência de reações alérgicas, é necessário realizar exames para detectar a presença de inibidores.
Em tais casos, é recomendável entrar em contato com um centro especializado no tratamento de distúrbios hemostáticos.
Durante o uso do medicamento em pacientes com doença de von Willebrand com fatores de risco clínicos ou laboratoriais conhecidos, existe o risco de ocorrência de complicações trombóticas.
A manutenção de níveis excessivamente altos de FVIII durante o tratamento com fator VIII que contém fator de von Willebrand aumenta o risco de ocorrência de complicações trombóticas.
Durante vários estudos clínicos realizados com 164 pacientes, foram administradas um total de 7000 infusões de FANHDI. Os resultados obtidos nos estudos indicam uma boa tolerabilidade do medicamento e uma baixa frequência de ocorrência de efeitos indesejados. Foram observados apenas 2 casos de efeitos indesejados relacionados ao produto medicamental administrado. Nesses casos, foi relatada a ocorrência de febre.
Tabela de efeitos indesejados
A tabela abaixo lista as categorias de sistemas e órgãos (SOC e nível de termo preferido) de acordo com a classificação MedDRA.
A frequência de ocorrência foi avaliada de acordo com os seguintes critérios:
- muito frequente (≥ 1/10)
- frequente (≥ 1/100 a <1>
- menos frequente (≥ 1/1000 a <1>
- raros (≥ 1/10 000 a <1>
- muito raros (<1>
- desconhecidos (frequência não pode ser estimada com base nos dados disponíveis).
Em cada categoria de frequência, os efeitos indesejados são listados começando com os mais graves e seguidos pelos menos graves.
Crianças e adolescentes
A frequência de ocorrência, o tipo e a gravidade dos efeitos indesejados esperados em crianças não diferem daqueles observados em adultos.
| Classificação de sistemas e órgãos | Efeitos indesejados | Frequência de ocorrência |
| Distúrbios gerais e condições no local da administração | Febre. | Raro |
- 1.3.1. SPC, rotulagem e folheto da embalagem
Notificação de suspeitas de efeitos indesejados
Após a autorização do medicamento, é importante notificar as suspeitas de efeitos indesejados. Isso permite o monitoramento contínuo da relação benefício-risco do medicamento.
Os profissionais de saúde devem notificar quaisquer suspeitas de efeitos indesejados por meio de:
Departamento de Monitoramento de Efeitos Indesejados de Medicamentos da Agência Reguladora de Medicamentos, Produtos Médicos e Produtos Biocidas
Al. Jerozolimskie 181C
02-222 Varsóvia
Tel.: +48 222 49 21 301
Fax: +48 222 49 21 309
e-mail: [email protected]
A notificação de efeitos indesejados permite coletar mais informações sobre a segurança do medicamento.
Informações sobre medidas de segurança contra a transmissão de agentes infecciosos, ver ponto 2.
- 2.
5. COMO ARMazenAR O MEDICAMENTO FANHDI
O medicamento deve ser armazenado em um local não visível e inacessível a crianças.
Não armazenar a uma temperatura superior a 30°C. Não congelar.
Não use o medicamento após o vencimento da data de validade.
A solução deve ser transparente e ligeiramente opalescente.
Não use soluções que contenham precipitação ou sedimento.
Não use se, após a reconstituição, o produto contiver partículas visíveis ou a solução mudar de cor.
Após a reconstituição, a estabilidade química e física do produto é mantida por 12 horas a 25 ºC. Do ponto de vista microbiológico, o produto deve ser usado imediatamente. Se, após a reconstituição, o produto não for usado, pode ser armazenado por no máximo 24 horas a 2 ºC – 8 ºC, mas apenas se a responsabilidade pelo preparo da solução for do usuário e se seguir as normas de assepsia.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Os medicamentos não devem ser jogados na canalização. É necessário perguntar a um farmacêutico como eliminar os medicamentos que não são mais usados. Essa ação ajudará a proteger o meio ambiente.
Prazo de validade
3 anos,
Não use o medicamento após o vencimento da data de validade impressa na embalagem.
6. CONTEÚDO DA EMBALAGEM E OUTRAS INFORMAÇÕES
O que contém o medicamento FANHDI
A substância ativa é o complexo de fator VIII de coagulação humano e fator de von Willebrand.
Cada frasco de pó contém 500 UI de fator VIII de coagulação humano e 600 UI de fator de von Willebrand.
Após a reconstituição em 10 ml de água para injeção, o produto contém 50 UI/ml de FVIII e 60 UI/ml de VWF.
Outros componentes são: albumina humana, histidina e arginina.
Cada seringa contém 10 ml de água para injeção.
Como é o medicamento FANHDI e o que o conteúdo da embalagem
Frascos com pó branco ou amarelado claro e seringa com água para injeção.
Cada embalagem de FANHDI contém um frasco com 500 UI de fator VIII de coagulação humano e 600 UI de fator de von Willebrand (pó para injeção e infusão) e 1 seringa com 10 ml de água para injeção (solvente).
Conjunto para preparo da solução e administração incluído na embalagem de FANHDI: conector de fixação ao frasco, filtro e conjunto para infusão.
Embalagens disponíveis:
FANHDI 250 UI de FVIII + 300 UI de VWF
FANHDI 1000 UI de FVIII + 1200 UI de VWF
Nem todas as embalagens podem estar disponíveis.
Responsável e fabricante
- 1.3.1. SPC, rotulagem e folheto da embalagem
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Barcelona, Espanha
Para obter informações mais detalhadas, é necessário contatar o representante local do responsável:
Grifols Polska Sp. z o. o.
Ul. Grzybowska 87, 00-844 Varsóvia
Tel: +48 22 378 85 61
Data da última atualização do folheto:
…………………………………………………………………………………………………
Informações destinadas exclusivamente a profissionais de saúde:
Posologia
Deficiência de fator VIII de coagulação
A posologia e a duração do tratamento de substituição dependem do grau de deficiência de fator VIII, da localização e extensão da hemorragia e do estado clínico do paciente.
A dose de fator VIII de coagulação administrada é expressa em unidades internacionais (UI) de acordo com as normas atuais da OMS para produtos medicinais que contenham fator VIII de coagulação humano. A atividade de fator VIII de coagulação no sangue pode ser expressa em porcentagem (em relação à atividade em sangue normal) ou em unidades internacionais (de acordo com o padrão internacional para fator VIII de coagulação no sangue).
Uma unidade internacional (UI) de atividade de fator VIII de coagulação corresponde à quantidade de fator VIII de coagulação presente em 1 ml de sangue humano normal.
Tratamento de hemorragias
O cálculo da dose necessária de fator VIII de coagulação baseia-se na observação empírica de que a administração de 1 UI/kg de peso corporal aumenta a atividade de fator VIII de coagulação no sangue em 1,7% a 2,5% da atividade normal. A dose é calculada com base na seguinte fórmula:
Dose necessária = peso corporal (kg) x aumento desejado da atividade de fator VIII de coagulação (%) (UI/dl) x 0,5
A dose e a frequência de administração devem ser sempre adaptadas individualmente para cada caso, dependendo da resposta do paciente ao tratamento.
- 1.3.1. SPC, rotulagem e folheto da embalagem
No tratamento de hemorragias, dependendo da causa e localização, é necessário manter durante o período de tratamento recomendado um nível adequado de atividade de fator VIII de coagulação (em % da norma ou UI/dl).
Para determinar a dose com base no tipo de hemorragia e procedimento cirúrgico, pode-se usar a seguinte tabela:
| Gravidade da hemorragia/tipo de procedimento cirúrgico | Nível necessário de fator VIII (%) (UI/dl) | Frequência de administração (horas)/período de tratamento (dias) |
| Hemorragia Hemorragia recente nas articulações, músculos ou hemorragia na boca. Hemorragia mais grave nas articulações, músculos ou hemorragia com hematoma. Hemorragias que ameaçam a vida. |
| Repetir a cada 12-24 horas por pelo menos 1 dia, até que a dor causada pela hemorragia desapareça ou a lesão seja curada. Repetir as infusões a cada 12-24 horas por 3-4 dias ou mais, até que a dor desapareça ou a lesão seja curada. Repetir as infusões a cada 8-24 horas até que o perigo tenha passado |
| Procedimentos cirúrgicos Menores Incluindo extração de dentes Maiores |
| A cada 24 horas, por pelo menos 1 dia, até que a lesão seja curada. Repetir as infusões a cada 8-24 horas até que se obtenha uma cicatrização adequada da lesão, e então continuar o tratamento por mais 7 dias, mantendo a atividade de fator VIII em níveis de 30% a 60% (UI/dl) |
Tratamento profilático
Na profilaxia de longo prazo de hemorragias em pacientes com hemofilia A grave, geralmente se usa uma dose de 20 a 40 UI/kg de peso corporal a cada 2 a 3 dias. Em alguns casos, especialmente em pacientes jovens, pode ser necessário reduzir os intervalos de tempo entre as injeções ou aumentar a dose.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Durante o tratamento, para determinar a dose e a frequência de administração das infusões, é recomendável realizar exames para detectar os níveis de fator VIII no sangue. Especialmente em casos de procedimentos cirúrgicos complexos, é necessário um monitoramento rigoroso do tratamento de substituição por meio de exames do sistema de coagulação (atividade de fator VIII no sangue).
Os pacientes podem reagir individualmente ao tratamento com fator VIII, o que se reflete em níveis diferentes de recuperação in vivo e em períodos de meia-vida em pacientes individuais.
Doença de von Willebrand
Geralmente, se aceita que a administração de 1 UI de VWF:RCo/kg de peso corporal aumenta o nível de VWF:RCo em circulação em 2%. O objetivo do tratamento é alcançar um nível de VWF:RCo > 0,6 UI/ml (60%) e FVIII:C > 0,4 UI/ml (40%) no sangue.
Na maioria dos casos, para alcançar a hemostase, se recomenda uma dose de 40 a 80 UI/kg de peso corporal de fator de von Willebrand e 20 a 40 UI/kg de peso corporal de fator FVIII:C.
Pacientes com doença de von Willebrand do tipo 3, que podem necessitar de doses mais altas para manter os níveis adequados de fator, podem requerer uma dose inicial de fator de von Willebrand de 80 UI/kg de peso corporal.
A dose adequada deve ser administrada a cada 12 a 24 horas. A posologia e a duração do tratamento dependem do estado clínico do paciente, da localização e extensão da hemorragia e dos níveis de VWF:RCo e FVIII:C.
Durante o uso de produtos medicinais que contenham fator VIII com fator de von Willebrand, o médico que trata o paciente deve considerar a possibilidade de um aumento excessivo do nível de FVIII:C. Para evitar o aumento excessivo do nível de FVIII:C, após 24 a 48 horas de tratamento, é necessário considerar a redução da dose ou o prolongamento do intervalo entre as doses ou o uso de produtos medicinais que contenham VWF e uma quantidade menor de fator VIII.
- 24 a 48 horas após o início do tratamento, é necessário considerar a redução da dose ou o prolongamento do intervalo entre as doses ou o uso de produtos medicinais que contenham VWF e uma quantidade menor de fator VIII.
Crianças e adolescentes
No referido indicativo, estão disponíveis apenas dados limitados de estudos clínicos em crianças abaixo de 6 anos de idade e, portanto, não há recomendações para o uso do produto medicinal nesta faixa etária.
Em crianças, na referida indicação, a adaptação da dose para a eficácia clínica também é baseada no cálculo da dose com base no peso corporal.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorInstituto Grifols, S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FanhdiForma farmacêutica: Pó, 25 UI/ml; 250 UI + 30 UI/ml; 300 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 100 UI/ml; 1000 UI + 120 UI/ml; 1200 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 1000 UI + 2400 UI/15 mlSubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Fanhdi noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Fanhdi em Ukraine
Alternativa a Fanhdi em Spain
Médicos online para Fanhdi
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Fanhdi – sujeita a avaliação médica e regras locais.














