
Fanhdi

Pergunte a um médico sobre a prescrição de Fanhdi

Como usar Fanhdi
FOLHETO DA EMBALAGEM: INFORMAÇÃO PARA
USUÁRIOS
FANHDI
250 UI de FVIII + 300 UI de VWF
Pó e pós-solvente para a preparação de uma solução para injeção e infusão
Complexo do fator humano VIII de coagulação e fator humano de von Willebrand
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o paciente.
- Deve conservar este folheto, para que possa relê-lo se necessário.
- Em caso de alguma dúvida, deve consultar um médico ou farmacêutico.
- Este medicamento foi prescrito para uma pessoa específica. Não deve ser dado a outras pessoas. O medicamento pode prejudicar outra pessoa, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o paciente apresentar algum sintoma indesejado, incluindo qualquer sintoma indesejado não mencionado neste folheto, deve informar o médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é o medicamento FANHDI e para que é utilizado
- 2. Informações importantes antes de tomar o medicamento FANHDI
- 3. Como tomar o medicamento FANHDI
- 4. Efeitos indesejados
- 5. Como conservar o medicamento FANHDI
- 6. Conteúdo da embalagem e outras informações
1. O QUE É O MEDICAMENTO FANHDI E PARA QUE É UTILIZADO
FANHDI, apresenta-se sob a forma de pó e solvente para a preparação de uma solução para injeção e infusão em frascos contendo nominalmente 250 UI do fator humano VIII de coagulação (FVIII) e 300 UI do fator humano de von Willebrand (VWF).
Após a reconstituição com a quantidade adequada de solvente (água para injeção), o produto contém 25 UI/ml de FVIII e 30 UI/ml de VWF.
Grupo farmacoterapêutico: medicamentos antihemorrágicos, combinação do fator VIII de coagulação e fator de von Willebrand.
FANHDI é utilizado na prevenção e tratamento de hemorragias em pacientes com hemofilia A (deficiência congênita do fator VIII de coagulação).
A utilização de FANHDI também é indicada na prevenção e tratamento de hemorragias (incluindo hemorragias durante procedimentos cirúrgicos) em pacientes com doença de von Willebrand (VWD), quando o tratamento com desmopressina (DDAVP) é ineficaz ou contraindicado.
- 1.3.1. SPC, rotulagem e folheto da embalagem
O produto pode ser utilizado no tratamento da deficiência adquirida do fator humano VIII de coagulação.
2. INFORMAÇÕES IMPORTANTES ANTES DE TOMAR O MEDICAMENTO FANHDI
Quando não tomar o medicamento FANHDI
- Quando o paciente apresenta hipersensibilidade (alergia) ao complexo do fator VIII de coagulação e fator de von Willebrand ou a qualquer um dos outros componentes do medicamento (listados no ponto 6).
Deve consultar um médico se precisar de aconselhamento ou informação adicional.
Advertências e precauções
- Em casos raros, podem ocorrer reações anafiláticas (reações alérgicas graves e súbitas). A hipersensibilidade ao FANHDI pode manifestar-se como erupção cutânea, urticária generalizada, sensação de pressão no peito, tontura, mesmo quando em pé. Se ocorrerem estes sintomas, deve interromper a administração do medicamento e informar o médico.
- Para determinar a dose de FANHDI que garanta a obtenção e manutenção de um nível adequado de fator VIII, o médico pode solicitar a realização de uma série de exames.
- Se a hemorragia não parar, apesar da administração de FANHDI, deve informar o médico. Pode ser devido à formação de um inibidor do fator VIII, o que requer confirmação por exames. Os inibidores do fator VIII são anticorpos que bloqueiam a ação do fator VIII administrado. Como resultado, ocorre uma redução da eficácia do fator VIII na prevenção de hemorragias.
- Se anteriormente já ocorreu a formação de um inibidor do fator VIII e, posteriormente, o tratamento foi alterado para outro produto que contenha fator VIII, existe um risco maior de recorrência desta complicação.
- Durante o tratamento da doença de von Willebrand com fatores de risco clínicos ou laboratoriais conhecidos, existe o risco de ocorrência de complicações trombóticas. Por este motivo, é necessário realizar exames adequados para a detecção precoce de sintomas causados por estas complicações e aplicar o tratamento recomendado para as complicações tromboembólicas.
- Na doença de von Willebrand, especialmente do tipo 3, podem ocorrer a formação de anticorpos neutralizantes (inibidores) do fator de von Willebrand. Os inibidores do fator de von Willebrand são anticorpos presentes no sangue que podem bloquear a ação do fator administrado. Nesses casos, em que o tratamento não alcança os níveis esperados de atividade do fator de von Willebrand no soro ou não consegue controlar a hemorragia, apesar da administração de doses adequadas, deve ser realizado um exame para detectar a presença de um inibidor do fator de von Willebrand. Em pacientes com níveis altos de inibidor, o tratamento com fator de von Willebrand pode ser ineficaz.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Se for necessário administrar FANHDI por acesso venoso central, o médico deve estar ciente da possibilidade de ocorrência de infecção local, bacteriemia (infecção do sangue por bactérias) e formação de um coágulo na veia no local da inserção do cateter.
- Se a hemorragia não parar, apesar da administração de FANHDI, deve informar o médico. Pode ser devido à formação de um inibidor do fator VIII, o que requer confirmação por exames.
No processo de fabricação de produtos derivados do sangue ou plasma humano, são aplicadas as seguintes medidas para garantir a segurança contra a transmissão de agentes infecciosos:
- seleção rigorosa dos doadores para excluir portadores de agentes infecciosos,
- exame de cada doação e pool de plasma para detectar a presença de vírus,
- aplicação de procedimentos de inativação/remoção de vírus do sangue e plasma durante o processo de fabricação.
Apesar disso, não é possível excluir completamente a transmissão de agentes infecciosos durante a administração de produtos medicinais derivados do sangue ou plasma humano. Isso se aplica também a vírus desconhecidos ou emergentes e outros patógenos.
Os métodos utilizados são considerados eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV), hepatite B (HBV), hepatite C (HCV) e vírus da hepatite A não envelopado. A eficácia desses métodos contra vírus não envelopados, como o parvovirus B19, pode ser limitada.
A infecção por parvovirus B19 pode ser particularmente grave em mulheres grávidas (infecção do feto) e em pessoas com imunidade reduzida ou certos tipos de anemia (por exemplo, anemia falciforme ou anemia hemolítica).
Em pacientes que recebem regularmente doses repetidas de produtos derivados do plasma que contenham fator VIII, o médico responsável pode recomendar a administração de vacinas contra a hepatite A e B.
É recomendado que, a cada administração do medicamento FANHDI ao paciente, seja registrada a identidade do paciente e o número de lote do produto, para que possa ser estabelecida uma ligação entre o paciente e o lote do medicamento.
Ver também o ponto 4.
Crianças e adolescentes
As advertências e precauções mencionadas se aplicam tanto a adultos quanto a crianças.
FANHDI e outros medicamentos
- 1.3.1. SPC, rotulagem e folheto da embalagem
Deve informar o médico sobre todos os medicamentos que está tomando atualmente ou recentemente, bem como sobre os medicamentos que planeja tomar.
As interações entre o complexo do fator humano VIII de coagulação e fator de von Willebrand e outros medicamentos não são conhecidas.
Gravidez e amamentação
Devido ao fato de a hemofilia A ser rara em mulheres, não há evidências sobre a utilização do complexo do fator FVIII/VWF durante a gravidez e amamentação.
Deve consultar um médico ou farmacêutico antes de iniciar a utilização de qualquer medicamento.
Condução de veículos e operação de máquinas
FANHDI não afeta a capacidade de conduzir veículos ou operar máquinas.
3. COMO TOMAR O MEDICAMENTO FANHDI
O medicamento deve ser administrado por via intravenosa. A velocidade de administração não deve exceder 10 ml/min.
Deve seguir as instruções do médico ou do profissional de saúde do centro de tratamento da hemofilia. Em caso de dúvida, deve consultar um médico ou farmacêutico.
A dose de FANHDI a ser utilizada depende de vários fatores, como peso corporal, condição clínica e tipo e gravidade da hemorragia. Para alcançar o nível adequado de fator VIII e fator de von Willebrand no sangue, o médico determinará a dose de FANHDI e a frequência de administração.
O médico determinará a duração do tratamento com FANHDI.
Não deve conservar o medicamento para uso posterior, mesmo se for armazenado na geladeira.
Preparação da solução:
Deve garantir que as ações sejam realizadas em condições que evitem a contaminação.
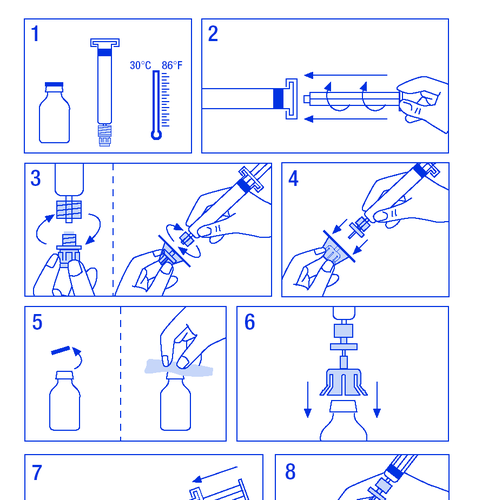
- 1. Aquecer os frascos a uma temperatura não superior a 30 ºC (figura nº 1).
- 2. Fixar o êmbolo na seringa com solvente (figura nº 2).
- 3. Retirar o filtro da embalagem. Retirar a tampa plástica da extremidade da seringa e fixar o filtro (figura nº 3).
- 4. Retirar o conector que fixa a seringa ao frasco e conectar a seringa com filtro (figura nº 4).
- 1.3.1. SPC, rotulagem e folheto da embalagem
- 5. Retirar a tampa plástica do frasco e expor o batoque de borracha, desinfetando-o com um agente desinfetante (figura nº 5).
- 6. Perfurar o batoque do frasco com a agulha do conector (figura nº 6).
- 7. Injetar todo o solvente no frasco (figura nº 7).
- 8. Agitar suavemente o frasco até a dissolução completa do pó (figura nº 8). Como no caso de outros produtos para administração intravenosa, não deve ser administrado se o produto não estiver dissolvido ou se houver partículas visíveis.
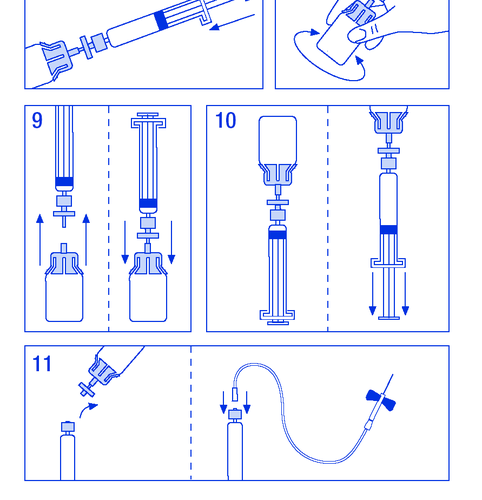
- 9. Desconectar a seringa com filtro do frasco por um momento para permitir a entrada de ar (figura nº 9).
- 10. Inverter o frasco e aspirar a solução para a seringa (figura nº 10).
- 11. Preparar o local da injeção, desconectar a seringa e injetar o produto por meio de uma agulha de borboleta ou outra agulha estéril. Administrar lentamente por via intravenosa a uma velocidade de 3 ml/min e nunca exceder 10 ml/min para evitar reações vasculares (figura nº 11).
- 1.3.1. SPC, rotulagem e folheto da embalagem
- 1.3.1. SPC, rotulagem e folheto da embalagem
Não deve reutilizar o conjunto para administração.
Todas as sobras do medicamento não utilizado e outros resíduos devem ser eliminados de acordo com as regulamentações locais.
Uso de uma dose maior do que a recomendada de FANHDI
Não foram relatados sintomas de qualquer caso de superdose do complexo do fator humano VIII de coagulação e fator de von Willebrand. Após uma superdose significativa, podem ocorrer complicações tromboembólicas. Independentemente disso, qualquer caso de superdose de FANHDI deve ser discutido imediatamente com um farmacêutico ou médico.
Omissão da administração de FANHDI
- Se uma dose for omitida, deve ser administrada a próxima dose imediatamente e continuar o tratamento regularmente, de acordo com as recomendações do médico.
- Não deve ser administrada uma dose dupla para compensar a dose omitida.
4. EFEITOS INDESEJADOS
Como qualquer medicamento, este medicamento pode causar efeitos indesejados, embora não ocorram em todos.
Hipersensibilidade ou reações alérgicas (erupção cutânea, urticária, sensação de queimadura ou picada no local da injeção, calafrios, rubor facial, urticária generalizada, cefaleia, erupção cutânea, hipotensão, letargia, náuseas, ansiedade, taquicardia, sensação de pressão no peito, suor, vômitos) foram observadas raramente e, em alguns casos, levaram ao desenvolvimento de uma reação anafilática grave (incluindo choque).
Em casos raros, foi observado um aumento da temperatura corporal.
Em caso de reação anafilática ou alérgica, deve interromper a administração do medicamento e informar o médico imediatamente.
Não é possível excluir completamente a possibilidade de ocorrência de reações alérgicas após a administração deste medicamento.
Pacientes com hemofilia A podem desenvolver anticorpos neutralizantes (inibidores) contra o fator VIII.
Na ocorrência de tais inibidores, observa-se uma resposta clínica inadequada ao tratamento.
Em casos muito raros, em pacientes com doença de von Willebrand, especialmente do tipo 3, podem ocorrer a formação de anticorpos neutralizantes (inibidores) do fator de von Willebrand. Se ocorrerem tais inibidores, observa-se uma resposta clínica inadequada ao tratamento.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Os inibidores podem aumentar o risco de ocorrência de reações alérgicas (choque anafilático). Em caso de ocorrência de reações alérgicas, deve ser realizado um exame para detectar a presença de inibidores.
Em tais casos, é recomendado entrar em contato com um centro especializado no tratamento de distúrbios hemostáticos.
Durante a administração do medicamento em pacientes com doença de von Willebrand com fatores de risco clínicos ou laboratoriais conhecidos, existe o risco de ocorrência de complicações trombóticas.
A manutenção de níveis excessivamente altos de FVIII durante o tratamento com fator VIII que contém fator de von Willebrand aumenta o risco de ocorrência de complicações trombóticas.
Em vários estudos clínicos realizados com 164 pacientes, foram administradas um total de 7000 infusões de FANHDI. Os resultados obtidos nos estudos indicam uma boa tolerabilidade do medicamento e uma baixa frequência de efeitos indesejados. Foram observados apenas 2 casos de efeitos indesejados relacionados ao medicamento administrado. Nesses casos, foi relatada a ocorrência de febre.
| Classificação de sistemas e órgãos | Efeitos indesejados | Frequência de ocorrência |
| Distúrbios gerais e condições no local da administração | Febre. | Raro |
- 1.3.1. SPC, rotulagem e folheto da embalagem
Crianças e adolescentes
A frequência de ocorrência, tipo e gravidade dos efeitos indesejados esperados em crianças não diferem dos observados em adultos.
Notificação de suspeitas de efeitos indesejados
Após a autorização do medicamento, é importante notificar suspeitas de efeitos indesejados. Isso permite o monitoramento contínuo da relação benefício-risco do medicamento. Profissionais de saúde devem notificar qualquer suspeita de efeito indesejado por meio de:
Departamento de Monitoramento de Efeitos Indesejados de Medicamentos da Agência Nacional de Vigilância Sanitária
Rua Alexandre Herculano, 111 - 5º andar
40010-020 Salvador - Bahia
Telefone: +55 71 3255 1200
Fax: +55 71 3255 1201
e-mail: [[email protected]](mailto:[email protected])
A notificação de efeitos indesejados permite a coleta de mais informações sobre a segurança do medicamento.
Informações sobre as medidas de segurança contra a transmissão de agentes infecciosos, ver ponto 2.
- 5.COMO CONSERVAR O MEDICAMENTO FANHDI
O medicamento deve ser conservado em um local não visível e inacessível a crianças.
Não deve ser conservado a uma temperatura superior a 30°C. Não deve ser congelado.
Não deve ser utilizado após o vencimento do prazo de validade.
A solução deve ser transparente e ligeiramente opalescente.
Não deve ser utilizado se a solução contiver partículas ou sedimentos.
Não deve ser utilizado se, após a reconstituição, o medicamento contiver partículas ou a solução tiver mudado de cor.
Após a reconstituição, a estabilidade química e física do produto é mantida por 12 horas a 25 ºC. Do ponto de vista microbiológico, o produto deve ser utilizado imediatamente. Se, após a reconstituição, o produto não for utilizado, pode ser conservado por no máximo 24 horas a 2 ºC – 8 ºC, mas apenas se a responsabilidade pela preparação da solução for do usuário e se seguir as normas de assepsia.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Os medicamentos não devem ser jogados na rede de esgotos. Deve perguntar ao farmacêutico como eliminar os medicamentos que não são mais utilizados. Este procedimento ajudará a proteger o meio ambiente.
Prazo de validade
3 anos,
Não deve ser utilizado após o vencimento do prazo de validade impresso na embalagem.
- 1.3.1. SPC, rotulagem e folheto da embalagem
- 6.CONTEÚDO DA EMBALAGEM E OUTRAS INFORMAÇÕES
O que contém o medicamento FANHDI
A substância ativa é o complexo do fator humano VIII de coagulação e fator de von Willebrand.
Cada frasco de pó contém 250 UI do fator humano VIII de coagulação e 300 UI do fator de von Willebrand.
Após a reconstituição em 10 ml de água para injeção, o produto contém 25 UI/ml de FVIII e 30 UI/ml de VWF.
Os outros componentes são: albumina humana, histidina e arginina.
Cada seringa contém 10 ml de água para injeção.
Como é o medicamento FANHDI e o que contém a embalagem
Frascos com pó branco ou amarelado claro e seringas com água para injeção.
Cada embalagem de FANHDI contém um frasco com 250 UI do fator humano VIII de coagulação e 300 UI do fator de von Willebrand (pó para injeção e infusão) e 1 seringa com 10 ml de água para injeção (solvente).
Conjunto para a preparação da solução e administração incluído na embalagem de FANHDI: conector que fixa a seringa ao frasco, filtro e conjunto para infusão.
Embalagens disponíveis:
FANHDI 500 UI de FVIII + 600 UI de VWF
FANHDI 1000 UI de FVIII + 1200 UI de VWF
Nem todas as embalagens podem estar disponíveis.
Responsável e fabricante
Instituto Grifols, S.A.
Can Guasc, 2 - Parets del Vallès
08150 Barcelona, Espanha
Para obter informações mais detalhadas, deve consultar o representante local do responsável:
Grifols Portugal, Lda.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Avenida da República, 45 - 4º andar
1050-188 Lisboa
Telefone: +351 213 122 400
Data da última atualização do folheto:
…………………………………………………………………………………………………
Informações destinadas exclusivamente a profissionais de saúde:
Posologia
Deficiência do fator VIII de coagulação
A posologia e a duração do tratamento de substituição dependem do grau de deficiência do fator VIII, da localização e extensão da hemorragia e do estado clínico do paciente.
A dose de fator VIII de coagulação administrada é expressa em unidades internacionais (UI) de acordo com as normas atuais da OMS para produtos medicinais que contenham fator humano VIII de coagulação. A atividade do fator VIII de coagulação no soro pode ser expressa em porcentagem (em relação à atividade no soro normal) ou em unidades internacionais (de acordo com o padrão internacional para o fator VIII de coagulação no soro).
Uma unidade internacional (UI) de atividade do fator VIII de coagulação corresponde à quantidade de fator VIII de coagulação presente em 1 ml de soro humano normal.
Tratamento de hemorragias
O cálculo da dose necessária de fator VIII de coagulação baseia-se na observação empírica de que a administração de 1 UI/kg de peso corporal aumenta a atividade do fator VIII de coagulação no soro em 1,7% a 2,5% da atividade normal. A dose é calculada com base na seguinte fórmula:
Dose necessária (UI) = peso corporal (kg) x aumento desejado da atividade do fator VIII de coagulação (%) x 0,5
A dose e a frequência de administração devem ser sempre adaptadas individualmente para cada caso, dependendo da resposta do paciente ao tratamento.
No tratamento de hemorragias, dependendo da causa e localização, deve-se manter durante o período de tratamento recomendado um nível adequado de atividade do fator VIII de coagulação (em % da norma ou UI/dl).
Para determinar a dose com base no tipo de hemorragia e procedimento cirúrgico, pode-se utilizar a seguinte tabela:
| Gravidade da hemorragia/tipo de procedimento cirúrgico | Nível necessário de fator VIII (%)(UI/dl) | Frequência de administração (horas)/período de tratamento (dias) |
- 1.3.1. SPC, rotulagem e folheto da embalagem
| Hemorragia Hemorragia recente nas articulações, músculos ou hemorragia na boca. Hemorragia mais grave nas articulações, músculos ou hemorragia com formação de hematoma. Hemorragias que colocam a vida em risco. |
| Repetir a cada 12-24 horas por pelo menos 1 dia, até que a dor causada pela hemorragia desapareça ou a lesão seja curada. Repetir as infusões a cada 12-24 horas por 3-4 dias ou mais, até que a dor ou a disfunção desapareçam. Repetir as infusões a cada 8-24 horas até que o risco tenha passado |
| Procedimentos cirúrgicos Menores Incluindo extração de dentes Maior |
| A cada 24 horas, por pelo menos 1 dia, até a cicatrização da ferida. Repetir as infusões a cada 8-24 horas até que a cicatrização da ferida seja adequada, e então continuar o tratamento por mais 7 dias, mantendo a atividade do fator VIII em níveis de 30% a 60% (UI/dl) |
Tratamento profilático
No tratamento profilático de longo prazo de hemorragias em pacientes com hemofilia A grave, geralmente são administradas doses de 20 a 40 UI/kg de peso corporal a cada 2 a 3 dias. Em alguns casos, especialmente em pacientes jovens, pode ser necessário reduzir os intervalos de tempo entre as injeções ou aumentar a dose.
Durante o tratamento, para determinar a dose e a frequência de administração das infusões, é recomendado realizar exames para detectar os níveis de fator VIII no soro. Especialmente em casos de procedimentos cirúrgicos importantes, é necessário um monitoramento rigoroso do tratamento de substituição por meio de exames do sistema de coagulação (atividade do fator VIII no soro).
Pacientes podem reagir individualmente ao tratamento com fator VIII, o que se reflete em níveis diferentes de recuperação in vivo e períodos de meia-vida em pacientes individuais.
- 1.3.1. SPC, rotulagem e folheto da embalagem
Doença de von Willebrand
Geralmente, aceita-se que a administração de 1 UI de VWF:RCo/kg de peso corporal aumenta o nível de VWF:RCo em 2% na circulação. O objetivo do tratamento é alcançar um nível de VWF:RCo > 0,6 UI/ml (60%) e FVIII:C > 0,4 UI/ml (40%) no soro.
Na maioria dos casos, para alcançar a hemostase, são recomendadas doses de 40 a 80 UI/kg de peso corporal de fator de von Willebrand e 20 a 40 UI/kg de peso corporal de fator FVIII:C.
Pacientes com doença de von Willebrand do tipo 3, que podem necessitar de doses mais altas para manter os níveis adequados do fator, podem requerer uma dose inicial de 80 UI/kg de peso corporal de fator de von Willebrand.
A dose adequada deve ser administrada a cada 12 a 24 horas. A posologia e a duração do tratamento dependem do estado clínico do paciente, localização e extensão da hemorragia e dos níveis de VWF:RCo e FVIII:C.
Durante a administração de produtos medicinais que contenham fator VIII com fator de von Willebrand, o médico que trata o paciente deve considerar a possibilidade de um aumento excessivo do nível de FVIII:C. Para evitar um aumento excessivo do nível de FVIII:C, após 24 a 48 horas de tratamento, deve-se considerar a redução da dose ou o prolongamento do intervalo entre as doses ou a utilização de produtos medicinais que contenham VWF e menos fator VIII.
- 24 a 48 horas após o início do tratamento, deve-se considerar a redução da dose ou o prolongamento do intervalo entre as doses ou a utilização de produtos medicinais que contenham VWF e menos fator VIII.
Crianças e adolescentes
Para esta indicação, apenas estão disponíveis dados limitados de estudos clínicos em crianças abaixo de 6 anos de idade e, portanto, não há recomendações para a utilização do medicamento nesta faixa etária.
Em crianças, na indicação acima mencionada, a adaptação da dose para a eficácia clínica também é baseada no cálculo da dose com base no peso corporal.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorInstituto Grifols, S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a FanhdiForma farmacêutica: Pó, 50 UI/ml; 500 UI + 60 UI/ml; 600 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 100 UI/ml; 1000 UI + 120 UI/ml; 1200 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 1000 UI + 2400 UI/15 mlSubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: CSL Behring GmbHRequer receita médica
Alternativas a Fanhdi noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Fanhdi em Ukraine
Alternativa a Fanhdi em Spain
Médicos online para Fanhdi
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Fanhdi – sujeita a avaliação médica e regras locais.














