
Haemate P 1000 i.m. Fviii/2400 i.m. Vuf

Pergunte a um médico sobre a prescrição de Haemate P 1000 i.m. Fviii/2400 i.m. Vuf

Como usar Haemate P 1000 i.m. Fviii/2400 i.m. Vuf
FOLHETO INFORMATIVO - INFORMAÇÃO PARA O UTILIZADOR
HaemateP 250 UI FVIII/600 UI VWF
HaemateP 500 UI FVIII/1200 UI VWF
HaemateP 1000 UI FVIII/2400 UI VWF
Pó e solvente para solução injetável ou infusão
Fator VIII humano e fator de von Willebrand humano
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para poder reler se necessário.
- Se tiver alguma dúvida, deve consultar o seu médico ou farmacêutico.
- Este medicamento foi prescrito apenas para si. Não o deve dar a outros. O medicamento pode ser prejudicial para outras pessoas, mesmo que os sintomas da sua doença sejam semelhantes.
- Se ocorrerem efeitos secundários, incluindo quaisquer efeitos secundários não mencionados neste folheto, deve informar o seu médico ou farmacêutico. Ver ponto 4.
Índice do folheto:
- 1. O que é o Haemate P e para que é utilizado
- 2. Informações importantes antes de tomar o Haemate P
- 3. Como tomar o Haemate P
- 4. Efeitos secundários possíveis
- 5. Como conservar o Haemate P
- 6. Conteúdo da embalagem e outras informações
1. O QUE É O HAEMATE P E PARA QUE É UTILIZADO
O que é o Haemate P
O Haemate P é fornecido sob a forma de pó e solvente. A solução reconstituída é administrada por via intravenosa, em injeção ou infusão.
O Haemate P é produzido a partir de plasma humano (a parte líquida do sangue) e contém fator de von Willebrand humano e fator VIII humano de coagulação do sangue.
Para que é utilizado o Haemate P
O Haemate P contém tanto o fator VIII humano de coagulação do sangue (FVIII )como o fator de von Willebrand
(VWF), o que é muito importante, pois o doente precisa mais de um ou de outro. Se o doente tiver hemofilia A,
o médico prescreverá o Haemate P com o número de unidades do fator VIII. Se o doente tiver doença de von
Willebrand, o médico prescreverá o Haemate P com o número de unidades do fator VWF.
Doença de von Willebrand (VWD)
O Haemate P é utilizado na prevenção e tratamento de hemorragias, incluindo hemorragias durante procedimentos cirúrgicos, causadas pela falta de fator de von Willebrand, quando a terapia com desmopressina (DDAVP) é ineficaz ou contraindicada.
Hemofilia A (deficiência congénita do fator VIII)
O Haemate P é utilizado na prevenção ou controle de hemorragias causadas pela falta de fator VIII no sangue.
Pode ser também utilizado no tratamento de deficiência adquirida do fator VIII e no tratamento de doentes com anticorpos contra o fator VIII.
2. INFORMAÇÕES IMPORTANTES ANTES DE TOMAR O HAEMATE P
As seguintes secções contêm informações que deve considerar antes de tomar o Haemate P
Quando não tomar o Haemate P:
- em caso de hipersensibilidade (alergia) ao fator de von Willebrand humano ou ao fator VIII humano de coagulação do sangue ou a qualquer um dos outros componentes deste medicamento (listados no ponto 6.).
Em caso de alergia a qualquer medicamento ou alimentos, deve informar o seu médico.
Precauções e advertências
Identificabilidade
É especialmente recomendado que, em cada administração do Haemate P ao doente, sejam registados o nome e o número de lote
para manter um registo dos lotes administrados.
Antes de iniciar o tratamento com o Haemate P, deve discutir com o seu médico ou farmacêutico:
- em caso de reações alérgicas ou anafilactoides(reação alérgica grave que causa problemas respiratórios graves ou tonturas). Como em qualquer injeção de proteína, é possível ocorrer uma reação de hipersensibilidade do tipo alérgico. O médico deve informar o doente sobre os primeiros sintomas de reação de hipersensibilidade, tais como urticária, erupção cutânea generalizada, compressão no peito, respiração sibilante, queda da pressão arterial e anafilaxia (reação alérgica grave que causa problemas respiratórios graves ou tonturas). Se ocorrerem estes sintomas, deve parar imediatamente a administração do medicamento e contactar o seu médico.
- A formação de inibidores(anticorpos) é uma complicação conhecida que pode ocorrer durante o tratamento com todos os medicamentos que contenham fator VIII. Estes inibidores, especialmente em altas concentrações, interrompem o tratamento eficaz e o doente será monitorizado atentamente para a produção destes inibidores. Se a hemorragia no doente não for controlada adequadamente com o Haemate P, deve informar imediatamente o seu médico.
- em caso de doença cardíaca pré-existente ou risco de doença cardíaca, deve informar o seu médico ou farmacêutico.
- se for necessário um dispositivo de acesso venoso central (ang. central venous access device, CVAD) para a administração do Haemate P, o médico deve considerar o risco de complicações associadas ao CVAD, incluindo infecções locais, bacteriemia e trombose no local de inserção do cateter.
Doença de von Willebrand
- Em caso de risco conhecido de trombose (histórico de trombose, incluindo trombose pulmonar), especialmente em doentes com fatores de risco clínicos ou morfológicos (por exemplo, períodos pós-operatórios sem profilaxia antitrombótica, imobilização prolongada, obesidade, sobredosagem, cancro). Neste caso, o doente deve ser monitorizado para detectar sinais precoces de trombose. Deve ser implementada uma profilaxia antitrombótica, de acordo com as diretrizes atuais.
O médico avaliará cuidadosamente os benefícios do tratamento com Haemate P em relação ao risco de complicações.
Segurança do uso em relação à possibilidade de transmissão de vírus
Em caso de medicamentos preparados a partir de sangue ou plasma humano, são tomadas medidas de precaução
para evitar a infecção dos doentes. Incluem:
- seleção rigorosa dos doadores de sangue e plasma, para garantir que os doadores com risco de transmissão de infecção sejam excluídos.
- teste de cada doação e pool de plasma para detectar a presença de vírus/infecção, e
- inclusão no processo de tratamento do sangue ou plasma de procedimentos que possam inativar ou remover vírus.
Apesar da sua implementação, a administração de medicamentos preparados a partir de sangue ou plasma humano não pode
excluir completamente a possibilidade de transmissão de infecção. Isso inclui vírus desconhecidos ou recentemente descobertos e outros tipos de infecção.
Os procedimentos implementados são considerados eficazes contra vírus envelopados, tais como o vírus da imunodeficiência humana (HIV, vírus que causa a AIDS), vírus da hepatite B e vírus da hepatite C (inflamação do fígado) e contra o vírus da hepatite A (inflamação do fígado) não envelopado.
Contra os vírus não envelopados, como o parvovirus B19, os procedimentos implementados podem ter eficácia limitada.
Infecções por parvovirus B19 podem ser graves:
- para mulheres grávidas (infecção do feto) e
- para pessoas com sistema imunológico debilitado ou com produção aumentada de glóbulos vermelhos devido a certos tipos de anemia (por exemplo, anemia falciforme ou hemolítica).
Em caso de administração regular/repetida de produtos produzidos a partir de plasma humano que contenham fator de von Willebrand e fator VIII de coagulação, o médico pode recomendar considerar a vacinação contra a hepatite A e B.
Haemate P e outros medicamentos
Deve informar o seu médico ou farmacêutico sobre todos os medicamentos que está a tomar atualmente ou
recentemente, bem como sobre os medicamentos que planeia tomar, incluindo medicamentos disponíveis sem receita médica
- O Haemate P não deve ser misturado com outros medicamentos, solventes ou diluentes.
Gravidez, amamentação e fertilidade
- Se estiver grávida ou a amamentar, suspeita que possa estar grávida ou planeia ter um filho, deve consultar o seu médico ou farmacêutico antes de tomar este medicamento.
- Como a hemofilia A é rara em mulheres, não há dados disponíveis sobre o uso do fator VIII durante a gravidez e amamentação.
- No caso da doença de von Willebrand, as mulheres estão mais expostas do que os homens devido ao risco adicional de hemorragias associadas à menstruação, gravidez, parto, nascimento e complicações ginecológicas. Com base na experiência obtida a partir de estudos pós-comercialização, na prevenção e tratamento de hemorragias agudas, é recomendada a substituição do fator de von Willebrand (VWF). Estudos clínicos sobre a terapia de substituição do VWF em mulheres grávidas e lactantes não estão disponíveis.
- Durante a gravidez e amamentação, o Haemate P deve ser administrado apenas se houver indicações médicas para isso.
Condução de veículos e utilização de máquinas
Não há relatos de que o Haemate P afete a capacidade de conduzir veículos ou operar máquinas.
Haemate P contém sódio
Haemate 250 UI FVIII/600 UI VWF contém menos de 1 mmol de sódio (23 mg) por frasco, pelo que pode ser considerado essencialmente "livre de sódio".
Haemate 500 UI FVIII/1200 UI VWF contém 26 mg de sódio (componente principal do sal de cozinha) por frasco, o que corresponde a 1,3% da dose diária máxima recomendada de sódio para um adulto.
Haemate 1000 UI FVIII / 2400 UI VWF contém 52,5 mg de sódio (componente principal do sal de cozinha) por frasco, o que corresponde a 2,6% da dose diária máxima recomendada de sódio para um adulto.
3. COMO TOMAR O HAEMATE P
O tratamento deve ser iniciado e conduzido sob a supervisão de um médico com experiência no tratamento desta doença.
Dosagem
A quantidade necessária de fator de von Willebrand e fator VIII, bem como a duração do tratamento, dependem de vários
fatores, tais como peso corporal, gravidade da doença, localização e intensidade da hemorragia ou necessidade de prevenção de hemorragia durante procedimentos cirúrgicos ou exames (ver secção "Informações destinadas apenas ao pessoal médico").
Se o Haemate P for prescrito para uso em casa, o doente será instruído pelo médico sobre como administrar a injeção e a dosagem.
Deve seguir as instruções fornecidas pelo seu médico ou enfermeira do centro de tratamento de hemofilia.
Uso de dose maior do que a recomendada de Haemate P
Sintomas de superdose de VWF ou FVIII não são conhecidos. No entanto, o risco de trombose (trombose) não pode ser excluído em caso de administração de doses excepcionalmente altas, especialmente com produtos VWF com alto teor de FVIII.
Reconstituição e administração Informações gerais
- O pó deve ser misturado (reconstituído) com o solvente (parte líquida) e retirado do frasco em condições assépticas.
- A solução deve ser transparente ou ligeiramente opalescente. Após a filtragem/retirada (ver abaixo), o produto reconstituído deve ser verificado visualmente para detectar partículas e descoloração. Mesmo que as instruções para o procedimento de reconstituição sejam seguidas rigorosamente, a presença de alguns grumos ou partículas não é rara. O filtro fornecido com o dispositivo Mix2Vial remove essas partículas completamente. A filtragem não afeta os cálculos de dosagem.
- Não use soluções que sejam visivelmente turvas ou contenham grumos ou partículas após a filtragem.
- Qualquer resíduo de produto não utilizado após a administração ou resíduos deve ser eliminado de acordo com as regulamentações nacionais e as recomendações do médico.
Reconstituição
Não abrindo nenhum dos frascos, aqueça o pó e o solvente do Haemate P à temperatura ambiente,
deixando os frascos nessa temperatura por cerca de uma hora ou segurando-os por alguns minutos na mão. NÃO
exponha os frascos a uma fonte direta de calor. Não aqueça os frascos acima da temperatura corporal (37°C).
Remova cuidadosamente as tampas protetoras dos frascos do solvente e do Haemate P. Limpe as tampas de borracha expostas dos dois frascos com um cotonete embebido em álcool e deixe-as secar. O solvente pode ser então transferido para o frasco do pó usando o conjunto fornecido (Mix2Vial). Siga as instruções abaixo.
1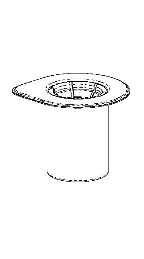 |
|
2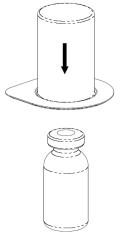 |
|
3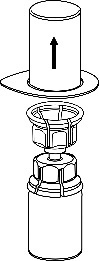 |
|
4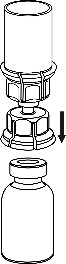 |
|
5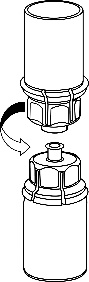 |
|
6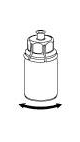 |
|
7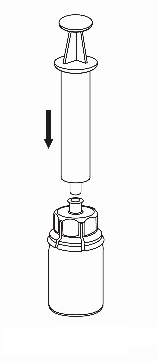 |
|
Retirada e administração
8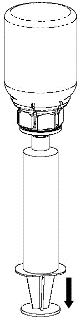 |
|
9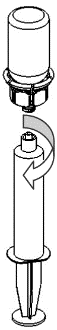 |
|
Modo de administração
Para a injeção do Haemate P, é recomendada a utilização de seringas de plástico descartáveis, pois as soluções deste tipo tendem a aderir à superfície de todas as seringas de vidro.
A solução deve ser administrada lentamente por via intravenosa, a uma taxa não superior a 4 ml por minuto. Deve-se ter cuidado para que o sangue não entre na seringa cheia de produto. Após a retirada do produto para a seringa, deve-se usá-lo imediatamente.
Se for necessário administrar uma quantidade maior de fator, isso também pode ser feito por infusão. Para isso, o produto reconstituído deve ser transferido para um sistema de infusão aprovado. A infusão deve ser realizada de acordo com as recomendações do médico. Deve-se estar atento ao aparecimento de qualquer reação imediata. Em caso de qualquer reação que possa estar relacionada à administração do Haemate P, a injeção/infusão deve ser interrompida (ver também a secção 2).
Em caso de dúvidas adicionais sobre a administração deste medicamento, deve consultar o seu médico ou farmacêutico.
4. EFEITOS SECUNDÁRIOS POSSÍVEIS
Como qualquer medicamento, o Haemate P pode causar efeitos secundários, embora não todos os doentes os experimentem.
As seguintes reações adversas ocorreram muito raramente (em menos de 1 em 10.000 doentes):
- Reação alérgica aguda (como angioedema, sensação de queimadura e picada no local da infusão, arrepios, rubor facial, urticária generalizada, dor de cabeça, reação alérgica cutânea (urticária), queda da pressão arterial, letargia, náuseas, ansiedade, taquicardia, compressão no peito, formigamento, vômitos, respiração sibilante), que ocorreu muito raramente e em alguns casos pode levar a anafilaxia aguda (reação alérgica grave que causa problemas respiratórios graves ou tonturas).
- Aumento da temperatura corporal (febre).
Doença de von Willebrand
- Muito raramente, existe o risco de ocorrência de sintomas trombóticos/tromboembólicos, incluindo tromboses pulmonares (risco de formação e deslocamento de trombos para o sistema vascular (veias/arterias) com potencial impacto nos órgãos),
- Em doentes que recebem produtos VWF que mantêm níveis elevados de FVIII:C no sangue, podem aumentar o risco de formação de trombos (ver também o ponto 2)
- Em doentes com doença de von Willebrand, podem ocorrer muito raramente inibidores (anticorpos neutralizantes) contra o VWF. Se esses inibidores ocorrerem, resultarão em uma resposta clínica inadequada, levando a hemorragias prolongadas. Isso ocorre especialmente em doentes com um tipo específico de doença de von Willebrand, conhecido como tipo 3 da doença. Esses anticorpos podem ser formados e aparecer em reações anafiláticas. Nesse caso, os doentes que apresentaram reação anafilática devem ser submetidos a um exame para detectar a presença de inibidor. Nesses casos, é recomendada a consulta a um centro especializado no tratamento de hemofilia.
Hemofilia A
- Em crianças não tratadas anteriormente com medicamentos que contenham fator VIII, podem ocorrer anticorpos bloqueadores (ver ponto 2) muito frequentemente (em mais de 1 em 10 doentes). No entanto, em doentes que foram tratados anteriormente com fator VIII (mais de 150 dias de tratamento), o risco é incomum (menos de 1 em 100 doentes). Se isso ocorrer, os medicamentos do doente podem deixar de funcionar corretamente e o doente pode apresentar hemorragias prolongadas. Se isso ocorrer, deve-se entrar em contato imediatamente com o médico.
Efeitos secundários em crianças e adolescentes
A frequência, tipo e gravidade das reações adversas em crianças são comparáveis às dos adultos.
Notificação de efeitos secundários
Se ocorrerem efeitos secundários, incluindo quaisquer efeitos secundários não mencionados no folheto, deve informar o seu médico ou farmacêutico, ou enfermeira. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Nacional de Vigilância Sanitária:
Rua X, nº Y
Zip Code
Telefone: XXXXXXXXXX
Fax: XXXXXXXXXX
Site: https://www.anvisa.gov.br
Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos secundários pode ajudar a obter mais informações sobre a segurança do medicamento.
5. COMO CONSERVAR O HAEMATE P
- Manter o medicamento fora do alcance e da vista das crianças.
- Não use este medicamento após o prazo de validade impresso na etiqueta e na caixa (após a abreviação EXP)
- Não armazenar a uma temperatura superior a 25 oC.
- Não congelar.
- Manter os frascos na embalagem exterior para proteger da luz.
- O Haemate P não contém conservante, portanto, a solução reconstituída deve ser usada imediatamente.
- Se a solução reconstituída não for administrada imediatamente, deve ser usada dentro de 3 horas.
- Após a retirada do produto para a seringa, deve-se usá-lo imediatamente.
- O número do lote está gravado na etiqueta e na caixa após a abreviação (Lote).
6. CONTEÚDO DA EMBALAGEM E OUTRAS INFORMAÇÕES
O que contém o Haemate P Substâncias ativas do medicamento:
Fator de von Willebrand humano e fator VIII humano de coagulação do sangue
Outros componentes (substâncias auxiliares) são:
Albumina humana, glicina, cloreto de sódio, citrato de sódio, hidróxido de sódio ou ácido clorídrico (em pequenas quantidades para ajustar o pH)
Solvente: Água para injeção
Como é o Haemate P e o que contém a embalagem
O Haemate P é fornecido como um pó branco ou amarelo claro, ou uma massa cristalizada, e água para injeção como solvente. A solução reconstituída deve ser transparente ou ligeiramente opalescente, ou seja, pode brilhar quando segurada contra a luz, mas não deve conter partículas visíveis.
Embalagens disponíveis
A embalagem do medicamento na dose de 250 UI FVIII/ 600 UI VWF contém:
1 frasco de pó
1 frasco de 5 ml de água para injeção
1 sistema de transferência 20/20 com filtro,
Conjunto para administração (embalagem interna)
1 seringa de uso único de 5ml,
1 conjunto para punção,
2 cotonetes embebidos em álcool,
1 adesivo não estéril
A embalagem do medicamento na dose de 500 UI FVIII/1200 UI VWF contém:
1 frasco de pó
1 frasco de 10 ml de água para injeção
1 sistema de transferência 20/20 com filtro
Conjunto para administração (embalagem interna)
1 seringa de uso único de 10 ml,
1 conjunto para punção,
2 cotonetes embebidos em álcool,
1 adesivo não estéril
A embalagem do medicamento na dose de 1000 UI FVIII/ 2400 UI VWF contém:
1 frasco de pó
1 frasco de 15 ml de água para injeção
1 sistema de transferência 20/20 com filtro,
Conjunto para administração (embalagem interna)
1 seringa de uso único de 20 ml,
1 conjunto para punção,
2 cotonetes embebidos em álcool,
1 adesivo não estéril
Nem todos os tamanhos podem estar disponíveis.
Titular da autorização de comercialização e fabricante
CSL Behring GmbH
Rua Emil-von-Behring, 76
35041 Marburgo
Alemanha
Data de aprovação do folheto:
Informações destinadas apenas ao pessoal médico:
Dosagem Doença de von Willebrand:
É importante calcular a dose usando o número de unidades internacionais (UI) de VWF: RCo
1 UI/kg de VWF:RCo geralmente aumenta o nível de VWF:RCo circulante em 0,02 UI/ml (2%).
Deve-se tentar alcançar um nível de VWF:RCo > 0,6 UI/ml (60%) e FVIII:C > 0,4 UI/ml (40%).
- 40 – 80 UI/kg de fator de von Willebrand (VWF:RCo) e 20 – 40 UI de FVIII:C/kg de peso corporal (pc) são geralmente recomendados para alcançar a hemostase.
Pode ser necessário um dose inicial de fator de von Willebrand de 80 UI/kg, especialmente em doentes com tipo 3 de doença de von Willebrand, onde a manutenção de níveis adequados pode exigir doses maiores do que em outros tipos de doença.
Prevenção de hemorragia durante procedimentos cirúrgicos ou lesões graves:
Para prevenir hemorragia maciça durante ou após um procedimento cirúrgico, a injeção deve ser iniciada 1 a 2 horas antes do procedimento.
A dose adequada deve ser administrada a cada 12 – 24 horas. A dose e a duração do tratamento dependem do estado clínico do doente, do tipo e da intensidade da hemorragia, bem como dos níveis de VWF:RCo e FVIII:C.
Ao usar produtos de fator de von Willebrand que contenham FVIII, o médico responsável deve estar ciente de que a terapia prolongada pode causar um aumento excessivo do nível de FVIII:C. Após 24 – 48 horas de tratamento, para evitar um aumento excessivo do nível de FVIII:C, deve-se considerar a redução das doses e/ou o prolongamento do intervalo entre as administrações.
Crianças e adolescentes
A dosagem em crianças depende do peso corporal, portanto, o tamanho da dose é determinado da mesma forma que em adultos. A frequência de administração deve ser sempre determinada individualmente com base na eficácia clínica.
Hemofilia A:
Monitorização do tratamento
Durante o tratamento, é necessário medir adequadamente os níveis de fator VIII para determinar a dose adequada a ser administrada ao doente e a frequência das injeções repetidas. As respostas dos doentes individuais ao fator VIII podem variar, devido a diferentes níveis de recuperação e tempos de meia-vida. A dosagem com base no peso corporal pode exigir ajustes em doentes com sobrepeso ou baixo peso. Especialmente em procedimentos cirúrgicos mais graves, é necessário um monitoramento rigoroso da terapia de substituição por meio do controle do processo de coagulação (nível de atividade do fator VIII no sangue).
Os doentes devem ser monitorizados para detectar a formação de inibidores do fator VIII. Ver também o ponto 2.
A dosagem e a duração do tratamento de substituição dependem da gravidade da deficiência do fator VIII, da localização e da intensidade da hemorragia, bem como do estado clínico do doente.
É importante calcular a dose usando o número de unidades internacionais (UI) de FVIII: RCo
A quantidade de fator VIII administrada é expressa em unidades internacionais (UI), que se referem ao padrão atual da OMS para produtos de concentração de fator VIII. A atividade do fator VIII no sangue é expressa como porcentagem (em relação ao sangue humano normal) ou melhor em UI (em relação ao Padrão Internacional para fator VIII no sangue).
Uma UI de atividade do fator VIII é igual à quantidade de fator VIII contida em 1 ml de sangue humano normal.
Tratamento de emergência
O cálculo da dose necessária de fator VIII é baseado na observação empírica de que 1 UI de fator VIII por kg de peso corporal aumenta a atividade do fator VIII no sangue em cerca de 2% (2 UI/dl). A dose necessária é calculada usando a seguinte fórmula:
Dose necessária = peso corporal [kg] x aumento desejado do nível de fator VIII [% ou UI/dl] x 0,5.
A dose e a frequência de administração do produto devem ser sempre determinadas individualmente com base na eficácia clínica em doentes individuais.
Em caso de hemorragias ou procedimentos cirúrgicos, a atividade do fator VIII não deve cair abaixo dos valores para a atividade no sangue (em % ou UI/dl) no período de tempo correspondente.
| Tipo de hemorragia/procedimento cirúrgico | Nível terapêutico de atividade do fator VIII no sangue (% ou UI/dl) | Frequência de dosagem (horas) / duração do tratamento (dias) |
| Hemorragias | ||
| Hemorragia leve no joelho, hemorragia muscular ou sangramento na boca | 20-40 | Repita a injeção a cada 12 a 24 horas por pelo menos 1 dia até que a dor e o sangramento cessem ou até a recuperação |
| Hemorragia extensa no joelho; hemorragia muscular ou hematoma | 30-60 | Repita a injeção a cada 12-24 horas por 3 a 4 dias ou mais até que a dor e a disfunção aguda cessem |
| Hemorragias que ameaçam a vida: | 60-100 | Repita a injeção a cada 8 a 24 horas até que o perigo cesse |
| Procedimentos cirúrgicos | ||
| Procedimentos cirúrgicos menores, incluindo extração de dentes | 30-60 | A cada 24 horas, por pelo menos 1 dia, até a recuperação. |
| Procedimentos cirúrgicos maiores | 80-100 (pré e pós-operatório) | Repita a injeção a cada 8 – 24 horas até a cicatrização adequada da ferida, seguida de tratamento terapêutico por pelo menos 7 dias para alcançar 30% a 60% (UI/dl) de atividade do fator VIII. |
Prevenção
No tratamento de longo prazo para doentes com hemofilia A grave, geralmente são administradas 20 a 40 UI de fator VIII por kg de peso corporal a cada 2 a 3 dias.
Em alguns casos, especialmente em doentes jovens, pode ser necessário administrar o fator VIII com mais frequência ou em doses maiores.
Crianças e adolescentes
Não há dados disponíveis de estudos clínicos sobre a dosagem do Haemate P em crianças.
Precauções e advertências especiais para a utilização
Ao usar produtos VWF, o médico responsável deve estar ciente de que a terapia prolongada pode causar um aumento excessivo do nível de FVIII:C. Em doentes que recebem produtos VWF que contenham FVIII, deve-se monitorar os níveis de FVIII:C no sangue para evitar um aumento excessivo e prolongado do nível de FVIII:C, que pode aumentar o risco de trombose, e também deve-se considerar o uso de medidas antitrombóticas.
Efeitos secundários
Quando for necessário administrar doses muito altas ou repetidas, ou quando estiverem presentes inibidores, ou no caso de cuidados pré e pós-operatórios, todos os doentes devem ser monitorizados para detectar sinais de hipervolemia. Além disso, doentes com grupos sanguíneos A, B e AB devem ser monitorizados para detectar sinais de hemólise intravascular e/ou redução dos valores de hematócrito.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorCSL Behring GmbH
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Haemate P 1000 i.m. Fviii/2400 i.m. VufForma farmacêutica: Pó, 50 UI/ml; 500 UI + 60 UI/ml; 600 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 25 UI/ml; 250 UI + 30 UI/ml; 300 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médicaForma farmacêutica: Pó, 100 UI/ml; 1000 UI + 120 UI/ml; 1200 UISubstância ativa: von Willebrand factor and coagulation factor VIII in combinationFabricante: Instituto Grifols S.A.Requer receita médica
Alternativas a Haemate P 1000 i.m. Fviii/2400 i.m. Vuf noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Haemate P 1000 i.m. Fviii/2400 i.m. Vuf em Ukraine
Alternativa a Haemate P 1000 i.m. Fviii/2400 i.m. Vuf em Espanha
Médicos online para Haemate P 1000 i.m. Fviii/2400 i.m. Vuf
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Haemate P 1000 i.m. Fviii/2400 i.m. Vuf – sujeita a avaliação médica e regras locais.














