

Feiba Nf

Pergunte a um médico sobre a prescrição de Feiba Nf

Como usar Feiba Nf
Folheto informativo: informação para o utilizador
FEIBA NF, 1000 UI (50 UI/ml), pó e solvente para solução para injeção
Conjunto de factores de coagulação contra inibidor do factor VIII
Para tratamento de hemorragias e prevenção de hemorragias em doentes com hemofilia A complicada com inibidor do factor VIII e com hemofilia B complicada com inibidor do factor IX.
Deve ler atentamente o conteúdo do folheto antes de tomar o medicamento, pois contém informações importantes para o doente.
- Deve guardar este folheto para o poder reler se necessário.
- Em caso de dúvidas, deve consultar o médico, farmacêutico ou enfermeiro.
- Este medicamento foi prescrito apenas para si. Não o deve dar a outros. O medicamento pode ser prejudicial para outras pessoas, mesmo que os sintomas da sua doença sejam os mesmos.
- Se o doente apresentar algum efeito não desejado, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Ver secção 4.
Sumário do folheto
- 1. O que é FEIBA NF e para que é utilizado
- 2. Informações importantes antes de tomar FEIBA NF
- 3. Como tomar FEIBA NF
- 4. Efeitos não desejados
- 5. Como conservar FEIBA NF
- 6. Conteúdo da embalagem e outras informações
1. O que é FEIBA NF e para que é utilizado
FEIBA NF é um medicamento obtido a partir de plasma humano, que permite a coagulação do sangue em caso de deficiência ou falta de certos factores de coagulação.
FEIBA NF é utilizado para tratar hemorragias e prevenir hemorragias em doentes com hemofilia A complicada com inibidor do factor VIII e com hemofilia B complicada com inibidor do factor IX.
Além disso, FEIBA NF pode ser utilizado para tratar e prevenir hemorragias em pessoas que não sofrem de hemofilia, mas que têm inibidores adquiridos dos factores VIII, IX e XI.
FEIBA NF também é utilizado em combinação com concentrado de factor VIII durante o tratamento de longa duração destinado a eliminar completamente e permanentemente os inibidores do factor VIII, para permitir o tratamento regular com concentrado de factor VIII, como em doentes sem inibidores.
Em casos isolados, FEIBA NF foi utilizado em doentes com inibidor do factor von Willebrand.
2. Informações importantes antes de tomar FEIBA NF
Deve informar o médico se tiver alguma alergia.
Deve informar o médico se estiver a seguir uma dieta com baixo teor de sódio.
Quando não tomar FEIBA NF
Nas seguintes situações, não deve tomar FEIBA NF, a menos que não haja outra opção de tratamento:
- se tiver hipersensibilidade ao conjunto de factores de coagulação contra inibidor do factor VIII ou a qualquer um dos outros componentes do medicamento (listados na secção 6).
- se tiver coagulação intravascular disseminada (CID, coagulopatia de consumo, estado que ameaça a vida, relacionado com a coagulação maciça do sangue com formação de coágulos no interior dos vasos). Isso leva a um consumo geral dos factores de coagulação.
- se tiver trombose aguda ou embolia (incluindo infarto do miocárdio).
Ver secção "Precauções e advertências".
Precauções e advertências
Antes de começar a tomar FEIBA NF, deve discutir com o médico.
Este medicamento pode causar reações de hipersensibilidade do tipo alérgico, que incluem urticária, angioedema, sintomas gastrointestinais, espasmo brônquico e hipotensão; essas reações podem ser graves e sistémicas (por exemplo, reação anafilática com urticária e angioedema, espasmo brônquico e choque). Também foram relatadas outras reações relacionadas à infusão, como calafrios, febre e hipertensão.
Em caso de aparecimento dos primeiros sinais ou sintomas relacionados à infusão/reação de hipersensibilidade (ver secção 4), deve interromper a administração do medicamento e iniciar a assistência médica apropriada.
Em caso de doentes com suspeita de hipersensibilidade ao medicamento ou a qualquer um dos seus componentes, o médico decidirá sobre a readministração de FEIBA NF apenas após uma avaliação cuidadosa do risco e dos benefícios esperados e (ou) quando não se pode esperar resultados de tratamento com outra terapia preventiva ou medidas terapêuticas alternativas.
Durante o tratamento com FEIBA NF, ocorreram distúrbios tromboembólicos, incluindo coagulação intravascular disseminada (CID), trombose venosa, embolia pulmonar, infarto do miocárdio e acidente vascular cerebral.
Em caso de aparecimento dos primeiros sinais ou sintomas de distúrbios tromboembólicos (ver secção 4), deve interromper imediatamente a infusão e iniciar a investigação diagnóstica e terapêutica apropriada.
Alguns distúrbios tromboembólicos ocorreram em caso de administração de grandes doses de FEIBA NF ou em doentes com outros fatores de risco para distúrbios tromboembólicos, incluindo CID, doença aterosclerótica avançada, trauma esmagador ou septicemia. A administração concomitante de factor VIIa recombinante pode aumentar o risco de distúrbios tromboembólicos. Em doentes com hemofilia congênita ou adquirida, deve-se sempre considerar a possibilidade de tais fatores de risco.
O medicamento deve ser utilizado com especial cautela em doentes com risco de CID, trombose arterial ou venosa.
Foram relatados casos de microangiopatia trombótica em um estudo clínico de emicizumab, no qual os doentes receberam FEIBA NF como parte do esquema de tratamento de hemorragia de ruptura.
Em doentes com hemofilia e inibidor ou inibidores adquiridos para os factores de coagulação, durante o tratamento com FEIBA NF, pode ocorrer uma tendência aumentada para hemorragias e, ao mesmo tempo, um risco aumentado de trombose.
- Coagulação intravascular disseminada (CID).
- Lesão hepática: devido à eliminação retardada dos factores de coagulação ativos em doentes com disfunção hepática, existe um risco aumentado de CID.
- Doença coronária, trombose aguda e (ou) embolia. Ver secção "Quando não tomar FEIBA NF".
Em caso de medicamentos produzidos a partir de sangue ou plasma humano, são tomadas medidas específicas para prevenir infecções transmitidas aos doentes. Essas medidas incluem a seleção rigorosa dos doadores de sangue e plasma para garantir que aqueles que estão em grupo de risco de transmissão de infecções sejam excluídos, bem como a verificação de amostras individuais de sangue doado e de pools de plasma coletado para vírus/infecções. Os fabricantes desses produtos também incluem etapas no processo de tratamento do sangue e plasma que visam inativar ou remover vírus. No entanto, em caso de administração de medicamentos produzidos a partir de sangue ou plasma humano, não é possível excluir completamente a possibilidade de transmissão de infecção. Isso inclui vírus desconhecidos ou recentemente descobertos ou outros tipos de infecções.
As medidas tomadas são consideradas eficazes contra vírus envelopados, como o vírus da imunodeficiência humana (HIV), vírus da hepatite B e vírus da hepatite C, bem como contra o vírus da hepatite A não envelopado. As medidas tomadas podem ter um valor limitado contra vírus não envelopados, como o parvovirus B19. A infecção por parvovirus B19 pode ser grave em mulheres grávidas (infecção do feto) e em pessoas com deficiência imunológica ou com eritropoese aumentada (por exemplo, anemia hemolítica).
Em doentes que recebem regularmente ou várias vezes o factor VIII obtido a partir de plasma humano, deve-se considerar a administração de vacinas apropriadas (contra a hepatite A e B).
Após a administração de grandes doses de FEIBA NF, pode ocorrer um aumento transitório nos níveis de anticorpos passivamente transferidos contra o antígeno de superfície do vírus da hepatite B, o que pode resultar em resultados falsos positivos nos testes serológicos.
O medicamento contém iso-hemaglutininas, anticorpos contra os glóbulos vermelhos, que podem influenciar os resultados dos testes serológicos para a detecção de anticorpos contra os glóbulos vermelhos, como o teste de antiglobulina (teste de Coombs).
Em cada administração de uma dose de FEIBA NF, deve-se registrar claramente o nome e o número de lote do medicamento para manter o registro dos lotes utilizados.
FEIBA NF e outros medicamentos
Deve informar o médico sobre todos os medicamentos que está a tomar atualmente ou recentemente, incluindo os disponíveis sem receita médica.
Não foram realizados estudos adequados e bem controlados sobre o tratamento combinado ou sequencial com FEIBA NF e factor VIIa recombinante, medicamentos que inibem a fibrinólise ou emicizumab (ver "Precauções e advertências").
Deve-se considerar a possibilidade de ocorrência de incidentes tromboembólicos em caso de administração concomitante de medicamentos que inibem a fibrinólise, como o ácido tranexâmico e o ácido aminocaproico, em combinação com FEIBA NF. Por isso, os medicamentos que inibem a fibrinólise não devem ser administrados durante aproximadamente 6 a 12 horas após a administração de FEIBA NF.
Com base nos dados disponíveis de estudos in vitro e observações clínicas, no caso de administração concomitante de factor VIIa recombinante, não é possível excluir a possibilidade de uma interação medicamentosa potencial que possa resultar em um incidente tromboembólico.
Se o tratamento com FEIBA NF for considerado após a administração de emicizumab, o doente deve ser monitorizado de perto pelo médico.
Como no caso de todos os medicamentos que contenham factores de coagulação, não se deve misturar FEIBA NF com outros medicamentos antes da administração; isso pode afetar negativamente a eficácia e a segurança do medicamento.
Recomenda-se que, antes e após a administração de FEIBA NF, a entrada venosa seja lavada com solução salina isotônica.
Gravidez, amamentação e fertilidade
O médico decidirá se pode tomar FEIBA NF durante a gravidez ou amamentação. Devido ao risco aumentado de tromboses durante a gravidez, FEIBA NF deve ser utilizado apenas sob controle médico rigoroso e quando estiver claramente indicado.
Quanto ao risco de infecção por parvovirus B19, ver "Precauções e advertências".
Condução de veículos e utilização de máquinas
Não foram observados efeitos na capacidade de conduzir veículos ou utilizar máquinas.
FEIBA NF contém sódio
O medicamento contém 80 mg de sódio (principal componente do sal de cozinha) em cada frasco. Isso corresponde a 4% da dose diária máxima recomendada de sódio na dieta para adultos.
3. Como tomar FEIBA NF
O pó liofilizado FEIBA NF é reconstituído com o solvente fornecido e administrado por via intravenosa.
Este medicamento deve ser sempre utilizado de acordo com as recomendações do médico. Em caso de dúvidas, deve consultar o médico ou farmacêutico.
O tratamento deve ser iniciado e conduzido sob supervisão de um médico com experiência no tratamento de distúrbios de coagulação.
O médico determina a dose adequada e a frequência de administração individualmente para cada doente, considerando a gravidade do distúrbio de coagulação, a localização e a extensão da hemorragia, bem como o estado clínico geral do doente e sua resposta ao medicamento. Não deve alterar a dosagem estabelecida pelo médico ou interromper a administração do medicamento.
Se o doente sentir que o medicamento está a actuar demasiado forte ou demasiado fraco, deve contactar o médico ou farmacêutico.
Antes da administração, deve-se aquecer o medicamento à temperatura ambiente ou à temperatura corporal, se necessário.
FEIBA NF deve ser preparado apenas imediatamente antes da administração.
A solução preparada deve ser utilizada imediatamente (o medicamento não contém conservantes).
Misture suavemente, com movimento rotativo, até que o pó esteja completamente dissolvido. Deve-se certificar de que FEIBA NF esteja completamente dissolvido; caso contrário, menos unidades de FEIBA passarão pelo filtro do dispositivo.
Não deve utilizar a solução se estiver turva ou contiver sedimentos. Não utilize a solução de frascos previamente abertos.
Utilize apenas o solvente fornecido (água para injeção) e o kit para preparação da solução.
Se utilizar um kit diferente para preparação e administração do que o fornecido com FEIBA NF, certifique-se de que utilize um filtro com tamanho de poros de pelo menos 149 µm.
Não administre se o sistema de manutenção da esterilidade ou a embalagem do medicamento estiverem danificados ou comprometidos.
Registre a administração do medicamento no rótulo autoadesivo fornecido.
Elimine qualquer resíduo não utilizado do medicamento ou seus resíduos de acordo com as regulamentações locais.
Administração com agulha:
Preparação da solução para injeção
Deve seguir as normas de assepsia durante todo o procedimento.
- 1. Aqueça o frasco fechado com o solvente (água para injeção) à temperatura ambiente, se necessário, por exemplo, utilizando um banho de água por alguns minutos (máximo 37°C).
- 2. Remova as cápsulas de proteção dos frascos com o pó e o solvente e desinfete os cortes de borracha dos frascos.
- 3. Gire e puxe para remover a cobertura da agulha dupla (fig. A) e insira a agulha exposta no corte de borracha do frasco com o solvente (fig. C).
- 4. Remova a cobertura do outro extremo da agulha dupla, tendo cuidado para não tocar na parte exposta.
- 5. Vire o frasco com o solvente de cabeça para baixo sobre o frasco com o pó e insira a extremidade livre da agulha dupla no corte de borracha do frasco com o pó (fig. D). O solvente será sugado para o frasco com o pó por sucção.
- 6. Separe os dois frascos puxando a agulha do frasco com o pó (fig. E). Agite suavemente ou gire o frasco com o pó para acelerar o processo de dissolução.
- 7. Após a dissolução completa do pó, insira a agulha com o dispositivo de ventilação (fig. F) e a espuma formada desaparecerá. Remova a agulha com o dispositivo de ventilação.
Injeção/infusão
Deve seguir as normas de assepsia durante todo o procedimento.
- 1. Remova a cobertura da agulha com filtro girando e conecte-a à seringa estéril de uso único. Aspire a solução para a seringa (fig. G).
- 2. Desconecte a agulha com filtro da seringa e, após conectar o conjunto de infusão fornecido com a agulha de borboleta (ou agulha de injeção de uso único), administre a solução lentamente por via intravenosa. Pode-se utilizar uma bomba de seringa para controlar a velocidade de administração.
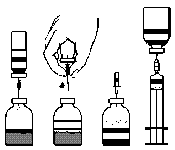
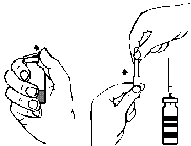
fig. A fig. B fig. C fig. D fig. E fig. F fig. G
Não exceda a velocidade de 2 unidades de FEIBA por kg de peso corporal por minuto. Administração com BAXJECT II Hi-Flow:
Preparação da solução para injeção
Deve seguir as normas de assepsia durante todo o procedimento.
- 1. Aqueça o frasco com o solvente (água para injeção) à temperatura ambiente, se necessário, por exemplo, utilizando um banho de água por alguns minutos (máximo 37°C).
- 2. Remova as cápsulas de proteção dos frascos com o pó e o solvente e desinfete os cortes de borracha dos frascos. Coloque os frascos sobre uma superfície plana.
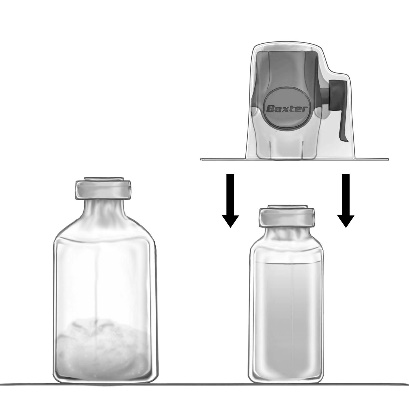
- 3. Abra a embalagem do dispositivo BAXJECT II Hi-Flow retirando a tampa de papel, sem tocar no interior (fig. a). Não retire o dispositivo da embalagem.
- 4. Vire a embalagem de cabeça para baixo e perfure a lâmina de plástico transparente através do corte de borracha do frasco com o solvente (fig. b). Segurando a embalagem pelas bordas, retire-a do dispositivo BAXJECT II Hi-Flow (fig. c). Não retire a tampa azul do dispositivo BAXJECT II Hi-Flow.
- 5. O dispositivo BAXJECT II Hi-Flow conectado ao frasco com o solvente deve ser virado de modo que o frasco com o solvente fique sobre o dispositivo. Perfure a lâmina de plástico roxa através do corte de borracha do frasco com o pó FEIBA NF. Sob ação da sucção, o solvente será sugado para o frasco com o pó FEIBA NF (fig. d).
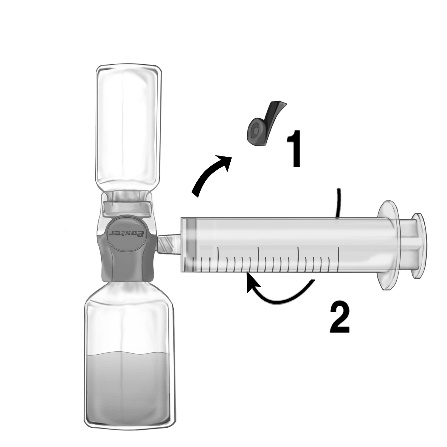
- 6. Misture suavemente, com movimento rotativo, mas sem agitar, até que o produto esteja completamente dissolvido. Deve-se certificar de que FEIBA NF esteja completamente dissolvido; caso contrário, a substância ativa não passará pelo filtro do dispositivo.
fig. a
fig. b
fig. c

Injeção/infusão
Deve seguir as normas de assepsia durante todo o procedimento.
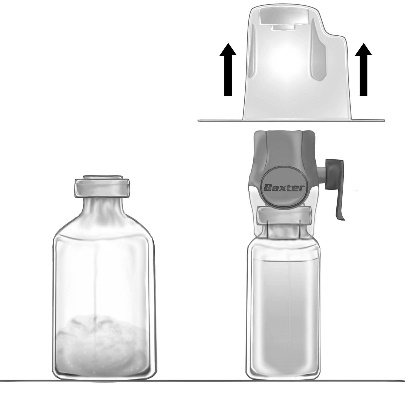
- 1. Remova a tampa azul do dispositivo BAXJECT II Hi-Flow. Conecte firmemente a seringa ao dispositivo BAXJECT II Hi-Flow (NÃO ASPIRE AR PARA A SERINGA) Para garantir uma conexão hermética entre a seringa e o dispositivo BAXJECT II Hi-Flow, especialmente se recomenda o uso de uma seringa com cone de luera (conectando a seringa, gire-a no sentido dos ponteiros do relógio até parar) (fig. e).
- 2. Vire o conjunto de modo que a solução fique sobre o dispositivo. Aspire a solução para a seringa, PUXANDO LENTAMENTE O ÉMBULO E CERTIFICANDO-SE DE QUE A CONEXÃO ENTRE A SERINGA E O DISPOSITIVO BAXJECT II HI-FLOW ESTEJA HERMÉTICA E A SERINGA ESTEJA CONECTADA DURANTE TODO O PROCEDIMENTO DE ASPIRAÇÃO (fig. f).
- 3. Desconecte a seringa.
- 4. Se a solução estiver espumosa, aguarde até que a espuma desapareça. Administre a solução lentamente por via intravenosa, utilizando o conjunto de infusão fornecido (ou agulha de injeção de uso único). Pode-se utilizar uma bomba de seringa para controlar a velocidade de administração.
fig. d
fig. e
fig. f

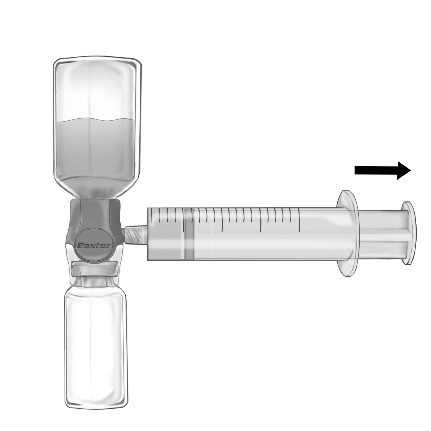
Não exceda a velocidade de 2 unidades de FEIBA por kg de peso corporal por minuto.
Administração de uma dose maior do que a recomendada de FEIBA NF
Deve informar imediatamente o médico. A sobredosagem de FEIBA NF pode aumentar o risco de efeitos não desejados, como distúrbios tromboembólicos (formação de coágulos sanguíneos que se movem nos vasos sanguíneos), coagulopatia de consumo (distúrbio de coagulação sanguínea) ou infarto do miocárdio.
4. Efeitos não desejados
Como qualquer medicamento, este medicamento pode causar efeitos não desejados, embora não ocorram em todos.
Deve contactar imediatamente o médicose ocorrer um ou mais dos seguintes sintomas:
- reações de hipersensibilidade: erupções cutâneas, urticária, prurido, angioedema, inchaço dos lábios e língua, respiração sibilante, sensação de pressão no peito, sintomas gastrointestinais, tontura, queda repentina da pressão sanguínea, calafrios, febre, hipertensão, coma
- coagulação intravascular disseminada (CID): equimoses espontâneas, petéquias, hemorragias graves (por exemplo, de feridas, locais de punção, mucosas, trato genital), insuficiência de órgãos devido à falta de oxigenação (por exemplo, nos rins - anúria ou oligúria; nos pulmões - dificuldade respiratória, tosse, hemoptise; no cérebro - alterações de consciência e problemas de concentração, convulsões, alterações de consciência, coma)
- trombose venosa: dor e inchaço de um membro, geralmente unilateral, aumento da temperatura da pele, estado subfebril ou febril
- embolia pulmonar: alteração significativa da pressão sanguínea ou frequência cardíaca, dificuldade respiratória, tosse ou dor no peito
- infarto do miocárdio: dor no peito que pode irradiar para o braço esquerdo ou direito, queixo, epigástrio ou costas; dificuldade respiratória, palpitações, tontura, síncope, fraqueza, ansiedade, medo
- acidente vascular cerebral: dor de cabeça súbita e intensa, alteração visual, ptose unilateral, dificuldade de deglutição e fala, alteração de coordenação motora e equilíbrio, sonolência, desorientação, perda de consciência
Efeitos não desejados frequentes (podem afetar até 1 em 10 pessoas):
- Hipersensibilidade
- Dor de cabeça, tontura
- Hipotensão
- Erupções cutâneas
- Resultado positivo para anticorpos contra o antígeno de superfície do vírus da hepatite B, aumento dos níveis de D-dímeros de fibrina
Efeitos não desejados de frequência desconhecida (não pode ser estimada a partir dos dados disponíveis):
- Coagulação intravascular disseminada (CID), aumento do título do inibidor
- Reação anafilática (reação de hipersensibilidade rápida e potencialmente fatal), urticária generalizada
- Sensação de formigamento nos membros (parestesia), sensação anormal ou diminuição da sensação (disestesia), acidente vascular cerebral (avc isquêmico, avc hemorrágico), sonolência, alterações do paladar
- Infarto do miocárdio (ataque cardíaco), palpitações
- Formação de coágulos (trombose venosa, trombose arterial), que se movem nos vasos sanguíneos (eventos tromboembólicos), aumento da pressão sanguínea (hipertensão), rubor súbito
- Embolia pulmonar (embolia pulmonar), espasmo brônquico, respiração sibilante, tosse, dificuldade respiratória
- Vômitos, diarreia, desconforto abdominal, náuseas
- Sensação de formigamento no rosto, inchaço do rosto, língua e lábios (angioedema), urticária generalizada, prurido
- Dor no local da injeção, mal-estar geral, sensação de calor, calafrios, febre, dor no peito, desconforto no peito
- Queda da pressão sanguínea
Os sintomas de reação de hipersensibilidade após a administração de medicamentos derivados do plasma humano também incluem coma e ansiedade.
Notificação de efeitos não desejados
Se ocorrerem efeitos não desejados, incluindo quaisquer efeitos não desejados não mencionados neste folheto, deve informar o médico, farmacêutico ou enfermeiro. Os efeitos não desejados podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Não Desejados de Medicamentos do Instituto Nacional de Farmacologia.
Os efeitos não desejados também podem ser notificados ao titular da autorização de comercialização.
A notificação de efeitos não desejados é importante, pois permite reunir mais informações sobre a segurança do medicamento.
5. Como conservar FEIBA NF
Deve conservar o medicamento em um local onde as crianças não possam alcançá-lo.
Não conserve em temperatura superior a 25°C. Não congele.
Conservar o medicamento na embalagem exterior para protegê-lo da luz.
Não utilize este medicamento após a data de validade impressa na embalagem.
A data de validade é o último dia do mês indicado.
Não elimine os medicamentos no esgoto ou em recipientes de lixo doméstico. Deve perguntar ao farmacêutico como eliminar os medicamentos que já não são necessários. Esse procedimento ajudará a proteger o meio ambiente.
6. Conteúdo da embalagem e outras informações
O que contém FEIBA NF
Pó
- O princípio ativo é o conjunto de factores de coagulação contra inibidor do factor VIII. Após reconstituição em 20 ml do solvente fornecido, 1 ml contém aproximadamente 50 UI do conjunto de factores de coagulação contra inibidor do factor VIII. 1 frasco contém 1000 UI do factor VIII com actividade de bypass para o inibidor em 400-1200 mg de proteína do plasma humano.
- FEIBA NF também contém factores II, IX e X, principalmente na forma não ativada, bem como factor VII ativado. O antígeno coagulante do factor VIII (F VIII C:Ag) está presente em uma concentração de até 0,1 UI por 1 UI de FEIBA. Os factores do sistema calicreína-quinina estão presentes apenas em quantidades residuais ou estão ausentes.
- Os outros componentes do medicamento são cloreto de sódio e citrato de sódio.
Solvente
- Água para injeção
Como é FEIBA NF e que conteúdo tem a embalagem
O medicamento é um pó liofilizado ou uma substância sólida fina de cor branca ou verde-clara.
O pó e o solvente são fornecidos em frascos de vidro fechados com cortes de borracha.
O valor de pH da solução após reconstituição é entre 6,8 e 7,6.
Tamanho da embalagem: 1 kit
Conteúdo da embalagem (com agulhas):
1 frasco com 1000 UI de FEIBA NF, fechado com um corte de borracha
1 frasco com 20 ml de água para injeção, fechado com um corte de borracha
1 agulha dupla
1 agulha com dispositivo de ventilação
1 seringa de uso único
1 agulha para injeção
1 agulha com filtro
1 agulha de borboleta (kit de infusão com agulha de borboleta)
Conteúdo da embalagem (com BAXJECT II Hi-Flow):
1 frasco com 1000 UI de FEIBA NF, fechado com um corte de borracha
1 frasco com 20 ml de água para injeção, fechado com um corte de borracha
1 BAXJECT II Hi-Flow - dispositivo de transferência sem agulha para transferir e misturar medicamentos contidos em dois frascos
1 seringa de uso único
1 agulha para injeção
1 agulha de borboleta (kit de infusão com agulha de borboleta)
Titular da autorização de comercialização e fabricante
Titular da autorização de comercialização:
Takeda Pharma, S.A.
Rua Proença de Ataíde, 3 - 4º
1200-233 Lisboa
Tel: +351 213 122 400
[email protected]
Fabricante:
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Viena, Áustria
Data da última revisão do folheto:
-----------------------------------------------------------------------------------------------------------------
Informações destinadas apenas a profissionais de saúde:
O tratamento deve ser iniciado e supervisionado por um médico com experiência no tratamento de hemofilia.
Posologia
A posologia e a duração do tratamento dependem da gravidade do distúrbio de coagulação, da localização e extensão da hemorragia, bem como do estado clínico do doente.
A dose, bem como a frequência de administração, devem ser sempre orientadas para a eficácia clínica no caso específico.
Geralmente, recomenda-se uma dose de 50-100 UI de FEIBA por kg de peso corporal, mas não deve exceder a dose única de 100 UI/kg de peso corporal ou a dose diária máxima de 200 UI/kg de peso corporal, a menos que a gravidade da hemorragia exija e justifique o uso de doses maiores.
Devido a fatores específicos do doente, a resposta ao conjunto de factores com actividade de bypass para o inibidor do factor VIII pode variar, e em um caso específico de hemorragia em um doente que responde inadequadamente a um dos factores, deve-se considerar o uso de outro factor.
Crianças e adolescentes
A experiência com o uso em crianças com menos de 6 anos é limitada; o esquema de dosagem, semelhante ao dos adultos, deve ser adaptado ao estado clínico da criança.
- 1)
Hemorragias espontâneas
Hemorragias nas articulações, músculos e tecidos moles
Nos casos de hemorragias pequenas ou moderadas, recomenda-se uma dose de 50-75 UI/kg em intervalos de 12 horas. O tratamento deve ser continuado até que se obtenham sinais clínicos de melhoria, como a resolução da dor, redução do inchaço ou mobilidade da articulação.
Nos casos de hemorragias grandes nos músculos e tecidos moles, como hemorragias na cavidade abdominal, recomenda-se uma dose de 100 UI/kg em intervalos de 12 horas.
Hemorragias nas mucosas
Recomenda-se uma dose de 50 UI/kg a cada 6 horas, com monitorização cuidadosa do doente (monitorização da superfície de hemorragia, hematócrito repetido no doente). Se a hemorragia não parar, a dose pode ser aumentada para 100 UI/kg. Não deve exceder a dose diária máxima de 200 UI/kg.
Outras hemorragias graves
Nos casos de hemorragias graves, como hemorragia no sistema nervoso central, recomenda-se uma dose de 100 UI/kg em intervalos de 12 horas. Em casos individuais, pode-se administrar FEIBA NF em intervalos de 6 horas até que se obtenha uma melhoria clínica significativa. Não deve exceder a dose diária máxima de 200 UI/kg.
- 2)
Procedimentos cirúrgicos
Administre 50-100 UI/kg em intervalos de 6 horas, tendo cuidado para não exceder a dose diária máxima.
- 3)
Profilaxia
Existem dados clínicos limitados sobre a administração de FEIBA NF para profilaxia de hemorragias em doentes com hemofilia.
- Tratamento profilático de hemorragias em doentes com título alto de inibidor e hemorragias frequentes, nos quais a indução de tolerância imunológica (ITI) não foi bem-sucedida ou não é considerada: Recomenda-se uma dose de 70-100 UI/kg a cada 2 dias. Se a hemorragia no doente não parar, a dose pode ser aumentada para 100 UI/kg administrados diariamente, ou gradualmente reduzida.
- Tratamento profilático de hemorragias em doentes com título alto de inibidores durante a indução de tolerância imunológica (ITI): FEIBA NF pode ser administrado concomitantemente com concentrados de factor VIII, em doses de 50-100 UI/kg duas vezes ao dia, até que o título do inibidor do factor VIII diminua para <2 ui.*< li>
*1 UI de Bethesda é definida como a quantidade de anticorpo que reduz em 50% a actividade do factor VIII no plasma humano normal após 2 horas de incubação a 37°C.
Modo de administração
Ver também a secção "FEIBA NF e outros medicamentos" e a secção 3 do folheto.
FEIBA NF deve ser administrado por via intravenosa lenta (não mais rápido do que 2 UI/kg de peso corporal por minuto).
FEIBA NF deve ser preparado imediatamente antes da administração.
A solução preparada deve ser utilizada imediatamente (o medicamento não contém conservantes).
Não deve utilizar a solução se estiver turva ou contiver sedimentos.
Não deve administrar se o dispositivo de transferência sem agulha ou a agulha dupla, o sistema de manutenção da esterilidade ou a embalagem do medicamento estiverem danificados ou comprometidos.
Os resíduos não utilizados da solução devem ser eliminados de acordo com o procedimento local.
Monitorização do tratamento
Devido ao mecanismo de ação complexo, não há um método direto de monitorização dos componentes ativos.
Os resultados dos testes laboratoriais in vitro para avaliar a eficácia do tratamento, como o aPTT, o tempo de coagulação e o tromboelastograma (TEG), podem não refletir a melhoria clínica. Por isso, as tentativas de restaurar os valores normais desses parâmetros aumentando as doses de FEIBA NF podem ser enganosas e devem ser evitadas devido ao risco de CID causado por sobredosagem.
Em caso de resposta inadequada ao tratamento com FEIBA NF, recomenda-se determinar o número de plaquetas, pois uma quantidade suficiente de plaquetas funcionais é necessária para a eficácia de FEIBA NF.
Não deve exceder as doses únicas de 100 UI/kg de peso corporal e a dose diária de 200 UI/kg de peso corporal. Os doentes que recebem mais de 100 UI/kg de peso corporal devem ser monitorizados para detectar CID e (ou) doença coronária aguda. As grandes doses de FEIBA NF devem ser administradas apenas durante o período necessário para controlar a hemorragia.
Em caso de alterações significativas da pressão sanguínea, frequência cardíaca, distúrbios respiratórios, dor no peito e tosse, deve-se interromper imediatamente a administração do medicamento e iniciar as medidas diagnósticas e terapêuticas apropriadas.
Os resultados laboratoriais que indicam CID são: diminuição da fibrinogena, redução do número de plaquetas e presença de produtos de degradação da fibrina/fibrinogena (FDP).
A administração de FEIBA NF a doentes com inibidores pode resultar num aumento inicial do título do inibidor. Sob a influência da administração contínua de FEIBA NF, o título do inibidor pode diminuir com o tempo. Os dados clínicos e da literatura sugerem que a eficácia de FEIBA NF não é reduzida.
Durante a administração de FEIBA NF, em doentes com hemofilia complicada com inibidor ou com inibidores adquiridos para os factores de coagulação, pode ocorrer uma tendência simultânea para hemorragias e um risco aumentado de trombose.
Ver também a secção "Precauções e advertências".
Informações detalhadas sobre este medicamento estão disponíveis na Característica do Produto do Medicamento disponível no site do Infarmed.
- País de registo
- Substância ativa
- Requer receita médicaSim
- Fabricante
- ImportadorTakeda Manufacturing Austria AG
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Feiba NfForma farmacêutica: Pó, 500 UI = 500 UI FEIBASubstância ativa: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequer receita médicaForma farmacêutica: Pó, 500 UI (500 UI FEIBA), 50 UI/mlSubstância ativa: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequer receita médicaForma farmacêutica: Pó, 2500 UI (2500 UI FEIBA), 50 UI/mlSubstância ativa: factor VIII inhibitor bypassing activityFabricante: Takeda Manufacturing Austria AGRequer receita médica
Alternativas a Feiba Nf noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Feiba Nf em Espanha
Médicos online para Feiba Nf
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Feiba Nf – sujeita a avaliação médica e regras locais.














