
Curosurf

Pergunte a um médico sobre a prescrição de Curosurf

Como usar Curosurf
Folheto anexo ao embalagem: informação para pais e tutores
Atenção! Deve manter o folheto. Informação no embalagem primário em língua estrangeira.
Curosurf, 80 mg/ml, suspensão para administração intratraqueal e intra-bronquial
(Poractant alfa)
Fracionamento de fosfolipídios de pulmão de porco
Deve ler atentamente o conteúdo do folheto antes de administrar o medicamento, pois contém informações importantes para o paciente.
- Deve manter este folheto, para que possa lê-lo novamente se necessário.
- Em caso de dúvidas, deve consultar um médico.
- Se o paciente apresentar algum efeito colateral, incluindo qualquer efeito colateral não mencionado neste folheto, deve informar o médico ou enfermeiro. Ver ponto 3.
Índice do folheto:
- 1. O que é o medicamento Curosurf e para que é utilizado
- 2. Como administrar o medicamento Curosurf
- 3. Efeitos colaterais possíveis
- 4. Como armazenar o medicamento Curosurf
- 5. Conteúdo do embalagem e outras informações
1. O QUE É O MEDICAMENTO CUROSURF E PARA QUE É UTILIZADO
O medicamento Curosurf é utilizado no tratamento e prevenção da síndrome de dificuldade respiratória (em inglês, Respiratory Distress Syndrome: RDS) em recém-nascidos. Na maioria dos recém-nascidos, os pulmões contêm uma substância chamada surfactante (fator de superfície ativo). Essa substância reveste os alvéolos pulmonares, evita que eles grudem e permite a respiração normal. No entanto, alguns recém-nascidos, especialmente prematuros, nascem com deficiência de surfactante, o que leva ao desenvolvimento da RDS. O medicamento Curosurf é um surfactante natural que atua da mesma forma que o surfactante produzido pelos recém-nascidos e, portanto, ajuda os recém-nascidos a respirar normalmente até que comecem a produzir seu próprio surfactante natural.
Em um recém-nascido, podem ocorrer outras doenças que possam exigir tratamento diferente.
2. COMO É ADMINISTRADO O MEDICAMENTO CUROSURF
Dosagem:
O médico escolhe a dose adequada do medicamento, dependendo do peso do bebê. Se o bebê receber o medicamento Curosurf para prevenir a RDS, o medicamento deve ser administrado dentro de 15 minutos após o nascimento.
Se o bebê receber o medicamento Curosurf para tratar a RDS, o medicamento deve ser administrado o mais rápido possível após o diagnóstico da doença. Se o bebê precisar de uma dose adicional do medicamento Curosurf, a dose adicional deve ser administrada 12 horas após a administração da primeira dose. Se necessário, após 12 horas adicionais, pode ser administrada uma terceira dose.
A administração do medicamento Curosurf em prematuros com insuficiência hepática ou renal não foi estudada.
Modo de administração do medicamento:
O medicamento Curosurf é administrado ao bebê em um incubadora por um médico ou enfermeiro. O medicamento será aquecido à temperatura ambiente e, em seguida, administrado com a ajuda de uma seringa através de um tubo de intubação para a traqueia do bebê. Para isso, pode ser necessário desconectar o bebê do respirador por alguns minutos.
Também pode ser utilizada a técnica de administração menos invasiva de surfactante por um cateter fino (LISA – em inglês, Less Invasive Surfactant Administration).
O medicamento Curosurf contém sódio
O medicamento contém menos de 1 mmol (23 mg) de sódio em uma ampola, ou seja, o medicamento é considerado "livre de sódio".
3. EFEITOS COLATERAIS POSSÍVEIS
Como qualquer medicamento, este medicamento pode causar efeitos colaterais, embora não todos os pacientes os experimentem.
Os efeitos colaterais possíveis são listados abaixo, de acordo com a frequência de ocorrência:
Em caso de dúvida sobre efeitos colaterais, deve consultar um médico.
Não muito frequentes(ocorrem em menos de 1 em 100 pacientes):
- infecção
- sangramento no cérebro
- ar no tórax devido a lesão pulmonar
Raros(ocorrem em menos de 1 em 1000 pacientes):
- desaceleração da atividade cardíaca
- baixa pressão arterial
- doença pulmonar crônica
- redução da quantidade de oxigênio no organismo
Além disso, foram relatados os seguintes efeitos colaterais:
- aumento da quantidade de oxigênio no organismo
- coloração azulada da pele ou mucosas devido à falta de oxigênio
- parada respiratória
- complicações decorrentes da colocação de tubos nos pulmões
- redução da atividade cerebral
Durante a administração do medicamento Curosurf por um cateter fino, foram relatados alguns efeitos colaterais leves e temporários: bradicardia, apneia, redução da saturação de oxigênio no sangue, espuma na boca, tosse, engasgo e espirros.
Notificação de efeitos colaterais
Se ocorrerem algum efeito colateral, incluindo qualquer efeito colateral não mencionado neste folheto, deve informar o médico ou enfermeiro.
Os efeitos colaterais podem ser notificados diretamente ao Departamento de Monitoramento de Efeitos Colaterais de Medicamentos da Agência Reguladora de Medicamentos,
Al. Jerozolimskie 181C, 02-222 Varsóvia, telefone: +48 22 49 21 301, fax: +48 22 49 21 309, site: https://smz.ezdrowie.gov.pl
A notificação de efeitos colaterais permitirá reunir mais informações sobre a segurança do medicamento.
4. COMO ARMAZENAR O MEDICAMENTO CUROSURF
- O medicamento deve ser armazenado em um local inacessível e invisível para crianças.
- Armazenar na geladeira (2°C - 8°C). Armazenar no embalagem original para proteger da luz. Antes da administração ao bebê, deve ser aquecido à temperatura ambiente.
- As ampolas não abertas e não utilizadas do medicamento Curosurf, que foram aquecidas à temperatura ambiente, podem ser devolvidas à geladeira dentro de 24 horas para uso posterior. O medicamento não deve ser aquecido à temperatura ambiente e devolvido à geladeira mais de uma vez.
- Não utilizar o medicamento após a data de validade impressa na caixa e na ampola. A data de validade é o último dia do mês indicado.
- Um recipiente deve ser utilizado uma vez, e os resíduos devem ser descartados. O hospital deve garantir a eliminação segura dos resíduos não utilizados do medicamento Curosurf.
- Os medicamentos não devem ser descartados no sistema de esgoto. Deve perguntar ao farmacêutico como descartar os medicamentos que não são mais utilizados. Essa ação ajudará a proteger o meio ambiente.
5. CONTEÚDO DO EMBALAGEM E OUTRAS INFORMAÇÕES
O que contém o medicamento Curosurf
- A substância ativa é uma mistura de lipídios e proteínas obtidas de alvéolos pulmonares de porco.
- Os outros componentes são: cloreto de sódio, água para injeção, bicarbonato de sódio (para ajuste de pH).
Como é o medicamento Curosurf e o que contém o embalagem
O medicamento Curosurf é uma suspensão estéril. Está disponível em ampolas de vidro de uso único, contendo 1,5 ml (120 mg) de fracionamento de fosfolipídios de alvéolos pulmonares de porco.
Cada ml da suspensão estéril contém 80 mg de fracionamento de fosfolipídios de alvéolos pulmonares de porco. Em um embalagem, há 2 ampolas de 1,5 ml da suspensão do medicamento Curosurf.
Para obter informações mais detalhadas, deve consultar o responsável ou o importador paralelo.
Responsável na Bulgária, país de exportação:
Chiesi Farmaceutici S.p.A.
Via Palermo, 26/A
43122 Parma, Itália
Fabricante:
Chiesi Farmaceutici S.p.A
Via San Leonardo 96 - Via Palermo 26/A, 43122 Parma, Itália
Chiesi Pharmaceuticals GmbH
Gonzagagasse 16/16, A-1010 Viena, Áustria
Importador paralelo:
Delfarma Sp. z o.o.
ul. Św. Teresy od Dzieciątka Jezus 111
91-222 Łódź
Reembalado em:
Delfarma Sp. z o.o.
ul. Św. Teresy od Dzieciątka Jezus 111
91-222 Łódź
Número de autorização na Bulgária, país de exportação: 9600101
Número de autorização para importação paralela: 211/24
Data de aprovação do folheto: 24.05.2024
[Informação sobre marca registrada]
Pede-se que leia a informação no verso do folheto
------------------------------------------------------------------------------------------------------------------------
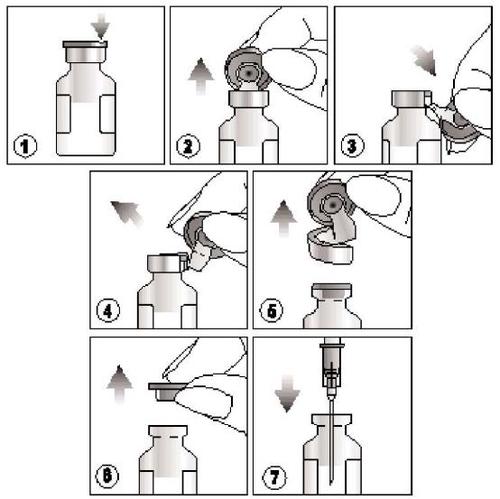
Como abrir o produto?
- 1) Encontrar a ranhura localizada na tampa de plástico colorida,
- 2) Levantar a tampa na ranhura e puxá-la para cima,
- 3) Puxar a parte plástica da tampa para baixo junto com a parte de alumínio,
- 4) e 5) Remover toda a tampa puxando o anel de alumínio
- 6) e 7) Retirar a tampa de borracha antes de retirar o conteúdo da ampola.
Para uso único. A suspensão não utilizada que reste na ampola deve ser descartada.
Não armazenar a suspensão não utilizada para uso posterior.
Os resíduos do produto não utilizado ou seus dejetos devem ser eliminados de acordo com as regulamentações.
- País de registo
- Substância ativa
- Requer receita médicaNão
- Titular da Autorização de Introdução no Mercado (AIM, MAH)Chiesi Farmaceutici S.p.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a CurosurfForma farmacêutica: Suspensão, 80 mg, correspondendo a aproximadamente 74 mg de conteúdo total de fosfolípidos e 0,9 mg de proteínas hidrofóbicas de baixo peso molecular.Substância ativa: natural phospholipidsNão requer receita médicaForma farmacêutica: Suspensão, 80 mg/mlSubstância ativa: natural phospholipidsNão requer receita médicaForma farmacêutica: Pastilhas, 1500 mg + 125 mgSubstância ativa: nikethamideFabricante: Przedsiębiorstwo Produkcyjno-Handlowe EWA S.A.Não requer receita médica
Alternativas a Curosurf noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Curosurf em Ukraine
Alternativa a Curosurf em Espanha
Médicos online para Curosurf
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Curosurf – sujeita a avaliação médica e regras locais.














