
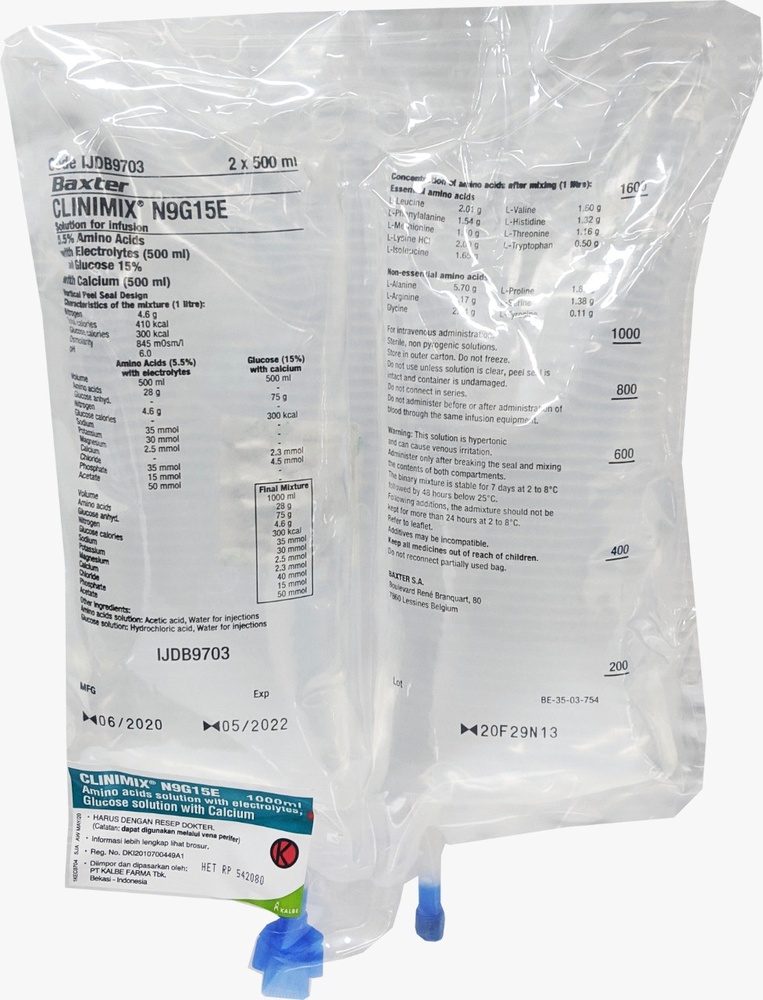
Clinimix N9g15e

Pergunte a um médico sobre a prescrição de Clinimix N9g15e

Como usar Clinimix N9g15e
Folheto informativo: informação para o utilizador
CLINIMIX N9G15E
Solução para infusão
Deve ler atentamente o conteúdo do folheto antes de usar o medicamento, pois contém informações importantes para o doente.
- Deve conservar este folheto para poder relê-lo se necessário.
- Em caso de dúvidas, deve consultar o médico ou a enfermeira.
- Se o doente apresentar algum efeito secundário, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico ou a enfermeira. Ver secção 4.
Índice
- 1. O que é CLINIMIX e para que é usado
- 2. Informações importantes antes de usar CLINIMIX
- 3. Como usar CLINIMIX
- 4. Efeitos secundários
- 5. Como conservar CLINIMIX
- 6. Conteúdo do pacote e outras informações
1. O que é CLINIMIX e para que é usado
CLINIMIX é uma solução para infusão. É fornecido em sacos com duas câmaras. Uma câmara contém uma solução de aminoácidos com eletrólitos, e a outra contém uma solução de glicose com cálcio. As câmaras são separadas por uma solda quebrável. O conteúdo de ambas as câmaras deve ser misturado imediatamente antes da administração ao doente, esmagando ou torcendo o saco a partir do topo para quebrar a solda. CLINIMIX é administrado por injeção intravenosa para fornecer nutrientes a adultos e crianças quando a alimentação oral é inadequada. CLINIMIX só deve ser administrado sob supervisão médica.
2. Informações importantes antes de usar CLINIMIX
Quando não usar CLINIMIX
- se o doente tiver alergia a qualquer um dos componentes do medicamento (listados na secção 6)
- se o uso de alguns aminoácidos causar problemas para o organismo do doente
- se o doente tiver níveis de açúcar no sangue muito altos (hiperglicemia grave)
- se o doente tiver níveis de ácido no sangue muito altos (acidose metabólica devido a níveis elevados de lactato)
- se o doente tiver níveis de sódio, potássio, magnésio, cálcio e/ou fósforo muito altos no sangue (hipernatremia, hipercalemia, hipermagnesemia, hipercalcemia e/ou hiperfosfatemia).
- em crianças abaixo de 28 dias de vida, não deve ser administrado ceftriaxona juntamente com soluções para injeção intravenosa, pois podem formar-se partículas insolúveis.
Em todos os casos, a decisão do médico de administrar este medicamento ao doente dependerá de factores como a idade, o peso do doente, o seu estado clínico, incluindo os resultados de quaisquer exames realizados.
Precauções e advertências
Antes de começar a usar CLINIMIX, deve discutir com o médico ou a enfermeira. Se ocorrerem sintomas incomuns ou sinais de reação alérgica, como febre, arrepios, erupções cutâneas ou dificuldades respiratórias, suor excessivo, náuseas ou dor de cabeça, deve informar o médico ou a enfermeira: a infusão será interrompida imediatamente. O médico monitorizará o estado do doente durante a administração do medicamento e pode recomendar alterações na dose ou adicionar nutrientes adicionais, como gorduras, vitaminas, eletrólitos e oligoelementos, se considerar necessário. Alguns medicamentos e doenças podem aumentar o risco de infecções ou sepsia (presença de bactérias no sangue). O risco de infecções ou sepsia está particularmente associado à inserção de um cateter venoso no doente. O médico monitorizará o doente para detectar quaisquer sinais de infecção. A utilização de técnicas assépticas durante a inserção e manutenção do cateter, bem como durante a preparação da solução para infusão, pode reduzir o risco de infecção. CLINIMIX com eletrólitos contém cálcio. Não deve ser administrado com o antibiótico ceftriaxona, pois pode levar à formação de partículas. Em casos de desnutrição grave que requerem administração de nutrientes intravenosos, é recomendável iniciar a nutrição parenteral lentamente e com cautela. Desde o início da infusão, o médico monitorizará o estado do doente, especialmente se tiver problemas de fígado, rins, supra-renais ou circulação. O médico também deve ser informado sobre doenças graves que afetam o metabolismo de carboidratos, gorduras, proteínas e sais no organismo (distúrbios metabólicos). Se ocorrerem sintomas incomuns, incluindo irritação venosa, a infusão deve ser interrompida imediatamente. Durante a administração do medicamento, o médico realizará exames clínicos e laboratoriais para verificar a eficácia e garantir a segurança da administração do medicamento. Se o doente receber o medicamento durante várias semanas, os exames de sangue serão realizados regularmente. Em particular, em caso de intolerância à glicose, os níveis de glicose no sangue e na urina devem ser monitorizados regularmente e, se o doente tiver diabetes, a dose de insulina pode precisar ser ajustada.
Crianças e adolescentes
Quando usado em lactentes e crianças abaixo de 2 anos de idade, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração (ver secção 2). A exposição da solução CLINIMIX à luz, especialmente após a adição de oligoelementos e/ou vitaminas, pode levar à formação de peróxidos e outros produtos de degradação, o que pode ser minimizado protegendo-a da luz.
CLINIMIX e outros medicamentos
Deve informar o médico sobre todos os medicamentos que está a tomar atualmente ou recentemente, bem como sobre os medicamentos que planeia tomar. CLINIMIX com eletrólitos contém cálcio. Não deve ser administrado com o antibiótico ceftriaxona, pois pode levar à formação de partículas. Devido ao teor de potássio em CLINIMIX, deve-se ter cuidado especial em doentes que tomam diuréticos poupadores de potássio (por exemplo, amilorida, espironolactona, triamtereno), inibidores da enzima conversora da angiotensina (ECA), antagonistas do receptor da angiotensina II ou imunossupressores como tacrolimo ou ciclosporina, devido ao risco de hipercalemia.
Gravidez, amamentação e fertilidade
Se a paciente estiver grávida ou a amamentar, ou se suspeitar que está grávida ou planeia engravidar, deve consultar o médico antes de usar este medicamento.
3. Como usar CLINIMIX
Antes da administração, a solda entre as duas câmaras deve ser quebrada e o conteúdo de ambas as câmaras deve ser misturado. CLINIMIX pode ser administrado a adultos e crianças. Quando usado em lactentes e crianças abaixo de 2 anos de idade, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração (ver secção 2). CLINIMIX é uma solução para infusão intravenosa para administração por injeção venosa periférica ou central.
Dosagem - Adultos e crianças
O médico decidirá qual dose é necessária para o doente e por quanto tempo será administrada. Isso dependerá da idade, peso e crescimento, estado clínico, balanço diário de líquidos, necessidades energéticas e necessidades de azoto. Deve sempre usar CLINIMIX exatamente como recomendado pelo médico. Se tiver alguma dúvida, deve consultar o médico. O tratamento pode ser continuado por tanto tempo quanto necessário, dependendo do estado clínico do doente. A infusão de um saco geralmente dura entre 8 e 24 horas.
Uso de mais do que a dose recomendada de CLINIMIX
Se o doente receber uma dose excessiva de medicamento ou se a infusão for administrada muito rapidamente, pode ocorrer um aumento do volume de líquido no sistema circulatório ou o sangue pode tornar-se muito ácido. A glicose presente no produto pode aumentar os níveis de glicose no sangue e na urina. A administração de um volume excessivo de solução pode causar náuseas, vômitos, arrepios e distúrbios eletrolíticos. Nesse caso, a infusão deve ser interrompida imediatamente. Em alguns casos graves, para ajudar os rins do doente a eliminar o excesso de CLINIMIX, o médico pode usar diálise renal temporária. Para evitar tais situações, o médico monitorizará regularmente o estado do doente e verificará os parâmetros sanguíneos. Se tiver alguma dúvida adicional sobre o uso deste medicamento, deve consultar o médico.
4. Efeitos secundários
Como qualquer medicamento, CLINIMIX pode causar efeitos secundários, embora não todos os doentes os experimentem. Se ocorrerem alguma alteração no bem-estar durante ou após o tratamento, deve informar o médico ou a enfermeira imediatamente. Os exames realizados pelo médico durante o tratamento devem minimizar o risco de efeitos secundários. Se ocorrerem sintomas incomuns de reação alérgica, como pressão arterial muito baixa ou muito alta, coloração azulada ou roxa da pele, frequência cardíaca acelerada, dificuldades respiratórias, vômitos, náuseas, erupções cutâneas, febre, suor excessivo ou arrepios, a infusão será interrompida imediatamente. Foram também observados outros efeitos secundários que ocorreram com maior ou menor frequência:
- Anafilaxia (reação alérgica grave que pode ser fatal)
- Aumento dos níveis de glicose, amônia e compostos nitrogenados no sangue
- Distúrbios da função hepática, resultados anormais de exames de sangue que avaliam a função hepática
- Coledocolitíase, presença de cálculos biliares na vesícula biliar
- Flebite no local da injeção, irritação venosa, dor, inflamação, vermelhidão, inchaço
- Presença de glicose na urina
- Cetoacidose diabética
- Formação de pequenas partículas (sedimento) que podem bloquear os vasos sanguíneos nos pulmões
Notificação de efeitos secundários
Se ocorrerem efeitos secundários, incluindo qualquer efeito secundário não mencionado neste folheto, deve informar o médico ou o farmacêutico. Os efeitos secundários podem ser notificados diretamente ao Departamento de Monitorização de Efeitos Secundários de Medicamentos da Agência Reguladora de Medicamentos. Endereço: Al. Jerozolimskie 181 C, 02-222 Warszawa, Tel.: +48 22 49 21 301, Fax: +48 22 49 21 309, Website: https://smz.ezdrowie.gov.pl. Os efeitos secundários também podem ser notificados ao titular da autorização de comercialização. A notificação de efeitos secundários pode ajudar a obter mais informações sobre a segurança do medicamento.
5. Como conservar CLINIMIX
Conservar em local não acessível a crianças. Quando usado em lactentes e crianças abaixo de 2 anos de idade, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração (ver secção 2). Não use este medicamento após a data de validade impressa na etiqueta do saco e no pacote exterior (MM/AAAA). A data de validade é o último dia do mês indicado. Conservar em temperatura ambiente. Não congelar. Conservar no pacote exterior de cartão. Os medicamentos não devem ser eliminados na canalização ou nos contentores de resíduos domésticos. Deve perguntar ao farmacêutico como eliminar os medicamentos de que já não precisa. Essa ação ajudará a proteger o ambiente.
6. Conteúdo do pacote e outras informações
O que contém CLINIMIX N9G15E
Conteúdo de substâncias ativas em cada saco após a mistura do conteúdo de ambas as câmaras:
| Substâncias ativas | 1 l | 1,5 l | 2 l |
| 5,70 g 3,17 g 2,84 g 1,32 g 1,65 g 2,01 g 1,60 g (2,00 g) 1,10 g 1,54 g 1,87 g 1,38 g 1,16 g 0,50 g 0,11 g 1,60 g 2,16 g 2,61 g 1,12 g 0,51 g 75 g (83 g) 0,33 g | 8,54 g 4,75 g 4,25 g 1,98 g 2,48 g 3,02 g 2,39 g (2,99 g) 1,65 g 2,31 g 2,81 g 2,06 g 1,73 g 0,74 g 0,17 g 2,39 g 3,23 g 3,92 g 1,68 g 0,77 g 113 g (124 g) 0,50 g | 11,39 g 6,33 g 5,67 g 2,64 g 3,30 g 4,02 g 3,19 g (3,99 g) 2,20 g 3,08 g 3,74 g 2,75 g 2,31 g 0,99 g 0,22 g 3,19 g 4,31 g 5,22 g 2,24 g 1,02 g 150 g (165 g) 0,66 g |
Os outros componentes são:
- ácido acético, ácido clorídrico (para ajustar o pH da solução),
- água para injeção.
Como é CLINIMIX e que conteúdo tem o pacote
CLINIMIX é uma solução para infusão fornecida em um saco com duas câmaras, que é um saco plástico multicamada. A camada interna (em contato) do saco é feita de polímeros (mistura de copolímeros de poliolefinas), que são compatíveis com os componentes da solução e aditivos permitidos. As outras camadas são feitas de EVA (poli(etileno-acetato de vinila)) e copolímero. Antes da mistura do conteúdo das câmaras do saco, a solução de aminoácidos e a solução de glicose são claras, incolores ou ligeiramente amareladas. Após a mistura, a solução também é clara, incolor ou ligeiramente amarelada. Para proteger contra o oxigênio, o saco é colocado em um pacote protetor que contém um sachê que absorve oxigênio. Tamanhos do pacote: Sacos de 1000 ml - embalados em 8 unidades; Sacos de 1500 ml - embalados em 6 unidades; Sacos de 2000 ml - embalados em 4 unidades. Nem todos os tamanhos de pacotes precisam estar disponíveis.
Titular da autorização de comercialização
Baxter Polska Sp. z o.o., ul. Kruczkowskiego 8, 00-380 Warszawa
Fabricante
Baxter S.A., Boulevard René Branquart, 80, 7860 Lessines, Bélgica
Data da última revisão do folheto
...
Informações destinadas apenas ao pessoal médico especializado
1. COMPOSIÇÃO QUANTITATIVA
Após a mistura do conteúdo de ambas as câmaras, a composição da mistura para os tamanhos de sacos disponíveis é a seguinte:
2. DOSAGEM E MODO DE ADMINISTRAÇÃO
Administrar apenas após a quebra da solda que separa as duas câmaras e a mistura do conteúdo de ambas as câmaras.
Dosagem e velocidade de infusão
A dosagem deve ser adaptada às necessidades nutricionais e de líquidos individuais do doente, ao gasto energético, ao estado clínico, ao peso e à capacidade de metabolizar os componentes do medicamento CLINIMIX, bem como à energia ou proteína adicionais administradas por via oral ou enteral. Além disso, com o aumento da idade, a necessidade diária de líquidos, azoto e energia diminui constantemente. Em adultos, a necessidade é de 0,16 g de azoto/kg de peso corporal/dia (cerca de 1 g de aminoácidos/kg de peso corporal/dia) a 0,32 g de azoto/kg de peso corporal/dia (cerca de 2 g de aminoácidos/kg de peso corporal/dia).
| 1 l | 1,5 l | 2 l | |
| azoto (g) aminoácidos (g) glicose (g) | 4,6 28 75 | 6,8 41 113 | 9,1 55 150 |
| Valor energético total (kcal) Valor energético da glicose (kcal) | 410 300 | 615 450 | 820 600 |
| sódio (mmol) potássio (mmol) magnésio (mmol) cálcio (mmol) octanos (mmol) cloruros (mmol) fosfatos como HPO4 (mmol) | 35 30 2,5 2,3 50 40 15 | 53 45 3,8 3,4 75 60 23 | 70 60 5 4,5 100 80 30 |
| pH osmolalidade (mOsm/l) | 6 845 | ||
Em crianças abaixo de 2 anos de idade, a necessidade é de 0,16 g de azoto/kg de peso corporal/dia (cerca de 1,0 g de aminoácidos/kg de peso corporal/dia) a 0,40 g de azoto/kg de peso corporal/dia (cerca de 2,5 g de aminoácidos/kg de peso corporal/dia). Em adultos e doentes de 12 a 18 anos de idade, a necessidade de energia varia de 25 a 40 kcal/kg de peso corporal/dia, dependendo do estado nutricional do doente e do grau de catabolismo. Doentes abaixo de 12 anos de idade podem ter necessidades mais altas. Pode ocorrer situações clínicas em que os doentes necessitem de quantidades diferentes de nutrientes do que as presentes no medicamento CLINIMIX. Nesse caso, quaisquer ajustes na dose (volume) devem levar em conta o efeito resultante na dosagem de todos os outros nutrientes do medicamento CLINIMIX. A velocidade e o volume da infusão devem ser determinados pelo médico, com experiência em nutrição parenteral de crianças e terapia com líquidos intravenosos. Este produto não contém os aminoácidos cisteína e taurina, considerados condicionalmente essenciais para lactentes e crianças abaixo de 2 anos de idade. Este medicamento não é recomendado para recém-nascidos prematuros, a termo e crianças abaixo de 2 anos de idade. A velocidade de administração deve ser escolhida com base na dose, características da solução administrada, volume total de líquidos administrados em 24 horas e duração da infusão. A infusão deve durar mais de 8 horas. Geralmente, a velocidade de infusão é aumentada gradualmente durante a primeira hora, até um valor máximo de 3 ml/kg de peso corporal/hora, e a dose diária máxima é de 40 ml/kg de peso corporal/dia. Em crianças abaixo de 2 anos de idade, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração.
Modo de administração
Em crianças abaixo de 2 anos de idade, a solução (no saco e no conjunto de administração) deve ser protegida da luz até o final da administração.
Via de administração
A escolha da veia periférica ou central depende da osmolalidade final da mistura. Geralmente, aceita-se que as misturas com osmolalidade de até cerca de 800 mOsm/l podem ser administradas por veias periféricas, mas isso muda significativamente dependendo da idade, estado geral do doente, estado das veias periféricas, duração da infusão e composição do saco de nutrição.
3. PRECAUÇÕES E ADVERTÊNCIAS ESPECIAIS DE USO
USO
ADVERTÊNCIAS Foram relatados casos de reações de hipersensibilidade/reações à infusão com o uso de produtos CLINIMIX, incluindo hipotensão, hipertensão, cianose periférica, taquicardia, dispneia, vômitos, náuseas, urticária, erupções cutâneas, prurido, rubor, suor excessivo, febre e arrepios. Foram relatados casos de reações anafiláticas com o uso de outros produtos de nutrição parenteral. No início de cada infusão intravenosa, é necessário um controle clínico especial. Se ocorrerem sintomas incomuns, como reação de hipersensibilidade/reação à infusão, a infusão deve ser interrompida imediatamente. Em doentes alérgicos à zeína ou produtos de zeína, deve-se ter cuidado ao administrar soluções que contenham glicose, se administradas. Em doentes que recebem nutrição parenteral, foram relatados casos de formação de sedimento nos vasos pulmonares. Alguns casos resultaram em morte. O excesso de cálcio e fósforo aumenta o risco de formação de sedimento de fosfato de cálcio. Foram relatados casos de formação de sedimento mesmo na ausência de sais de fósforo na solução. Também foram relatados casos de formação de sedimento distante do filtro na linha de infusão e casos suspeitos de formação de sedimento in vivo. Pode ocorrer complicações clínicas associadas à formação de sedimento nos vasos pulmonares, como síndrome de dificuldade respiratória aguda, embolia pulmonar, pneumonite intersticial. Se ocorrerem sintomas de dificuldade respiratória aguda, a infusão deve ser interrompida e um exame médico deve ser realizado. Além do controle da solução, também deve-se verificar periodicamente o conjunto de infusão e o cateter para detectar a presença de sedimento. Em doentes com mais de 28 dias de vida (incluindo adultos), não deve ser administrado ceftriaxona juntamente com soluções intravenosas que contenham cálcio, incluindo o medicamento CLINIMIX N9G15E, pelo mesmo conjunto de infusão (por exemplo, por um conector em Y). Se o mesmo conjunto de infusão for usado para uma administração subsequente, deve ser completamente lavado com um líquido compatível entre as administrações. Infecções e sepsia podem ocorrer em doentes que recebem nutrição parenteral devido ao uso de cateteres intravenosos, cuidados inadequados com os cateteres ou soluções contaminadas. A imunossupressão e outros fatores, como hiperglicemia, desnutrição e/ou condição associada à doença subjacente, podem predispor os doentes a complicações infecciosas. O monitoramento frequente de sinais e resultados de exames laboratoriais para detectar febre/arrepios, leucocitose, complicações técnicas relacionadas ao acesso venoso e hiperglicemia pode ajudar no diagnóstico precoce de infecção. A frequência de ocorrência de complicações infecciosas pode ser reduzida aumentando a ênfase na utilização de técnicas assépticas durante a inserção e manutenção do cateter, bem como durante a preparação do produto para nutrição. A suplementação de doentes desnutridos graves pode levar a um conjunto de sintomas associados, caracterizados pela transferência de potássio, fósforo e magnésio para os fluidos intracelulares, pois o doente começa a predominar o metabolismo anabólico. Também pode ocorrer deficiência de tiamina e retenção de líquidos no organismo. O controle rigoroso e o aumento gradual da administração de nutrientes, evitando a superalimentação, podem prevenir essas complicações. Soluções hipertônicas administradas por via venosa periférica podem causar irritação venosa. A escolha da veia periférica ou central depende da osmolalidade final da mistura. Geralmente, aceita-se que as misturas com osmolalidade de até cerca de 800 mOsm/l podem ser administradas por veias periféricas, mas isso muda significativamente dependendo da idade, estado geral do doente, estado das veias periféricas, duração da infusão e composição do saco de nutrição. Não deve-se ligar os sacos em série para evitar embolia aérea causada pelo ar residual no primeiro saco. PRECAUÇÕES Antes de iniciar a infusão, deve-se corrigir as alterações graves do equilíbrio hidroeletrolítico, das condições de condução e dos distúrbios metabólicos graves. Se a quantidade de nutrientes administrados não for adaptada às necessidades do doente ou se a capacidade metabólica de qualquer um dos componentes nutricionais não for avaliada com precisão, podem ocorrer distúrbios metabólicos. Efeitos secundários metabólicos indesejados podem resultar da administração excessiva ou inadequada de nutrientes ou de uma composição inadequada de nutrientes adicionais em relação às necessidades do doente. O controle adequado durante o tratamento garante a avaliação frequente do estado clínico e exames laboratoriais. Devem incluir um ionograma e testes de função renal e hepática. Em doentes que recebem líquidos para nutrição parenteral, deve-se determinar e monitorar com precisão as necessidades de eletrólitos, especialmente quando se administram soluções que não contenham eletrólitos. A intolerância à glicose é uma complicação metabólica comum em doentes gravemente doentes. Como resultado da infusão, pode ocorrer hiperglicemia, glicosúria e síndrome hiperosmótica. Os níveis de glicose no sangue e na urina devem ser verificados rotineiramente, e a dose de insulina em doentes diabéticos deve ser ajustada adequadamente. Deve-se ter cuidado ao usar o produto em doentes com insuficiência renal, especialmente se houver hipercalemia, pois existe o risco de desenvolver ou agravar a acidose metabólica e a hiperazotemia, se não for realizada a remoção extrarrenal de produtos do metabolismo. Nesses doentes, deve-se monitorar com atenção o estado dos fluidos e eletrólitos. Em caso de insuficiência renal grave, deve-se preferir o uso de soluções de aminoácidos com composição especial. Deve-se ter cuidado ao administrar a solução CLINIMIX a doentes com insuficiência suprarrenal. Deve-se ter cuidado para evitar a sobrecarga do sistema circulatório, especialmente em doentes com edema pulmonar, insuficiência cardíaca compensada e descompensada. Durante o tratamento, deve-se monitorar o equilíbrio dos fluidos corporais. Em doentes com doença hepática na história ou insuficiência hepática, além dos testes hepáticos de rotina, deve-se prestar atenção à possibilidade de ocorrer hipermanemia. Em alguns doentes que recebem nutrição parenteral, foram relatados distúrbios hepáticos e biliares, incluindo colestase, esteatose, fibrose e cirrose hepática, que podem causar insuficiência hepática, bem como coledocolitíase e cálculos biliares. Acredita-se que a etiologia dessas doenças seja multifatorial e possa variar entre os doentes. Doentes que apresentem anormalidades nos resultados dos exames laboratoriais ou outros sinais de distúrbios hepáticos e biliares devem ser submetidos a um exame médico o mais breve possível para determinar a causa e iniciar o tratamento adequado. Em doentes que recebem soluções de aminoácidos, pode ocorrer um aumento dos níveis de amônia e hipermanemia. Em alguns doentes, isso pode indicar distúrbios metabólicos inatos de aminoácidos (ver secção 4.3 da Característica do Produto) ou insuficiência hepática. Os níveis de amônia no sangue devem ser medidos com frequência em crianças abaixo de 2 anos de idade para detectar hipermanemia, que pode indicar a presença de distúrbios inatos do metabolismo de aminoácidos. Dependendo da gravidade e etiologia, a hipermanemia pode exigir intervenção imediata. A infusão excessivamente rápida de aminoácidos pode causar náuseas, vômitos e arrepios. Nesses casos, a infusão deve ser interrompida imediatamente. Em princípio, deve-se ter cuidado ao escolher a dose em idosos, devido à maior frequência de distúrbios da função hepática, renal ou cardíaca, bem como doenças concomitantes e uso de outros medicamentos. Crianças e adolescentes
- Não foram realizados estudos em crianças e adolescentes.
- Quanto ao monitoramento da hipermanemia em crianças abaixo de 2 anos de idade, ver acima.
A exposição da solução de nutrição parenteral à luz, especialmente após a adição de oligoelementos e/ou vitaminas, pode ter um efeito adverso nos resultados clínicos em lactentes, devido à formação de peróxidos e outros produtos de degradação. Quando usado em lactentes e crianças abaixo de 2 anos de idade, o medicamento CLINIMIX deve ser protegido da luz até o final da administração.
4. INFORMAÇÕES PRÁTICAS SOBRE A PREPARAÇÃO DO PRODUTO PARA USO E ELIMINAÇÃO DE RESÍDUOS
DO PRODUTO
ATENÇÃO: Adminstrar apenas após a quebra da solda e a mistura do conteúdo de ambas as câmaras.

Quebrar o pacote protetor
na parte superior.
Remover a parte frontal do
pacote protetor para expor o
saco CLINIMIX.
Descartar o pacote protetor e o
sachê que absorve oxigênio.
Colocar o saco em uma superfície
plana, horizontal e limpa, com o
cabozinho para cima.

Levantar o saco segurando-o pelo
cabozinho para remover o líquido
da parte superior do saco. Torcer o
saco com as duas mãos, começando
da parte superior do saco, até quebrar
as soldas (aproximadamente até
metade do seu comprimento).
Misturar o conteúdo do saco,
virando-o pelo menos 3 vezes.
Suspender o saco. Remover a
capa plástica do local de injeção do
conjunto de administração.
Insira a agulha do conjunto de
administração com firmeza no local.
Não use se a solução não for clara,
incolor ou ligeiramente amarelada e
o recipiente estiver danificado.
Antes da administração, deve-se
levar o CLINIMIX à temperatura
ambiente.
O conteúdo de ambas as câmaras do
saco CLINIMIX pode ser misturado
antes ou após a remoção do pacote
protetor.
Apenas para uso único.
Não armazenar sacos parcialmente
usados e descartar todo o equipamento
após o uso.
Não reconectar sacos parcialmente
usados.
Não ligar os sacos em série.
Quando usado em lactentes e crianças
abaixo de 2 anos de idade, proteger
do luz até o final da administração.
A exposição do medicamento CLINIMIX
à luz, especialmente após a adição de
oligoelementos e/ou vitaminas, pode
levar à formação de peróxidos e outros
produtos de degradação, o que pode ser
minimizado protegendo-o da luz.
Aditivos
Doentes que recebem nutrição parenteral de longo prazo devem receber suplementos de gorduras, vitaminas e oligoelementos.
Se a adição de outros componentes for necessária, deve-se verificar a compatibilidade com a solução e controlar a estabilidade da mistura.
Todos os componentes adicionais podem ser adicionados apenas após a quebra da solda (após a mistura do conteúdo de ambas as câmaras). CLINIMIX pode ser suplementado com os seguintes componentes:
- emulsões de gordura (por exemplo, CLINOLEIC 20%) em uma quantidade de 50 a 250 ml por 1 litro de CLINIMIX.
| CLINIMIX N9G15E – 1 l + 100 ml de gordura 20% | CLINIMIX N9G15E – 1,5 l + 100 ml de gordura 20% | CLINIMIX N9G15E – 2 l + 250 ml de gordura 20% | |
| Azoto (g) Aminoácidos (g) Glicose (g) Gordura (g) | 4,6 28 75 20 | 6,8 41 113 20 | 9,1 55 150 50 |
| Valor energético total (kcal) Valor energético da glicose (kcal) Valor energético da gordura (kcal) Relação glicose/gordura | 610 300 200 60/40 | 815 450 200 69/31 | 1320 600 500 55/45 |
| Sódio (mmol) Potássio (mmol) Magnésio (mmol) Cálcio (mmol) Octanos (mmol) Cloruros (mmol) Fosfatos como HPO4 (mmol) | 35 30 2,5 2,3 50 40 15 | 53 45 3,8 3,4 75 60 23 | 70 60 5,0 4,5 100 80 30 |
| pH Osmolalidade (mOsm/l) | 6 795 | 6 810 | 6 785 |
- eletrólitos: por 1 litro de CLINIMIX
| Sódio | Potássio | Magnésio | Cálcio | |
| Concentração final | 80 mmol | 60 mmol | 5,6 mmol | 3,0 mmol |
- oligoelementos: por 1 litro de CLINIMIX
- vitaminas: por 1 litro de CLINIMIX
Dados sobre a estabilidade da mistura CLINIMIX com outras emulsões de gordura disponíveis e outros aditivos e componentes nutricionais estão disponíveis a pedido.
Se ocorrer uma separação leve da mistura, deve-se misturar completamente a solução com o componente adicionado, agitando suavemente, até obter uma emulsão homogênea antes da administração.
Os componentes adicionais devem ser adicionados em condições assépticas.
Os componentes adicionais podem ser adicionados usando uma seringa ou um conjunto de administração com agulha.
- Adição de componentes usando uma seringa ou um conjunto de administração com agulha: Prepare o porto de injeção (porto único, ver Figura 1 da Característica do Produto). Perfure o porto e injete. Misture a solução com os componentes adicionados.
Incompatibilidades
Os componentes adicionais podem causar incompatibilidades farmacêuticas. Deve-se consultar o titular da autorização de comercialização para obter informações detalhadas.
Se a adição de outros componentes for necessária, deve-se verificar a compatibilidade com a solução e controlar a estabilidade da mistura.
Devido ao risco de pseudoaglutinação, não deve-se administrar a solução antes, durante ou após a transfusão de sangue usando o mesmo conjunto de administração.
CLINIMIX N9G15E contém íons de cálcio, o que aumenta o risco de coagulação em preparações de sangue ou componentes de sangue conservados com citrato.
Assim como no caso de qualquer mistura para nutrição parenteral, deve-se prestar atenção à relação entre cálcio e fósforo. A adição excessiva de cálcio e fósforo, especialmente em forma de sais minerais, pode levar à formação de um sedimento de fosfato de cálcio.
| Concentração final | Cobre | 10 μmol | Zinco | 77 μmol |
| Cromo | 0,14 μmol | Manganês | 2,5 μmol | |
| Flúor | 38 μmol | Cobalto | 0,0125 μmol | |
| Selênio | 0,44 μmol | Molibdênio | 0,13 μmol | |
| Iodo | 0,5 μmol | Ferro | 10 μmol |
| Concentração final | Vitamina A | 1750 UI | Biotina | 35 μg |
| Vitamina B6 | 2,27 mg | Vitamina B1 | 1,76 mg | |
| Vitamina D | 110 UI | Ácido fólico | 207 μg | |
| Vitamina B12 | 3,0 μg | Vitamina B2 | 2,07 mg | |
| Vitamina E | 5,1 mg | Vitamina C | 63 mg | |
| Vitamina PP | 23 mg | Vitamina B5 | 8,63 mg | |
| Vitamina K | 75 μg |
Assim como no caso de qualquer solução para infusão que contenha cálcio, a administração concomitante de ceftriaxona e CLINIMIX N9G15E é contraindicada em recém-nascidos (≤ 28 dias de vida), mesmo que se usem conjuntos de infusão separados (devido ao risco de morte devido à formação de sais de cálcio de ceftriaxona na circulação do recém-nascido). Em doentes com mais de 28 dias de vida (incluindo adultos), não deve-se administrar ceftriaxona juntamente com soluções intravenosas que contenham cálcio, incluindo o medicamento CLINIMIX N9G15E, pelo mesmo conjunto de infusão (por exemplo, por um conector em Y). Se o mesmo conjunto de infusão for usado para uma administração subsequente, deve ser completamente lavado com um líquido compatível entre as administrações.
5. PRAZO DE VALIDADE
2 anos, se armazenado no pacote protetor. Recomenda-se que o produto seja usado imediatamente após a quebra das soldas que separam as câmaras (ou seja, após a mistura do conteúdo de ambas as câmaras). No entanto, foi demonstrado que, após a mistura do conteúdo de ambas as câmaras (ou seja, após a quebra da solda interna que separa as câmaras), a mistura resultante mantém a estabilidade química e física por 7 dias a uma temperatura de 2°C a 8°C e, subsequentemente, por 48 horas a uma temperatura abaixo de 25°C. Se componentes adicionais forem introduzidos na mistura, do ponto de vista microbiológico, essa mistura deve ser usada imediatamente. Se a mistura não for usada imediatamente após a preparação e a suplementação não for realizada em condições controladas, validadas e assépticas, a responsabilidade pelo tempo e condições de armazenamento antes do uso cabe ao usuário. Esse tempo geralmente não deve exceder 24 horas a uma temperatura de 2°C a 8°C. Se, em casos excepcionais, for necessário armazenar a mistura pronta por um período mais longo, é possível contatar o fabricante, pois estão disponíveis dados sobre a estabilidade química e física por 7 dias a uma temperatura de 2°C a 8°C e, subsequentemente, por 48 horas a uma temperatura abaixo de 25°C. Baxter, Clinimix, ClinOleic são marcas registradas da Baxter International Inc.
- País de registo
- Requer receita médicaNão
- Fabricante
- ImportadorBaxter S.A.
- Esta informação é apenas para referência e não constitui aconselhamento médico. Consulte sempre um médico antes de tomar qualquer medicamento. A Oladoctor não se responsabiliza por decisões médicas baseadas neste conteúdo.
- Alternativas a Clinimix N9g15eForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médicaForma farmacêutica: Solução, -Substância ativa: combinationsNão requer receita médica
Alternativas a Clinimix N9g15e noutros países
As melhores alternativas com o mesmo princípio ativo e efeito terapêutico.
Alternativa a Clinimix N9g15e em Espanha
Médicos online para Clinimix N9g15e
Avaliação de posologia, efeitos secundários, interações, contraindicações e renovação da receita de Clinimix N9g15e – sujeita a avaliação médica e regras locais.














