ICATIBANTO HIKMA 30 mg Injectable Solution in Pre-filled Syringe

How to use ICATIBANTO HIKMA 30 mg Injectable Solution in Pre-filled Syringe
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the User
Icatibant Hikma 30 mg solution for injection in pre-filled syringe EFG
Read all of this leaflet carefully before you start using this medicine because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor or pharmacist.
- This medicine has been prescribed for you only. Do not pass it on to others. It may harm them, even if their signs of illness are the same as yours.
- If you get any side effects, talk to your doctor or pharmacist. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the pack
- What is Icatibant Hikma and what is it used for
- What you need to know before you use Icatibant Hikma
- How to use Icatibant Hikma
- Possible side effects
- Storing Icatibant Hikma
- Contents of the pack and other information
1. What is Icatibant Hikma and what is it used for
Icatibant Hikma contains the active substance icatibant.
Icatibant is used to treat acute attacks of hereditary angioedema (HAE) in adults, adolescents, and children aged 2 years and older.
In HAE, levels of a substance called bradykinin increase in the blood, leading to symptoms such as swelling, pain, nausea, and diarrhea.
Icatibant blocks the action of bradykinin and therefore reduces the progression of symptoms.
2. What you need to know before you use Icatibant Hikma
Do not use Icatibant Hikma
- if you are allergic to icatibant or any of the other ingredients of this medicine (listed in section 6).
Warnings and precautions
Consult your doctor before starting treatment with this medicine:
- If you have coronary heart disease (reduced blood flow to the heart).
- If you have recently had a stroke.
Side effects related to icatibant are similar to the symptoms of your own disease. Consult your doctor immediately if you notice that the symptoms of the attack worsen after you have been given icatibant.
In addition:
- You or your caregiver should learn the technique for administering subcutaneous injections (under the skin) before you self-administer or your caregiver administers icatibant to you.
- Immediately after self-administering icatibant or after your caregiver has administered it to you while you are experiencing a laryngeal attack (obstruction of the upper airway), you should seek medical attention at a medical institution.
- If your symptoms do not resolve after a self-administered injection of icatibant or after an injection administered by your caregiver, you should consult your doctor about administering additional injections of icatibant. In adult patients, up to 2 additional injections can be administered within 24 hours.
Children and adolescents
Icatibant is not recommended for use in children under 2 years of age or weighing less than 12 kg, as it has not been studied in these patients.
Other medicines and Icatibant Hikma
Tell your doctor if you are taking, have recently taken, or might take any other medicines.
No interactions of icatibant with other medicines are known. If you are taking any medicine that is an angiotensin-converting enzyme inhibitor (e.g., captopril, enalapril, ramipril, quinapril, lisinopril) to lower blood pressure or for any other reason, inform your doctor before using icatibant.
Pregnancy and breastfeeding
If you are pregnant or breastfeeding, think you may be pregnant, or are planning to have a baby, ask your doctor for advice before taking this medicine.
If you are breastfeeding, you should not breastfeed your child for 12 hours after the last administration of icatibant.
Driving and using machines
Do not drive or use machines if you feel tired or dizzy as a result of the HAE attack or after using icatibant.
Icatibant Hikma contains sodium
This medicine contains less than 1 mmol of sodium (23 mg) per 3 ml, which is essentially "sodium-free".
3. How to use Icatibant Hikma
Follow the instructions for administration of this medicine exactly as told by your doctor. If you are unsure, consult your doctor again.
If you have never been administered icatibant before, the first dose of icatibant should always be injected by medical or nursing staff. Your doctor will discharge you when they consider it safe for you to go home. After discussing with your doctor or nurse and learning the technique for subcutaneous injections (under the skin), you or your caregiver can administer icatibant if you have an HAE attack. It is essential to inject icatibant subcutaneously (under the skin) as soon as you notice an angioedema attack. Healthcare staff will teach you and your caregiver how to safely inject icatibant 30 mg/3 ml, following the instructions in the package leaflet.
When and how often should you use Icatibant Hikma?
Your doctor has determined the exact dose of icatibant and will tell you how often to use it.
Adults
- The recommended dose of icatibant is one injection (3 ml, 30 mg) administered subcutaneously (under the skin) as soon as you notice the angioedema attack (e.g., with increased skin swelling, especially on the face and neck, or increased abdominal pain).
- If you do not notice an improvement in symptoms after 6 hours, you should seek medical advice about administering additional injections of icatibant. In adults, up to 2 additional injections can be administered within 24 hours.
- You should not receive more than 3 injections in a 24-hour period, and if you need more than 8 injections in a month, you should seek medical advice.
Children and adolescents from 2 to 17 years
- The recommended dose of icatibant is an injection of 1 ml up to a maximum of 3 ml, depending on body weight, administered subcutaneously (under the skin) as soon as symptoms of an angioedema attack appear (e.g., increased skin swelling, especially on the face and neck, or increased abdominal pain).
- Consult the section on instructions for use to see the dose you should inject.
- If you are unsure about the dose to inject, consult your doctor, pharmacist, or nurse.
- If your symptoms worsen or do not improve, you should seek medical advice immediately.
How should you administer Icatibant Hikma?
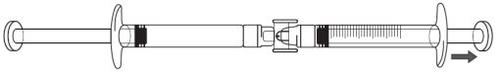
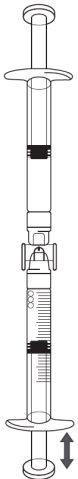
Icatibant is administered by subcutaneous injection (under the skin). Each syringe should only be used once.
Icatibant is injected with a short needle into the fatty tissue under the skin of the abdomen (belly). If you have any further questions on the use of this medicine, ask your doctor or pharmacist.
The following step-by-step instructions are intended for:
- self-administration (adults)
- administration by a caregiver or healthcare professional for adults, adolescents, or children over 2 years (weighing at least 12 kg).
The instructions include the following main steps:
- General information
2a) Preparation of the syringe for children and adolescents (2-17 years) weighing 65 kg or less
2b) Preparation of the syringe and needle for injection (all patients)
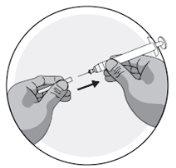
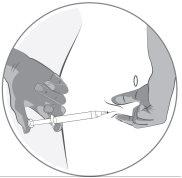
- Preparation of the injection site
- Injection of the solution
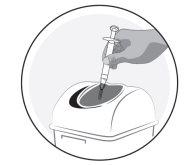
- Disposal of injection materials
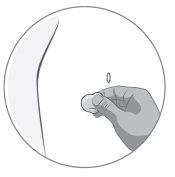
Step-by-step instructions for injection
1) General information |
|
2a) Preparation of the syringe for children and adolescents (2-17 years) weighing 65 kg or less: |
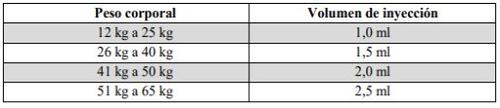
Important information for healthcare professionals and caregivers: When the dose is less than 30 mg (3 ml), the following equipment is needed to extract the correct dose (see information below):
The required injection volume in ml should be prepared in an empty 3 ml graduated syringe (see table below). Table 1: Dosing schedule for children and adolescents
Patients weighing more than 65 kgwill use the entire contents of the pre-filled syringe (3 ml). |
If you are unsure about the volume of solution to extract, consult your doctor, pharmacist, or nurse
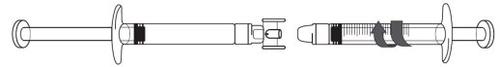
Transfer the icatibant solution to the graduated syringe:
|
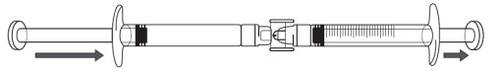
If there is air in the graduated syringe:
|
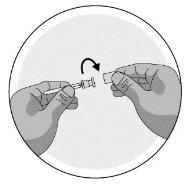
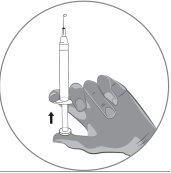
2b) Preparation of the syringe and needle for injection: All patients (adults, adolescents, and children) |
|
|
|
|
|
|
|
4. Possible side effects
Like all medicines, this medicine can cause side effects, although not everybody gets them.
Almost all patients who receive icatibant notice a reaction at the injection site (such as skin irritation, inflammation, pain, itching, redness of the skin, and burning). These effects are usually mild and improve without the need for any additional treatment.
Very common (may affect more than 1 in 10 people):
Additional reactions at the injection site (feeling of pressure, bruising, decreased sensitivity and/or numbness, increased skin rash with itching and heat).
Common (may affect up to 1 in 10 people):
Malaise
Headache
Dizziness
Fever
Itching
Rash
Redness of the skin
Abnormal liver function tests
Frequency not known (cannot be estimated from the available data):
Hives (urticaria)
Tell your doctor immediately if you notice that the symptoms of the attack worsen after you have been given icatibant 30 mg/3 ml.
If you experience side effects, talk to your doctor or pharmacist, even if they are not listed in this leaflet.
Reporting of side effects
If you experience any side effects, talk to your doctor or pharmacist. This includes any possible side effects not listed in this leaflet. You can also report side effects directly via the Spanish Medicines Monitoring System for Human Use: https://www.notificaram.es. By reporting side effects, you can help provide more information on the safety of this medicine.
5. Storing Icatibant Hikma
Keep this medicine out of the sight and reach of children.
Do not use this medicine after the expiry date which is stated on the carton after "EXP". The expiry date refers to the last day of that month.
Do not store above 30°C. Do not freeze.
Do not use this medicine if you notice that the syringe or needle packaging is damaged or if you notice visible signs of deterioration, such as if the solution is cloudy, contains floating particles, or has changed color.
Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of medicines no longer required. This will help protect the environment.
6. Container contents and additional information
Composition of Icatibant Hikma
The active ingredient is icatibant. Each pre-filled syringe contains 30 milligrams of icatibant (as icatibant acetate). The other components (excipients) are sodium chloride, glacial acetic acid, sodium hydroxide, and water for injectable preparations.
Appearance of the product and container contents
Icatibant Hikma is presented as a clear and colorless injectable solution in a 3 ml pre-filled glass syringe. The container includes a sterile subcutaneous needle.
Icatibant Hikma is available in a single-unit container with one pre-filled syringe and one needle, or in a multiple-unit container with three pre-filled syringes and three needles.
Only certain package sizes may be marketed.
Marketing authorization holder and manufacturer
Marketing authorization holder
Hikma Farmacêutica (Portugal) S.A.
Estrada do Rio da Mó, 8, 8A and 8B –
Fervença Terrugem SNT
2705-906
Portugal
Manufacturer
Universal Farma S.L.
Calle Dulcinea S/n
28805 Alcalá De Henares
Madrid
Spain
For further information about this medicinal product, please contact the local representative of the marketing authorization holder:
Hikma España, S.L.U.
Calle Anabel Segura nº11, Edificio A, planta 1ª, oficina 2
28108 - Alcobendas, Madrid
Spain
This medicinal product is authorized in the Member States of the European Economic Area under the following names:
Germany | Icatibant Hikma 30 mg solution for injection in a pre-filled syringe |
Austria | Icatibant Hikma 30 mg solution for injection in a pre-filled syringe |
Belgium | Icatibant Hikma 30 mg solution for injection in a pre-filled syringe |
Spain: | Icatibanto Hikma 30 mg solution for injection in a pre-filled syringe EFG |
Finland | Icatibant Universal Farma 30 mg solution for injection in a pre-filled syringe |
France | Icatibant Hikma 30 mg, solution for injection in a pre-filled syringe |
Hungary | Icatibant Universal Farma 30 mg solution for injection in a pre-filled syringe |
Italy: | Icatibant Hikma |
Netherlands: | Icatibant Hikma 30 mg solution for injection in a pre-filled syringe |
Portugal: | Icatibant Hikma |
Czech Republic: | Icatibant Universal Farma |
Romania | Icatibant Universal Farma 30 mg solution for injection in a pre-filled syringe |
Date of last revision of this leaflet:September 2024.
Detailed information on this medicinal product is available on the website of the Spanish Agency for Medicines and Health Products (AEMPS) http://www.aemps.gob.es
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to ICATIBANTO HIKMA 30 mg Injectable Solution in Pre-filled SyringeDosage form: INJECTABLE, 30 mgActive substance: icatibantManufacturer: Takeda Pharmaceuticals International Ag Ireland BranchPrescription requiredDosage form: INJECTABLE, 30 mgActive substance: icatibantManufacturer: Accord Healthcare S.L.U.Prescription requiredDosage form: INJECTABLE, 30 mgActive substance: icatibantManufacturer: Laboratoire AguettantPrescription required
Online doctors for ICATIBANTO HIKMA 30 mg Injectable Solution in Pre-filled Syringe
Discuss questions about ICATIBANTO HIKMA 30 mg Injectable Solution in Pre-filled Syringe, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions