EYDENZELT 40 mg/ml Injectable Solution in Pre-filled Syringe

How to use EYDENZELT 40 mg/ml Injectable Solution in Pre-filled Syringe
Translated with AI
This page provides general information and does not replace a doctor’s consultation. Always consult a doctor before taking any medication. Seek urgent medical care if symptoms are severe.
Show originalContents of the leaflet
Introduction
Package Leaflet: Information for the Patient
Eydenzelt 40 mg/ml Solution for Injection in Pre-filled Syringe
aflibercept
This medicinal product is subject to additional monitoring, which will allow for quick identification of new safety information. You can help by reporting any side effects you may get. The last section of this leaflet includes information on how to report side effects.
Read all of this leaflet carefully before you are given this medicine, because it contains important information for you.
- Keep this leaflet, you may need to read it again.
- If you have any further questions, ask your doctor.
- If you get any side effects, talk to your doctor. This includes any possible side effects not listed in this leaflet. See section 4.
Contents of the pack
- What is Eydenzelt and what is it used for
- What you need to know before you are given Eydenzelt
- How Eydenzelt will be given to you
- Possible side effects
- How to store Eydenzelt
- Contents of the pack and other information
1. What is Eydenzelt and what is it used for
Eydenzelt is a solution that is injected into the eye to treat certain eye diseases in adult patients, known as:
- neovascular (exudative) age-related macular degeneration (AMD)
- visual impairment due to macular edema following branch retinal vein occlusion (BRVO) or central retinal vein occlusion (CRVO)
- visual impairment due to diabetic macular edema (DME)
- visual impairment due to myopic choroidal neovascularization (mCNV).
Aflibercept, the active substance in Eydenzelt, blocks the activity of a group of factors known as vascular endothelial growth factor A (VEGF-A) and placental growth factor (PlGF).
In patients with exudative AMD and myopic CNV, when these factors are present in excess, they promote the formation of abnormal new blood vessels in the eye. These new blood vessels can cause leakage of blood components into the eye, resulting in damage to the tissues responsible for vision.
In patients with CRVO, there is a blockage of the main vein that carries blood from the retina. As a result, VEGF levels increase, causing fluid leakage into the retina and subsequent swelling of the macula (the part of the retina responsible for fine vision), known as macular edema.
When the macula becomes filled with fluid, central vision becomes blurred.
In patients with BRVO, there is a blockage of one or more branches of the main blood vessel that carries blood from the retina. As a result, VEGF levels increase, causing fluid leakage into the retina and subsequent swelling of the macula.
Diabetic macular edema is a swelling of the retina that occurs in patients with diabetes due to leakage of fluid from the blood vessels in the macula. The macula is the part of the retina responsible for fine vision. When the macula becomes swollen with fluid, central vision becomes blurred.
Aflibercept has been shown to stop the growth of abnormal new blood vessels in the eye that often bleed or leak fluid. Eydenzelt may help to stabilize and, in many cases, improve vision loss caused by exudative AMD, BRVO, CRVO, DME, and myopic CNV.
2. What you need to know before you are given Eydenzelt
You should not be given Eydenzelt
- if you are allergicto aflibercept or any of the other ingredients of this medicine (listed in section 6)
- if you have an active infection or suspect that you may have an infection in or around the eye (ocular or periocular infection)
- if you have severe inflammation of the eye (indicated by pain or redness).
Warnings and precautions
Tell your doctor before you are given Eydenzelt:
- If you have glaucoma.
- If you have a history of seeing flashes of light or floaters, or if you suddenly experience an increase in the size and number of floaters.
- If you have had surgery or are scheduled to have surgery on your eye within the previous 4 weeks or the next 4 weeks.
- If you have a severe form of BRVO or CRVO (ischemic BRVO or CRVO), treatment with Eydenzelt is not recommended.
Additionally, it is important that you know that:
- The safety and efficacy of Eydenzelt when administered in both eyes at the same time have not been studied, and if used in this way, it may increase the risk of side effects.
- Eydenzelt injections may cause an increase in pressure inside the eye (intraocular pressure) in some patients within 60 minutes after injection. Your doctor will monitor you after each injection.
- If you develop an infection or inflammation inside the eye (endophthalmitis) or other complications, you may notice pain or increased discomfort in the eye, worsening of redness, blurred or decreased vision, and increased sensitivity to light. It is essential that any symptoms that appear are diagnosed and treated as soon as possible.
- Your doctor will check if you have other risk factors that may increase the likelihood of a tear or detachment of the posterior layers of the eye (retinal tear or detachment, or retinal pigment epithelial tear or detachment), in which case Eydenzelt will be administered with caution.
- Eydenzelt should not be used during pregnancy, unless the potential benefit outweighs the potential risk to the fetus.
- Women of childbearing potential should use effective contraceptive methods during treatment and for at least 3 months after the last injection of Eydenzelt.
The systemic use of VEGF inhibitors, substances similar to those contained in Eydenzelt, is potentially associated with an increased risk of blood clots blocking blood vessels (arterial thromboembolic events) that can lead to a heart attack or stroke. After injection of Eydenzelt into the eye, there is a theoretical risk that these events may occur. Data on the safety of treatment in patients with BRVO, CRVO, DME, and myopic CNV who have had a stroke, transient ischemic attack, or myocardial infarction in the last 6 months are limited. If any of these apply to you, Eydenzelt will be administered with caution.
Experience is limited in the treatment of:
- Patient with DME due to type 1 diabetes.
- Diabetic patients with very high average blood sugar levels (HbA1c above 12%).
- Diabetic patients with a diabetic eye disease known as proliferative diabetic retinopathy.
There is no experience in the treatment of:
- Patient with acute infections.
- Patient with other eye diseases such as retinal detachment or macular hole.
- Diabetic patients with uncontrolled hypertension.
- Non-Asian patients with myopic CNV.
- Patient who have been previously treated for myopic CNV.
- Patient with damage outside the central part of the macula (extrafoveal lesions) due to myopic CNV.
If any of the above applies to you, your doctor will take into account this lack of information when treating you with Eydenzelt.
Children and adolescents
The use of Eydenzelt has not been studied in children and adolescents under 18 years of age.
Other medicines and Eydenzelt
Tell your doctor if you are using, have recently used, or might use any other medicines.
Pregnancy and breastfeeding
- Women of childbearing potential should use effective contraceptive methods during treatment and for at least 3 months after the last injection of Eydenzelt.
- There is no experience with the use of Eydenzelt in pregnant women. Eydenzelt should not be used during pregnancy unless the potential benefit outweighs the potential risk to the fetus. If you are pregnant or plan to become pregnant, tell your doctor before treatment with Eydenzelt.
- Small amounts of Eydenzelt may pass into breast milk. The effects on newborns/infants are unknown. Eydenzelt is not recommended during breastfeeding. If you are breastfeeding, tell your doctor before treatment with Eydenzelt.
Driving and using machines
After injection of Eydenzelt, you may experience some temporary visual disturbances. Do not drive or use machines while these disturbances last.
Eydenzelt contains
- less than 1 mmol of sodium (23 mg) per dose; this is essentially "sodium-free".
- 0.015 mg of polysorbate 20 in each 0.05 ml dose, equivalent to 0.3 mg/ml. Polysorbates may cause allergic reactions. Tell your doctor if you have any known allergies.
3. How Eydenzelt will be given to you
Eydenzelt will be given to you by a doctor with experience in giving eye injections, under aseptic conditions (clean and sterile).
The recommended dose is 2 mg of aflibercept (0.05 ml).
Eydenzelt is given as an injection into the eye (intravitreal injection).
Before the injection, your doctor will use an antiseptic eye wash to carefully clean your eye to prevent infection. Your doctor will also give you a local anesthetic to reduce or prevent any pain you may feel with the injection.
Exudative AMD
Patient with exudative AMD will be treated with one injection per month for the first three doses, followed by another injection after two months.
Your doctor will then decide if the treatment interval between injections can be maintained every two months or gradually extended to intervals of 2 or 4 weeks if your disease has stabilized.
If your disease worsens, the interval between injections may be shortened.
You do not need to visit your doctor between injections, unless your doctor thinks it is necessary or you experience any problems.
Macular edema secondary to retinal vein occlusion (branch or central)
Your doctor will determine the most suitable treatment schedule for you. Your treatment will start with a series of Eydenzelt injections given once a month.
The interval between two injections should not be less than one month.
Your doctor may decide to stop treatment with Eydenzelt if you do not benefit from continued treatment.
Treatment will continue with one injection per month until your disease has stabilized. You may need three or more monthly injections.
Your doctor will monitor your response to treatment and may continue treatment, gradually increasing the interval between injections to stabilize your disease. If your disease worsens with a longer treatment interval, your doctor will reduce the interval between injections.
Depending on your response to treatment, your doctor will decide on the follow-up and treatment schedule.
Diabetic macular edema (DME)
Patient with DME will be treated with one injection per month for the first five consecutive doses, and then one injection every two months.
The interval between treatments may be maintained every two months or adjusted according to your disease, based on the examination by your doctor. Your doctor will decide on the follow-up visit schedule.
Your doctor may decide to stop treatment with Eydenzelt if you do not benefit from continued treatment.
Myopic choroidal neovascularization (mCNV)
Patient with mCNV will be treated with a single injection. You will only receive additional injections if your doctor's examinations show that your disease has not improved.
The interval between two injections should not be less than one month.
If your disease disappears and then recurs, your doctor may restart treatment.
Your doctor will decide on the follow-up schedule.
Detailed instructions for use are presented at the end of this leaflet in "How to prepare and administer Eydenzelt to adults".
If you miss a dose of Eydenzelt
Make a new appointment to be examined and given the injection.
Stopping treatment with Eydenzelt
Talk to your doctor before stopping treatment.
If you have any further questions on the use of this medicine, ask your doctor.
4. Possible Adverse Effects
Like all medicines, this medicine can cause adverse effects, although not all people suffer from them.
Potentially, allergic reactions(hypersensitivity) may occur. These can be serious and require immediate contact with your doctor.
With the administration of Eydenzelt, some adverse effects that affect the eyes may occur due to the injection procedure. Some may be serious, including blindness, a severe infection or inflammation inside the eye(endophthalmitis), detachment, tear, or hemorrhage of the light-sensitive layer at the back of the eye(retinal detachment or tear), clouding of the lens(cataract), bleeding in the eye(vitreous hemorrhage), detachment of the gel-like substance inside the eye from the retina(vitreous detachment), and increased pressure inside the eye(see section 2). These serious eye-related adverse effects occurred in less than 1 in 1,900 injections during clinical trials.
If you notice a sudden decrease in vision or an increase in pain and redness in the eye after injection, consult your doctor immediately.
List of Reported Adverse Effects
The following is a list of adverse effects reported as possibly related to the injection procedure or the medicine. You should not be alarmed, as you may not experience any of them. Always consult your doctor about any suspected adverse effect.
Very Common Adverse Effects(may affect more than 1 in 10 people):
- vision impairment
- bleeding in the back of the eye (retinal hemorrhage)
- blood in the eye due to bleeding from small blood vessels in the outer layers of the eye
- eye pain
Common Adverse Effects(may affect up to 1 in 10 people):
- detachment or tear of one of the layers in the back of the eye that produces flashes of light with floating spots that may progress to vision loss
(retinal pigment epithelial tear/detachment, retinal tear/detachment)
- *Adverse effects known to be associated with exudative age-related macular degeneration; observed only in patients with exudative age-related macular degeneration.
- retinal degeneration (causing vision disturbances)
- bleeding in the eye (vitreous hemorrhage)
- certain forms of clouding of the lens (cataract)
- damage to the outer layer of the eyeball (cornea)
- increased pressure inside the eye
- floaters in the vision (vitreous floaters)
- detachment of the gel-like substance inside the eye from the retina (vitreous detachment, resulting in flashes of light with floaters)
- sensation of having something in the eye
- increased tear production
- eyelid swelling
- bleeding at the injection site
- eye redness
Uncommon Adverse Effects(may affect up to 1 in 100 people):
- allergic reactions (hypersensitivity)**
- **Allergic reactions were reported as rash, itching (pruritus), hives (urticaria), and some cases of severe allergic reactions (anaphylactic/anaphylactoid).
- inflammation or severe infection inside the eye (endophthalmitis)
- inflammation of the iris or other parts of the eye (iritis, uveitis, iridocyclitis, cells in the anterior chamber)
- abnormal sensation in the eye
- irritation of the eyelid
- swelling of the outer layer of the eyeball (cornea)
Rare Adverse Effects(may affect up to 1 in 1,000 people)
- blindness
- clouding of the lens due to injury (traumatic cataract)
- inflammation of the gel-like substance inside the eye
- pus in the eye
Frequency Not Known(cannot be estimated from the available data):
- inflammation of the white part of the eye associated with redness and pain (scleritis)
In clinical trials, an increased incidence of bleeding from small blood vessels in the outer layers of the eye (conjunctival hemorrhage) was observed in patients with exudative age-related macular degeneration who were receiving anticoagulant treatment. This increased incidence was comparable in patients treated with ranibizumab and aflibercept.
The use of VEGF inhibitors systemically, substances similar to those contained in Eydenzelt, is potentially related to the risk of blood clots that block blood vessels (arterial thromboembolic events) that can cause a heart attack or embolism. There is a theoretical risk that this type of event may occur after injection of Eydenzelt into the eye.
As with all therapeutic proteins, there is a possibility of an immune reaction (antibody formation) with Eydenzelt.
Reporting of Adverse Effects
If you experience any type of adverse effect, consult your doctor, even if it is a possible adverse effect that is not listed in this leaflet. You can also report them directly through the national reporting system included in Appendix V. By reporting adverse effects, you can contribute to providing more information on the safety of this medicine.
5. Storage of Eydenzelt
- Keep this medicine out of the sight and reach of children.
- Do not use this medicine after the expiration date stated on the carton and label after "EXP". The expiration date is the last day of the month indicated.
- Store in a refrigerator (between 2 °C - 8 °C). Do not freeze.
- The unopened blister pack can be stored outside the refrigerator below 25 °C for a maximum of 24 hours.
- Store in the original packaging to protect it from light.
- Medicines should not be disposed of via wastewater or household waste. Ask your pharmacist how to dispose of the packaging and
6. Container Contents and Additional Information
Eydenzelt Composition
- The active ingredient is: aflibercept. A prefilled syringe contains an extractable volume of at least 0.09 ml, equivalent to at least 3.6 mg of aflibercept. A prefilled syringe provides a dose of 2 mg of aflibercept in 0.05 ml.
- The other components are: polysorbate 20 (E 432), histidine (for pH adjustment), histidine monohydrochloride monohydrate (for pH adjustment), sodium chloride, trehalose, water for injectable preparations.
See "Eydenzelt contains" in section 2 for more information.
Product Appearance and Container Contents
Eydenzelt is an injectable solution (injectable) in a prefilled syringe. The solution is transparent to slightly opalescent and colorless to very pale yellowish-brown.
Container with 1 prefilled syringe.
Marketing Authorization Holder
Celltrion Healthcare Hungary Kft.
1062 Budapest
Váci út 1-3. WestEnd Office Building B tower
Hungary
Manufacturer
Nuvisan France SARL
2400, Route des Colles,
06410, Biot,
France
Midas Pharma GmbH
Rheinstr. 49,
55218 Ingelheim,
Germany
KYMOS S.L.
Ronda Can Fatjó, 7B.
08290 Cerdanyola del Vallès,
Barcelona,
Spain
You can request more information about this medicine by contacting the local representative of the marketing authorization holder:
België/Belgique/Belgien Celltrion Healthcare Belgium BVBA Tél/Tel: + 32 1 528 7418 | Lietuva Celltrion Healthcare Hungary Kft. Tel.: +36 1 231 0493 |
| Luxembourg/Luxemburg Celltrion Healthcare Belgium BVBA Tél/Tel: + 32 1 528 7418 |
Ceská republika Celltrion Healthcare Hungary Kft. Tel: +36 1 231 0493 | Magyarország Celltrion Healthcare Hungary Kft. Tel.: +36 1 231 0493 |
Danmark Celltrion Healthcare Denmark ApS Tlf: +45 3535 2989 | Malta Mint Health Ltd. Tel: +356 2093 9800 |
Deutschland Celltrion Healthcare Deutschland GmbH Tel: +49 303 464 941 50 | Nederland Celltrion Healthcare Netherlands B.V. Tel: + 31 20 888 7300 |
Eesti Celltrion Healthcare Hungary Kft. Tel: +36 1 231 0493 | Norge Celltrion Healthcare Norway AS [email protected] |
España CELLTRION FARMACEUTICA (ESPAÑA) S.L. Tel: +34 910 498 478 | Österreich Astro-Pharma GmbH Tel: +43 1 97 99 860 |
Ελλάδα ΒΙΑΝΕΞ Α.Ε. Τηλ: +30 210 8009111 - 120 | Polska Celltrion Healthcare Hungary Kft. Tel.: +36 1 231 0493 |
France Celltrion Healthcare France SAS Tél.: +33 (0)1 71 25 27 00 | Portugal CELLTRION PORTUGAL, UNIPESSOAL LDA Tel: +351 21 936 8542 |
Hrvatska Oktal Pharma d.o.o. Tel: +385 1 6595 777 | România Celltrion Healthcare Hungary Kft. Tel: +36 1 231 0493 |
Ireland Celltrion Healthcare Ireland Limited Tel: +353 1 223 4026 | Slovenija OPH Oktal Pharma d.o.o. Tel.: +386 1 519 29 22 |
Ísland Celltrion Healthcare Hungary Kft. Sími: +36 1 231 0493 | Slovenská republika Celltrion Healthcare Hungary Kft. Tel: +36 1 231 0493 |
Italia Celltrion Healthcare Italy S.R.L. Tel: +39 0247927040 | Suomi/Finland Celltrion Healthcare Finland Oy. Puh/Tel: +358 29 170 7755 |
Κύπρος C.A. Papaellinas Ltd Τηλ: +357 22741741 | Sverige Celltrion Sweden AB [email protected] |
Latvija Celltrion Healthcare Hungary Kft. Talr.: +36 1 231 0493 |
Date of Last Revision of this Leaflet:
Detailed information on this medicine is available on the European Medicines Agency website: https://www.ema.europa.eu
This information is intended for healthcare professionals only:
How to Prepare and Administer Eydenzelt
The prefilled syringe should be used for the treatment of one eye only. Do not open the blister with the sterile prefilled syringe outside the clean room.
The prefilled syringe contains more than the recommended dose of 2 mg of aflibercept (equivalent to 0.05 ml). The excess volume should be eliminated before administration.
Before administration, the solution should be visually inspected for the presence of particles and/or a change in color or any change in physical appearance. If you observe any of these, do not use the medicine.
The unopened blister can be stored outside the refrigerator at a temperature below 25 °C for a maximum of 24 hours. After opening the blister, proceed under aseptic conditions.
For intravitreal injection, a 30 G x ½ inch (1.27 cm) injection needle should be used.
Prefilled Syringe Instructions:
To prepare the prefilled syringe for administration, follow all the steps indicated below.
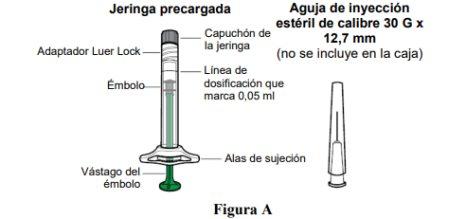
Materials: 1 prefilled syringe
Materials not included:
- 30 G x 12.7 mm injection needle
- Gather the materials.
Using aseptic technique, gather the materials and place them on a clean, flat surface.
- Open the box.
When you are ready to administer Eydenzelt, open the box and remove the sterile blister. Carefully peel off the blister's foil to avoid compromising the sterility of its contents.
- Do notremove the prefilled syringe from the sterile blister until you are ready to attach the injection needle.
- Do notuse this medicine if the expiration date has passed.
- Do notopen the blister of the sterile prefilled syringe outside the clean room where the medicine will be administered.
- Remove the prefilled syringe.
Using aseptic technique, remove the prefilled syringe from the sterile blister.
- Inspect the prefilled syringe and the medicine.
4a. Inspect the prefilled syringe and check that it is not damaged and that the syringe cap is attached to the Luer Lock adapter.
- Do notuse the prefilled syringe if any of its components are damaged or if the syringe cap is not attached to the Luer Lock adapter.
4b. Inspect the medicine and confirm that the solution is transparent to slightly opalescent, colorless to very pale yellowish-brown, and that it does not contain particles.
- Do not use this medicine if it contains visible particles, is cloudy, or has changed color.
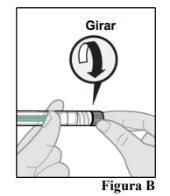
To remove the syringe cap, hold the prefilled syringe with one hand and twist the syringe cap with the other while holding it between your index finger and thumb (see Figure B).
|
|
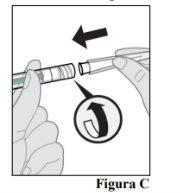
Using aseptic technique, firmly attach the 30 G x 12.7 mm injection needle to the Luer Lock adapter on the end of the prefilled syringe with a twisting motion (see Figure C). |
|
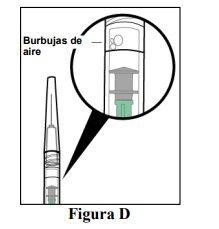
- Check that it does not contain air bubbles.
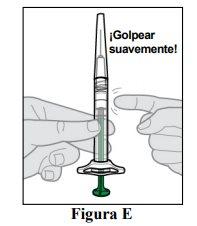
Hold the prefilled syringe with the needle pointing upwards and check that it does not contain air bubbles (see Figure D). If you observe air bubbles, gently tap the prefilled syringe with your finger until the air bubbles rise to the top (see Figure E).
|
|
- Eliminate air bubbles and set the dose.
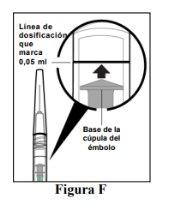
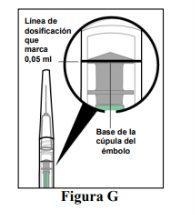
To eliminate all air bubbles and expel excess medicine, slowly press the plunger rod until the base of the plunger's dome (see Figure F) aligns with the dosing line on the prefilled syringe's cylinder (equivalent to 0.05 ml, i.e., 2 mg of aflibercept) (see Figure G).
Note:This exact positioning of the plunger is very important, as incorrect positioning may result in administering a dose that is greater than or less than the recommended dose.
|
|
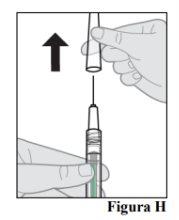
When you are ready to administer Eydenzelt, remove the plastic needle cap (see Figure H). |
|
- When ready, administer the intravitreal injection.
The intravitreal injection procedure should be performed under controlled aseptic conditions, including surgical hand washing, use of sterile gloves, a sterile surgical drape, and a sterile blepharostat (or equivalent). Adequate anesthesia and a broad-spectrum topical microbicide should be administered before injection.
Each sterile prefilled syringe should be used exclusively for the treatment of one eye only. If it is necessary to treat the contralateral eye, a new sterile prefilled syringe should be used and a new field, syringe, gloves, surgical drapes, blepharostat, filter, and injection needles should be used to administer Eydenzelt in the contralateral eye.
Press the plunger rod carefully and with constant pressure to administer the injection.
- Do notapply additional pressure once the plunger rod has reached the bottom of the prefilled syringe. You may observe a small residual volume in the prefilled syringe after injecting a full dose. This is normal.
- Do notadminister any residual solution volume that may remain in the prefilled syringe.
- The prefilled syringe is for single use.
Withdrawing multiple doses from a prefilled syringe may increase the risk of contamination and subsequent infection. Disposal of unused medicine and all materials that have come into contact with it should be carried out in accordance with local regulations.
- Monitor the patient after injection.
Immediately after intravitreal injection, patients should be monitored to detect an elevation in intraocular pressure. Adequate monitoring may consist of checking the perfusion of the optic nerve head or performing tonometry. If necessary, a sterile paracentesis needle should be available.
After intravitreal injection, patients and/or caregivers should be instructed to immediately report any symptoms that suggest endophthalmitis or retinal detachment (e.g., eye pain, eye redness, photophobia, or blurred vision).
- Country of registration
- Active substance
- Prescription requiredYes
- Manufacturer
- This information is for reference only and does not constitute medical advice. Always consult a doctor before taking any medication. Oladoctor is not responsible for medical decisions based on this content.
- Alternatives to EYDENZELT 40 mg/ml Injectable Solution in Pre-filled SyringeDosage form: INJECTABLE, 40 mg/mlActive substance: afliberceptManufacturer: Sandoz GmbhPrescription requiredDosage form: INJECTABLE, 40 mg/mlActive substance: afliberceptManufacturer: Sandoz GmbhPrescription requiredDosage form: INJECTABLE, 114.3 mg/mlActive substance: afliberceptManufacturer: Bayer AgPrescription required
Online doctors for EYDENZELT 40 mg/ml Injectable Solution in Pre-filled Syringe
Discuss questions about EYDENZELT 40 mg/ml Injectable Solution in Pre-filled Syringe, including use, safety considerations and prescription review, subject to medical assessment and local regulations.
Frequently Asked Questions