ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃ

Zapytaj lekarza o receptę na ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃ

Jak stosować ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃ
Wprowadzenie
Charakterystyka produktu: informacje dla użytkownika
ADZYNMA 500UI proszek i rozpuszczalnik do roztworu do wstrzykiwań
ADZYNMA 1500UI proszek i rozpuszczalnik do roztworu do wstrzykiwań
rADAMTS13
Ten lek podlega dodatkowemu monitorowaniu, co ułatwi wykrycie nowych informacji o jego bezpieczeństwie. Możesz przyczynić się do tego, zgłaszając wszelkie niepożądane działania, których doświadczasz. Część końcowa sekcji 4 zawiera informacje o tym, jak zgłaszać te niepożądane działania.
Przeczytaj całą ulotkę uważnie przed rozpoczęciem stosowania tego leku, ponieważ zawiera ważne informacje dla Ciebie.
- Zachowaj tę ulotkę, ponieważ może być konieczne ponowne jej przeczytanie.
- Jeśli masz jakieś wątpliwości, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką.
- Ten lek został przepisany wyłącznie Tobie i nie powinieneś go podawać innym osobom, nawet jeśli mają takie same objawy, ponieważ może im zaszkodzić.
- Jeśli doświadczasz niepożądanych działań, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką, nawet jeśli są to niepożądane działania, które nie są wymienione w tej ulotce. Zobacz sekcję 4.
Zawartość ulotki
- 1. Co to jest ADZYNMA i w jakim celu się go stosuje
- Co należy wiedzieć przed rozpoczęciem stosowania ADZYNMA
- Jak stosować ADZYNMA
- Mogące wystąpić niepożądane działania
- Przechowywanie ADZYNMA
- Zawartość opakowania i dodatkowe informacje
- Instrukcje stosowania
1. Co to jest ADZYNMA i w jakim celu się go stosuje
ADZYNMA zawiera substancję czynną rADAMTS13, syntetyczną kopię naturalnej enzymu (białka) ADAMTS13. Osoby z wrodzoną małopłytkowością zakrzepową (PTT) nie mają tego enzymu.
Wrodzona małopłytkowość zakrzepowa jest bardzo rzadkim, dziedzicznym zaburzeniem hematologicznym, które powoduje tworzenie się skrzepów krwi w małych naczyniach krwionośnych. Skrzepy te mogą zablokować przepływ krwi i tlenu do narządów, co prowadzi do mniejszej liczby płytek krwi (składników krwi, które przyczyniają się do jej krzepnięcia) we krwi.
Wrodzona małopłytkowość zakrzepowa jest spowodowana brakiem enzymu ADAMTS13 we krwi. ADAMTS13 przyczynia się do zapobiegania tworzeniu się skrzepów krwi przez rozkładanie dużych cząsteczek zwanych czynnikiem von Willebranda (VWF). Gdy cząsteczki VWF są zbyt duże, mogą powodować niebezpieczne skrzepy krwi. ADZYNMA stosuje się w celu uzupełnienia poziomu ADAMTS13, co pomaga w rozkładaniu tych dużych cząsteczek na mniejsze. To zmniejsza prawdopodobieństwo tworzenia się skrzepów krwi i może zapobiec zbyt niskiej liczbie płytek krwi u osób z PTT.
2. Co należy wiedzieć przed rozpoczęciem stosowania ADZYNMA
Nie stosuj ADZYNMA
- Jeśli miałeś ciężkie lub potencjalnie śmiertelne reakcje alergiczne na Radamts13 lub którykolwiek z pozostałych składników tego leku (wymienionych w sekcji 6).
Ostrzeżenia i środki ostrożności
Skonsultuj się z lekarzem, farmaceutą lub pielęgniarką przed rozpoczęciem stosowania ADZYNMA.
Reakcje alergiczne
Istnieje ryzyko wystąpienia reakcji nadwrażliwości typu alergicznego na ADZYNMA. Twój lekarz powinien poinformować Cię o objawach natychmiastowych ciężkich reakcji alergicznych, takich jak:
- szybka akcja serca
- ucisk w klatce piersiowej
- świsty i/lub nagłe trudności w oddychaniu
- niskie ciśnienie krwi
- swędzenie, pokrzywka i zaczerwienienie skóry
- katar i zatkanie nosa
- zaczerwienienie oczu
- kichanie
- szybkie obrzmienie pod skórą w okolicach takich jak twarz, gardło, ramiona i nogi
- zmęczenie
- mdłości (uczucie choroby)
- wymioty
- uczucie drętwienia, mrowienia, bólu
- niepokój
- anafilaksja (ciężka reakcja alergiczna, która może powodować trudności w połykaniu i/lub oddychaniu oraz zaczerwienienie lub obrzmienie twarzy i/lub rąk).
Jeśli masz którykolwiek z tych objawów, twój lekarz zdecyduje, czy leczenie ADZYNMA powinno być przerwane, i zapewni Ci niezbędne leki do leczenia reakcji alergicznej. Ciężkie objawy, w tym trudności w oddychaniu i zawroty głowy, wymagają pilnego leczenia.
Inhibitory
U niektórych pacjentów, którzy stosują ADZYNMA, mogą rozwinąć się przeciwciała neutralizujące (zwane inhibitorami). Inhibitory te mogą potencjalnie spowodować, że leczenie przestanie działać prawidłowo. Poinformuj swojego lekarza, jeśli uważasz, że lek nie działa.
Pozostałe leki i ADZYNMA
Poinformuj swojego lekarza lub farmaceutę, jeśli stosujesz, stosowałeś niedawno lub możesz potrzebować stosować inny lek.
Ciąża i laktacja
Jeśli jesteś w ciąży lub w okresie karmienia piersią, uważasz, że możesz być w ciąży lub planujesz ciążę, skonsultuj się z lekarzem lub farmaceutą przed zastosowaniem tego leku.
Nie powinieneś stosować ADZYNMA w czasie ciąży, chyba że twój lekarz wyraźnie zaleci to. Ty i twój lekarz powinniście zdecydować, czy możesz stosować ADZYNMA w czasie karmienia piersią.
Jazda i obsługa maszyn
Wpływ tego leku na zdolność prowadzenia pojazdów i obsługiwania maszyn może być niewielki. Po zastosowaniu ADZYNMA mogą wystąpić zawroty głowy i senność.
Prowadzenie rejestru
W celu poprawy identyfikowalności leków biologicznych, nazwa i numer serii leku powinny być wyraźnie zarejestrowane.
ADZYNMA zawiera sodu
Ten lek zawiera mniej niż 23 mg sodu (1 mmol) na fiolkę; jest to zatem „w zasadzie wolny od sodu”.
ADZYNMA zawiera polisorbat 80
Ten lek zawiera 2,7 mg polisorbatu 80 w każdej fiolce ADZYNMA 500 UI lub 1500 UI, co odpowiada maksymalnie 0,216 mg/kg. Polisorbaty mogą powodować reakcje alergiczne. Poinformuj swojego lekarza, jeśli masz znaną alergię.
3. Jak stosować ADZYNMA
Leczenie ADZYNMA będzie stosowane pod nadzorem lekarza z doświadczeniem w leczeniu pacjentów z zaburzeniami krwi.
ADZYNMA jest podawany przez wstrzyknięcie dożylnie (do żyły). Jest dostarczany Twojemu lekarzowi jako proszek, który jest rozpuszczany (rekonstytuowany) z rozpuszczalnikiem (płynem, w którym można rozpuścić proszek) dostarczonym przed podaniem.
Dawka jest obliczana na podstawie Twojej masy ciała.
Podanie leku w domu
Twój lekarz może rozważyć stosowanie ADZYNMA w Twoim domu, jeśli dobrze tolerujesz wstrzyknięcia. Gdy będziesz w stanie podać sobie ADZYNMA (lub ktoś inny, np. opiekun, będzie mógł Ci go podać) po otrzymaniu odpowiedniej edukacji od lekarza lub pielęgniarki odpowiedzialnej za leczenie, twój lekarz nadal będzie monitorował Twoją odpowiedź na leczenie. Jeśli zauważysz jakiekolwiek niepożądane działania podczas stosowania leku w domu, natychmiast przerwij wstrzyknięcie i szukaj pomocy medycznej.
Zalecana dawka
Profilmaktyczna terapia zastępcza enzymatyczna
Zwykła dawka wynosi 40 UI/kg masy ciała, podawana co dwa tygodnie.
Twój lekarz może zmienić częstotliwość na raz w tygodniu, jeśli podawanie ADZYNMA co dwa tygodnie nie działa.
Terapia zastępcza enzymatyczna na żądanie w przypadku nagłych epizodów PTT
Jeśli doświadczasz nagłego epizodu (ostry) púrpury małopłytkowej zakrzepowej (PTT), zalecana dawka ADZYNMA wynosi:
- 40 UI/kg masy ciała w dniu 1.
- 20 UI/kg masy ciała w dniu 2.
- 15 UI/kg masy ciała raz dziennie, rozpoczynając od dnia 3 i do dwóch dni po ustąpieniu nagłego epizodu PTT.
Jeśli zażyjesz zbyt dużo ADZYNMA
Zażywanie zbyt dużej ilości tego leku może powodować krwawienie.
Jeśli zapomnisz zażyć ADZYNMA
Jeśli ominąłeś wstrzyknięcie ADZYNMA, poinformuj swojego lekarza jak najszybciej. Nie zażywaj podwójnej dawki, aby nadrobić ominione dawki.
Jeśli przerwiesz leczenie ADZYNMA
Jeśli chcesz przerwać leczenie ADZYNMA, skonsultuj się z lekarzem. Jeśli przerwiesz leczenie, objawy choroby mogą się nasilić.
Jeśli masz jakieś inne wątpliwości dotyczące stosowania tego leku, zapytaj swojego lekarza, farmaceutę lub pielęgniarkę.
4. Mogące wystąpić niepożądane działania
Jak wszystkie leki, ten lek może powodować niepożądane działania, chociaż nie wszystkie osoby je doświadczają.
Podano następujące niepożądane działania z ADZYNMA:
Bardzo częste(mogą wystąpić u więcej niż 1 na 10 osób)
- infekcja nosa i gardła
- ból głowy
- uczucie zawrotu głowy
- migrena
- biegunka
- mdłości
Częste(mogą wystąpić u do 1 na 10 osób)
- podwyższona liczba płytek krwi we krwi (trombocytosis)
- senność
- zaparcie
- obrzęk (wzdęcie brzucha)
- słabość (astenia)
- uczucie ciepła
- nieprawidłowa aktywność ADAMTS13
Zgłaszanie niepożądanych działań
Jeśli doświadczasz jakiegokolwiek niepożądanego działania, skonsultuj się z lekarzem, farmaceutą lub pielęgniarką, nawet jeśli jest to możliwe niepożądane działanie, które nie jest wymienione w tej ulotce. Możesz również zgłaszać je bezpośrednio przez krajowy system zgłaszania wskazany w Załączniku V. Poprzez zgłaszanie niepożądanych działań możesz przyczynić się do zapewnienia większej ilości informacji o bezpieczeństwie tego leku.
5. Przechowywanie ADZYNMA
Przechowuj ten lek poza zasięgiem dzieci.
Nie stosuj tego leku po upływie terminu ważności zamieszczonego na etykiecie i na pudełku po dacie CAD. Data ważności jest ostatnim dniem miesiąca wskazanego.
Fiolki niewypełnione
Przechowuj w lodówce (między 2°C – 8°C).
Nie zamrażaj.
Przechowuj w oryginalnym opakowaniu, aby zabezpieczyć przed światłem.
Fiolki z proszkiem ADZYNMA niewypełnione mogą być przechowywane w temperaturze pokojowej (do 30°C) przez okres do 6 miesięcy, ale nie dłużej niż data ważności. Nie umieszczaj ADZYNMA z powrotem w lodówce po przechowywaniu w temperaturze pokojowej. Zapisz na pudełku datę, kiedy ADZYNMA zostało usunięte z lodówki.
Po rekonstytucji
Wyrzuć niezużyty lek po upływie 3 godzin.
Nie stosuj tego leku, jeśli zauważysz, że nie jest przezroczysty i bezbarwny.
Leków nie wolno wylewać do kanalizacji ani wyrzucać do śmieci. Poproś farmaceutę, jak usunąć opakowania i leki, których już nie potrzebujesz. Dzięki temu pomożesz chronić środowisko.
6. Zawartość opakowania i dodatkowe informacje
Skład ADZYNMA
- Substancja czynna, ADAMTS13, jest rekombinowaną ludzką dezintegriną A i metaloproteinazą z motywami trombospondyny 13.
Nominalna zawartość każdego fiolka z proszkiem wynosi 500 lub 1 500 UI aktywności rADAMTS13.
- Fiolka z rozpuszczalnikiem zawiera 5 ml wody do wstrzykiwań.
- Pozostałe substancje pomocnicze to chlorek sodu, chlorek wapnia dihydrat, L-histydyna, mannitol, sacharosa i polisorbat 80 (E433). Zobacz sekcję 2 „ADZYNMA zawiera sód” i „ADZYNMA zawiera polisorbat 80”.
Wygląd produktu i zawartość opakowania
ADZYNMA jest dostarczany jako proszek i rozpuszczalnik do roztworu do wstrzykiwań. Proszek jest białym liofilizowanym proszkiem. Rozpuszczalnik jest przeźroczysty i bezbarwny.
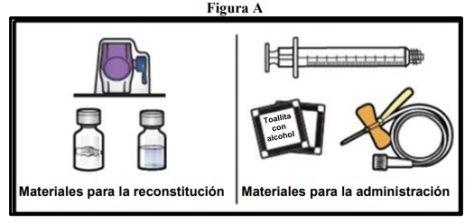
Każde opakowanie zawiera fiolkę z proszkiem, fiolkę z rozpuszczalnikiem, urządzenie do rekonstytucji (BAXJECT II Hi-Flow), strzykawkę jednorazową, zestaw do infuzji i dwie watki z alkoholem.
Posiadacz pozwolenia na dopuszczenie do obrotu i odpowiedzialny za wytwarzanie
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wiedeń
Austria
Można uzyskać więcej informacji na temat tego leku, kontaktując się z lokalnym przedstawicielem posiadacza pozwolenia na dopuszczenie do obrotu:
België/Belgique/Belgien Takeda Belgium NV Tel: +32 2 464 06 11 | Lietuva Takeda, UAB Tel: +370 521 09 070 |
| Luxembourg/Luxemburg Takeda Belgium NV Tel: +32 2 464 06 11 |
Ceská republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel: +420 234 722 722 | Magyarország Takeda Pharma Kft. Tel.: +36 1 270 7030 |
Danmark Takeda Pharma A/S Tlf: +45 46 77 10 10 | Malta Takeda HELLAS S.A. Tel: +30 210 6387800 |
Deutschland Takeda GmbH Tel: +49 (0)800 825 3325 | Nederland Takeda Nederland B.V. Tel: +31 20 203 5492 |
Eesti Takeda Pharma OÜ Tel: +372 6177 669 | Norge Takeda AS Tlf: +47 800 800 30 |
| Österreich Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 |
España Takeda Farmacéutica España, S.A. Tel: +34 917 90 42 22 | Polska Takeda Pharma Sp. z o.o. Tel.: +48223062447 |
France Takeda France SAS Tél: + 33 1 40 67 33 00 | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 |
Hrvatska Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 | România Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Ireland Takeda Products Ireland Ltd Tel: 1800 937 970 | Slovenija Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel: + 386 (0) 59 082 480 |
Ísland Vistor hf. Sími: +354 535 7000 | Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. el: +421 (2) 20 602 600 |
Italia Takeda Italia S.p.A. Tel: +39 06 502601 | Suomi/Finland Teva Finland Oy Puh/Tel: +358 20 180 5900 |
| Sverige Takeda Pharma AB Tel: 020 795 079 |
Latvija Takeda Latvia SIA Tel: +371 67840082 |
Data ostatniej aktualizacji tego prospektu: 08/2024.
Ten lek został autoryzowany w „wyjątkowych okolicznościach”. Ten tryb autoryzacji oznacza, że ze względu na rzadkość tej choroby nie było możliwe uzyskanie pełnej informacji o tym leku.
Agencja Europejska ds. Leków będzie corocznie przeglądać nowe informacje o tym leku, które mogą być dostępne, a ten prospekt zostanie zaktualizowany, gdy będzie to konieczne.
Inne źródła informacji
Szczegółowa informacja o tym leku jest dostępna na stronie internetowej Agencji Europejskiej ds. Leków: https://www.ema.europa.eu. Istnieją również linki do innych stron internetowych dotyczących rzadkich chorób i leków sierocych.
- Instrukcje użytkowania
Te instrukcje zawierają informacje o tym, jak rekonstytuować i podawać ADZYNMA.
Te instrukcje użytkowania są skierowane do profesjonalistów opieki zdrowotnej i pacjentów/opiekunów, którzy podają ADZYNMA w domu po otrzymaniu odpowiedniej szkolenia od profesjonalisty opieki zdrowotnej.
Leczenie ADZYNMA powinno być przepisane i nadzorowane przez profesjonalistę opieki zdrowotnej z doświadczeniem w leczeniu pacjentów z zaburzeniami krwi.
Ważne:
- Tylko do wstrzyknięcia dożylnego po rekonstytucji.
- Używaj techniki aseptycznej podczas całej procedury.
- Sprawdź datę ważności produktu przed jego użyciem.
- Nieużywaj ADZYNMA, jeśli data ważności minęła.
- Jeśli pacjent potrzebuje więcej niż jednej fiolki ADZYNMA na wstrzyknięcie, rekonstytuuj każdą fiolkę zgodnie z instrukcjami szczegółowymi, które są podane w „Rekonstytucja”.
- Zbadaj roztwór rekonstytuowany ADZYNMA w celu wykrycia cząstek lub zmiany koloru przed podaniem. Roztwór powinien mieć przeźroczysty i bezbarwny wygląd.
- Niepodawaj, jeśli zaobserwujesz cząstki lub zmiany koloru.
- Jeśli przechowujesz w temperaturze pokojowej, użyj ADZYNMA przed upływem 3godzinod rekonstytucji.
- Niepodawaj ADZYNMA w tym samym tubie lub pojemniku i jednocześnie z innymi lekami do infuzji.
Rekonstytucja
- Priorytetem jest przygotowanie czystej i płaskiej powierzchni oraz zebranie wszystkich niezbędnych materiałów do rekonstytucji i podania (Rys.A).
|
- Pozwól, aby fiolki ADZYNMA i rozpuszczalnika osiągnęły temperaturę pokojową przed użyciem.
- Umieść fiolki ADZYNMA i rozpuszczalnika na płaskiej powierzchni (Rys.B).
Rys.B
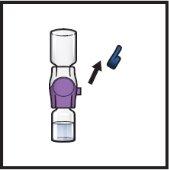
- Oczyść korki gumowe watką z alkoholem i pozostaw je do wyschnięcia przed użyciem (Rys.C).
Rys.C
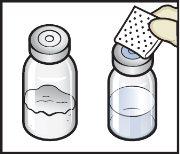
- Otwórz opakowanie urządzenia BAXJECT II Hi-Flow, usuwając pokrywę, nie dotykając wnętrza (Rys.D).
- Niewyjmuj urządzenia BAXJECT II Hi-Flow z opakowania.
- Niedotykaj przezroczystego plastikowego końca.
Rys.D
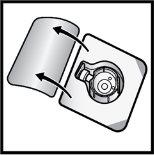
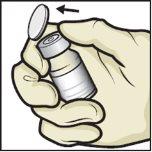
- Odwróć opakowanie z urządzeniem BAXJECT II Hi-Flow i umieść je na górze fiolki z rozpuszczalnikiem. Naciskaj prosto w dół, aż przezroczysty plastikowy koniecprzebije korek fiolki z rozpuszczalnikiem(Rys.E).
Rys.E
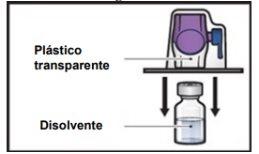
- Trzymaj opakowanie urządzenia BAXJECT II Hi-Flow za krawędź i wyjmij je z urządzenia (Rys.F).
- Nieusuwaj niebieskiego korkaz urządzenia BAXJECT II Hi-Flow.
- Niedotykaj fioletowego plastikowego końca, który został odsłonięty.
Rys.F
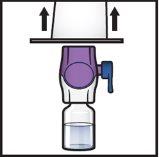
- Odwróć system, tak aby fiolka z rozpuszczalnikiembyła na górze. Naciskaj urządzenie BAXJECT II Hi-Flow prosto w dół, aż fioletowy plastikowy koniecprzebije korek fiolki z proszkiemADZYNMA (Rys.G). Podciśnienie spowoduje, że rozpuszczalnik wnika do fiolki z proszkiemADZYNMA.
- Możesz zauważyć pęcherzyki lub pianę; jest to normalne i powinny one szybko zniknąć.
Rys.G
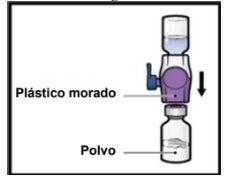
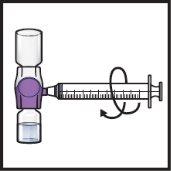
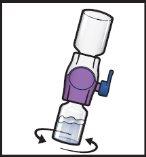
- Gładko i ciągle obracaj połączone fiolki, robiąc koła, aż proszek zostanie całkowicie rozpuszczony (Rys.H).
- Niepotrząsaj fiolką.
Rys.H
- Przed podaniem zbadaj wizualnie roztwór rekonstytuowany w celu wykrycia cząstek.
- Nieużywaj produktu, jeśli zaobserwujesz cząstki lub zmiany koloru.
- Jeśli dawka wymaga więcej niż jednej fiolki ADZYNMA, rekonstytuuj każdą fiolkę postępując zgodnie z powyższymi krokami.
- Użyj oddzielnego urządzenia BAXJECT II Hi-Flow do rekonstytucji każdej fiolki ADZYNMA.
Podanie ADZYNMA
- Usuń niebieski korekz urządzenia BAXJECT II Hi-Flow (Rys.I). Podłącz strzykawkę z konektorem Luer-Lock (Rys.J).
- Niewstrzykuj powietrza do systemu.
|
- Odwróć system(tak, aby fiolka z ADZYNMA była na górze). Wyjmij roztwór rekonstytuowanydo strzykawki, powoli ciągnąc tłok (Rys.K).
Rys.K
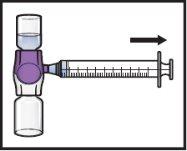
- Jeśli pacjent ma otrzymać więcej niż jedną fiolkę ADZYNMA, można wyjmować zawartość kilku fiolek do tej samej strzykawki. Powtórz ten proces ze wszystkimi zrekonstytuowanymi fiolkami ADZYNMA, aż do osiągnięcia całkowitej objętości podania.
- Odłącz strzykawkę i podłącz odpowiednią igłę do wstrzyknięcia lub zestaw do infuzji.
- Skieruj igłę do góry i usuń pęcherzyki powietrza, delikatnie stukając palcem w strzykawkę i powoli wypuszczając powietrze ze strzykawki i igły.
- Nałóż opaskę uciskową i oczyść miejsce wstrzyknięcia wybranego obszaru skóry watką z alkoholem (Rys.L).
Rys.L
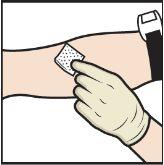
- Wprowadź igłę do żyły i usuń opaskę uciskową.
- Wstrzyknij rekonstytuowany ADZYNMA wolno, z prędkością 2do4ml na minutę(Rys.M).
- Aby kontrolować prędkość podania, można użyć pompy strzykawkowej.
Rys.M
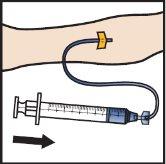
- Wyjmij igłę z żyły i naciśnij miejsce wstrzyknięcia przez kilka minut.
- Nieprzykrywaj igły.
Przechowywanie ADZYNMA
- Przechowuj ADZYNMA w lodówce (między 2°C - 8°C) lub w temperaturze pokojowej (do 30°C) przez okres do 6 miesięcy.
- Niewprowadzaj ADZYNMA z powrotem do lodówki po przechowywaniu w temperaturze pokojowej.
- Zapiszna pudełku datę, w której ADZYNMA zostało usunięte z lodówki.
- Niezamrażaj.
- Przechowuj w oryginalnym opakowaniu, aby zabezpieczyć przed światłem.
- Nieużywaj po upływie terminu ważności, który jest podany na etykiecie i pudełku po CAD.
- Użyj ADZYNMA przed upływem 3godzinod rekonstytucji. Wyrzuć zrekonstytuowany lek, który nie został użyty w ciągu 3 godzin od rekonstytucji.
Usuwanie ADZYNMA
- Fiolki są przeznaczone do jednorazowego użytku.
- Wyrzuć używaną igłę, strzykawkę i puste fiolki do pojemnika na ostre przedmioty, który jest odporny na przebicie.
Leków nie wolno wylewać do kanalizacji ani wyrzucać do śmieci. Zapytaj swojego farmaceutę, jak usunąć opakowania i leki, których już nie potrzebujesz. Dzięki temu pomożesz chronić środowisko.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃPostać farmaceutyczna: ROZTWÓR DO WSTRZYKIWAŃ, 1500 IUSubstancja czynna: apadamtase alfa and cinaxadamtase alfaProducent: Takeda Manufacturing Austria AgWymaga receptyPostać farmaceutyczna: ROZTWÓR DO WSTRZYKIWAŃ, 10 mgSubstancja czynna: alteplaseProducent: Boehringer Ingelheim International GmbhWymaga receptySubstancja czynna: protein CProducent: Takeda Manufacturing Austria AgWymaga recepty
Odpowiedniki ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃ w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃ – Ukraina
Lekarze online w sprawie ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃ
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na ADZYNMA 500 IU PROSZEK I ROZPUSZCZALNIK DO PRZYGOTOWANIA ROZTWORU DO WSTRZYKIWAŃ – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.