
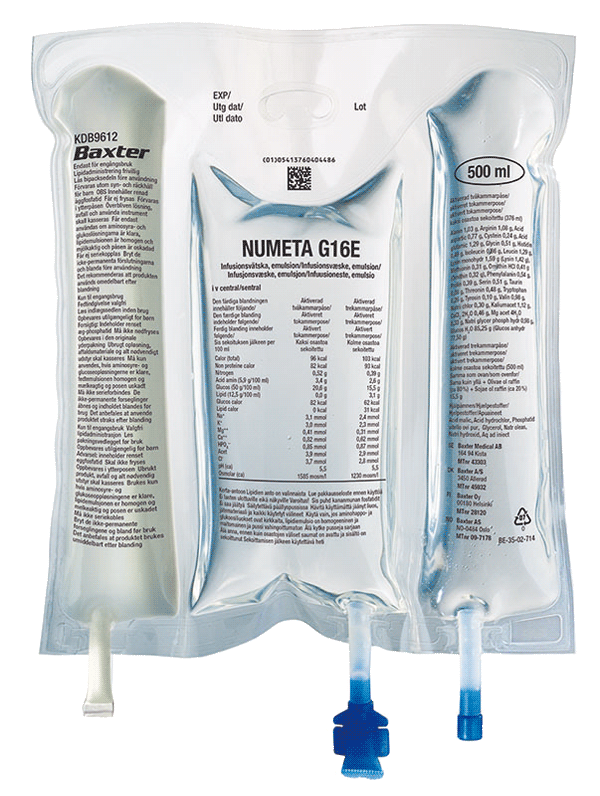
Numeta G16%E

Zapytaj lekarza o receptę na Numeta G16%E

Jak stosować Numeta G16%E
Ulotka dołączona do opakowania: informacja dla użytkownika
NUMETA G16%E, emulsja do infuzji
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza dziecka, farmaceuty lub pielęgniarki.
- Jeśli u dziecka wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi prowadzącemu lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek NUMETA G16%E i w jakim celu się go stosuje
- 2. Informacje ważne przed podaniem dziecku leku NUMETA G16%E
- 3. Jak stosować lek NUMETA G16%E
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek NUMETA G16%E
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek NUMETA G16%E i w jakim celu się go stosuje
Lek NUMETA G16%E jest specjalistyczną emulsją do żywienia przeznaczoną dla noworodków
urodzonych o czasie i dzieci do 2 lat. Jest podawana przez rurkę wprowadzaną do żyły dziecka, w
sytuacji, gdy dziecko nie może przyjmować wszystkich składników pożywienia doustnie.
Lek NUMETA występuje w postaci worka trójkomorowego, gdzie poszczególne komory zawierają:
roztwór glukozy 50%;
pediatryczny roztwór aminokwasów z elektrolitami 5,9%;
emulsję tłuszczową 12,5%.
W zależności od potrzeb dziecka, dwa lub trzy z tych roztworów są mieszane w worku przed podaniem
dziecku.
Lek NUMETA G16%E można stosować jedynie pod kontrolą lekarza.
2. Informacje ważne przed podaniem dziecku leku NUMETA G16%E
Kiedy dziecku nie powinien być podawany lek NUMETA G16%E:
W przypadku 2 roztworów wymieszanych w worku („2 w 1”):
- jeśli u dziecka stwierdzono uczulenie na białka jaja kurzego, soję, orzeszki ziemne lub którykolwiek ze składników zawartych w komorze z glukozą lub aminokwasami (wymienione w punkcie 6);
- jeśli organizm dziecka nie może wykorzystywać składników budulcowych białka;
- jeśli we krwi dziecka jest duże stężenie któregokolwiek z elektrolitów występujących w leku NUMETA G16%E;
- w przypadku noworodka (≤28 dnia życia), lek NUMETA G16%E (lub inne roztwory zawierające wapń) nie może być podawany równocześnie z ceftriaksonem (antybiotyk), nawet jeśli używa się osobnych linii do infuzji. Istnieje ryzyko powstawania cząstek w krążeniu noworodka, które mogą prowadzić do zgonu.
- jeśli dziecko ma hiperglikemię (szczególnie duże stężenie cukru we krwi).
W przypadku 3 roztworów wymieszanych w worku („3 w 1”):
- we wszystkich wymienionych powyżej sytuacjach dla leku „2 w 1” oraz dodatkowo:
- jeśli u dziecka występuje szczególnie duże stężenie tłuszczów we krwi.
We wszystkich przypadkach lekarz podejmuje decyzję o podaniu leku uwzględniając wiek, masę ciała i
stan kliniczny dziecka. Lekarz weźmie również pod uwagę wyniki wszystkich przeprowadzonych badań.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem podawania leku NUMETA G16%E należy omówić to z lekarzem prowadzącym lub
pielęgniarką.
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania. Ekspozycja leku
NUMETA G16%E na światło otoczenia, zwłaszcza po zmieszaniu z pierwiastkami śladowymi
i (lub) witaminami, powoduje wytwarzanie nadtlenków i innych produktów degradacji, co można
zmniejszyć przez ochronę przed światłem.
Reakcje alergiczne:
Jeśli wystąpią jakiekolwiek oznaki lub objawy reakcji alergicznej (takie jak gorączka, pocenie się,
dreszcze, ból głowy, wysypka skórna lub trudności w oddychaniu), infuzję należy natychmiast przerwać.
Ten lek zawiera olej sojowy, który rzadko może powodować reakcje nadwrażliwości. U niektórych osób
uczulonych na białka orzeszków ziemnych rzadko obserwowano również uczulenie na białka soi.
Lek NUMETA G16%E zawiera glukozę wytwarzaną ze skrobi kukurydzianej. Dlatego lek NUMETA G16%E
należy stosować z ostrożnością u pacjentów ze stwierdzoną alergią na kukurydzę lub produkty
zawierające kukurydzę.
Ryzyko powstawania osadu z ceftriaksonem (antybiotyk):
Antybiotyku o nazwie ceftriakson nie można mieszać ani podawać jednocześnie z żadnymi roztworami
zawierającymi wapń (w tym z lekiem NUMETA G16%E), podawanymi drogą kroplówki dożylnej.
Lekarz wie o tym i nie poda ich pacjentowi jednocześnie, nawet przez różne linie do infuzji albo inne
miejsca infuzji.
Jednakże, lekarz może podać wapń i ceftriakson kolejno jeden po drugim, jeśli linie do infuzji są wkłute
w różne miejsca lub są wymieniane albo dokładnie płukane roztworem soli fizjologicznej między
infuzjami, aby uniknąć wytrącania osadów.
Powstawanie małych cząstek w naczyniach krwionośnych w płucach:
Trudności z oddychaniem mogą być również oznaką, że powstały małe cząstki blokujące naczynia
krwionośne w płucach (osady w naczyniach płucnych). Jeśli u dziecka wystąpią jakiekolwiek trudności z
oddychaniem, należy powiedzieć o tym lekarzowi lub pielęgniarce. Zdecydują oni o podjęciu
odpowiedniego działania.
Zakażenie i posocznica:
Lekarz będzie uważnie obserwował dziecko celem wykrycia objawów infekcji. Stosowanie zasad aseptyki
(postępowanie chroniące od drobnoustrojów) przy wprowadzaniu i utrzymywaniu cewnika, oraz podczas
przygotowywania mieszaniny odżywczej, może zmniejszyć ryzyko infekcji.
Niekiedy, jeśli w żyle umieszczona jest rurka (cewnik dożylny), u dziecka może dojść do zakażenia i
posocznicy (obecności bakterii we krwi). Niektóre leki oraz choroby mogą zwiększać ryzyko zakażenia
lub posocznicy. Pacjenci wymagający odżywiania pozajelitowego (podawania pożywienia za pomocą
rurki umieszczonej w żyle), ze względu na stan zdrowia mogą być bardziej narażeni na powstanie
zakażenia.
Zespół przeciążenia tłuszczami:
Podczas stosowania podobnych leków opisywano występowanie zespołu przeciążenia tłuszczami.
Zmniejszona lub ograniczona zdolność organizmu do usuwania tłuszczów zawartych w leku
NUMETA G16%E lub przedawkowanie, może skutkować tzw. zespołem przeciążenia tłuszczami (patrz
punkty 3 i 4).
Zmiany zawartości substancji chemicznych we krwi:
Lekarz będzie sprawdzał i śledził stan płynów u dziecka, skład chemiczny krwi oraz zawartość innych
substancji, ponieważ czasem odżywianie osób poważnie niedożywionych może spowodować zmiany
składu chemicznego krwi. Może również pojawić się dodatkowy płyn w tkankach i opuchlizna. Zaleca się
powolne i ostrożne rozpoczęcie odżywiania pozajelitowego.
Podwyższone stężenie magnezu we krwi:
Ilość magnezu znajdująca się w produkcie NUMETA G16%E może spowodować podwyższenie stężenia
magnezu we krwi. W takim przypadku mogą wystąpić następujące objawy: osłabienie, spowolnienie
odruchów, nudności, wymioty, niski poziom wapnia we krwi, problemy z oddychaniem, niskie ciśnienie
krwi i nieregularne bicie serca. Objawy mogą być trudne do wykrycia, dlatego lekarz może monitorować
stężenie magnezu we krwi dziecka, zwłaszcza w przypadku dzieci, u których występują czynniki ryzyka
podwyższonego stężenia magnezu we krwi, do których należy zaburzenie czynności nerek. Jeśli stężenie
magnezu we krwi jest podwyższone, infuzja zostanie wstrzymana lub zmniejszona zostanie szybkość
podawania leku.
Monitorowanie i dostosowanie:
Lekarz będzie uważnie obserwował i dostosowywał podawanie leku NUMETA do
indywidualnych potrzeb dziecka w następujących okolicznościach:
- ciężkie stany pourazowe;
- ciężka cukrzyca;
- wstrząs;
- atak serca;
- ciężkie zakażenie;
- pewne rodzaje śpiączki.
Stosowanie z zachowaniem ostrożności:
Lek NUMETA powinien być stosowany z zachowaniem ostrożności, jeśli dziecko ma:
- obrzęk płuc (płyn w płucach) lub niewydolność serca;
- ciężkie zaburzenia czynności wątroby;
- zaburzenia przyswajania składników odżywczych;
- duże stężenie cukru we krwi;
- choroby nerek;
- ciężkie zaburzenia przemiany materii (kiedy proces rozkładu substancji nie przebiega normalnie);
- zaburzenia krzepnięcia krwi.
Dokładnie sprawdzana będzie zawartość płynów w organizmie dziecka, wyniki badań wątroby i (lub)
krwi.
Lek NUMETA G16%E a inne leki
Należy powiedzieć lekarzowi o wszystkich lekach stosowanych obecnie lub ostatnio przez dziecko, a
także o lekach, które dziecko będzie stosować.
Lek NUMETA nie może być podawany w tym samym czasie co:
- ceftriakson(antybiotyk), nawet w osobnych liniach do infuzji, z powodu ryzyka powstawania cząstek stałych;
- krewprzez ten sam zestaw do infuzji, z powodu ryzyka pseudoaglutynacji (czerwone krwinki ulegają sklejaniu);
- ampicylina, fosfenytoina lub furosemidprzez tą samą linię do infuzji, z powodu ryzyka powstawania cząstek stałych.
Kumaryna i warfaryna (antykoagulanty):
Lekarz będzie uważnie obserwował dziecko, czy stosuje kumarynę lub warfarynę.
Witamina K1 jest naturalnym składnikiem oliwy oraz oleju sojowego. Witamina K1 może wchodzić
w interakcje z lekami takimi jak kumaryna i warfaryna. Leki te są antykoagulantami stosowanymi do
zapobiegania krzepnięciu krwi.
Testy laboratoryjne:
Lipidy wchodzące w skład tej emulsji mogą wpływać na wyniki określonych badań laboratoryjnych.
Badania laboratoryjne mogą zostać przeprowadzone po upływie od 5 do 6 godzin od ostatniego podania
lipidów.
Interakcje leku NUMETA G16%E z lekami mogącymi wpływać na stężenie potasu/metabolizm:
Lek NUMETA zawiera potas. Duże stężenia potasu we krwi mogą wywołać nieprawidłowy rytm pracy
serca. Należy otoczyć szczególną opieką pacjentów przyjmujących diuretyki (leki mające na celu
zmniejszenie zatrzymywania płynów) lub inhibitory ACE (leki stosowane w wysokim ciśnieniu krwi) lub
antagonistów receptora angiotensyny II (leki stosowane w wysokim ciśnieniu krwi) lub leki
immunosupresyjne (leki mogące zmniejszać normalną odpowiedź immunologiczną organizmu). Leki tego
typu mogą zwiększać stężenie potasu.
3. Jak stosować lek NUMETA G16%E
Lek NUMETA G16%E powinien być zawsze podawany dziecku zgodnie z zaleceniami lekarza. W razie
wątpliwości należy skontaktować się z lekarzem.
Grupa wiekowa
Lek NUMETA G16%E został zaprojektowany do zaspokojenia potrzeb żywieniowych noworodków
urodzonych o czasie oraz dzieci do 2 lat.
Lekarz dziecka zadecyduje, czy ten lek jest dla niego odpowiedni.
Podawanie
Ten lek jest emulsją do infuzji. Jest on podawany przez plastikową rurkę do żyły w ramieniu lub do dużej
żyły w klatce piersiowej dziecka.
Lekarz może zadecydować o niepodawaniu dziecku lipidów. Worek leku NUMETA G16%E jest
zaprojektowany w taki sposób, że jeśli to konieczne, można rozerwać przegrody jedynie pomiędzy
komorą z aminokwasami/elektrolitami, a komorą zawierającą glukozę. W takim przypadku, przegroda
pomiędzy komorą z aminokwasami a lipidami pozostaje nienaruszona. W ten sposób zawartość worka
może zostać podana bez lipidów.
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania (patrz punkt 2).
Dawka i czas trwania leczenia
Lekarz zadecyduje o dawce leku oraz jak długo będzie on podawany. Dawka zależy od potrzeb
żywieniowych dziecka. Dawka zostanie ustalona na podstawie masy ciała dziecka, stanu klinicznego oraz
zdolności jego organizmu do rozkładu i wykorzystania składników leku NUMETA G16%E. Dodatkowe
składniki żywieniowe lub białka podawane doustnie/dojelitowo mogą być również podawane.
Zastosowanie u dziecka większej niż zalecana dawki leku NUMETA G16%E
Objawy
Za duża dawka leku lub zbyt szybkie podawanie może spowodować:
- nudności (mdłości);
- wymioty;
- drgawki;
- zaburzenia elektrolitowe (nieprawidłowe ilości elektrolitów we krwi);
- objawy hiperwolemii (zwiększonej objętości krwi krążącej);
- kwasicę (zwiększoną kwasowość krwi).
W sytuacjach jak powyżej, należy natychmiast przerwać infuzję. Lekarz podejmie decyzję, czy wymagane
są dodatkowe działania.
Przedawkowanie tłuszczów zawartych w leku NUMETA G16%E może prowadzić do wystąpienia
„zespołu przeciążenia tłuszczami”, który zwykle ustępuje po przerwaniu infuzji. U noworodków
(niemowląt) i małych dzieci (dzieci poniżej 2 lat) zespół przeciążenia tłuszczami jest powiązany z
zaburzeniami oddychania prowadzącymi do zmniejszenia ilości tlenu w organizmie (niewydolność
oddechowa) i stanami prowadzącymi do zwiększonej kwasowości krwi (kwasica).
Aby zapobiec takim sytuacjom, lekarz będzie systematycznie sprawdzał stan dziecka oraz przeprowadzał
u niego badania krwi w trakcie leczenia.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego dziecka one
wystąpią.
W przypadku zaobserwowania u dziecka jakichkolwiek zmian samopoczucia podczas leczenia lub po jego
zakończeniu, należy natychmiast powiadomić lekarza lub pielęgniarkę.
Badania przeprowadzane przez lekarza podczas stosowania leku przez dziecko powinny zminimalizować
ryzyko działań niepożądanych.
Jeśli wystąpią objawy reakcji alergicznej, infuzja powinna zostać wstrzymana i należy natychmiast
skontaktować się z lekarzem. Może być to poważne, a objawy mogą obejmować:
- pocenie się
- dreszcze
- ból głowy
- wysypki skórne
- trudności z oddychaniem
Inne zaobserwowane działania niepożądane:
Częste: mogą dotyczyć 1 na 10 osób
- Małe stężenie fosforanów we krwi (hipofosfatemia)
- Duże stężenie cukru we krwi (hiperglikemia)
- Duże stężenie wapnia we krwi (hiperkalcemia)
- Duże stężenie triglicerydów we krwi (hipertriglicerydemia)
- Zaburzenia elektrolitowe (hiponatremia)
Niezbyt częste: mogą dotyczyć 1 na 100 osób
- Duże stężenie lipidów we krwi (hiperlipidemia)
- Stan, w którym żółć nie może płynąć z wątroby do dwunastnicy (cholestaza). Dwunastnica jest częścią jelit.
Nieznana: częstość nie może być określona na podstawie dostępnych danych(Te działania niepożądane
zgłoszono tylko po obwodowym podaniu leku NUMETA G13%E Preterm i NUMETA G16%E przy
niedostatecznym rozcieńczeniu).
- Martwica skóry
- Uszkodzenie tkanki miękkiej
- Wynaczynienie
Następujące działania niepożądane były zgłaszane dla innych leków do żywienia pozajelitowego:
Zmniejszona lub ograniczona zdolność do usuwania lipidów zawartych w leku NUMETA może
prowadzić do wystąpienia zespołu przeciążenia tłuszczami. Poniższe oznaki i objawy tego zespołu
zazwyczaj ustępują po zaprzestaniu infuzji emulsji tłuszczowej:
- Nagłe i ostre pogorszenie stanu klinicznego pacjenta
- Duże stężenie tłuszczów we krwi (hiperlipidemia)
- Gorączka
- Stłuszczenie wątroby (hepatomegalia)
- Pogorszenie czynności wątroby
- Zmniejszenie liczby czerwonych krwinek, które może spowodować bladość skóry i być przyczyną osłabienia lub duszności (niedokrwistość)
- Zmniejszenie liczby białych krwinek, które może zwiększać ryzyko zakażenia (leukopenia)
- Zmniejszenie liczby płytek krwi, które może zwiększać ryzyko powstawania siniaków i (lub) krwawień (małopłytkowość)
- Zaburzenia krzepnięcia krwi, które wpływają na zdolność krwi do wytwarzania zakrzepu
- Zaburzenia oddychania prowadzące do zmniejszenia ilości tlenu w organizmie (niewydolność oddechowa)
- Stany prowadzące do zwiększonej kwasowości krwi (kwasica)
- Śpiączka wymagająca hospitalizacji
Powstawanie małych cząstek, które mogą spowodować zablokowanie naczyń krwionośnych w płucach
(osady w naczyniach płucnych) lub trudności z oddychaniem.
Zgłaszanie działań niepożądanych
Jeśli u dziecka wystąpią jakiekolwiek objawy niepożądane, należy zwrócić się do lekarza prowadzącego
lub pielęgniarki. Dotyczy to również wszelkich objawów niepożądanych niewymienionych w tej ulotce.
Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych
Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i
Produktów Biobójczych
Al. Jerozolimskie 181 C
PL 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek NUMETA G16%E
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci, gdy nie jest podawany.
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania (patrz punkt 2).
Nie stosować tego leku po upływie terminu ważności, zamieszczonego na worku oraz opakowaniu
zewnętrznym (MM/RRRR). Termin ważności oznacza ostatni dzień podanego miesiąca.
Nie zamrażać.
Przechowywać w worku ochronnym.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Jak wygląda lek NUMETA G16%E i co zawiera opakowanie
Lek NUMETA znajduje się w trójkomorowym worku. Zawartość każdego worka jest jałowa i składa się
z roztworu glukozy, roztworu aminokwasów dla dzieci wraz z elektrolitami oraz emulsji tłuszczowej,
zgodnie z poniższym opisem.
| Wielkość pojemnika | 50% roztwór glukozy | 5,9% roztwór aminokwasów z elektrolitami | 12,5% emulsja tłuszczowa |
| 500 ml | 155 ml | 221 ml | 124 ml |
Wygląd przed przygotowaniem:
- Roztwory w komorach zawierających aminokwasy i glukozę są przezroczyste, bezbarwne lub lekko żółte
- Komora z emulsją tłuszczową jest jednolitym i mlecznobiałym płynem Wygląd po przygotowaniu:
- Roztwory do infuzji „2 w 1” są przezroczyste, bezbarwne lub lekko żółte
- Emulsja do infuzji „3 w 1” jest jednolita i mlecznobiała
Trójkomorowy worek to wielowarstwowy worek plastikowy.
Aby uchronić przed kontaktem z powietrzem, worek NUMETA jest opakowany w worek ochronny,
chroniący przed dostępem tlenu, który zawiera pochłaniacz tlenu i wskaźnik tlenu.
Wielkość opakowań
worki 500 ml: 6 worków w tekturowym pudełku
1 worek 500 ml
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Warszawa
Wytwórca
Baxter S.A.
Boulevard Rene Branquart 80
7860 Lessines
Belgia
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
| Austria Niemcy | Numeta G 16 % E Emulsion zur Infusion |
| Belgia Luksemburg | NUMETZAH G16%E, émulsion pour perfusion |
| Francja | NUMETAH G16 %E, émulsion pour perfusion |
| Dania Norwegia Szwecja | Numeta G16E |
| Republika Czeska Grecja | NUMETA G 16 % E |
| Holandia | NUMETA G16%E emulsie voor infusie |
| Irlandia Wielka Brytania | Numeta G16%E, Emulsion for Infusion |
| Włochy | NUMETA G16%E emulsione per infusione |
| Finlandia | Numeta G16E infuusioneste, emulsio |
| Polska | NUMETA G16%E |
| Portugalia | Numeta G16%E |
| Hiszpania | NUMETA G16%E, emulsión para perfusión |
Data ostatniej aktualizacji ulotki: Maj 2024 --------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego lub pracowników służby zdrowia*
*W niektórych przypadkach ten lek może być podawany w domu przez rodziców lub innych opiekunów.
W tych przypadkach, rodzice/opiekunowie powinni przeczytać poniższe informacje.
Nie należy wprowadzać do worka dodatkowych składników bez uprzedniego sprawdzenia zgodności.
Mogłoby to powodować powstanie cząstek stałych lub destabilizację emulsji tłuszczowej. To może
prowadzić do zatykania żył.
Lek NUMETA G16%E powinien osiągnąć temperaturę pokojową przed zastosowaniem.
Przed podaniem leku NUMETA G16%E, worek przygotowuje się jak pokazano poniżej.
Należy upewnić się, że worek nie jest uszkodzony. Worek można użyć wyłącznie, gdy nie jest
uszkodzony. Poniżej podano cechy nieuszkodzonego worka:
- Przegrody są nienaruszone. Wskazuje na to brak wymieszania zawartości którejkolwiek z trzech komór.
- Roztwory zawierające aminokwasy i glukozę są przezroczyste, bezbarwne lub lekko żółte, bez widocznych cząstek.
- Emulsja tłuszczowa jest jednolitym płynem o mlecznobiałym wyglądzie.
Przed otwarciem worka ochronnego należy sprawdzić barwę pochłaniacza tlenu.
- Należy porównać ją z barwą wzorcową wydrukowaną obok symbolu OK i pokazaną na zadrukowanym obszarze etykiety wskaźnika.
- Nie należy stosować leku, gdy barwa wskaźnika tlenu nie odpowiada barwie wzorcowej wydrukowanej obok symbolu OK.
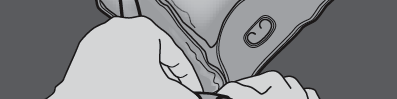
Rysunki 1 i 2 przedstawiają sposób zdejmowania worka ochronnego. Wyrzucić worek ochronny,
wskaźnik tlenu i pochłaniacz tlenu.













Rysunek 1
Rysunek 2
Przygotowanie zmieszanej emulsji:
- Przed rozerwaniem spawów upewnić się, że lek ma temperaturę pokojową.
- Umieścić worek na płaskiej, czystej powierzchni.
Aktywowanie trójkomorowego worka (mieszanie 3 roztworów przez otwarcie dwóch rozrywalnych
spawów)
Krok 1: Zwijanie worka należy rozpoczynać od strony z wieszakiem.
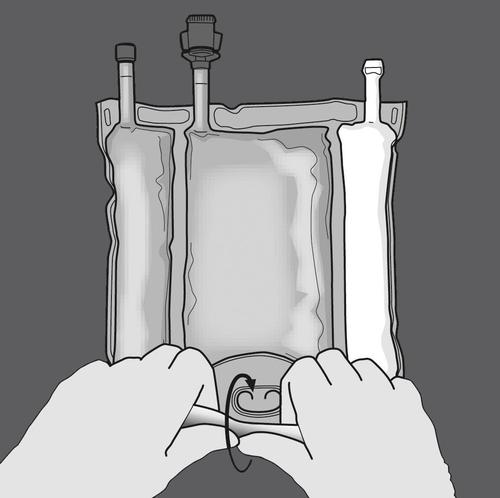
Krok 2: Naciskać, aż otworzą się spawy.
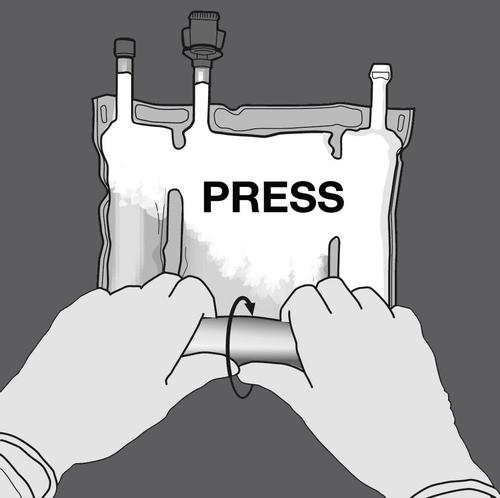
NACISNĄĆ
Krok 3: Zmienić kierunek przez zwijanie worka w kierunku do wieszaka.
Kontynuować do całkowitego otwarcia spawu.
Postępować w ten sam sposób do całkowitego otwarcia drugiego spawu.
NACISNĄĆ
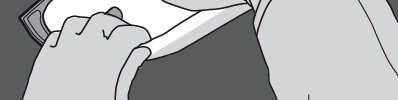

Krok 4: Obrócić worek co najmniej trzy razy, aby dokładnie wymieszać zawartość.
Wymieszany roztwór powinien mieć wygląd mlecznobiałej emulsji.

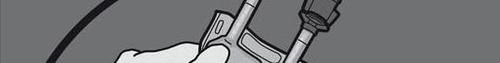






Krok 5: Usunąć zatyczkę ochronną z miejsca do podawania leku i wprowadzić zestaw do
podawania dożylnego.








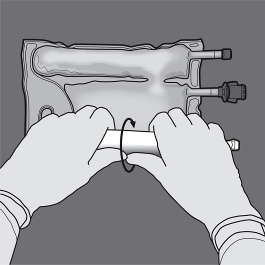
Aktywowanie worka dwukomorowego (mieszanie 2 roztworów przez otwarcie rozrywalnego spawu między
komorami zawierającymi aminokwasy i glukozę)
Krok 1: Aby wymieszać tylko 2 roztwory, zwinąć worek, rozpoczynając od górnego rogu
(z wieszakiem) obok spawu oddzielającego roztwory.
Nacisnąć, aby otworzyć spaw oddzielający przedziały z glukozą i aminokwasami.
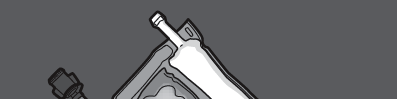
NACISNĄĆ

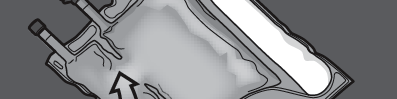
Krok 2: Ułożyć worek tak, by komora z emulsją tłuszczową była najbliżej użytkownika.
Zwinąć worek, ochraniając dłońmi komorę z emulsją tłuszczową.
Krok 3: Naciskać jedną ręką i zwijać worek w kierunku rurek.

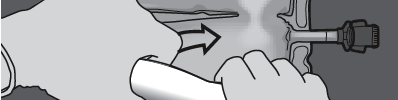
NACISNĄĆ


Krok 4: Zmienić kierunek, zwijając worek w kierunku górnego końca (z wieszakiem).
Nacisnąć drugą ręką do momentu całkowitego rozerwania spawu oddzielającego roztwory
aminokwasów i glukozy.

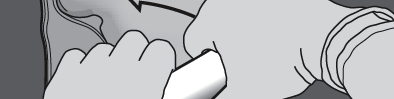
NACISNĄĆ


Krok 5: Obrócić worek co najmniej trzy razy, aby dokładnie wymieszać zawartość.
Wymieszany roztwór powinien być przezroczysty, bezbarwny lub lekko żółty.







Krok 6: Usunąć zatyczkę ochronną z miejsca do podawania leku i wprowadzić zestaw do
podawania dożylnego.
W ciągu pierwszej godziny szybkość przepływu należy stopniowo zwiększać. Szybkość przepływu
podawania musi zostać dostosowana na podstawie poniższych czynników:








- podawanej dawki
- przyjmowanej dziennie objętości
- czasu trwania infuzji.
Sposób podawania:
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania.
Do podawania leku NUMETA G16%E zaleca się stosowanie filtra 1,2 mikrona.
Z powodu dużej osmolarności nierozcieńczony lek NUMETA G16%E można podawać wyłącznie przez
żyłę centralną. Odpowiednie rozcieńczenie leku NUMETA G16%E wodą do wstrzykiwań zmniejsza
osmolarność i umożliwia infuzję do naczynia obwodowego.
Poniższy wzór przedstawia wpływ rozcieńczenia na osmolarność leku.
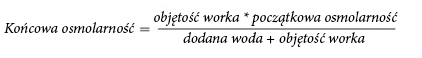
W poniższej tabeli przedstawiono przykłady osmolarności aktywowanego worka dwukomorowego
i aktywowanego worka trójkomorowego po dodaniu wody do wstrzykiwań:
| Aminokwasy i glukoza (aktywowany W2K) | Aminokwasy, glukoza i lipidy (aktywowany W3K) | |
| Objętość początkowa w worku (ml) | 376 | 500 |
| Osmolarność początkowa (mOsm/l w przybliżeniu) | 1585 | 1230 |
| Objętość dodanej wody (ml) | 376 | 500 |
| Objętość końcowa po dodaniu (ml) | 752 | 1000 |
| Osmolarność po dodaniu (mOsm/l w przybliżeniu) | 792,5 | 615 |
Wprowadzanie dodatkowych składników:
Ekspozycja na światło roztworów do dożylnego żywienia pozajelitowego, zwłaszcza po zmieszaniu z
pierwiastkami śladowymi i (lub) witaminami, może mieć niekorzystny wpływ na wyniki kliniczne u
noworodków, ze względu na wytwarzanie nadtlenków i innych produktów degradacji. W przypadku
stosowania u noworodków i dzieci poniżej 2 lat, lek NUMETA G16%E należy chronić przed światłem
otoczenia aż do zakończenia podawania.
Dodatkowe składniki wykazujące zgodność, można dodawać do odtworzonej mieszaniny poprzez miejsce
do wstrzykiwań (po otwarciu rozrywalnych spawów i po zmieszaniu zawartości dwóch lub trzech komór).
Witaminy mogą być również dodawane do komory zawierającej glukozę przed odtworzeniem mieszaniny
(przed otwarciem rozrywalnych spawów i przed zmieszaniem roztworów i emulsji).
Możliwe dodatki gotowych roztworów pierwiastków śladowych (zidentyfikowanych jako TE1, TE2 i
TE4), witamin (zidentyfikowanych jako liofilizat V1 i emulsja V2) i elektrolitów w określonych ilościach
przedstawiono w Tabelach 1-6.
- 1.Zgodność z TE4, V1 i V2
Tabela 1: Zgodność 3-w-1 (aktywowany W3K) z rozcieńczeniem wodą i bez rozcieńczenia
| Na 500 ml (po wymieszaniu 3 komór, z lipidami) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 12,0 | 25,6 | 37,6 | 12,0 | 25,6 | 37,6 |
| Potas (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
| Magnez (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
| Wapń (mmol) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
| Fosforany* (mmol) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
| Pierwiastki śladowe i witaminy | 10 ml TE4 + 1 fiolka V1 + 30 ml V2 | 10 ml TE4 + 1 fiolka V1 + 30 ml V2 | 5 mL TE4 + ½ vial V1 + 5 mL V2 | 5 ml TE4 + ½ fiolki V1 + 5 ml V2 | ||
| Woda do wstrzykiwań | 350 ml | 350 ml | ||||
Tabela 2: Zgodność 2-w-1 (aktywowany W2K) z rozcieńczeniem wodą i bez rozcieńczenia
| Na 376 ml (po wymieszaniu 2 komór, bez lipidów) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potas (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnez (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Wapń (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosforany* (mmol) | 3,2 |
| 11,3 | 3,2 | 0,0 | 3,2 |
| Pierwiastki śladowe i witaminy | 5ml TE4 + ½ fiolki V1 | 5ml TE4 + ½ fiolki V1 | 5ml TE4 + ½ fiolki V1 | 5ml TE4 + ½ fiolki V1 | ||
| Woda do wstrzykiwań | 450 ml | 450 ml | ||||
- 2.Zgodność z TE1, V1 i V2Tabela 3: Zgodność 3-w-1 (aktywowany W3K) z rozcieńczeniem wodą i bez rozcieńczenia
| Na 500 ml (po wymieszaniu 3 komór, z lipidami) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Potas (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnez (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Wapń (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosforany* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Pierwiastki śladowe i witaminy | 5 ml TE1 + ½ fiolki V1 + 5 ml V2 | 5 ml TE1 + ½ fiolki V1 + 5 ml V2 | 5 ml TE1 + ½ fiolki V1 + 5 ml V2 | 5 ml TE1 + ½ fiolki V1 + 5 ml V2 | ||
| Woda do wstrzykiwań | 350 ml | 350 ml | ||||
Tabela 4: Zgodność 2-w-1 (aktywowany W2K) z rozcieńczaniem wodą i bez rozcieńczania
| Na 376 ml (po wymieszaniu 2 komór, bez lipidów) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potas (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnez (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Wapń (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosforany* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Pierwiastki śladowe i witaminy | 5 ml TE1 + ½ fiolki V1 | 5 ml TE1 + ½ fiolki V1 | 5 ml TE1 + ½ fiolki V1 | 5 ml TE1 + ½ fiolki V1 | ||
| Woda do wstrzykiwań | 450 ml | 450 ml | ||||
- 3.Zgodność z TE2, V1 i V2Tabela 5: Zgodność 3-w-1 (aktywowany W3K) z rozcieńczeniem wodą i bez rozcieńczenia
| Na 500 ml (po wymieszaniu 3 komór, z lipidami) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Potas (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnez (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Wapń (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosforany* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Pierwiastki śladowe i witaminy | 5 ml TE2 + ½ fiolki V1 + 5 ml V2 | 5 ml TE2 + ½ fiolki V1 + 5 ml V2 | 5 ml TE2 + ½ fiolki V1 + 5 ml V2 | 5 ml TE2 + ½ fiolki V1 + 5 ml V2 | ||
| Woda do wstrzykiwań | 350 ml | 350 ml | ||||
Tabela 6: Zgodność 2-w-1 (aktywowany W2K) z rozcieńczaniem wodą i bez rozcieńczania
| Na 376 ml (po wymieszaniu 2 komór, bez lipidów) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potas (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnez (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Wapń (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosforany* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Pierwiastki śladowe i witaminy | 5 ml TE2 + ½ fiolki V1 | 5 ml TE2 + ½ fiolki V1 | 5 ml TE2 + ½ fiolki V1 | 5 ml TE2 + ½ fiolki V1 | ||
| Woda do wstrzykiwań | 450 ml | 450 ml | ||||
Skład preparatów zawierających witaminy i pierwiastki śladowe przedstawiono w Tabeli 7 i 8.
Tabela 7: Skład użytego gotowego preparatu zawierającego pierwiastki śladowe:
| Skład na fiolkę 10 ml | TE1 | TE2 | TE4 |
| Żelazo | 8,9 µmol lub 0,5 mg | ||
| Cynk | 38,2 µmol lub 2,5 mg | 15,3 µmol lub 1 mg | 15,3 µmol lub 1 mg |
| Selen | 0,253 µmol lub 0,02 mg | 0,6 µmol lub 0,05 mg | 0,253 µmol lub 0,02 mg |
| Miedź | 3,15 µmol lub 0,2 mg | 4,7 µmol lub 0,3 mg | 3,15 µmol lub 0,2 mg |
| Jod | 0,0788 µmol lub 0,01 mg | 0,4 µmol lub 0,05 mg | 0,079 µmol lub 0,01 mg |
| Fluor | 30 µmol lub 0,57 mg | 26,3 µmol lub 0,5 mg | |
| Molibden | 0,5 µmol lub 0,05 mg | ||
| Mangan | 0,182 µmol lub 0,01 mg | 1,8 µmol lub 0,1 mg | 0,091 µmol lub 0,005 mg |
| Kobalt | 2,5 µmol lub 0,15 mg | ||
| Chrom | 0,4 µmol lub 0,02 mg 18 |
Tabela 8: Skład użytego gotowego preparatu zawierającego witaminy:
Wprowadzanie dodatkowych składników:
- Muszą być zachowane warunki aseptyczne.
- Przygotować miejsce wstrzyknięcia do worka.
- Przebić miejsce wstrzyknięcia i wstrzyknąć dodatkowe składniki za pomocą igły do wstrzykiwań lub urządzenia do przygotowania leku.
- Wymieszać zawartość worka z dodatkowymi składnikami.
Przygotowanie wlewu:
- Muszą być zachowane warunki aseptyczne.
- Zawiesić worek.
- Usunąć plastikowy ochraniacz z portu do podawania leku.
- Zdecydowanym ruchem wprowadzić iglicę zestawu do infuzji do portu do podawania leku.
Podawanie infuzji:
- Wyłącznie do jednorazowego stosowania.
- Podawać lek wyłącznie po rozerwaniu spawów między dwoma lub trzema komorami i wymieszaniu zawartości dwóch lub trzech komór.
- Należy upewnić się, że w gotowej emulsji aktywowanego worka trójkomorowego do infuzji nie następuje rozdzielanie faz lub w gotowym roztworze worka dwukomorowego do infuzji nie ma żadnych cząstek stałych.
- Zaleca się natychmiastowe użycie po otwarciu rozrywalnych spawów. Leku NUMETA G16%E nie należy przechowywać do następnej infuzji.
- Nie podłączać częściowo zużytych worków.
- W celu uniknięcia powstania zatoru powietrznego spowodowanego resztkowym powietrzem zawartym w pierwszym worku, nie podłączać worków seryjnie.
- Do podawania leku NUMETA G16%E zaleca się stosowanie filtra 1,2 mikrona.
- W przypadku stosowania u noworodków i dzieci poniżej 2 lat, należy chronić przed światłem aż do zakończenia podawania. Ekspozycja leku NUMETA G16%E na światło otoczenia, zwłaszcza po zmieszaniu z pierwiastkami śladowymi i (lub) witaminami. powoduje wytwarzanie nadtlenków i innych produktów degradacji, co można zmniejszyć przez ochronę przed światłem.
- Wszelkie resztki niewykorzystanego leku lub jego odpady oraz cały wymagany zestaw jednorazowego użytku należy w odpowiedni sposób usunąć.
| Skład na fiolkę | V1 | V2 |
| Witamina B1 | 2,5 mg | |
| Witamina B2 | 3,6 mg | |
| Nikotynamid | 40 mg | |
| Witamina B6 | 4,0 mg | |
| Kwas pantotenowy | 15,0 mg | |
| Biotyna | 60 µg | |
| Kwas foliowy | 400 µg | |
| Witamina B12 | 5,0 µg | |
| Witamina C | 100 mg | |
| Witamina A | 2300 j.m. | |
| Witamina D | 400 j.m. | |
| Witamina E | 7 j.m. | |
| Witamina K | 200 µg |
Okres ważności po wymieszaniu roztworów:
Lek należy zużyć natychmiast po otwarciu rozrywalnych spawów między dwoma lub trzema komorami.
Badania stabilności mieszanin były prowadzone przez 7 dni w temperaturze od 2°C do 8°C, a następnie
48 godzin w temperaturze 30°C.
Okres ważności po wprowadzeniu dodatkowych składników (elektrolitów, pierwiastków śladowych,
witamin, wody)
Dla określonych dodatkowych składników wykazano stabilność fizyczną leku NUMETA przez 7 dni w
temperaturze od 2°C do 8°C, a następnie w ciągu 48 godzin w temperaturze 30°C.
Z mikrobiologicznego punktu widzenia, lek należy użyć natychmiast. Jeśli taki lek nie zostanie użyty
natychmiast, za czas i warunki przechowywania do momentu jego zastosowania odpowiada użytkownik,
jednak standardowo nie należy przekraczać 24 godzin w temperaturze od 2°C do 8°C, chyba że
przygotowanie/rozpuszczenie/wprowadzenie dodatkowych składników odbyło się w kontrolowanych i
zwalidowanych warunkach aseptycznych.
Nie stosować leku NUMETA G16%E, jeśli worek jest uszkodzony. Poniżej podano cechy uszkodzonego
worka:
- Rozrywalne spawy są otwarte
- Którakolwiek z komór zawiera mieszaninę roztworów
- Roztwory zawierające aminokwasy i glukozę nie są przezroczyste, bezbarwne lub lekko żółte i (lub) zawierają widoczne cząstki
- Emulsja tłuszczowa nie jest jednolitym płynem o mlecznobiałym wyglądzie.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpady. Należy zapytać
farmaceutę co zrobić z lekami, których się już nie potrzebuje. Takie postępowanie pomoże chronić
środowisko.
Co zawiera lek NUMETA G16%E
Substancje czynne:
| Skład | ||
| Substancja czynna | Aktywowany W2K (376 ml) | Aktywowany W3K (500 ml) |
| Komora z aminokwasami | ||
| Alanina | 1,03 g | 1,03 g |
| Arginina | 1,08 g | 1,08 g |
| Kwas asparaginowy | 0,77 g | 0,77 g |
| Cysteina | 0,24 g | 0,24 g |
| Kwas glutaminowy | 1,29 g | 1,29 g |
| Glicyna | 0,51 g | 0,51 g |
| Histydyna | 0,49 g | 0,49 g |
| Izoleucyna | 0,86 g | 0,86 g |
| Leucyna | 1,29 g | 1,29 g |
| Lizyna jednowodna (co odpowiada lizynie) | 1,59 g (1,42 g) | 1,59 g (1,42 g) |
| Metionina | 0,31 g | 0,31 g |
| Ornityny chlorowodorek (co odpowiada ornitynie) | 0,41 g (0,32 g) | 0,41 g (0,32 g) |
| Fenyloalanina | 0,54 g | 0,54 g |
| Prolina | 0,39 g | 0,39 g |
| Seryna | 0,51 g | 0,51 g |
| Tauryna | 0,08 g | 0,08 g |
| Treonina | 0,48 g | 0,48 g |
| Tryptofan | 0,26 g | 0,26 g |
| Tyrozyna | 0,10 g | 0,10 g |
| Walina | 0,98 g | 0,98 g |
| Sodu chlorek | 0,30 g | 0,30 g |
| Potasu octan | 1,12 g | 1,12 g |
| Wapnia chlorek dwuwodny | 0,46 g | 0,46 g |
| Magnezu octan czterowodny | 0,33 g | 0,33 g |
| Sodu glicerofosforan uwodniony | 0,98 g | 0,98 g |
| Komora z glukozą | ||
| Glukoza jednowodna (co odpowiada glukozie bezwodnej) | 85,25 g (77,50 g) | 85,25 g (77,50 g) |
| Komora z lipidami | ||
| Olej z oliwek oczyszczony (ok. 80%) + olej sojowy oczyszczony (ok. 20%) | 15,5 g | |
Roztwór po zmieszaniu/emulsja zawiera następujące składniki:
| Skład | ||||
| Aktywowany W2K | Aktywowany W3K | |||
| Na jednostkę objętości (ml) Azot (g) Aminokwasy (g) Glukoza (g) Lipidy (g) Wartość energetyczna Całkowita wartość energetyczna (kcal) Wartość energetyczna niebiałkowa (kcal) Wartość energetyczna glukozy (kcal) Wartość energetyczna lipidówa (kcal) Wartość energetyczna niebiałkowa/azot (kcal/g N) Wartość energetyczna lipidów/ wartość energetyczna niebiałkowa (%) Wartość energetyczna lipidów/całkowita wartość energetyczna (%) Elektrolity Sód (mmol) Potas (mmol) Magnez (mmol) Wapń (mmol) Fosforanyb (mmol) | 376 2,0 13,0 77,5 0 362 310 310 0 158 Nie dot. Nie dot. 11,6 11,4 1,6 3,1 3,2 | 100 0,52 3,5 20,6 0 96 82 82 0 158 Nie dot. Nie dot. 3,1 3,0 0,41 0,82 0,85 | 500 2,0 13,0 77,5 15,5 517 465 310 155 237 33 30 12,0 11,4 1,6 3,1 4,4 | 100 0,39 2,6 15,5 3,1 103 93 62 31 237 33 30 2,4 2,3 0,31 0,62 0,87 |
| Octany (mmol) Jabłczany (mmol) Chlorki (mmol) | 14,5 4,3 13,8 | 3,9 1,1 3,7 | 14,5 4,3 13,8 | 2,9 0,86 2,8 |
| pH (w przybliżeniu) Osmolarność w przybliżeniu (mOsm/l) | 5,5 1585 | 5,5 1585 | 5,5 1230 | 5,5 1230 |
W tym wartość energetyczna fosfolipidów z jaja kurzego do wstrzykiwań.
W tym fosforany z fosfolipidów z jaja kurzego do wstrzykiwań będące składnikiem emulsji lipidowej.
Pozostałe składniki:
Kwas L-jabłkowy
Kwas solny
Fosfolipidy z jaja kurzego do wstrzykiwań
Glicerol
Sodu oleinian
Sodu wodorotlenek
Woda do wstrzykiwań
do ustalenia pH
Baxter, Numeta, Numetzah i Numetah są znakami towarowymi Baxter International Inc.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterBaxter S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Numeta G16%EPostać farmaceutyczna: Roztwór, -Substancja czynna: combinationsBez receptyPostać farmaceutyczna: Roztwór, -Substancja czynna: combinationsBez receptyPostać farmaceutyczna: Roztwór, -Substancja czynna: combinationsBez recepty
Odpowiedniki Numeta G16%E w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Numeta G16%E – Hiszpania
Odpowiednik Numeta G16%E – Ukraina
Lekarze online w sprawie Numeta G16%E
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Numeta G16%E – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














