
Numeta G13%E Preterm

Zapytaj lekarza o receptę na Numeta G13%E Preterm

Jak stosować Numeta G13%E Preterm
Ulotka dołączona do opakowania: informacja dla użytkownika
NUMETA G13%E Preterm, emulsja do infuzji
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona
informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza dziecka, farmaceuty lub pielęgniarki.
- Jeśli u dziecka wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi prowadzącemu lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek NUMETA G13%E Preterm i w jakim celu się go stosuje
- 2. Informacje ważne przed podaniem dziecku leku NUMETA G13%E Preterm
- 3. Jak stosować lek NUMETA G13%E Preterm
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek NUMETA G13%E Preterm
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek NUMETA G13%E Preterm i w jakim celu się go stosuje
Lek NUMETA G13%E Preterm jest specjalistyczną emulsją do żywienia przeznaczoną dla noworodków
urodzonych przedwcześnie. Jest podawana przez rurkę wprowadzaną do żyły dziecka, w sytuacji, gdy
dziecko nie może przyjmować wszystkich składników pożywienia doustnie.
Lek NUMETA występuje w postaci worka trójkomorowego, gdzie poszczególne komory zawierają:
- roztwór glukozy 50%;
- pediatryczny roztwór aminokwasów z elektrolitami 5,9%;
- emulsję tłuszczową 12,5%.
W zależności od potrzeb dziecka, dwa lub trzy z tych roztworów są mieszane w worku przed podaniem
dziecku.
Lek NUMETA G13%E Preterm musi być stosowany jedynie pod kontrolą lekarza.
2. Informacje ważne przed podaniem dziecku leku NUMETA G13%E Preterm
Kiedy dziecku nie powinien być podawany lek NUMETA G13%E Preterm:
W przypadku roztworów glukozy i aminokwasów z elektrolitami wymieszanych w worku („2 w 1”):
- jeśli dziecko ma uczulenie na jaja, soję, orzeszki ziemne lub którykolwiek z pozostałych składników tego leku lub na składniki pojemnika (wymienione w punkcie 6);
- jeśli organizm dziecka nie może wykorzystywać składników budulcowych białka;
- jeśli we krwi dziecka jest duże stężenie któregokolwiek z elektrolitów występujących w leku NUMETA G13%E Preterm;
- lek NUMETA G13%E Preterm (lub inne roztwory zawierające wapń) nie może być podawany równocześnie z ceftriaksonem (antybiotyk), nawet jeśli używa się osobnych linii do infuzji. Istnieje ryzyko powstawania cząstek w krążeniu noworodka, które mogą prowadzić do zgonu.
- jeśli dziecko ma hiperglikemię (szczególnie duże stężenie cukru we krwi).
W przypadku roztworów z glukozą, aminokwasami z elektrolitami i emulsją tłuszczową wymieszanych w worku („3 w 1”):
We wszystkich wymienionych powyżej sytuacjach dla leku „2 w 1” oraz dodatkowo:
- jeśli u dziecka występuje szczególnie duże stężenie tłuszczów we krwi.
We wszystkich przypadkach lekarz podejmuje decyzję o podaniu leku uwzględniając wiek, masę ciała i
stan kliniczny dziecka. Lekarz weźmie również pod uwagę wyniki wszystkich przeprowadzonych badań.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem podawania leku NUMETA G13%E Preterm należy omówić to z lekarzem
prowadzącym lub pielęgniarką.
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania. Ekspozycja leku
NUMETA G13%E Preterm na światło otoczenia, zwłaszcza po zmieszaniu z pierwiastkami śladowymi
i (lub) witaminami, powoduje wytwarzanie nadtlenków i innych produktów degradacji, co można
zmniejszyć przez ochronę przed światłem.
Reakcje alergiczne:
Infuzję należy natychmiast przerwać, jeśli wystąpią jakiekolwiek oznaki lub objawy reakcji alergicznej
(takie jak gorączka, pocenie się, dreszcze, ból głowy, wysypka skórna lub trudności w oddychaniu). Ten
lek zawiera olej sojowy, który rzadko może powodować reakcje nadwrażliwości. U niektórych osób
uczulonych na białka orzeszków ziemnych rzadko obserwowano również uczulenie na białka soi.
Lek NUMETA G13%E Preterm zawiera glukozę wytwarzaną ze skrobi kukurydzianej. Dlatego lek
NUMETA G13%E Preterm należy stosować z ostrożnością u pacjentów ze stwierdzoną alergią na
kukurydzę lub produkty zawierające kukurydzę.
Ryzyko powstawania osadu z ceftriaksonem (antybiotyk):
Antybiotyku o nazwie ceftriakson nie wolno mieszać ani podawać jednocześnie z żadnymi roztworami
zawierającymi wapń (w tym z lekiem NUMETA G13%E Preterm), podawanymi drogą kroplówki
dożylnej.
Lekarz wie o tym i nie poda ich pacjentowi jednocześnie, nawet przez różne linie do infuzji albo inne
miejsca infuzji.
Powstawanie małych cząstek w naczyniach krwionośnych w płucach:
Trudności z oddychaniem mogą być również oznaką, że powstały małe cząstki blokujące naczynia
krwionośne w płucach (osady w naczyniach płucnych). Jeśli u dziecka wystąpią jakiekolwiek trudności z
oddychaniem, należy powiedzieć o tym lekarzowi lub pielęgniarce. Zdecydują oni o podjęciu
odpowiedniego działania.
Zakażenie i posocznica:
Lekarz będzie uważnie obserwował dziecko celem wykrycia objawów infekcji. Stosowanie zasad aseptyki
(postępowanie chroniące od drobnoustrojów) przy wprowadzaniu i utrzymywaniu cewnika oraz podczas
przygotowywania mieszaniny odżywczej, może zmniejszyć ryzyko infekcji.
Niekiedy, jeśli w żyle umieszczona jest rurka (cewnik dożylny), u dziecka może dojść do zakażenia i
posocznicy (obecności bakterii we krwi). Niektóre leki oraz choroby mogą zwiększać ryzyko zakażenia
lub posocznicy. Pacjenci wymagający odżywiania pozajelitowego (podawania pożywienia za pomocą
rurki umieszczonej w żyle), ze względu na stan zdrowia mogą być bardziej narażeni na powstanie
zakażenia.
Zespół przeciążenia tłuszczami:
Podczas stosowania podobnych leków opisywano występowanie zespołu przeciążenia tłuszczami.
Zmniejszona lub ograniczona zdolność organizmu do usuwania tłuszczów zawartych w leku
NUMETA G13%E Preterm lub przedawkowanie, może skutkować tzw. zespołem przeciążenia tłuszczami
(patrz punkty 3 i 4).
Zmiany zawartości substancji chemicznych we krwi:
Lekarz będzie sprawdzał i śledził stan płynów u dziecka, skład chemiczny krwi oraz zawartość innych
substancji podczas leczenia z użyciem leku NUMETA G13%E Preterm. Czasami odżywianie osób
poważnie niedożywionych może spowodować istotne zmiany składu chemicznego krwi, które mogą
wymagać korekty. Może również pojawić się dodatkowy płyn w tkankach i opuchlizna. Zaleca się
powolne i ostrożne rozpoczęcie odżywiania pozajelitowego.
Monitorowanie i dostosowanie:
Lekarz będzie uważnie obserwował i dostosowywał podawanie leku NUMETA G13%E Preterm do
indywidualnych potrzeb dziecka, szczególnie w następujących okolicznościach:
- ciężkie stany pourazowe;
- ciężka cukrzyca;
- wstrząs;
- atak serca;
- ciężkie zakażenie;
- pewne rodzaje śpiączki.
Stosowanie z zachowaniem ostrożności:
Lek NUMETA G13%E Preterm powinien być stosowany z zachowaniem ostrożności, jeśli u dziecka
występuje:
- obrzęk płuc (płyn w płucach) lub niewydolność serca;
- ciężkie zaburzenia czynności wątroby;
- zaburzenia prawidłowego przyswajania składników odżywczych;
- duże stężenie cukru we krwi;
- problemy z nerkami;
- ciężkie zaburzenia przemiany materii (kiedy proces rozkładu substancji nie przebiega normalnie);
- zaburzenia krzepnięcia krwi.
Stan płynów w organizmie dziecka, wyniki badań wątroby i (lub) inne wyniki badań krwi będą dokładnie
sprawdzane.
Informacje o stosowaniu tego leku u wcześniaków urodzonych przed 28. tygodniem ciąży są ograniczone.
Lek NUMETA G13%E Preterm a inne leki
Należy powiedzieć lekarzowi o wszystkich lekach stosowanych obecnie lub ostatnio u dziecka, a także o
lekach, które będą stosowane.
Lek NUMETA G13%E Preterm nie może być podawany w tym samym czasie co:
- ceftriakson(antybiotyk), nawet w osobnych liniach do infuzji, z powodu ryzyka powstawania cząstek stałych;
- krewprzez ten sam zestaw do infuzji, z powodu ryzyka pseudoaglutynacji (czerwone krwinki ulegają sklejaniu);
- ampicylina, fosfenytoina lub furosemidprzez tą samą linię do infuzji, z powodu ryzyka powstawania cząstek stałych.
Kumaryna i warfaryna (antykoagulanty):
Lekarz będzie uważnie obserwował dziecko, jeśli jest u niego stosowana kumaryna lub warfaryna. Leki te
są antykoagulantami stosowanymi do zapobiegania krzepnięciu krwi. Witamina K1 jest naturalnym
składnikiem oliwy oraz oleju sojowego. Witamina K1 może wchodzić w interakcje z lekami takimi jak
kumaryna i warfaryna.
Testy laboratoryjne:
Lipidy wchodzące w skład tej emulsji mogą wpływać na wyniki określonych badań laboratoryjnych.
Badania laboratoryjne mogą zostać przeprowadzone po upływie od 5 do 6 godzin po zastosowaniu
lipidów lub od ostatniego ich podania.
Interakcje leku NUMETA G13%E Preterm z lekami mogącymi wpływać na stężenie potasu/ metabolizm:
Lek NUMETA G13%E Preterm zawiera potas. Duże stężenia potasu we krwi mogą wywołać
nieprawidłowy rytm pracy serca. Należy otoczyć szczególną opieką pacjentów przyjmujących diuretyki
(leki mające na celu zmniejszenie zatrzymywania płynów) lub inhibitory ACE (leki stosowane w
wysokim ciśnieniu krwi) lub antagonistów receptora angiotensyny II (leki stosowane w wysokim
ciśnieniu krwi) lub leki immunosupresyjne (leki mogące zmniejszać normalną odpowiedź
immunologiczną organizmu). Leki tego typu mogą zwiększać stężenie potasu.
3. Jak stosować lek NUMETA G13%E Preterm
Lek NUMETA G13%E Preterm powinien być zawsze podawany dziecku zgodnie z zaleceniami lekarza.
W razie wątpliwości należy skontaktować się z lekarzem.
Grupa wiekowa
Lek NUMETA G13%E Preterm został zaprojektowany do zaspokojenia potrzeb żywieniowych
noworodków urodzonych przedwcześnie.
Lek NUMETA G13%E Preterm może nie być właściwy dla niektórych wcześniaków, ponieważ ich stan
może wymagać zastosowania dobranego indywidualnie składu w celu zaspokojenia ich szczególnych
potrzeb żywieniowych. Lekarz zadecyduje, czy ten lek jest odpowiedni dla dziecka.
Podawanie
Ten lek jest emulsją do infuzji. Jest on podawany przez plastikową rurkę do żyły w ramieniu lub do dużej
żyły w klatce piersiowej dziecka.
Lekarz może zadecydować o niepodawaniu dziecku lipidów. Worek leku NUMETA G13%E Preterm jest
zaprojektowany w taki sposób, że jeśli to konieczne, można rozerwać przegrody jedynie pomiędzy
komorą z aminokwasami/elektrolitami, a komorą zawierającą glukozę. W takim przypadku, przegroda
pomiędzy komorą z aminokwasami a lipidami pozostaje nienaruszona. W ten sposób zawartość worka
może zostać podana bez lipidów.
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania (patrz punkt 2).
Dawka i czas trwania leczenia
Lekarz zadecyduje o dawce leku oraz jak długo będzie on podawany. Dawka zależy od potrzeb
żywieniowych dziecka. Dawka zostanie ustalona na podstawie masy ciała dziecka, stanu klinicznego oraz
zdolności organizmu do rozkładu i wykorzystania składników leku NUMETA G13%E Preterm.
Dodatkowe składniki żywieniowe lub białka można również podawać doustnie/dojelitowo.
Zastosowanie u dziecka większej niż zalecana dawki leku NUMETA G13%E Preterm
Objawy
Za duża dawka leku lub zbyt szybkie podawanie może spowodować:
- nudności (mdłości);
- wymioty;
- drgawki;
- zaburzenia elektrolitowe (nieprawidłowe ilości elektrolitów we krwi);
- objawy hiperwolemii (zwiększonej objętości krwi krążącej, nadmiar płynu w naczyniach krwionośnych);
- kwasicę (zwiększoną kwasowość krwi). W sytuacjach jak powyżej, należy natychmiast przerwać infuzję. Lekarz podejmie decyzję, czy wymagane są dodatkowe działania.
Przedawkowanie tłuszczów zawartych w leku NUMETA G13%E Preterm może prowadzić do
wystąpienia „zespołu przeciążenia tłuszczami”, który zwykle ustępuje po przerwaniu infuzji. U
noworodków (niemowląt) i małych dzieci (dzieci poniżej 2 lat) zespół przeciążenia tłuszczami był
powiązany z zaburzeniami oddychania prowadzącymi do zmniejszenia ilości tlenu w organizmie
(niewydolność oddechowa) i stanami prowadzącymi do zwiększonej kwasowości krwi (kwasica).
Aby zapobiec takim sytuacjom, lekarz będzie systematycznie sprawdzał stan dziecka oraz przeprowadzał
u niego badania krwi w trakcie leczenia.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego dziecka one
wystąpią.
W przypadku zaobserwowania u dziecka jakichkolwiek zmian samopoczucia podczas leczenia lub po jego
zakończeniu, należy natychmiast powiadomić lekarza lub pielęgniarkę.
Badania przeprowadzane przez lekarza podczas stosowania leku przez dziecko powinny zminimalizować
ryzyko działań niepożądanych.
Jeśli wystąpią objawy reakcji alergicznej, infuzja powinna zostać wstrzymana i należy natychmiast
skontaktować się z lekarzem. Może być to poważne, a objawy mogą obejmować:
- pocenie się
- dreszcze
- ból głowy
- wysypki skórne
- trudności z oddychaniem
Inne zaobserwowane działania niepożądane:
Częste: mogą dotyczyć 1 na 10 osób
- Małe stężenie fosforanów we krwi (hipofosfatemia)
- Duże stężenie cukru we krwi (hiperglikemia)
- Duże stężenie wapnia we krwi (hiperkalcemia)
- Duże stężenie triglicerydów we krwi (hipertriglicerydemia)
- Zaburzenia elektrolitowe (hiponatremia)
Niezbyt częste: mogą dotyczyć 1 na 100 osób
- Duże stężenie lipidów we krwi (hiperlipidemia)
- Stan, w którym żółć nie może płynąć z wątroby do dwunastnicy (cholestaza). Dwunastnica jest częścią jelit.
Nieznana: częstość nie może być określona na podstawie dostępnych danych(Te działania niepożądane
zgłoszono tylko po obwodowym podaniu leku NUMETA G13%E Preterm i NUMETA G16%E przy
niedostatecznym rozcieńczeniu).
- Martwica skóry
- Uszkodzenie tkanki miękkiej
- Wynaczynienie
Następujące działania niepożądane były zgłaszane dla innych leków do żywienia pozajelitowego:
- Zmniejszona lub ograniczona zdolność do usuwania lipidów zawartych w leku NUMETA może prowadzić do wystąpienia zespołu przeciążenia tłuszczami. Poniższe oznaki i objawy tego zespołu zazwyczaj ustępują po zaprzestaniu infuzji emulsji tłuszczowej:
- Nagłe i ostre pogorszenie stanu klinicznego pacjenta
- Duże stężenie tłuszczów we krwi (hiperlipidemia)
- Gorączka
- Stłuszczenie wątroby (hepatomegalia)
- Pogorszenie czynności wątroby
- Zmniejszenie liczby czerwonych krwinek, które może spowodować bladość skóry i być przyczyną osłabienia lub duszności (niedokrwistość)
- Zmniejszenie liczby białych krwinek, które może zwiększać ryzyko zakażenia (leukopenia)
- Zmniejszenie liczby płytek krwi, które może zwiększać ryzyko powstawania siniaków i (lub) krwawień (małopłytkowość)
- Zaburzenia krzepnięcia krwi, które wpływają na zdolność krwi do wytwarzania zakrzepu
- Zaburzenia oddychania prowadzące do zmniejszenia ilości tlenu w organizmie (niewydolność oddechowa)
- Stany prowadzące do zwiększonej kwasowości krwi (kwasica)
- Śpiączka wymagająca hospitalizacji
- Powstawanie małych cząstek, które mogą spowodować zablokowanie naczyń krwionośnych w płucach (osady w naczyniach płucnych) lub trudności z oddychaniem.
Zgłaszanie działań niepożądanych
Jeśli u dziecka wystąpią jakiekolwiek objawy niepożądane, należy zwrócić się do lekarza lub pielęgniarki.
Dotyczy to również wszelkich objawów niepożądanych niewymienionych w tej ulotce.
Działania niepożądane można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych
Działań Produktów Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i
Produktów Biobójczych
Al. Jerozolimskie 181 C
PL 02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek NUMETA G13%E Preterm
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci, gdy nie jest podawany.
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania (patrz punkt 2).
Nie stosować tego leku po upływie terminu ważności zamieszczonego na worku oraz opakowaniu
zewnętrznym (MM/RRRR). Termin ważności oznacza ostatni dzień podanego miesiąca.
Nie zamrażać.
Przechowywać w worku ochronnym.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić środowisko.
6. Zawartość opakowania i inne informacje
Jak wygląda lek NUMETA G13%E Preterm i co zawiera opakowanie
Lek NUMETA G13%E Preterm znajduje się w trójkomorowym worku. Zawartość każdego worka jest
jałowa i składa się z roztworu glukozy, roztworu aminokwasów dla dzieci wraz z elektrolitami oraz
emulsji tłuszczowej, zgodnie z poniższym opisem.
| Wielkość pojemnika | 50% roztwór glukozy | 5,9% roztwór aminokwasów z elektrolitami | 12,5% emulsja tłuszczowa |
| 300 ml | 80 ml | 160 ml | 60 ml |
Wygląd przed przygotowaniem:
- Roztwory w komorach zawierających aminokwasy i glukozę są przezroczyste, bezbarwne lub lekko żółte
- Emulsja tłuszczowa jest jednolitym i mlecznobiałym płynem Wygląd po przygotowaniu:
- Roztwory do infuzji „2 w 1” (aminokwasy/elektrolity i glukoza) są przezroczyste, bezbarwne lub lekko żółte
- Emulsja do infuzji „3 w 1” jest jednolita i mlecznobiała Trójkomorowy worek to wielowarstwowy worek plastikowy.
Aby uchronić przed kontaktem z powietrzem, worek NUMETA G13%E Preterm jest opakowany w worek
ochronny, chroniący przed dostępem tlenu, który zawiera również pochłaniacz tlenu i wskaźnik tlenu.
Wielkość opakowań
worki 300 ml: 10 worków w tekturowym pudełku
1 worek 300 ml
Nie wszystkie rodzaje opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Warszawa
Wytwórca
Baxter S.A.
Boulevard René Branquart 80
7860 Lessines
Belgia
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod następującymi nazwami:
| Kraj | Nazwa |
| Austria Niemcy | Numeta G 13 % E Emulsion zur Infusion |
| Belgia Luksemburg | NUMETZAH G13%E, émulsion pour perfusion |
| Francja | NUMETAH G13%E PREMATURES, emulsion pour perfusion |
| Dania Norwegia Szwecja | Numeta G13E |
| Republika Czeska | NUMETA G 13 % E |
| Grecja | NUMETA Preterm G 13 E |
| Holandia | NUMETA G13%E emulsie voor infusie |
| Irlandia Malta Wielka Brytania | Numeta G13%E Preterm, Emulsion for Infusion |
| Włochy | NUMETA G13E emulsione per infusione |
| Finlandia | Numeta G13E infuusioneste, emulsio |
| Polska | NUMETA G13%E Preterm |
| Portugalia | Numeta G13%E |
| Hiszpania | NUMETA G13%E, emulsión para perfusión |
Data ostatniej aktualizacji ulotki: Maj 2024 --------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego lub pracowników służby zdrowia*
*W niektórych przypadkach ten lek może być podawany w domu przez rodziców lub innych opiekunów.
W tych przypadkach, rodzice/opiekunowie powinni przeczytać poniższe informacje.
Nie należy wprowadzać do worka dodatkowych składników bez uprzedniego sprawdzenia zgodności.
Mogłoby to powodować powstanie cząstek stałych lub destabilizację emulsji tłuszczowej. To może
prowadzić do blokowania naczyń krwionośnych.
Lek NUMETA G13%E Preterm powinien osiągnąć temperaturę pokojową przed zastosowaniem.
Przed zastosowaniem leku NUMETA G13%E Preterm, worek przygotowuje się jak pokazano poniżej.
Należy upewnić się, że worek nie jest uszkodzony. Worek może być użyty wyłącznie, gdy nie jest
uszkodzony. Poniżej podano cechy nieuszkodzonego worka:
- Przegrody są nienaruszone. Wskazuje na to brak wymieszania zawartości którejkolwiek z trzech komór.
- Roztwory zawierające aminokwasy i glukozę są przezroczyste, bezbarwne lub lekko żółte, bez widocznych cząstek.
- Emulsja tłuszczowa jest jednolitym płynem o mlecznobiałym wyglądzie.
Przed otwarciem worka ochronnego należy sprawdzić barwę wskaźnika tlenu.
- Należy porównać ją z barwą wzorcową wydrukowaną obok symbolu OK i pokazaną na zadrukowanym obszarze etykiety wskaźnika.
- Nie należy stosować leku, gdy barwa wskaźnika tlenu nie odpowiada barwie wzorcowej wydrukowanej obok symbolu OK. Rysunki 1 i 2 przedstawiają sposób zdejmowania worka ochronnego. Wyrzucić worek ochronny, wskaźnik tlenu i pochłaniacz tlenu.









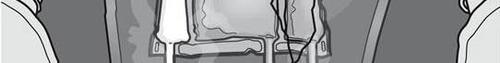
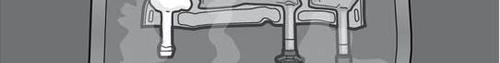




Rysunek 1
Rysunek 2
Przygotowanie zmieszanej emulsji:
- Przed rozerwaniem spawów upewnić się, że lek ma temperaturę pokojową.
- Umieścić worek na płaskiej, czystej powierzchni.
Aktywowanie worka trójkomorowego (mieszanie 3 roztworów przez otwarcie dwóch rozrywalnych
spawów)
Krok 1: Zwijanie worka należy rozpoczynać od strony z wieszakiem.
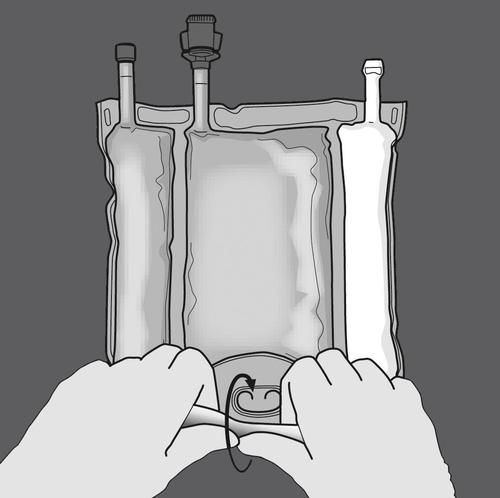
Krok 2: Naciskać, aż otworzą się spawy.
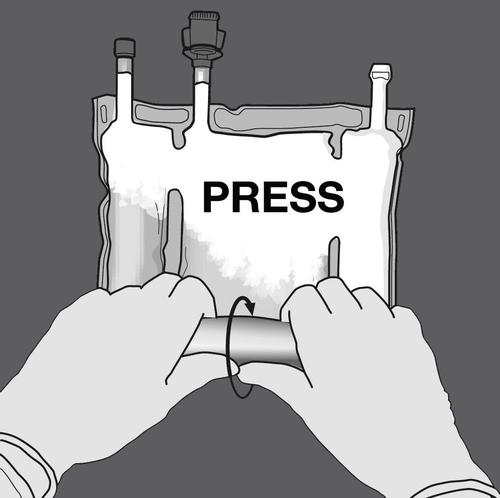
NACISNĄĆ
Krok 3: Zmienić kierunek przez zwijanie worka w kierunku do wieszaka.
Kontynuować do całkowitego otwarcia spawu.
Postępować w ten sam sposób do całkowitego otwarcia drugiego spawu.
NACISNĄĆ
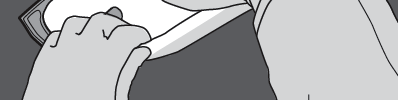

Krok 4: Obrócić worek co najmniej trzy razy, aby dokładnie wymieszać zawartość.
Wymieszany roztwór powinien mieć wygląd mlecznobiałej emulsji.

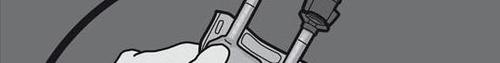






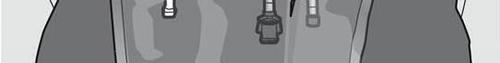
Krok 5: Usunąć zatyczkę ochronną z miejsca do podawania leku i wprowadzić zestaw do
podawania dożylnego.








Aktywowanie worka dwukomorowego (mieszanie 2 roztworów przez otwarcie rozrywalnego spawu między
komorami zawierającymi aminokwasy i glukozę)
Krok 1: Aby wymieszać tylko 2 roztwory, zwinąć worek, rozpoczynając od górnego rogu
(z wieszakiem) obok spawu oddzielającego roztwory.
Nacisnąć, aby otworzyć spaw oddzielający przedziały z glukozą i aminokwasami.
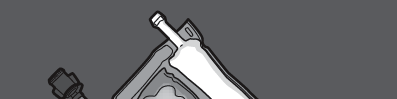
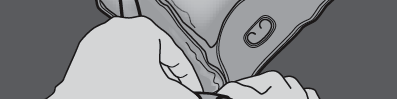
NACISNĄĆ

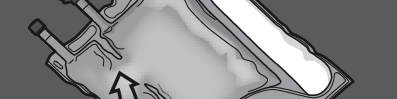
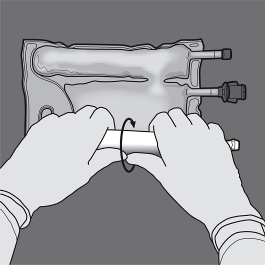
Krok 2: Ułożyć worek tak, by komora z emulsją tłuszczową była najbliżej użytkownika.
Zwinąć worek, ochraniając dłońmi komorę z emulsją tłuszczową.
Krok 3: Naciskać jedną ręką i zwijać worek w kierunku rurek.

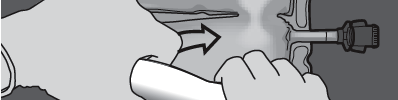
NACISNĄĆ


Krok 4: Zmienić kierunek, zwijając worek w kierunku górnego końca (z wieszakiem).
Nacisnąć drugą ręką do momentu całkowitego rozerwania spawu oddzielającego roztwory
aminokwasów i glukozy.

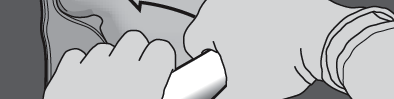
NACISNĄĆ


Krok 5: Obrócić worek co najmniej trzy razy, aby dokładnie wymieszać zawartość.
Wymieszany roztwór powinien być przezroczysty, bezbarwny lub lekko żółty.







Krok 6: Usunąć zatyczkę ochronną z miejsca do podawania leku i wprowadzić zestaw do
podawania dożylnego.








W ciągu pierwszej godziny szybkość przepływu należy stopniowo zwiększać. Szybkość przepływu
podawania musi zostać dostosowana na podstawie poniższych czynników:
- podawanej dawki;
- przyjmowanej dziennie objętości;
- czasu trwania infuzji.
Sposób podawania:
W przypadku stosowania u noworodków i dzieci poniżej 2 lat, roztwór (w workach i zestawach do
podawania) należy chronić przed światłem aż do zakończenia podawania.
Do podawania leku NUMETA G13%E Preterm zaleca się stosowanie filtra 1,2 mikrona.
Z powodu dużej osmolarności nierozcieńczony lek NUMETA G13%E Preterm można podawać wyłącznie
przez żyłę centralną. Odpowiednie rozcieńczenie leku NUMETA G13%E Preterm wodą do wstrzykiwań
zmniejsza osmolarność i umożliwia infuzję do naczynia obwodowego. Poniższy wzór przedstawia wpływ
rozcieńczenia na osmolarność leku.
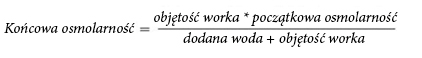
W poniższej tabeli przedstawiono przykłady osmolarności aktywowanego worka dwukomorowego
i aktywowanego worka trójkomorowego po dodaniu wody do wstrzykiwań:
| Aminokwasy i glukoza (aktywowany W2K) | Aminokwasy, glukoza i lipidy (aktywowany W3K) | |
| Objętość początkowa w worku (ml) | 240 | 300 |
| Osmolarność początkowa (mOsm/l w przybliżeniu) | 1400 | 1150 |
| Objętość dodanej wody (ml) | 240 | 300 |
| Objętość końcowa po dodaniu (ml) | 480 | 600 |
| Osmolarność po dodaniu (mOsm/l w przybliżeniu) | 700 | 575 |
Wprowadzanie dodatkowych składników:
Ekspozycja na światło roztworów do dożylnego żywienia pozajelitowego, zwłaszcza po zmieszaniu z
pierwiastkami śladowymi i (lub) witaminami, może mieć niekorzystny wpływ na wyniki kliniczne u
noworodków, ze względu na wytwarzanie nadtlenków i innych produktów degradacji. W przypadku
stosowania u noworodków i dzieci poniżej 2 lat, lek NUMETA G13%E Preterm należy chronić przed
światłem otoczenia aż do zakończenia podawania.
Dodatkowe składniki wykazujące zgodność, można dodawać do odtworzonej mieszaniny poprzez miejsce
do wstrzykiwań (po otwarciu rozrywalnych spawów i po zmieszaniu zawartości dwóch lub trzech komór).
Witaminy mogą być również dodawane do komory zawierającej glukozę przed odtworzeniem mieszaniny
(przed otwarciem rozrywalnych spawów i przed zmieszaniem roztworów i emulsji).
Możliwe dodatki gotowych roztworów pierwiastków śladowych (zidentyfikowanych jako TE1 i TE4),
witamin (zidentyfikowanych jako liofilizat V1 i emulsja V2) i elektrolitów w określonych ilościach
przedstawiono w Tabelach 1-4.
- 1.Zgodność z TE4, V1 i V2
Tabela 1: Zgodność 3-w-1 (aktywowany W3K) z rozcieńczeniem wodą i bez rozcieńczenia
| Na 300 ml (po wymieszaniu 3 komór, z lipidami) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 6,6 | 5,0 | 11,6 | 6,6 | 5,0 | 11,6 |
| Potas (mmol) | 6,2 | 4,2 | 10,4 | 6,2 | 4,2 | 10,4 |
| Magnez (mmol) | 0,47 | 0,83 | 1,3 | 0,47 | 0,83 | 1,3 |
| Wapń (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 3,5 | 7,3 |
| Fosforany* (mmol) | 3,8 | 2,5 | 6,3 | 3,8 | 2,5 | 6,3 |
| Pierwiastki śladowe i witaminy | 15 ml TE4 + 1,5 fiolki V1 + 25 ml V2 | 15 ml TE4 + 1,5 fiolki V1 + 25 ml V2 | 15 ml TE4 + 1,5 fiolki V1 + 25 ml V2 | 15 ml TE4 + 1,5 fiolki V1 + 25 ml V2 | ||
| Woda do wstrzykiwań | 300 ml | 300 ml | ||||
Tabela 2: Zgodność 2-w-1 (aktywowany W2K) z rozcieńczeniem wodą i bez rozcieńczenia
| Na 240 ml (po wymieszaniu 2 komór, bez lipidów) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 6,4 | 17,6 | 24 | 6,4 | 0,0 | 6,4 |
| Potas (mmol) | 6,2 | 17,8 | 24 | 6,2 | 0,0 | 6,2 |
| Magnez (mmol) | 0,47 | 2,13 | 2,6 | 0,47 | 0,0 | 0,47 |
| Wapń (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 0,0 | 3,8 |
| Fosforany* (mmol) | 3,2 | 4,0 | 7,2 | 3,2 | 0,0 | 3,2 |
| Pierwiastki śladowe i witaminy | 2,5 ml TE4 + ¼ fiolki V1 | 2,5 ml TE4 + ¼ fiolki V1 | 2,5 ml TE4 + ¼ fiolki V1 | 2,5 ml TE4 + ¼ fiolki V1 | ||
| Woda do wstrzykiwań | 240 ml | 240 ml |
- 2.Zgodność z TE1, V1 i V2Tabela 3: Zgodność 3-w-1 (aktywowany W3K) z rozcieńczeniem wodą i bez rozcieńczenia
| Na 300 ml (po wymieszaniu 3 komór, z lipidami) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 6,6 | 5,0 | 11,6 | 6,6 | 0,0 | 6,6 |
| Potas (mmol) | 6,2 | 4,2 | 10,4 | 6,2 | 0,0 | 6,2 |
| Magnez (mmol) | 0,47 | 0,83 | 1,3 | 0,47 | 0,0 | 0,47 |
| Wapń (mmol) | 3,8 | 1,9 | 5,7 | 3,8 | 0,0 | 3,8 |
| Fosforany* (mmol) | 3,8 | 2,5 | 6,3 | 3,8 | 0,0 | 3,8 |
| Pierwiastki śladowe i witaminy | 2,5 ml TE1 + ¼ fiolki V1 + 2,5 ml V2 | 2,5 ml TE1 + ¼ fiolki V1 + 2,5 ml V2 | 2,5 ml TE1 + ¼ fiolki V1 + 2,5 ml V2 | 2,5 ml TE1 + ¼ fiolki V1 + 2,5 ml V2 | ||
| Woda do wstrzykiwań | 300 ml | 300 ml | ||||
Tabela 4: Zgodność 2-w-1 (aktywowany W2K) z rozcieńczaniem wodą i bez rozcieńczania
| Na 240 ml (po wymieszaniu 2 komór, bez lipidów) | ||||||
| Dodatek bez rozcieńczenia | Dodatek z rozcieńczeniem | |||||
| Dodatkowe składniki | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość | Zawarta ilość | Maksymalna dodana ilość | Maksymalna całkowita ilość |
| Sód (mmol) | 6,4 | 17,6 | 24 | 6,4 | 0,0 | 6,4 |
| Potas (mmol) | 6,2 | 17,8 | 24 | 6,2 | 0,0 | 6,2 |
| Magnez (mmol) | 0,47 | 2,13 | 2,6 | 0,47 | 0,0 | 0,47 |
| Wapń (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 0,0 | 3,8 |
| Fosforany* (mmol) | 3,2 | 4,0 | 7,2 | 3,2 | 0,0 | 3,2 |
| Pierwiastki śladowe i witaminy | 2,5 ml TE1 + ¼ fiolki V1 | 2,5 ml TE1 + ¼ fiolki V1 | 2,5 ml TE1 + ¼ fiolki V1 | 2,5 ml TE1 + ¼ fiolki V1 | ||
| Woda do wstrzykiwań | 240 ml | 240 ml | ||||
Skład preparatów zawierających witaminy i pierwiastki śladowe przedstawiono w Tabeli 5 i 6.
Tabela 5: Skład użytego gotowego preparatu zawierającego pierwiastki śladowe:
Tabela 6: Skład użytego gotowego preparatu zawierającego witaminy:
Wprowadzanie dodatkowych składników:
- Muszą być zachowane warunki aseptyczne.
- Przygotować miejsce wstrzyknięcia do worka.
- Przebić miejsce wstrzyknięcia i wstrzyknąć dodatkowe składniki za pomocą igły do wstrzykiwań lub urządzenia do przygotowania leku.
- Wymieszać zawartość worka z dodatkowymi składnikami.
Przygotowanie wlewu:
- Muszą być zachowane warunki aseptyczne.
- Zawiesić worek.
- Usunąć plastikowy ochraniacz z portu do podawania leku.
- Zdecydowanym ruchem wprowadzić iglicę zestawu do infuzji do portu do podawania leku.
Podawanie infuzji:
- Wyłącznie do jednorazowego stosowania.
- Podawać lek wyłącznie po rozerwaniu spawów między dwoma lub trzema komorami i wymieszaniu zawartości dwóch lub trzech komór.
- Należy upewnić się, że w gotowej emulsji aktywowanego worka trójkomorowego do infuzji nie następuje rozdzielanie faz lub w gotowym roztworze worka dwukomorowego do infuzji nie ma żadnych cząstek stałych.
- Zaleca się natychmiastowe użycie po otwarciu rozrywalnych spawów. Leku NUMETA G13%E Preterm nie należy przechowywać do następnej infuzji.
- Nie podłączać częściowo zużytych worków.
| Skład na fiolkę | TE1 (10 ml) | TE4 (10 ml) |
| Cynk | 38,2 µmol lub 2,5 mg | 15,3 µmol lub 1 mg |
| Selen | 0,253 µmol lub 0,02 mg | 0,253 µmol lub 0,02 mg |
| Miedź | 3,15 µmol lub 0,2 mg | 3,15 µmol lub 0,2 mg |
| Jod | 0,0788 µmol lub 0,01 mg | 0,079 µmol lub 0,01 mg |
| Fluor | 30 µmol lub 0,57 mg | |
| Mangan | 0,182 µmol lub 0,01 mg | 0,091 µmol lub 0,005 mg |
| Skład na fiolkę | V1 | V2 |
| Witamina B1 | 2,5 mg | |
| Witamina B2 | 3,6 mg | |
| Nikotynamid | 40 mg | |
| Witamina B6 | 4,0 mg | |
| Kwas pantotenowy | 15,0 mg | |
| Biotyna | 60 µg | |
| Kwas foliowy | 400 µg | |
| Witamina B12 | 5,0 µg | |
| Witamina C | 100 mg | |
| Witamina A | 2300 j.m. | |
| Witamina D | 400 j.m. | |
| Witamina E | 7 j.m. | |
| Witamina K | 200 µg |
- W celu uniknięcia powstania zatoru powietrznego spowodowanego resztkowym powietrzem zawartym w pierwszym worku, nie podłączać worków seryjnie.
- Do podawania leku NUMETA G13%E Preterm zaleca się stosowanie filtra 1,2 mikrona.
- W przypadku stosowania u noworodków i dzieci poniżej 2 lat, należy chronić przed światłem aż do zakończenia podawania. Ekspozycja leku NUMETA G13%E Preterm na światło otoczenia, zwłaszcza po zmieszaniu z pierwiastkami śladowymi i (lub) witaminami. powoduje wytwarzanie nadtlenków i innych produktów degradacji, co można zmniejszyć przez ochronę przed światłem.
- Wszelkie resztki niewykorzystanego leku lub jego odpady oraz cały wymagany zestaw jednorazowego użytku należy w odpowiedni sposób usunąć.
Okres ważności po wymieszaniu roztworów
Lek należy zużyć natychmiast po otwarciu rozrywalnych spawów między dwoma lub trzema komorami.
Badania stabilności mieszanin były prowadzone przez 7 dni w temperaturze od 2°C do 8°C, a następnie
48 godzin w temperaturze 30°C.
Okres ważności po wprowadzeniu dodatkowych składników (elektrolitów, pierwiastków śladowych,
witamin, wody)
Dla określonych dodatkowych składników wykazano stabilność fizyczną leku NUMETA przez 7 dni w
temperaturze od 2°C do 8°C, a następnie w ciągu 48 godzin w temperaturze 30°C.
Informacje na temat tych dodatkowych składników znajdują się w punkcie 6.6 Charakterystyki Produktu
Leczniczego.
Z mikrobiologicznego punktu widzenia, lek należy użyć natychmiast. Jeśli taki lek nie zostanie użyty
natychmiast, za czas i warunki przechowywania do momentu jego zastosowania odpowiada użytkownik,
jednak nie należy przekraczać 24 godzin w temperaturze od 2°C do 8°C, chyba że
przygotowanie/rozpuszczenie/wprowadzenie dodatkowych składników odbyło się w kontrolowanych i
zwalidowanych warunkach aseptycznych.
Nie stosować leku NUMETA G13%E Preterm, jeśli worek jest uszkodzony. Poniżej podano cechy
uszkodzonego worka:
- Rozrywalne spawy są otwarte
- Którakolwiek z komór zawiera mieszaninę roztworów
- Roztwory zawierające aminokwasy i glukozę nie są przezroczyste, bezbarwne lub lekko żółte i (lub) zawierają widoczne cząstki
- Emulsja tłuszczowa nie jest jednolitym płynem o mlecznobiałym wyglądzie.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę co zrobić z lekami, których się już nie potrzebuje. Takie postępowanie pomoże chronić
środowisko.
Co zawiera lek NUMETA G13%E Preterm
Substancje czynne:
| Substancja czynna | Aktywowany W2K (240 ml) | Aktywowany W3K (300 ml) |
| Komora z aminokwasami | ||
| Alanina | 0,75 g | 0,75 g |
| Arginina | 0,78 g | 0,78 g |
| Kwas asparaginowy | 0,56 g | 0,56 g |
| Cysteina | 0,18 g | 0,18 g |
| Kwas glutaminowy | 0,93 g | 0,93 g |
| Glicyna | 0,37 g | 0,37 g |
| Histydyna | 0,35 g | 0,35 g |
| Izoleucyna | 0,62 g | 0,62 g |
| Leucyna | 0,93 g | 0,93 g |
| Lizyna jednowodna (co odpowiada lizynie) | 1,15 g (1,03 g) | 1,15 g (1,03 g) |
| Metionina | 0,22 g | 0,22 g |
| Ornityny chlorowodorek (co odpowiada ornitynie) | 0,30 g (0,23 g) | 0,30 g (0,23 g) |
| Fenyloalanina | 0,39 g | 0,39 g |
| Prolina | 0,28 g | 0,28 g |
| Seryna | 0,37 g | 0,37 g |
| Tauryna | 0,06 g | 0,06 g |
| Treonina | 0,35 g | 0,35 g |
| Tryptofan | 0,19 g | 0,19 g |
| Tyrozyna | 0,07 g | 0,07 g |
| Walina | 0,71 g | 0,71 g |
| Potasu octan | 0,61 g | 0,61 g |
| Wapnia chlorek dwuwodny | 0,55 g | 0,55 g |
| Magnezu octan czterowodny | 0,10 g | 0,10 g |
| Sodu glicerofosforan uwodniony | 0,98 g | 0,98 g |
| Komora z glukozą | ||
| Glukoza jednowodna (co odpowiada glukozie bezwodnej) | 44,00 g (40,00 g) | 44,00 g (40,00 g) |
| Komora z lipidami | ||
| Olej z oliwek oczyszczony (ok. 80%) + olej sojowy oczyszczony (ok. 20%) | 7,5 g | |
Roztwór po zmieszaniu/emulsja zawiera następujące składniki:
| Skład | ||||
| Aktywowany W2K | Aktywowany W3K | |||
| Na jednostkę objętości (ml) Azot (g) Aminokwasy (g) Glukoza (g) Lipidy (g) Wartość energetyczna Całkowita wartość energetyczna (kcal) | 240 1,4 9,4 40,0 0 198 | 100 0,59 3,9 16,7 0 82 | 300 1,4 9,4 40,0 7,5 273 | 100 0,47 3,1 13,3 2,5 91 |
| Wartość energetyczna niebiałkowa (kcal) Wartość energetyczna glukozy (kcal) Wartość energetyczna lipidówa (kcal) Wartość energetyczna niebiałkowa/azot (kcal/g N) Wartość energetyczna lipidów/ wartość energetyczna niebiałkowa (%) Wartość energetyczna lipidów/całkowita wartość energetyczna (%) Elektrolity Sód (mmol) Potas (mmol) Magnez (mmol) Wapń (mmol) Fosforanyb (mmol) Octany (mmol) Jabłczany (mmol) Chlorki (mmol) | 160 160 0 113 Nie dot. Nie dot. 6,4 6,2 0,47 3,8 3,2 7,2 3,2 9,3 | 67 67 0 113 Nie dot. Nie dot. 2,7 2,6 0,20 1,6 1,3 3,0 1,3 3,9 | 235 160 75 165 32 28 6,6 6,2 0,47 3,8 3,8 7,2 3,2 9,3 | 78 53 25 165 32 28 2,2 2,1 0,16 1,3 1,3 2,4 1,1 3,1 |
| pH (w przybliżeniu) Osmolarność w przybliżeniu (mOsm/l) | 5,5 1400 | 5,5 1400 | 5,5 1150 | 5,5 1150 |
W tym wartość energetyczna fosfolipidów z jaja kurzego do wstrzykiwań.
W tym fosforany z fosfolipidów z jaja kurzego do wstrzykiwań będące składnikiem emulsji lipidowej .
Pozostałe składniki:
Kwas L-jabłkowy
Kwas solny
Fosfolipidy z jaja kurzego do wstrzykiwań
Glicerol
Sodu oleinian
Sodu wodorotlenek
Woda do wstrzykiwań
do ustalenia pH
Baxter, Numeta, Numetzah i Numetah są znakami towarowymi Baxter International Inc.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterBaxter S.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Numeta G13%E PretermPostać farmaceutyczna: Roztwór, -Substancja czynna: combinationsBez receptyPostać farmaceutyczna: Roztwór, -Substancja czynna: combinationsBez receptyPostać farmaceutyczna: Roztwór, -Substancja czynna: combinationsBez recepty
Odpowiedniki Numeta G13%E Preterm w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Numeta G13%E Preterm – Hiszpania
Odpowiednik Numeta G13%E Preterm – Ukraina
Lekarze online w sprawie Numeta G13%E Preterm
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Numeta G13%E Preterm – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














