
Ig Vena

Zapytaj lekarza o receptę na Ig Vena

Jak stosować Ig Vena
Ulotka doł ą czona do opakowania: informacja dla u ż ytkownika
Ig VENA, 50 g/l, roztwór do infuzji
Immunoglobulina ludzka normalna do podania do ż ylnego (IVIg)
Należy uważnie zapoznaćsięz treściąulotki przed zastosowaniem leku, ponieważzawiera ona
informacje ważne dla pacjenta.
- Nale ż y zachowa ć t ę ulotk ę , aby w razie potrzeby móc j ą ponownie przeczyta ć .
- W razie jakichkolwiek w ą tpliwo ś ci nale ż y zwróci ć si ę do lekarza lub piel ę gniarki.
- Je ś li u pacjenta wyst ą pi ą jakiekolwiek objawy niepo żą dane, w tym wszelkie objawy niepo żą dane niewymienione w tej ulotce, nale ż y powiedzie ć o tym lekarzowi lub piel ę gniarce. Patrz punkt 4.
Spis tre ś ci ulotki:
- 1. Co to jest lek Ig VENA i w jakim celu si ę go stosuje
- 2. Informacje wa ż ne przed zastosowaniem leku Ig VENA
- 3. Jak stosowa ć Ig VENA
- 4. Mo ż liwe działania niepo żą dane
- 5. Jak przechowywa ć Ig VENA
- 6. Zawarto ść opakowania i inne informacje
1. Co to jest lek Ig VENA i w jakim celu si ę go stosuje
Ig VENA jest roztworem immunoglobuliny ludzkiej normalnej do podania do ż ylnego.
Immunoglobuliny s ą ludzkimi przeciwciałami obecnymi równie ż we krwi.
Ig VENA jest stosowana w nast ę puj ą cych terapiach:
Leczenie dorosłych oraz dzieci i młodzieży (0-18 lat), kiedy pacjent nie ma wystarczającej ilości
przeciwciał (leczenie substytucyjne) w następujących przypadkach:
- 1. U pacjentów z wrodzonym niedoborem wytwarzania przeciwciał (w zespołach pierwotnych niedoborów odporno ś ci).
- 2. U pacjentów z nabytym niedoborem wytwarzania przeciwciał (wtórny niedobór odporno ś ci), u których wyst ę puj ą ci ęż kie lub nawracaj ą ce zaka ż enia spowodowane ró ż nymi stanami klinicznymi (np. choroby onkologiczne lub autoimmunologiczne lub w wyniku nast ę pstw leczenia tych chorób). Leczenie antybiotykami u tych pacjentów było nieskuteczne i, albo nie uzyskali wystarczaj ą cego przyrostu miana przeciwciał IgG po szczepieniu (szczepionka przeciw pneumokokom polisacharydowa oraz szczepionka zawieraj ą ca antygen polipeptydowy), lub poziom IgG w surowicy krwi wynosił <4 g l.< li>
Leczenie dorosłych oraz dzieci i młodzie ż y (0-18 lat) z pewnymi chorobami zapalnymi (immunomodulacja) w następujących przypadkach:
- 1. U pacjentów z niewystarczaj ą c ą liczb ą płytek krwi (pierwotna małopłytkowo ść immunologiczna) i u pacjentów z du ż ym ryzykiem krwawienia lub przed operacj ą w celu uzyskania odpowiedniej liczby płytek.
- 2. U pacjentów z zespołem Guillain–Barré. Jest to ostra choroba objawiaj ą ca si ę zapaleniem nerwów obwodowych powoduj ą ca powa ż ne osłabienie mi ęś ni głównie w nogach i ko ń czynach górnych.
- 3. U pacjentów z chorob ą Kawasaki (w poł ą czeniu z kwasem acetylosalicylowym). Choroba Kawasaki jest ostr ą chorob ą pierwotn ą małych dzieci objawiaj ą c ą si ę zapaleniem naczy ń krwiono ś nych całego ciała
- 4. U pacjentów z przewlekł ą demielinizacyjn ą polineuropati ą zapaln ą (ang. CIDP - Chronic Inflammatory Demyelinating Polyradiculoneuropathy). Ta przewlekła choroba jest rzadko wyst ę puj ą cym zaburzeniem nerwów obwodowych charakteryzuj ą cym si ę stopniowo post ę puj ą cym osłabieniem ko ń czyn dolnych i, w mniejszym stopniu, ko ń czyn górnych.
- 5. W wieloogniskowej neuropatii ruchowej (ang. MMN - multifocal motor neuropathy). Jest to rzadka choroba, która atakuje nerwy ruchowe i objawia si ę powolnym, post ę puj ą cym asymetrycznym niedowładem ko ń czyn bez utraty czucia
2. Informacje wa ż ne przed zastosowaniem leku Ig VENA
Kiedy nie stosowa ć leku Ig VENA
Je ś li pacjent ma uczulenie (nadwra ż liwo ść ) na immunoglobulin ę ludzk ą normaln ą lub
którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
Kiedy u pacjenta wyst ę puj ą przeciwciała przeciwko immunoglobulinie A (IgA) we krwi,
poniewa ż podanie leku zawieraj ą cego IgA mo ż e prowadzi ć do ci ęż kiej reakcji alergicznej.
Ostrze ż enia i ś rodki ostro ż no ś ci
Przed rozpocz ę ciem stosowania leku Ig VENA nale ż y omówi ć to z lekarzem lub piel ę gniark ą .
Pacjenci musz ą by ć dokładnie monitorowani i uwa ż nie obserwowani podczas infuzji z powodu ryzyka
wyst ą pienia objawów niepo żą danych.
Niektóre reakcje niepo żą dane mog ą pojawia ć si ę cz ęś ciej:
- w przypadku zbyt szybkiej infuzji;
- u pacjentów z objawami nieleczonego zaka ż enia (np. gor ą czka) lub przewlekłego stanu zapalnego;
- u pacjentów, którzy otrzymuj ą immunoglobulin ę ludzk ą normaln ą po raz pierwszy;
- w rzadkich przypadkach, kiedy zmieniono podawany wcze ś niej lek immunoglobuliny ludzkiej normalnej na inny lub gdy od ostatniej infuzji upłyn ą ł długi czas.
W pewnych przypadkach, immunoglobuliny mog ą zwi ę kszy ć ryzyko zawału serca, udaru, zakrzepu tętnicy płucnej lub pogłębićzakrzepicężył głębokich
Z tego powodu, lekarz zachowa szczególn ą ostro ż no ść w nast ę puj ą cych przypadkach:
- u pacjentów otyłych,
- u osób w podeszłym wieku,
- u pacjentów z cukrzyc ą ,
- u pacjentów z nadci ś nieniem,
- u pacjentów ze zmniejszon ą obj ę to ś ci ą krwi (hipowolemia),
- u pacjentów z chorobami naczyniowymi,
- u pacjentów z ryzykiem wyst ą pienia stanów zakrzepowych krwi (nabyte lub wrodzone zaburzenia krzepliwo ś ci),
- u pacjentów ze stanami zakrzepowymi w wywiadzie
- u pacjentów z chorobami objawiaj ą cymi si ę zwi ę kszeniem lepko ś ci krwi,
- u pacjentów długotrwale unieruchomionych,
- u pacjentów z chorobami nerek obecnie lub w przeszło ś ci, lub przyjmuj ą cych leki, które mog ą uszkadza ć nerki (leki nefrotoksyczne), poniewa ż odnotowano przypadki ostrej niewydolno ś ci nerek. W przypadku uszkodzenia czynno ś ci nerek, nale ż y rozwa ż y ć przerwanie podawania immunoglobuliny.
Pacjent mo ż e mie ć alergi ę (nadwra ż liwo ść ) na immunoglobulin ę (przeciwciała) nie wiedząc o tym.
Nadwra ż liwo ść mo ż e wyst ą pi ć nawet u pacjenta, który otrzymał ju ż wcze ś niej
immunoglobulin ę ludzk ą normaln ą i dobrze j ą tolerował. Mo ż e wyst ą pi ć szczególnie w
przypadkach niedoboru immunoglobulin typu IgA (u pacjentów z przeciwciałami przeciw-
IgA). W tych rzadkich przypadkach mog ą wyst ą pi ć reakcje alergiczne (nadwra ż liwo ś ci) takie
jak nagły spadek ci ś nienia krwi lub reakcja anafilaktyczna.
W przypadku reakcji niepo żą danej, nale ż y albo zmniejszy ć szybko ść podawania, albo przerwa ć
podawanie immunoglobulin. Leczenie zale ż y od rodzaju i ci ęż ko ś ci działania niepo żą danego.
W przypadku wyst ą pienia wstrz ą su, nale ż y post ę powa ć według obecnie obowi ą zuj ą cych standardów
medycznych leczenia wstrz ą su. Nale ż y powiedzie ć lekarzowi, je ś li przynajmniej jeden w powy ż szych
przypadków dotyczy pacjenta. Lekarz podejmie odpowiednie ś rodki ostro ż no ś ci w podawaniu leku Ig
VENA.
Zapobieganie zaka ż eniom wirusowym
Leki wytwarzane z ludzkiej krwi lub osocza poddawane s ą okre ś lonym procedurom, które maj ą
zapobiec przeniesieniu zaka ż enia na leczonych pacjentów. Do tych procedur nale ż y selekcja dawców
krwi i osocza, której celem jest wykluczenie dawców mog ą cych by ć ź ródłem zaka ż enia; badanie
osocza pod k ą tem obecno ś ci czynników zaka ź nych/wirusów. Wytwórcy leków z ludzkiej krwi lub
osocza stosuj ą równie ż procesy, które inaktywuj ą lub usuwaj ą wirusy. Pomimo powy ż szych ś rodków
zapobiegawczych nie mo ż na całkowicie wykluczy ć mo ż liwo ś ci przeniesienia czynników zaka ź nych
przez lek przygotowany z ludzkiej krwi lub osocza. Odnosi si ę to równie ż do nieznanych lub
niedawno poznanych wirusów i innych patogenów.
Uwa ż a si ę , ż e przedsi ę wzi ę te ś rodki zapobiegawcze s ą skuteczne w stosunku do wirusów
otoczkowych, takich jak wirus ludzkiego niedoboru odporno ś ci (HIV), wirus zapalenia w ą troby typu
B (HBV) i typu C (HCV), oraz do wirusów bezotoczkowych, takich jak wirus zapalenia w ą troby typu
A (HAV).
Ś rodki te mog ą mie ć ograniczon ą skuteczno ść przeciwko wirusom bezotoczkowym, takim jak
parwowirus B19.
Nie stwierdzono, ż e immunoglobuliny mog ą by ć przyczyn ą zapalenia w ą troby typu A lub zaka ż enia
parwowirusem B 19, poniewa ż obecno ść przeciwciał mo ż e odgrywa ć istotn ą rol ę zabezpieczaj ą c ą
przed zaka ż eniami wirusowymi.
Zaleca si ę , aby za ka ż dym razem zastosowania Ig VENA, zapisa ć nazw ę i numer serii w celu
mo ż liwo ś ci identyfikacji leku.
Dzieci i młodzie ż
Po podaniu leku Ig VENA u dzieci i młodzie ż y obserwowano przemijaj ą c ą i łagodn ą glukozuri ę
(obecno ść glukozy w moczu), bez objawów klinicznych. Mo ż e to by ć zwi ą zane z zawarto ś ci ą maltozy
w leku Ig VENA, która w kanalikach nerkowych ulega hydrolizie do glukozy. Glukoza jest
resorbowana i w bardzo małym stopniu wydalana w moczu. Resorpcja glukozy zale ż y od wieku
pacjenta. Przemijaj ą ce zwi ę kszenie st ęż enia maltozy w osoczu mo ż e przekroczy ć pojemno ść nerkow ą
resorpcji cukru i wpłyn ąć na dodatni wynik badania glukozy w moczu.
Lek Ig VENA a inne leki
Nale ż y powiedzie ć lekarzowi o wszystkich lekach przyjmowanych przez pacjenta obecnie lub
ostatnio, a tak ż e o lekach, które pacjent planuje przyjmowa ć .
Nie wolno miesza ć immunoglobuliny ludzkiej normalnej do podawania do ż ylnego z innymi lekami
ani innymi lekami zawieraj ą cymi immunoglobuliny do podania do ż ylnego (IVIg).
Wpływ na ż ywe atenuowane szczepionki wirusowe
Podanie immunoglobuliny mo ż e osłabi ć przez okres od co najmniej 6 tygodni do 3 miesi ę cy
skuteczno ść szczepionek zawieraj ą cych ż ywe atenuowane wirusy, takie jak wirus odry, ró ż yczki,
ś winki lub ospy wietrznej. Po podaniu tego leku, nale ż y zachowa ć 3 miesi ę czn ą przerw ę przed
szczepieniem szczepionk ą zawieraj ą c ą ż ywe atenuowane wirusy. W przypadku odry, to osłabienie
mo ż e utrzymywa ć si ę do roku. Z tego powodu pacjenci otrzymuj ą cy szczepionk ę przeciw odrze
powinni mie ć oznaczone miano przeciwciał.
Diuretyki p ę tlowe (grupa leków zwi ę kszaj ą cych przepływ moczu)
Nale ż y unika ć jednoczesnego stosowania z diuretykami p ę tlowymi.
Wpływ na wyniki bada ń krwi
Po wstrzykni ę ciu immunoglobuliny, przej ś ciowy wzrost we krwi pacjenta biernie przeniesionych
ró ż nych przeciwciał mo ż e spowodowa ć fałszywie dodatnie wyniki testów serologicznych.
Bierne przeniesienie przeciwciał przeciw antygenom erytrocytów, np. A, B, D (odpowiedzialnych za
grup ę krwi) mog ą wpływa ć na wyniki niektórych testów serologicznych na przeciwciała dla
czerwonych krwinek np. bezpo ś redniego testu antyglobulinowego (DAT, test Coombsa).
Badanie st ęż enia glukozy we krwi
Niektóre rodzaje bada ń st ęż enia glukozy we krwi (np. wykorzystuj ą ce metody bazuj ą ce na
dehydrogenazie glukozy -pirolochinolinochinonu (GDH-PQQ) lub oksydoreduktazie glukozy-
barwniku) fałszywie interpretuj ą maltoz ę (100 mg/ml) zawart ą w leku Ig VENA jako glukoz ę . Mo ż e
to spowodowa ć fałszywie zawy ż ony odczyt st ęż enia glukozy w czasie infuzji i przez okres około 15
godzin po zako ń czeniu infuzji, co w konsekwencji mo ż e prowadzi ć do niewła ś ciwego podawania
insuliny, prowadz ą cego do zagra ż aj ą cej ż yciu hipoglikemii. Ponadto przypadki rzeczywistej
hipoglikemii mog ą pozosta ć nieleczone, je ż eli stan hipoglikemii został zamaskowany fałszywie
podwy ż szonymi odczytami st ęż enia glukozy. W zwi ą zku z tym, podaj ą c Ig VENA lub inne leki do
podawania pozajelitowego zawieraj ą ce maltoz ę , pomiar st ęż enia glukozy we krwi nale ż y
przeprowadzi ć metod ą swoist ą dla glukozy. Nale ż y dokładnie zapozna ć si ę z informacjami
dotycz ą cymi testów do badania st ęż enia glukozy we krwi, wł ą cznie z informacjami o paskach
testowych, w celu ustalenia, czy mo ż na je stosowa ć z zawieraj ą cymi maltoz ę lekami do podawania
pozajelitowego. W przypadku w ą tpliwo ś ci nale ż y skontaktowa ć si ę z producentem urz ą dzenia w celu
ustalenia, czy mo ż na je stosowa ć z zawieraj ą cymi maltoz ę lekami do podawania pozajelitowego.
Dzieci i młodzie ż
Chocia ż nie prowadzono bada ń interakcji u dzieci i młodzie ż y, jednak nie oczekuje si ę ró ż nic mi ę dzy
populacj ą dorosłych a dzieci i młodzie ż y.
Ci ąż a, karmienie piersi ą i wpływ na płodno ść
- Je ś li pacjentka jest w ci ąż y lub karmi piersi ą , przypuszcza, ż e mo ż e by ć w ci ąż y lub gdy planuje mie ć dziecko, powinna poradzi ć si ę lekarza przed zastosowaniem tego leku. Lekarz zdecyduje, czy lek Ig VENA mo ż e by ć zastosowany u pacjentki w ci ąż y.
- Nie prowadzono bada ń klinicznych z Ig VENA u kobiet w ci ąż y. Wykazano, ż e produkty immunoglobulin do ż ylnych przenikaj ą przez ło ż ysko, z nasileniem w czasie trzeciego trymestu. Jednak długotrwałe do ś wiadczenia kliniczne dotycz ą ce stosowania immunoglobulin sugeruj ą , ż e nie nale ż y spodziewa ć si ę ż adnego szkodliwego wpływu na przebieg ci ąż y, na płód ani na noworodka.
- Je ś li pacjentka karmi piersi ą i otrzymuje lek Ig VENA, przeciwciała z tego leku mog ą przenika ć do mleka ludzkiego. Mo ż e to przyczynia ć si ę do ochrony noworodkowa przeciw pewnym infekcjom.
- Do ś wiadczenie kliniczne dotycz ą ce stosowania immunoglobulin sugeruj ą , ż e nie nale ż y spodziewa ć si ę ż adnego szkodliwego wpływu na płodno ść .
Prowadzenie pojazdów i obsługiwanie maszyn
Niektóre działania niepo żą dane zwi ą zane z produktem Ig VENA mog ą pogarsza ć zdolno ść
prowadzenia pojazdów i obsługiwania maszyn. Pacjenci, u których wyst ą piły działania niepo żą dane w
czasie leczenia, powinni poczeka ć na ich ust ą pienie przed prowadzeniem pojazdu lub obsługiwaniem
maszyn.
Ig VENA zawiera maltoz ę i sód
Lek zawiera 100 mg maltozy w 1 ml.
Ten lek zawiera około 69 mg sodu w 1 litrze. Nale ż y wzi ąć to pod uwag ę w przypadku pacjentów na
diecie ubogosodowej.
3. Jak stosowa ć Ig VENA
Ig VENA mo ż e by ć podawany przez lekarza lub wyszkolony personel medyczny tylko w warunkach
szpitalnych lub ambulatoryjnych.
Dawka i schemat dawkowania zale żą od wskaza ń ; lekarz okre ś li odpowiednie dawkowanie wła ś ciwe
dla danego pacjenta.
Ig VENA nale ż y podawa ć pocz ą tkowo powoli. Je ś li lek jest dobrze tolerowany, szybko ść infuzji
mo ż na stopniowo zwi ę ksza ć .
Stosowanie u dzieci i młodzie ż y
Dawkowanie u dzieci i młodzie ż y (0-18 lat) nie ró ż ni si ę od tego stosowanego u dorosłych, poniewa ż
dawkowanie w poszczególnych wskazaniach okre ś lone jest na podstawie masy ciała i stanu
klinicznego pacjenta.
Przyj ę cie wi ę kszej ni ż zalecana dawki Ig VENA
Przedawkowanie mo ż e prowadzi ć do przeci ąż enia kr ąż enia i nadmiernej lepko ś ci krwi, zwłaszcza u
pacjentów z grup ryzyka, z pacjentami w wieku podeszłym lub z niewydolno ś ci ą serca lub nerek
wł ą cznie.
W razie jakichkolwiek dalszych pyta ń dotycz ą cych stosowania tego leku nale ż y zwróci ć si ę do lekarza
lub piel ę gniarki.
4. Mo ż liwe działania niepo żą dane
Jak ka ż dy lek, lek ten mo ż e powodowa ć działania niepo żą dane, chocia ż nie u ka ż dego one wyst ą pi ą .
Nast ę puj ą ce działania niepo żą dane mog ą wyst ą pi ć po podaniu leku zawieraj ą cego immunoglobuliny:
- dreszcze, ból głowy, zawroty głowy, gor ą czka, wymioty, nudno ś ci, reakcje alergiczne, ból stawów, obni ż enie ci ś nienia krwi i umiarkowany ból dolnej cz ęś ci pleców mog ą wyst ą pi ć sporadycznie;
- pojedyncze przypadki przej ś ciowego zmniejszenia liczby czerwonych krwinek (odwracalna anemia hemolityczna/hemoliza);
- nagły spadek ci ś nienia krwi mo ż e wyst ą pi ć rzadko, a w pojedynczych przypadkach mo ż e wyst ą pi ć wstrz ą s anafilaktyczny, nawet u pacjenta, u którego nie wyst ę powała nadwra ż liwo ść po wcze ś niejszych podaniach;
- obserwowano rzadkie przypadki przej ś ciowych reakcji skórnych;
- bardzo rzadko wyst ę powały powikłania zakrzepowo-zatorowe (powstawanie zakrzepów), które mog ą prowadzi ć do zawału serca, udaru mózgu, zakrzepu t ę tnicy płucnej (zator płucny), zakrzepicy ż ył gł ę bokich;
- przypadki przej ś ciowego, niezwi ą zanego z zaka ż eniem, zapalenia opon mózgowych (odwracalne aseptyczne zapalenie opon mózgowych);
- obserwowano wzrost poziomu kreatyniny w surowicy i/lub nagł ą niewydolno ść nerek;
- przypadki ostrego poprzetoczeniowego uszkodzenia płuc (ang. TRALI - Transfusion related acute lung injury ).
W badaniach klinicznych i po wprowadzeniu leku Ig VENA do obrotu obserwowano nast ę puj ą ce
działania niepo żą dane, wymienione wg zmniejszaj ą cej si ę cz ę sto ś ci wyst ę powania.
Cz ę sto (mo ż e dotyczy ć mniej ni ż 1 na 10 osób)
- Ból pleców
- Nudno ś ci
- Uczucie osłabienia, zm ę czenie, gor ą czka
- Ból mi ęś ni
- Ból głowy, senno ść .
Cz ę sto ść nieznana (nie mo ż e by ć okre ś lona na podstawie dost ę pnych danych)
- Aseptyczne zapalenie opon mózgowo-rdzeniowych
- Rozpad czerwonych krwinek powoduj ą cy niedokrwisto ść
- Reakcje alergiczne i gro ź ny dla ż ycia szok anafilaktyczny
- Stan spl ą tania
- Udar, zawroty głowy, niekontrolowane dr ż enie, dr ę twienie lub mrowienie skóry lub ko ń czyny
- Zawał serca, zasinienie skóry, szybkie bicie serca, powolne bicie serca, nieregularne bicie serca
- Zakrzep krwi w ż yłach gł ę bokich i naczyniach krwiono ś nych, niskie ci ś nienie krwi, wysokie ci ś nienie krwi, blado ść
- Zakrzep głównej t ę tnicy płuc, nieprawidłowa obj ę to ść płynu w płucach, trudno ś ci w oddychaniu ze ś wiszcz ą cym oddechem lub kaszlem
- Wymioty, biegunka, ból brzucha
- Szybko post ę puj ą cy obrz ę k skóry, pokrzywka, zaczerwienienie i zapalenie skóry, wysypka skórna, ś wi ą d, egzema, nadmierne pocenie si ę
- Ból stawów i mi ęś ni, ból pleców, ból szyi, sztywno ść mi ęś ni szkieletowych
- Nagła niewydolno ść nerek
- Zapalenie ż yły w miejscu podania leku, gor ą czka, ból lub uczucie dyskomfortu w klatce piersiowej, obrz ę k twarzy, ogólne złe samopoczucie
- Zwi ę kszone st ęż enie kreatyniny w krwi
Dodatkowe działania niepo żą dane u dzieci i młodzie ż y
Nale ż y spodziewa ć si ę , ż e cz ę sto ść , rodzaj i ci ęż ko ść działa ń niepo żą danych u dzieci i młodzie ż y s ą
takie same jak u dorosłych.
Po podaniu leku Ig VENA, u dzieci i młodzie ż y obserwowano przemijaj ą c ą i łagodn ą glukozuri ę
(obecno ść glukozy w moczu), bez objawów klinicznych.
Informacje dotycz ą ce bezpiecze ń stwa wirusowego patrz: punkt 2. „ Informacje ważne przed
zastosowaniem leku Ig VENA” .
Zgłaszanie działa ń niepo żą danych
Je ś li wyst ą pi ą jakiekolwiek objawy niepo żą dane, w tym wszelkie objawy niepo żą dane niewymienione
w ulotce, nale ż y powiedzie ć o tym lekarzowi lub piel ę gniarce. Działania niepo żą dane mo ż na zgłasza ć
do Departamentu Monitorowania Niepo żą danych Działa ń Produktów Leczniczych Urz ę du Rejestracji
Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych (Al. Jerozolimskie 181C,
02-222
Warszawa),
tel:
22
4921301,
faks:
22
4921309,
strona
internetowa:
https://smz.ezdrowie.gov.pl
Działania niepo żą dane mo ż na zgłasza ć równie ż podmiotowi odpowiedzialnemu.
5. Jak przechowywa ć Ig VENA
Lek nale ż y przechowywa ć w miejscu niewidocznym i niedost ę pnym dla dzieci.
Nie stosowa ć tego leku po upływie terminu wa ż no ś ci zamieszczonego na etykiecie fiolki i pudełku po
„EXP”. Termin wa ż no ś ci oznacza ostatni dzie ń danego miesi ą ca.
Przechowywa ć w lodówce (2 C - 8 C).
Przed u ż yciem i w okresie wa ż no ś ci, lek mo ż e by ć przechowywany w temperaturze pokojowej, nie
powy ż ej 25°C, przez maksymalnie 6 kolejnych miesi ę cy. Po tym czasie lek nale ż y usun ąć .
W ż adnym przypadku nie mo ż na leku ponownie wstawi ć do lodówki, je ś li był przechowywany w
temperaturze pokojowej. Na pudełku nale ż y zapisa ć pocz ą tkow ą dat ę przechowywania w
temperaturze pokojowej.
Po otwarciu fiolki zawarto ść nale ż y zu ż y ć natychmiast.
Fiolki przechowywa ć w opakowaniu zewn ę trznym Nie zamra ż a ć .
Nie stosowa ć tego leku, je ś li zauwa ż y si ę , ż e roztwór zm ę tniał, zmienił barw ę , lub ma widoczny osad.
Leków nie nale ż y wyrzuca ć do kanalizacji ani domowych pojemników na odpadki. Nale ż y zapyta ć
farmaceut ę , jak usun ąć leki, których si ę ju ż nie u ż ywa. Takie post ę powanie pomo ż e chroni ć
ś rodowisko.
6. Zawarto ść opakowania i inne informacje
Co zawiera lek Ig VENA
Substancj ą czynn ą leku jest immunoglobulina ludzka normalna.
1 ml roztworu zawiera 50 mg immunoglobuliny ludzkiej normalnej.
Roztwór zawiera ludzkie białko 50 g/l, w tym co najmniej 95% IgG (immunoglobulina G).
Rozkład podklas IgG jest nast ę puj ą ca:
IgG
62,1%
IgG
34,8%
IgG
2,5%
IgG
0,6%
Maksymalna zawarto ść IgA wynosi 50 mikrogramów/ml.
Lek wytworzono z osocza dawców krwi.
Pozostałe składniki leku to maltoza, woda do wstrzykiwa ń .
Jak wygl ą da lek Ig VENA i co zawiera opakowanie
Roztwór do infuzji IgVENA jest dost ę pny w pojedynczych fiolkach po 50 ml, 100 ml lub 200 ml z
zainstalowanym uchwytem (fiolka + uchwyt). Roztwór jest przezroczysty lub lekko opalizuj ą cy,
bezbarwny lub jasno ż ółty.
Wielko ś ci opakowa ń :
Opakowania pojedyncze:
1 fiolka zawieraj ą ca 2,5 g/50 ml
1 fiolka zawieraj ą ca 5 g/100 ml
1 fiolka zawieraj ą ca 10 g/200 ml
Opakowania zbiorcze:
Opakowanie zbiorcze zawieraj ą ce 2 pojedyncze opakowania po 1 fiolce 10 g/200 ml
Opakowanie zbiorcze zawieraj ą ce 3 pojedyncze opakowania po 1 fiolce 10 g/200 ml.
Nie wszystkie wielko ś ci opakowa ń musz ą znajdowa ć si ę w obrocie.
Podmiot odpowiedzialny:
Kedrion S.p.A.
Loc. Ai Conti, 55051 Castelvecchio Pascoli, Barga (Lucca), Włochy
Wytwórca:
Kedrion S.p.A.
55027 Bolognana, Gallicano (Lucca), Włochy
Ten produkt leczniczy jest dopuszczony do obrotu w krajach członkowskich Europejskiego
Obszaru Gospodarczego pod nast ę puj ą cymi nazwami:
| Austria | Ig Vena 50g/l Infusionslösung |
| Niemcy | Ig Vena 50 g/l Infusionslösung |
| Grecja | Ig VENA |
| Włochy | IG VENA |
| Polska | Ig VENA |
| Portugalia | Ig Vena |
W celu uzyskania bardziej szczegółowych informacji nale ż y zwróci ć si ę do miejscowego
przedstawiciela podmiotu odpowiedzialnego:
MB&S Medical Business and Science, ul. Chełmska 30/34, 00-725 Warszawa
Tel/faks. 22 851 52 08
Data ostatniej aktualizacji ulotki: 11/2020
Informacje przeznaczone wył ą cznie dla fachowego personelu medycznego:
Instrukcja prawidłowego stosowania
- Przed u ż yciem produkt Ig VENA nale ż y doprowadzi ć do temperatury pokojowej lub temperatury ciała.
- Przed u ż yciem roztwór powinien by ć oceniony wizualnie pod k ą tem obecno ś ci cz ą stek stałych i zabarwienia. Nie nale ż y stosowa ć roztworów, które s ą m ę tne lub maj ą osad.
- Immunoglobulin ę ludzk ą normaln ą nale ż y podawa ć do ż ylnie z pocz ą tkow ą szybko ś ci ą infuzji 0,46 - 0,92 ml/kg/godz. (10 - 20 kropli na minut ę ) przez 20 - 30 minut. W przypadku wyst ą pienia reakcji niepo żą danej nale ż y zmniejszy ć szybko ść infuzji lub zatrzyma ć podawanie. Je ś li jest dobrze tolerowana, szybko ść infuzji mo ż na stopniowo zwi ę ksza ć maksymalnie do 1,85 ml/kg/godz. (40 kropli na minut ę ).
- U pacjentów z pierwotnym niedoborem odporno ś ci, którzy toleruj ą szybko ść infuzji 0,92 ml/kg/godz., mo ż na stopniowo co 20-30 minut zwi ę ksza ć szybko ść podawania do 2 ml/kg/godz., 4 ml/kg/godz. i maksymalnie do 6 ml/kg/godz., ale tylko je ś li pacjent dobrze toleruje infuzj ę . Na ogół, dawkowanie i szybko ść infuzji musz ą by ć dostosowane indywidualnie do potrzeb pacjenta. W zale ż no ś ci od masy ciała pacjenta, dawkowania i wyst ę powania działa ń niepo żą danych maksymalna szybko ś ci infuzji mo ż e nie zosta ć osi ą gni ę ta. W przypadku wyst ą pienia działa ń niepo żą danych nale ż y natychmiast przerwa ć wlew a nast ę pnie wznowi ć z odpowiedni ą dla pacjenta szybko ś ci ą .
Populacje szczególne
U dzieci i młodzie ż y (0-18 lat) i u osób starszych (>64 lat) pocz ą tkowa szybko ść podawania
powinna wynosi ć 0,46 – 0,92 ml/kg/godz. (10 – 20 kropli na minut ę ) przez 20 - 30 minut. Je ś li
jest dobrze tolerowana, po uwzgl ę dnieniu stanu klinicznego pacjenta, szybko ść mo ż na stopniowo
zwi ę ksza ć maksymalnie do 1,85 ml/kg/godz. (40 kropli na minut ę ).
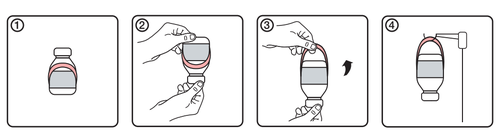
Instrukcja u ż ycia uchwytu
- 1.Pocz ą tkowy wygl ą d fiolki z etykiet ą uchwytu
- 2.Odwróci ć fiolk ę do góry dnem
- 3.Utworzy ć uchwyt przez rozwini ę cie go z etykiety
- 4. Powiesi ć fiolk ę na stojaku do infuzji
Ś rodki ostro ż no ś ci
Niektóre ci ęż kie działania niepo żą dane mog ą by ć zwi ą zane z szybko ś ci ą infuzji.
Potencjalnych powikła ń mo ż na cz ę sto unikn ąć przez upewnienie si ę :
- ż e pacjenci nie s ą uczuleni na immunoglobulin ę ludzk ą normaln ą , przez pocz ą tkowe powolne podawanie produktu (szybko ść podawania 0,46 - 0,92 ml/kg/godz.);
- ż e pacjenci s ą dokładnie monitorowani w czasie infuzji co do działa ń niepo żą danych. Szczególnie pacjenci otrzymuj ą cy immunoglobulin ę ludzk ą normaln ą po raz pierwszy, pacjenci którzy otrzymywali wcze ś niej inny produkt IVIg lub w przypadku długiej przerwy od poprzedniej infuzji powinni by ć monitorowani podczas pierwszej infuzji i przez pierwsz ą godzin ę po pierwszej infuzji, w celu zauwa ż enia objawów potencjalnych działa ń niepo żą danych. Pozostali pacjenci powinni by ć obserwowani przez co najmniej 20 minut po infuzji.
U wszystkich pacjentów podawanie do ż ylne Ig wymaga:
- odpowiedniego nawodnienia przed rozpocz ę ciem infuzji Ig
- monitorowania wydalania moczu
- monitorowania poziomu kreatyniny w surowicy
- unikania równoczesnego stosowania diuretyków p ę tlowych. W przypadku działania niepo żą danego, nale ż y albo zmniejszy ć szybko ść podawania, albo przerwa ć podawanie immunoglobulin. Leczenie zale ż y od rodzaju i ci ęż ko ś ci działania niepo żą danego. W przypadku wyst ą pienia wstrz ą su, nale ż y post ę powa ć według obecnie obowi ą zuj ą cych standardów medycznych leczenia wstrz ą su.
Reakcja na infuzj ę
Niektóre działania niepo żą dane (np. ból głowy, uderzenia gor ą ca, dreszcze, ból mi ęś ni, ś wiszcz ą cy
oddech, tachykardia, ból dolnej cz ęś ci pleców, nudno ś ci i niedoci ś nienie) mog ą by ć zwi ą zane z
szybko ś ci ą wlewu. Nale ż y ś ci ś le przestrzega ć zalecanej szybko ś ci infuzji. Pacjenci musz ą by ć
dokładnie monitorowani i uwa ż nie obserwowani podczas infuzji z powodu ryzyka wyst ą pienia działa ń
niepo żą danych.
Niektóre działania niepo żą dane mog ą pojawia ć si ę cz ęś ciej:
- u pacjentów, którzy otrzymuj ą immunoglobulin ę ludzk ą normaln ą po raz pierwszy, lub w rzadkich przypadkach, kiedy zmienia si ę produkt immunoglobuliny ludzkiej normalnej na inny lub gdy produkt podaje si ę po dłu ż szej przerwie
- u pacjentów z nieleczonym zaka ż eniem lub przewlekłym stanem zapalnym.
Dzieci i młodzie ż
Brak specjalnych zalece ń dotycz ą cych ś rodków zapobiegawczych lub monitorowania u dzieci i
młodzie ż y. Nie nale ż y spodziewa ć si ę ró ż nic u dzieci i młodzie ż y (od 0 do 18 lat).
Choroba zakrzepowo-zatorowa
Istniej ą kliniczne dowody na zwi ą zek pomi ę dzy podawaniem do ż ylnym Ig a przypadkami
zakrzepowo-zatorowymi takimi jak zawał serca, epizod naczyniowo-mózgowy (w tym udar), zakrzep
t ę tnicy płucnej i zakrzepica ż ył gł ę bokich, które uwa ż a si ę za maj ą ce zwi ą zek ze wzgl ę dnym
zwi ę kszeniem lepko ś ci krwi po intensywnym podaniu immunoglobuliny u pacjentów z grupy ryzyka.
Nale ż y zachowa ć ostro ż no ść w przepisywaniu i podawaniu produktu pacjentom otyłym i pacjentom, u
których istnieje ryzyko wyst ą pienia stanów zakrzepowych (takich jak podeszły wiek, nadci ś nienie,
cukrzyca i choroby naczyniowe lub stany zakrzepowe w wywiadzie, nabyte lub wrodzone zaburzenia
krzepliwo ś ci, długotrwale unieruchomionych, pacjentów z ci ęż k ą hipowolemi ą , pacjentów z
chorobami objawiaj ą cymi si ę zwi ę kszeniem lepko ś ci krwi).
U pacjentów z ryzykiem niepo żą danych reakcji zakrzepowo-zatorowych, immunoglobuliny do
stosowania do ż ylnego powinny by ć podawane z minimaln ą szybko ś ci ą infuzji i w mo ż liwie
najmniejszej stosowanej dawce.
Ostra niewydolno ść nerek
Odnotowano przypadki ostrej niewydolno ś ci nerek u pacjentów leczonych immunoglobulinami do
stosowania do ż ylnego. U wi ę kszo ś ci z nich zidentyfikowano czynniki ryzyka, takie jak istniej ą ca
uprzednio niewydolno ść nerek, cukrzyca, powa ż ne zmniejszenie obj ę to ś ci krwi kr ążą cej, nadwaga,
równoczesne przyjmowanie produktów o wła ś ciwo ś ciach nefrotoksycznych lub wiek powy ż ej 65 lat.
Nale ż y oceni ć parametry nerkowe przed podaniem wlewu IVIg i ponownie w odpowiednich
odst ę pach czasu, szczególnie u pacjentów, u których stwierdzono potencjalnie zwi ę kszone ryzyko
wyst ą pienia ostrej niewydolno ś ci nerek, U pacjentów z ryzykiem ostrej niewydolno ś ci nerek,
immunoglobuliny do ż ylne powinny by ć podawane z minimaln ą szybko ś ci ą infuzji i w mo ż liwie
najmniejszej stosowanej dawce.
W przypadku upo ś ledzenia czynno ś ci nerek, nale ż y rozwa ż y ć przerwanie do ż ylnego podawania Ig.
Doniesienia o zaburzeniu czynno ś ci nerek i ostrej niewydolno ś ci nerek dotyczyły stosowania wielu
licencjonowanych produktów do ż ylnych immunoglobulin zawieraj ą cych ró ż ne substancje pomocnicze
takie jak sacharoza, glukoza i maltoza. W ogólnej liczbie przypadków, udział produktów
zawieraj ą cych sacharoz ę jako stabilizator, był nieproporcjonalnie wi ę kszy. U pacjentów z grupy
ryzyka mo ż na rozwa ż y ć stosowanie produktów do ż ylnych immunoglobulin niezawieraj ą cych tych
substancji pomocniczych.
Aseptyczne zapalenie opon mózgowych
W czasie leczenia do ż ylnymi immunoglobulinami odnotowano wyst ę powanie zespołu aseptycznego
zapalenia opon mózgowych (ang. AMS - aseptic meningitis syndrome). Zespół z reguły rozpoczyna
si ę w ci ą gu kilku godzin do 2 dni od zastosowania IVIg.
W badaniach płynu mózgowo-rdzeniowego cz ę sto stwierdza si ę pleocytoz ę do kilku tysi ę cy komórek
na mm , głównie granulocytów, oraz st ęż enia białka podwy ż szone do kilkuset mg/dl.
AMS mo ż e wyst ę powa ć cz ęś ciej w zwi ą zku z leczeniem du ż ymi dawkami IVIg (2 g/kg).
Pacjenci z objawami przedmiotowymi i podmiotowymi powinni zosta ć poddani dokładnemu badaniu
neurologicznemu, w tym badaniu płynu mózgowo-rdzeniowego, w celu wykluczenia innych przyczyn
zapalenia opon mózgowych.
Przerwanie leczenia IVIg powodowało remisj ę AMS w ci ą gu kilku dni bez wyst ą pienia nast ę pstw.
Niedokrwisto ść hemolityczna
Produkty immunoglobuliny do ż ylnej mog ą zawiera ć przeciwciała grup krwi, które mog ą działa ć jak
hemolizyny i indukowa ć w warunkach in vivoopłaszczanie krwinek czerwonych immunoglobulin ą ,
powoduj ą c dodatni ą bezpo ś redni ą reakcj ę antyglobulinow ą (test Coombsa) oraz, rzadko, hemoliz ę .
Niedokrwisto ść hemolityczna mo ż e rozwin ąć si ę w czasie leczenia IVIg w wyniku wzmo ż onej
sekwestracji krwinek czerwonych. Pacjenci otrzymuj ą cy do ż ylnie immunoglobulin ę powinni by ć
monitorowani ze wzgl ę du na mo ż liwo ść wyst ą pienia klinicznych objawów hemolizy.
Neutropenia/leukopenia
Po leczeniu IVIg zgłaszano przemijaj ą ce zmniejszenie liczby neutrofilów i/lub epizodów neutropenii,
czasami powa ż nych. Zwykle wyst ę puje to w ci ą gu kilku godzin lub dni po podaniu IVIg i ust ę puje
samoistnie w ci ą gu 7 do 14 dni.
Ostre poprzetoczeniowe uszkodzenie płuc (TRALI, ang. Transfusion related acute lung injury)
U pacjentów otrzymuj ą cych produkty lecznicze IVIg zgłaszano pewne przypadki ostrego
niekardiogennego obrz ę ku płuc (ostre poprzetoczeniowe uszkodzenie płuc - TRALI). TRALI
charakteryzuje si ę ci ęż kim niedotlenieniem (hipoksja), niewydolno ś ci ą oddechow ą , zaburzeniami
oddychania, sinic ą , gor ą czk ą i niedoci ś nieniem. Objawy TRALI zwykle pojawiaj ą si ę w czasie 6
godzin po podaniu produktu IVIg, cz ę sto w ci ą gu 1-2 godzin. Dlatego, nale ż y monitorowa ć
pacjentów; w przypadku wyst ą pienia działa ń niepo żą danych ze strony układu oddechowego nale ż y
natychmiast zaprzesta ć infuzji IVIg. Wyst ą pienie TRALI mo ż e zagra ż a ć ż yciu, wymaga
natychmiastowego leczenia na oddziale intensywnej opieki medycznej.
Ten produkt leczniczy w 1 ml zawiera 100 mg maltozy jako substancj ę pomocnicz ą . Obecno ść
maltozy we krwi mo ż e wpływa ć na wynik badania glukozy, daj ą c fałszywie zawy ż ony odczyt st ęż enia
glukozy we krwi, co w konsekwencji mo ż e prowadzi ć do niewła ś ciwego podawania insuliny
powoduj ą cego zagra ż aj ą c ą ż yciu hipoglikemi ę i ś mier ć . Ponadto, przypadki rzeczywistej hipoglikemii
mog ą pozosta ć nieleczone, je ś li stan niedocukrzenia b ę dzie zamaskowany fałszywie zwi ę kszonym
wynikiem st ęż enia glukozy. W celu uzyskania dalszych informacji, patrz punkt „ Badanie stężenia
glukozy we krwi”.
Dawkowanie
Leczenie substytucyjne musi by ć rozpocz ę te i monitorowane przez lekarza specjalist ę
do ś wiadczonego w leczeniu niedoboru odporno ś ci.
Dawkowanie
Dawka i schemat dawkowania zale żą od wskaza ń . Dawk ę nale ż y ustali ć indywidualne dla ka ż dego
pacjenta w zale ż no ś ci od odpowiedzi klinicznej. Dawka zale ż na od masy ciała mo ż e wymaga ć
dostosowania u pacjentów z niedowaga lub nadwag ą .
Poni ż sze sposoby dawkowania podano jako wskazówk ę .
Leczenie substytucyjne w pierwotnych zespołach niedoboru odporności
Dawk ę nale ż y ustali ć tak ż eby osi ą gn ąć poziom IgG (mierzony przed nast ę pn ą infuzj ą ), co
najmniej 6 g/l lub w granicach normy dla wieku danej populacji. Od rozpocz ę cia leczenia do
wyrównania st ęż enia potrzeba trzy do sze ś ciu miesi ę cy (stabilny poziom IgG). Zaleca si ę stosowanie
dawki pocz ą tkowej 0,4 - 0,8 g/kg podanej jednorazowo, a nast ę pnie co najmniej 0,2 g/kg podawanej
co trzy do czterech tygodni. Dawka wymagana do osi ą gni ę cia minimalnego st ęż enia IgG 6 g/l wynosi
0,2 - 0,8 g/kg/miesi ą c. Po osi ą gni ę ciu stabilnego stanu, przerwy mi ę dzy infuzjami wynosz ą 3 - 4
tygodnie. Nale ż y oznacza ć i ocenia ć poziom immunoglobuliny w odniesieniu do cz ę sto ś ci
wyst ę powania zaka ż e ń . W celu zmniejszenia cz ę sto ś ci wyst ę powania zaka ż e ń bakteryjnych mo ż e by ć
konieczne zwi ę kszenie dawki w celu uzyskania wi ę kszego st ęż enia.
Wtórne niedobory odporności
Zalecana dawka wynosi 0,2 - 0,4 g/kg co trzy do czterech tygodni.
Nale ż y oznacza ć i ocenia ć minimalny poziom IgG w odniesieniu do cz ę sto ś ci wyst ę powania zaka ż e ń .
Dawk ę nale ż y dostosowa ć w miar ę potrzeby w celu uzyskania wła ś ciwej ochrony przed zaka ż eniami
mo ż e by ć konieczne zwi ę kszenie dawki u pacjentów z utrzymuj ą cym si ę zaka ż eniem; zmniejszenie
dawki mo ż na rozwa ż y ć , gdy pacjent nie ma zaka ż enia.
Pierwotna małopłytkowośćimmunologiczna
Dwa alternatywne schematy leczenia:
- dawka 0,8 - 1,0 g/kg w pierwszym dniu; dawka mo ż e by ć powtórzona raz w ci ą gu 3 dni
- 0,4 g/kg na dob ę przez dwa do pi ę ciu dni. Leczenie mo ż na powtórzy ć , je ś li nast ą pi nawrót choroby.
Zespół Guillain – Barré
0,4 g/kg/dob ę przez ponad 5 dni (mo ż liwe powtórzenie dawkowania w przypadku nawrotu).
Choroba Kawasaki
Nale ż y poda ć 2,0 g/kg w jednorazowej dawce. Pacjenci powinni otrzymywa ć równocze ś nie kwas
acetylosalicylowy.
Przewlekła zapalna polineuropatia demielinizacyjna (CIDP)
Dawka pocz ą tkowa: 2 g/kg przez 2-5 kolejnych dni.
Dawka podtrzymuj ą ca: 1 g/kg przez 1 – 2 kolejne dni co 3 tygodnie.
Skuteczno ść leczenia nale ż y ocenia ć po ka ż dym cyklu; je ś li obserwuje si ę brak skuteczno ś ci po 6
miesi ą cach, leczenie nale ż y przerwa ć .
Je ś li terapia jest skuteczna, lekarz powinien podj ąć decyzj ę o długoterminowym leczeniu bior ą c pod
uwag ę reakcje pacjenta i odpowied ź na leczenie podtrzymuj ą ce. Dawkowanie i przerwy w leczeniu
mog ą wymaga ć dostosowania w zale ż no ś ci od indywidualnego przebiegu choroby.
Wieloogniskowa neuropatia ruchowa (MMN)
Dawka pocz ą tkowa: 2 g/kg podawana przez 2 - 5 kolejnych dni.
Dawka podtrzymuj ą ca: 1 g/kg co 2 do 4 tygodni lub 2 g/kg co 4 do 8 tygodni.
Skuteczno ść leczenia nale ż y ocenia ć po ka ż dym cyklu; je ś li obserwuje si ę brak skuteczno ś ci po 6
miesi ą cach, leczenie nale ż y przerwa ć .
Je ś li terapia jest skuteczna, lekarz powinien podj ąć decyzj ę o długoterminowym leczeniu bior ą c pod
uwag ę reakcje pacjenta i odpowied ź na leczenie podtrzymuj ą ce. Dawkowanie i przerwy w leczeniu
mog ą wymaga ć dostosowania w zale ż no ś ci od indywidualnego przebiegu choroby.
Zalecane dawkowanie przedstawiono w poni ż szej tabeli:
| Wskazania | Dawka | Częstość wstrzyknięć |
| Leczenie substytucyjne | ||
| Pierwotne zespoły niedoboru odporności | dawka początkowa: 0,4 - 0,8 g/kg dawka podtrzymująca: 0,2 - 0,8 g/kg | co 3 - 4 tygodnie |
| Wtórne niedobory odporności | 0,2 - 0,4 g/kg | co 3 - 4 tygodnie |
| Leczenie immunomodulujące | ||
| Pierwotna małopłytkowość immunologiczna | 0,8 - 1 g/kg lub 0,4 g/kg/d | w pierwszym dniu, możliwe powtórzenie raz w ciągu 3 dni przez 2 - 5 dni |
| Zespół Guillain–Barré | 0,4 g/kg/d | przez 5 dni |
| Choroba Kawasaki | 2 g/kg | w jednej dawce w połączeniu z kwasem acetylosalicylowym |
| Przewlekła zapalna polineuropatia demielinizacyjna (CIDP) | dawka początkowa: 2 g/kg dawka podtrzymująca: 1 g/kg | w podzielonych dawkach przez 2 - 5 dni co 3 tygodnie przez 1 - 2 dni |
| Wieloogniskowa neuropatia ruchowa (MMN) | dawka podtrzymująca: 1 g/kg lub 2 g/kg | co 2 - 4 tygodnie lub co 4 - 8 tygodni przez 2 - 5 dni |
Stosowanie u dzieci i młodzieży
Dawkowanie u dzieci i młodzie ż y (0-18 lat) nie ró ż ni si ę od tego stosowanego u dorosłych, poniewa ż
dawkowanie w poszczególnych wskazaniach okre ś lone jest na podstawie masy ciała i stanu
klinicznego pacjenta odpowiednio do ww.
Pacjenci z niewydolnościąwątroby
Brak dost ę pnych danych o konieczno ś ci dostosowania dawkowania.
Pacjenci z niewydolnościąnerek
Nie ma konieczno ś ci dostosowania dawki, chyba ż e jest to uzasadnione klinicznie.
Osoby starsze
Nie ma konieczno ś ci dostosowania dawki, chyba ż e jest to uzasadnione klinicznie.
CIDP
Ze wzgl ę du na rzadkie wyst ę powanie przewlekłej zapalnej polineuropatii demielinizacyjnej i w
konsekwencji mał ą liczb ę pacjentów ogółem, do ś wiadczenie w stosowaniu immunoglobulin
do ż ylnych u dzieci z CIDP jest ograniczone; z tego wzgl ę du dost ę pne s ą tylko dane z literatury.
Jednak ż e, opublikowane dane s ą zgodne i wszystkie wykazuj ą , ż e leczenie IVIg u dorosłych i dzieci
jest jednakowo skuteczne, jak w przypadku zatwierdzonych dotychczas wskaza ń .
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyNie
- Producent
- ImporterKedrion S.p.A.
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Ig VenaSubstancja czynna: immunoglobulins, normal human, for intravascular adm.Producent: Baxalta Belgium Manufacturing S.A.Wymaga receptyPostać farmaceutyczna: Roztwór, 100 mg/mlSubstancja czynna: immunoglobulins, normal human, for intravascular adm.Producent: Instituto Grifols S.A.Wymaga receptyPostać farmaceutyczna: Roztwór, 50 g/l (50 mg/ml)Substancja czynna: immunoglobulins, normal human, for intravascular adm.Producent: Biotest Pharma GmbHWymaga recepty
Odpowiedniki Ig Vena w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Ig Vena – Hiszpania
Odpowiednik Ig Vena – Ukraina
Lekarze online w sprawie Ig Vena
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Ig Vena – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














