

Feiba NF

Zapytaj lekarza o receptę na Feiba NF

Jak stosować Feiba NF
Ulotka dołączona do opakowania: informacja dla użytkownika
FEIBA NF, 500 j. (50 j./ml), proszek i rozpuszczalnik do sporządzania roztworu do wstrzykiwań
Zespół czynników krzepnięcia przeciw inhibitorowi czynnika VIII
Należy uważnie zapoznać się z treścią ulotki przed zastosowaniem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza, farmaceuty lub pielęgniarki.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek FEIBA NF i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku FEIBA NF
- 3. Jak stosować lek FEIBA NF
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek FEIBA NF
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek FEIBA NF i w jakim celu się go stosuje
FEIBA NF jest lekiem otrzymanym z ludzkiego osocza, który umożliwia krzepnięcie krwi
w przypadku niedoboru lub braku niektórych czynników krzepnięcia.
Lek FEIBA NF jest stosowany do leczenia krwawień i zapobiegania krwawieniom u pacjentów
z hemofilią A powikłaną obecnością inhibitora czynnika VIII i z hemofilią B powikłaną obecnością
inhibitora czynnika IX.
Ponadto lek FEIBA NF może być stosowany do leczenia i zapobiegania krwawieniom u osób
niecierpiących na hemofilię, lecz posiadających nabyte inhibitory czynników VIII, IX i XI.
Lek FEIBA NF jest także stosowany w połączeniu z koncentratem czynnika VIII podczas
długotrwałego leczenia mającego na celu całkowitą i trwałą eliminację inhibitorów czynnika VIII, aby
umożliwić regularne leczenie koncentratem czynnika VIII, tak jak u pacjentów bez inhibitorów.
W odosobnionych przypadkach zastosowano lek FEIBA NF u pacjentów z inhibitorem czynnika
von Willebranda.
2. Informacje ważne przed zastosowaniem leku FEIBA NF
Należy poinformować lekarza, jeżeli u pacjenta występuje jakakolwiek alergia.
Należy poinformować lekarza, jeżeli pacjent stosuje dietę niskosodową.
Kiedy nie stosować leku FEIBA NF
W następujących sytuacjach nie należy stosować leku FEIBA NF, jeżeli istnieje możliwość
zastosowania innego leczenia:
- jeśli pacjent ma nadwrażliwość na zespół czynników krzepnięcia przeciw inhibitorowi czynnika VIII lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
- jeśli u pacjenta występuje rozsiane wykrzepianie śródnaczyniowe (DIC, koagulopatia ze zużycia, stan zagrażający życiu, związany z masywnym krzepnięciem krwi z tworzeniem skrzepów krwi w naczyniach. Prowadzi to do ogólnego zużycia czynników krzepnięcia.).
- jeśli pacjent ma ostrą zakrzepicę lub zator (w tym zawał mięśnia sercowego).
Patrz punkt „Ostrzeżenia i środki ostrożności”.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem przyjmowania leku FEIBA NF należy omówić to z lekarzem.
Ten lek może przyczyniać się do wystąpienia reakcji nadwrażliwości typu alergicznego, które
obejmują pokrzywkę, obrzęk naczynioruchowy, objawy ze strony przewodu pokarmowego, skurcze
oskrzeli i niedociśnienie; reakcje te mogą być ciężkie i układowe (np. reakcja anafilaktyczna
z pokrzywką i obrzękiem naczynioruchowym, skurcz oskrzeli i wstrząs krążeniowy). Zgłaszano
również inne reakcje związane z infuzją, jak dreszcze, gorączkę i nadciśnienie.
W przypadku pojawienia się pierwszych oznak lub objawów związanych z infuzją / reakcji
nadwrażliwości (patrz punkt 4) należy przerwać podawanie tego leku i rozpocząć odpowiednią opiekę
medyczną.
W przypadku pacjentów z podejrzeniem nadwrażliwości na lek lub którykolwiek z jego składników,
lekarz zdecyduje o ponownym podaniu leku FEIBA NF tylko po dokładnym rozważeniu ryzyka
i spodziewanych korzyści i (lub) gdy nie można spodziewać się wyników leczenia za pomocą innej
terapii zapobiegawczej lub alternatywnych środków leczniczych.
W trakcie leczenia lekiem FEIBA NF występowały zaburzenia zakrzepowo-zatorowe, w tym rozsiane
wykrzepianie śródnaczyniowe (DIC), zakrzepica żylna, zatorowość płucna, zawał mięśnia sercowego
i udar.
W przypadku pojawienia się pierwszych oznak lub objawów zaburzeń zakrzepowo-zatorowych (patrz
punkt 4) należy natychmiast przerwać infuzję i rozpocząć odpowiednie postępowanie diagnostyczne
i terapeutyczne.
Niektóre zaburzenia zakrzepowo-zatorowe występowały w przypadku stosowania dużych dawek leku
FEIBA NF lub u pacjentów z innymi czynnikami ryzyka predysponującymi do zaburzeń
zakrzepowo-zatorowych, w tym DIC, zaawansowaną chorobą miażdżycową, urazem
zmiażdżeniowym lub posocznicą. Jednoczesne stosowanie rekombinowanego czynnika VIIa może
zwiększać ryzyko wystąpienia zaburzeń zakrzepowo-zatorowych. U pacjentów z wrodzoną lub nabytą
hemofilią należy zawsze brać pod uwagę możliwość występowania takich czynników ryzyka.
Lek powinien być stosowany ze szczególną ostrożnością u pacjentów z ryzykiem DIC, zakrzepicą
tętniczą lub żylną.
Przypadki mikroangiopatii zakrzepowej zgłaszano w badaniu klinicznym emicizumabu, w którym
pacjenci otrzymywali lek FEIBA NF jako część schematu leczenia krwawienia przełomowego.
U pacjentów z hemofilią i obecnością inhibitora lub nabytymi inhibitorami na czynniki krzepnięcia,
podczas leczenia lekiem FEIBA NF może występować zwiększona tendencja do krwawień
i jednocześnie zwiększone ryzyko zatorowości.
W następujących sytuacjach zastosowanie FEIBA NF jest dopuszczalne jedynie, gdy spodziewany jest
brak reakcji na leczenie odpowiednim koncentratem czynnika krzepnięcia np. w sytuacji
występowania wysokiego miana inhibitora i zagrażającego życiu krwotoku lub ryzyka krwawienia
(np. pourazowego lub pooperacyjnego):
- Rozsiane wykrzepianie śródnaczyniowe (DIC).
- Uszkodzenie wątroby: z uwagi na opóźnione usuwanie aktywnych czynników krzepnięcia u pacjentów z zaburzoną czynnością wątroby występuje zwiększone ryzyko DIC.
- Choroba wieńcowa serca, ostra zakrzepica i (lub) zator. Patrz punkt „Kiedy nie stosować leku FEIBA NF”.
W przypadku leków wytwarzanych z ludzkiej krwi lub osocza, podejmowane są określone środki
zapobiegające zakażeniom przenoszonym na pacjentów. Do tych środków zalicza się dokładną
selekcję dawców krwi i osocza, aby upewnić się, że ci, którzy są w grupie ryzyka przenoszenia
zakażeń są wykluczeni oraz sprawdzanie pojedynczych próbek oddanej krwi i puli zebranego osocza
pod kątem wirusów/zakażeń. Wytwórcy tych produktów w procesie przetwarzania krwi i osocza
włączają także etapy, które mają na celu inaktywację lub usunięcie wirusów. Pomimo takich środków,
w przypadku podawania leków wytwarzanych z ludzkiej krwi lub osocza nie można całkowicie
wykluczyć możliwości przeniesienia zakażenia. Dotyczy to także nieznanych lub niedawno wykrytych
wirusów lub innych rodzajów zakażeń.
Podejmowane środki uważane są za skuteczne wobec wirusów osłonkowych, takich jak wirus HIV
(wywołujący AIDS), wirus zapalenia wątroby typu B i wirus zapalenia wątroby typu C, oraz
bezosłonkowego wirusa zapalenia wątroby typu A. Podejmowane środki mogą mieć ograniczoną
wartość wobec wirusów bezosłonkowych, takich jak parwowirus B19. Zakażenie parwowirusem B19
może być poważne u kobiet w ciąży (zakażenie płodu) i dla osób z niedoborem odporności lub
zwiększoną erytropoezą (np. anemia hemolityczna).
U pacjentów otrzymujących regularnie lub kilkakrotnie czynnik VIII otrzymany z osocza ludzkiego,
należy rozważyć zastosowanie odpowiednich szczepień (przeciwko wirusowemu zapaleniu wątroby
typu A i B).
Po podaniu dużych dawek leku FEIBA NF, przejściowy wzrost biernie przenoszonych przeciwciał
przeciwko antygenowi powierzchniowemu wirusa zapalenia wątroby typu B może skutkować
fałszywie dodatnimi wynikami testów serologicznych.
Lek zawiera izohemaglutyniny, przeciwciała przeciwko czerwonym krwinkom, które biernie
przeniesione mogą wpływać na wyniki testów serologicznych na obecność przeciwciał przeciwko
krwinkom czerwonym, takie jak test antyglobulinowy (test Coombsa).
Podczas każdorazowego podania pacjentowi dawki FEIBA NF należy czytelnie zapisać nazwę
i numer serii leku w celu zachowania informacji o użytych seriach.
FEIBA NF a inne leki
Należy poinformować lekarza o wszystkich obecnie i ostatnio przyjmowanych lekach, nawet tych
dostępnych bez recepty.
Nie przeprowadzono odpowiednich i dobrze kontrolowanych badań dotyczących leczenia
skojarzonego lub sekwencyjnego z zastosowaniem FEIBA NF i rekombinowanego czynnika VIIa,
leków hamujących fibrynolizę lub emicizumabu (patrz „Ostrzeżenia i środki ostrożności”).
Należy rozważyć możliwość wystąpienia incydentów zakrzepowo-zatorowych w przypadku
równoczesnego stosowania układowych leków hamujących fibrynolizę, takich jak np.: kwas
traneksamowy i kwas aminokapronowy w połączeniu z FEIBA NF. Dlatego leki hamujące fibrynolizę
nie powinny być stosowane przez około 6 do 12 godzin po podaniu FEIBA NF.
W odniesieniu do dostępnych danych z badań in vitroi obserwacji klinicznych, w przypadkach
jednoczesnego stosowania czynnika rekombinowanego VIIa, nie można wykluczyć wystąpienia
potencjalnej interakcji lekowej, która może skutkować incydentem zakrzepowo-zatorowym.
Jeżeli leczenie lekiem FEIBA NF jest rozważane po tym jak pacjent otrzymywał emicizumab, pacjent
musi być ściśle monitorowany przez lekarza prowadzącego.
Tak jak w przypadku wszystkich produktów leczniczych czynników krzepnięcia, nie wolno mieszać
leku FEIBA NF z innymi lekami przed podaniem; może to niekorzystnie wpłynąć na skuteczność
i bezpieczeństwo stosowania leku.
Zaleca się, aby przed i po podaniu leku FEIBA NF, wejście dożylne przepłukać izotonicznym
roztworem sodu chlorku.
Ciąża, karmienie piersią i wpływ na płodność
Lekarz zdecyduje, czy można zastosować FEIBA NF w czasie ciąży lub karmienia piersią. Z uwagi na
zwiększone ryzyko zakrzepów podczas ciąży, lek FEIBA NF powinien być stosowany wyłącznie pod
ścisłą kontrolą medyczną i gdy jest to wyraźnie wskazane.
Odnośnie ryzyka zakażeń parwowirusem B19, patrz „Ostrzeżenia i środki ostrożności”.
Prowadzenie pojazdów i obsługiwanie maszyn
Nie obserwowano żadnego wpływu na zdolność prowadzenia pojazdów i obsługiwania maszyn.
FEIBA NF zawiera sód
Lek zawiera 40 mg sodu (głównego składnika soli kuchennej) w każdej fiolce. Odpowiada to 2%
maksymalnej zalecanej dobowej dawki sodu w diecie u osób dorosłych.
3. Jak stosować lek FEIBA NF
Liofilizowany proszek FEIBA NF rozpuszcza się w załączonym rozpuszczalniku i podaje dożylnie.
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić
się do lekarza lub farmaceuty.
Leczenie należy rozpocząć i prowadzić pod nadzorem lekarza mającego doświadczenie w leczeniu
zaburzeń krzepnięcia.
Lekarz ustala odpowiednią dawkę i częstość podawania indywidualnie dla każdego pacjenta,
uwzględniając ciężkość zaburzenia krzepnięcia krwi, umiejscowienie i rozległość krwawienia oraz
ogólny stan pacjenta i jego reakcję na lek. Nie wolno samodzielnie zmieniać ustalonego przez lekarza
dawkowania leku, ani przerywać jego podawania.
Jeżeli w odczuciu pacjenta, lek działa zbyt silnie lub zbyt słabo należy skontaktować się z lekarzem
lub farmaceutą.
Przed podaniem należy ogrzać lek do temperatury pokojowej lub temperatury ciała, jeśli jest to
konieczne.
Lek FEIBA NF należy przygotować wyłącznie bezpośrednio przed podaniem.
Przygotowany roztwór należy użyć natychmiast (lek nie zawiera środków konserwujących).
Delikatnie mieszać ruchem obrotowym aż do rozpuszczenia proszku. Należy upewnić się, że lek
FEIBA NF uległ całkowitemu rozpuszczeniu, w przeciwnym razie przez filtr przyrządu przejdzie
mniej jednostek FEIBA.
Nie należy stosować roztworu, który jest mętny lub zawiera osad. Nie używać roztworu z wcześniej
napoczętych fiolek.
Stosować wyłącznie dostarczony rozpuszczalnik (jałową wodę do wstrzykiwań) i zestaw do
sporządzania roztworu.
Jeżeli stosuje się inny zestaw do sporządzenia i podawania niż załączony w opakowaniu FEIBA NF,
należy upewnić się, że użyje się właściwego filtra o wielkości porów co najmniej 149 µm.
Nie stosować, jeśli system utrzymujący jałowość lub opakowanie leku są uszkodzone lub zepsute.
Odnotować podanie leku na załączonej samoprzylepnej etykiecie.
Wszelkie niewykorzystane resztki leku lub jego odpady należy usunąć zgodnie z lokalnymi
przepisami.
Podanie z zastosowaniem igieł:
Sporządzanie roztworu do wstrzyknięć
Należy przestrzegać zasad aseptyki w trakcie całej procedury.
- 1. Ogrzać zamkniętą fiolkę zawierającą rozpuszczalnik (jałową wodę do wstrzykiwań) do temperatury pokojowej, jeśli to konieczne, np. używając do ogrzania łaźni wodnej przez kilka minut (maks. 37°C).
- 2. Usunąć kapsle ochronne z fiolek z proszkiem i rozpuszczalnikiem (ryc. A) i odkazić gumowe korki obu fiolek.
- 3. Przekręcając i ciągnąc, usunąć osłonkę z jednego końca załączonej igły dwustronnej (ryc. B). Wbić odsłoniętą igłę w korek gumowy fiolki z rozpuszczalnikiem (ryc. C).
- 4. Zdjąć osłonkę z drugiego końca igły dwustronnej zwracając uwagę by nie dotknąć części odsłoniętej.
- 5. Odwrócić fiolkę z rozpuszczalnikiem do góry dnem nad fiolką z proszkiem i wbić wolny koniec igły dwustronnej w gumowy korek fiolki z proszkiem (ryc. D). Rozpuszczalnik zostanie wessany do fiolki z proszkiem na zasadzie próżni.
- 6. Rozłączyć obie fiolki wyciągając igłę z fiolki z proszkiem (ryc. E). Delikatnie wstrząsnąć lub obracać fiolką proszku w celu przyspieszenia procesu rozpuszczania.
- 7. Po zakończeniu procesu rozpuszczania proszku wbić igłę z odpowietrznikiem (ryc. F) a powstała piana zniknie. Usunąć igłę z odpowietrznikiem.
Wstrzyknięcie/infuzja
Przestrzegać zasad aseptyki w trakcie całej procedury.
- 1. Zdjąć osłonkę z załączonej igły z filtrem przekręcając ją i nasadzić igłę na sterylną strzykawkę jednorazową. Pobrać roztwór do strzykawki (ryc. G).
- 2. Odłączyć igłę z filtrem od strzykawki i po założeniu dołączonego zestawu infuzyjnego z igłą motylkową (lub jednorazową igłą do wstrzykiwań) wstrzyknąć roztwór powoli dożylnie. Do kontrolowania szybkości podawania może być stosowana pompa strzykawkowa.
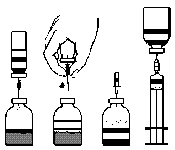
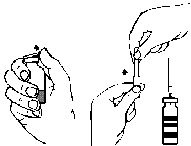
ryc. A ryc. B ryc. C ryc. D ryc. E ryc. F ryc. G
Nie należy przekraczać szybkości 2 jednostek FEIBA na kg mc. na minutę. Podanie z zastosowaniem BAXJECT II Hi-Flow:
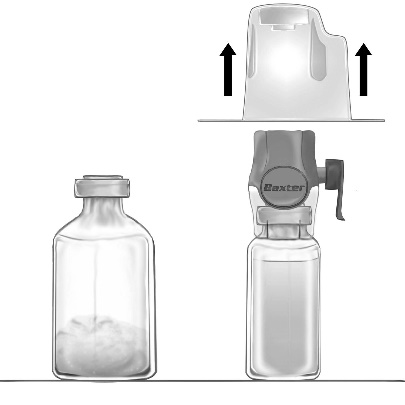
Sporządzanie roztworu do wstrzyknięć
Należy przestrzegać zasad aseptyki w trakcie całej procedury.
- 1. Doprowadzić fiolkę z rozpuszczalnikiem (jałową wodą do wstrzykiwań) do temperatury pokojowej, jeśli to konieczne, np. używając do ogrzania łaźni wodnej przez kilka minut (maks. 37°C).
- 2. Usunąć kapsle ochronne z fiolek z proszkiem i rozpuszczalnikiem i odkazić gumowe korki obu fiolek. Umieścić fiolki na płaskiej powierzchni.
- 3. Otworzyć opakowanie urządzenia BAXJECT II Hi-Flow przez oderwanie papierowego wieczka, nie dotykając wnętrza (Ryc. a). Nie wyjmować urządzenia z opakowania.
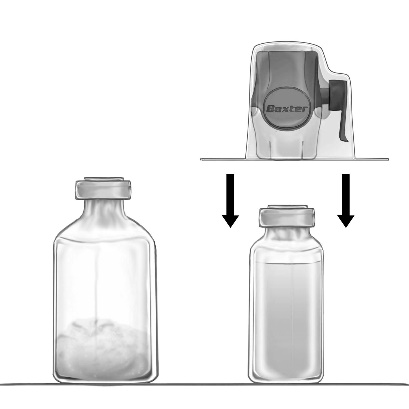
- 4. Obrócić opakowanie do góry dnem i przebić przezroczyste plastikowe ostrze przez korek fiolki rozpuszczalnika (Ryc. b). Chwytając opakowanie za krawędzie, zdjąć je z urządzenia
BAXJECT II Hi-Flow (Ryc. c). Nie usuwać niebieskiej zatyczki z urządzenia BAXJECT II
Hi-Flow.
- 5. BAXJECT II Hi-Flow połączony z fiolką z rozpuszczalnikiem odwrócić tak, aby fiolka z rozpuszczalnikiem znajdowała się nad urządzeniem. Przebić fioletowe plastikowe ostrze przez korek fiolki z proszkiem FEIBA NF. Pod wpływem próżni rozpuszczalnik zostanie wessany do fiolki z proszkiem FEIBA NF (Ryc. d).
- 6. Mieszać delikatnie, ruchem obrotowym, ale bez wstrząsania, aż do całkowitego rozpuszczenia produktu. Należy upewnić się, czy FEIBA NF uległ całkowitemu rozpuszczeniu – w przeciwnym razie substancja czynna nie przejdzie przez filtr urządzenia.
Ryc. a
Ryc. b
Ryc. c

Wstrzyknięcie/infuzja
Przestrzegać zasad aseptyki w trakcie całej procedury.
- 1. Usunąć niebieską zatyczkę z urządzenia BAXJECT II Hi-Flow. Ściśle połączyć strzykawkę z BAXJECT II Hi-Flow (NIE NABIERAĆ POWIETRZA DO STRZYKAWKI) W celu zapewnienia szczelnego połączenia pomiędzy strzykawką a urządzeniem BAXJECT II Hi-Flow szczególnie zaleca się stosowanie strzykawki z końcówką typu luer (mocując strzykawkę należy ją obrócić w kierunku zgodnym z ruchem wskazówek zegara aż do momentu zatrzymania) (Ryc. e).
- 2. Odwrócić zestaw, tak aby roztwór znajdował się na górze. Pobrać roztwór do strzykawki, POWOLI pociągając tłok w tył i upewniając się, że połączenie pomiędzy strzykawką a urządzeniem BAXJECT II Hi-Flow jest szczelne a strzykawka umocowana przez cały czas pobierania roztworu (Ryc. f).
- 3. Odłączyć strzykawkę.
- 4. Jeśli w strzykawce pojawi się spieniony roztwór, należy odczekać do czasu zniknięcia piany. Roztwór powoli podawać dożylnie używając zestawu infuzyjnego (lub igły do wstrzykiwań jednorazowego użytku). Do kontrolowania szybkości podawania może być stosowana pompa strzykawkowa.
Ryc. d
Ryc. e
Ryc. f
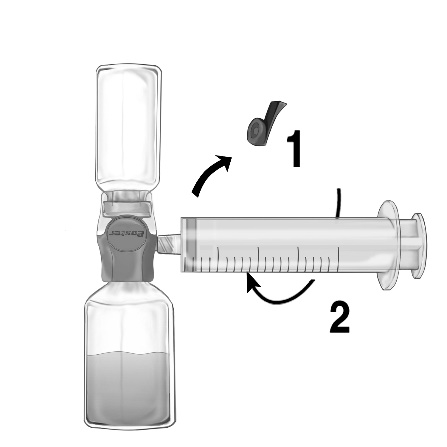

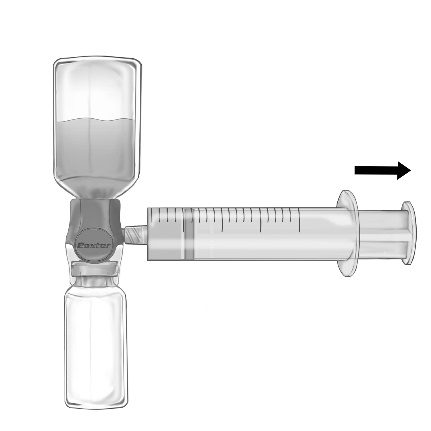
Nie należy przekraczać szybkości 2 jednostek FEIBA na kg mc. na minutę.
Przyjęcie większej niż zalecana dawki leku FEIBA NF
Należy natychmiast poinformować lekarza. Przedawkowanie FEIBA NF może zwiększyć ryzyko
działań niepożądanych, takich jak stany zakrzepowo-zatorowe (tworzenie zakrzepów krwi, które
przemieszczają się w naczyniach krwionośnych), koagulopatia „ze zużycia” (zaburzenie krzepnięcia
krwi DIC) lub zawał serca.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, choć nie u każdego one wystąpią.
Należy natychmiast skontaktować się z lekarzemw przypadku wystąpienia jednego lub więcej
z objawów:
- reakcji nadwrażliwości: wysypki, swędzącej wysypki (pokrzywki), swędzenia, obrzęku warg i języka, świszczącego oddechu, odczuwania ucisku w klatce piersiowej, objawów ze strony przewodu pokarmowego, zawrotów głowy, nagłego spadku ciśnienia krwi, dreszczy, gorączki, nadciśnienia, śpiączki
- rozsianego wykrzepiania śródnaczyniowego (DIC): samoistnie powstających siniaków, wybroczyn, silnego, jednoczesnego krwawienia (np. z ran, miejsc po wkłuciach, błon śluzowych, dróg rodnych), niewydolności narządów spowodowanej ich niedokrwieniem (w przypadku nerek np. bezmocz lub skąpomocz; płuc - duszność, kaszel, krwioplucie; mózgu - zaburzenia orientacji i problemy z koncentracją, drgawki, zaburzenia świadomości, śpiączka)
- zakrzepicy żylnej: bólu i obrzęku kończyny, zazwyczaj jednostronnego, wzrostu ocieplenia kończyny, stanu podgorączkowego lub gorączki
- zatorowości płucnej: znacznej zmiany ciśnienia krwi lub szybkości tętna, trudności w oddychaniu, kaszlu lub bólu w klatce piersiowej
- zawału serca: bólu w klatce piersiowej, który może promieniować do lewego barku lub ramienia, do żuchwy, nadbrzusza lub pleców; duszności, kołatania serca, zawrotów głowy, omdlenia, osłabienia, niepokoju, lęku
- udaru: nagłego, silnego bólu głowy, zaburzenia widzenia, jednostronnego opadania kącika ust, trudności w połykaniu i mówieniu, zaburzenia koordynacji ruchowej i równowagi, senności, dezorientacji, utraty przytomności
Częste działania niepożądane (mogą dotyczyć do 1 na 10 osób):
- Nadwrażliwość
- Ból głowy, zawroty głowy
- Niedociśnienie
- Wysypka
- Dodatni wynik przeciwciał przeciwko antygenowi powierzchniowemu wirusa zapalenia wątroby typu B, podwyższone stężenie D-dimerów fibryny
Działania niepożądane o częstości nieznanej (nie można określić na podstawie dostępnych danych):
- Rozsiane wykrzepianie śródnaczyniowe (DIC), wzrost miana inhibitora
- Reakcja anafilaktyczna (szybko rozpoczynająca się i zagrażająca życiu reakcja nadwrażliwości), swędząca wysypka skórna na całym ciele (pokrzywka)
- Uczucie zdrętwienia kończyn (niedoczulica), nieprawidłowe lub osłabione czucie (parestezje), udar (udar zakrzepowy, udar zatorowy), senność, zaburzenia smaku
- Atak serca (zawał serca), palpitacje serca (częstoskurcz)
- Powstawanie zakrzepów (zakrzepica żylna, zakrzepica tętnicza), które przemieszczają się w naczyniach krwionośnych (zdarzenia zakrzepowo-zatorowe), wzrost ciśnienia krwi (nadciśnienie), nagłe zaczerwienienie
- Zator tętnicy płucnej (zatorowość płucna), zwężenie dróg oddechowych (skurcz oskrzeli), świszczący oddech, kaszel, brak tchu (duszność)
- Wymioty, biegunka, dyskomfort w jamie brzusznej, nudności
- Uczucie zdrętwienia twarzy, obrzęk twarzy, języka i warg (obrzęk naczynioruchowy), swędząca wysypka na całym ciele (pokrzywka), swędzenie (świąd)
- Ból w miejscu podania, ogólne złe samopoczucie, uczucie gorąca, dreszcze, gorączka, ból w klatce piersiowej, dyskomfort w klatce piersiowej
- Spadek ciśnienia krwi
Objawy reakcji nadwrażliwości po podaniu leków pochodzących z osocza ludzkiego obejmują także
śpiączkę oraz niepokój.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek FEIBA NF
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie przechowywać w temperaturze powyżej 25°C. Nie zamrażać.
Przechowywać lek w opakowaniu zewnętrznym w celu ochrony przed światłem.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na opakowaniu.
Termin ważności oznacza ostatni dzień podanego miesiąca.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera FEIBA NF
Proszek
- Substancją czynną jest zespół czynników krzepnięcia przeciw inhibitorowi czynnika VIII. Po rekonstytucji w 10 ml dołączonego do opakowania rozpuszczalnika (woda do wstrzykiwań) 1 ml zawiera około 50 j. zespołu czynników krzepnięcia przeciw inhibitorowi czynnika VIII. 1 fiolka zawiera 500 j. czynnika VIII z aktywnością omijającą inhibitor w 200-600 mg białka ludzkiego osocza.
- FEIBA NF zawiera także czynniki II, IX, i X głównie w postaci nieaktywowanej oraz aktywowany czynnik VII. Antygen koagulacyjny czynnika VIII (F VIII C:Ag) obecny jest w stężeniu do 0,1 jednostki na 1 jednostkę FEIBA. Czynniki układu kalikreina-kininy są obecne tylko w śladowych ilościach lub w ogóle nie występują.
- Pozostałe składniki leku to: sodu chlorek i sodu cytrynian.
Rozpuszczalnik
- woda do wstrzykiwań
Jak wygląda FEIBA NF i co zawiera opakowanie
Lek występuje w postaci liofilizowanego proszku lub miałkiej substancji stałej o kolorze białawym
lub bladozielonym.
Proszek i rozpuszczalnik dostarczane są w szklanych fiolkach zamkniętych gumowymi korkami.
Wartość pH roztworu po rekonstytucji wynosi między 6,8 i 7,6.
Wielkość opakowania: 1 zestaw
Zawartość opakowania (z igłami):
1 fiolka z 500 j. FEIBA NF, zamknięta gumowym korkiem
1 fiolka z 10 ml wody do wstrzykiwań, zamknięta gumowym korkiem
1 igła dwustronna
1 igła z odpowietrznikiem
1 strzykawka jednorazowego użytku
1 igła do wstrzykiwań
1 igła z filtrem
1 igła motylkowa (zestaw infuzyjny z igłą motylkową)
Zawartość opakowania (z BAXJECT II Hi-Flow):
1 fiolka z 500 j. FEIBA NF, zamknięta gumowym korkiem
1 fiolka z 10 ml wody do wstrzykiwań, zamknięta gumowym korkiem
1 BAXJECT II Hi-Flow - bezigłowy przyrząd przenoszący, służący do przenoszenia do strzykawki
i mieszania leków zawartych w dwóch fiolkach
1 strzykawka jednorazowego użytku
1 igła do wstrzykiwań
1 igła motylkowa (zestaw infuzyjny z igłą motylkową)
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny:
Takeda Pharma Sp. z o.o.
ul. Prosta 68
00-838 Warszawa
Tel: +48 22 306 24 47
[email protected]
Wytwórca:
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wiedeń, Austria
Data ostatniej aktualizacji ulotki:
-----------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego:
Leczenie powinno być rozpoczęte i nadzorowane przez lekarza mającego doświadczenie w leczeniu
hemofilii.
Dawkowanie
Dawkowanie oraz czas leczenia zależą od ciężkości zaburzenia krzepnięcia, umiejscowienia
i rozległości krwawienia oraz od stanu klinicznego pacjenta.
Dawka, jak również częstość podawania powinny być zawsze ukierunkowane na skuteczność
kliniczną w danym przypadku.
Ogólnie zaleca się dawkę 50-100 jednostek FEIBA na kg masy ciała (mc.), jednakże nie należy
przekraczać jednorazowo dawki 100 j./kg mc., ani dawki maksymalnej dobowej 200 j./kg mc., chyba
że ciężkość krwawienia wymaga i uzasadnia użycie większych dawek.
Z uwagi na czynniki specyficzne dla danego pacjenta odpowiedź na zespół czynników z aktywnością
omijającą inhibitor czynnika VIII może być różna, a w określonym przypadku krwawienia u pacjenta,
u którego odpowiedź na jeden z czynników jest niedostateczna, należy rozważyć użycie innego
czynnika.
Dzieci i młodzież
Doświadczenie ze stosowaniem u dzieci w wieku poniżej 6 lat jest ograniczone; schemat dawkowania,
taki sam jak dla dorosłych, należy dostosować do stanu klinicznego dziecka.
- 1)
Krwotoki samoistne
Krwotoki do stawów, mięśni i tkanek miękkich
W przypadkach małych lub umiarkowanych krwawień zaleca się dawkę 50-75 j./kg mc.
w 12-godzinnych odstępach. Leczenie należy prowadzić do czasu uzyskania wyraźnych objawów
poprawy klinicznej, takich jak ustąpienie bólu, zmniejszenie obrzęku lub uruchomienie stawu.
W przypadkach dużych krwotoków do mięśni i tkanek miękkich, takich jak krwotoki do przestrzeni
zaotrzewnowej, zaleca się dawki 100 j./kg mc. w 12-godzinnych odstępach.
Krwotoki z błon śluzowych
Zaleca się dawkę 50 j./kg mc. co 6 godzin z równoczesną dokładną obserwacją pacjenta (obserwacja
powierzchni krwawiącej, powtarzane oznaczenia hematokrytu u pacjenta). Jeżeli krwawienie nie
ustanie, dawkę można zwiększyć do 100 j./kg mc. Nie należy przekraczać maksymalnej dawki
dobowej 200 j./kg mc.
Inne ciężkie krwotoki
W ciężkich krwotokach, takich jak krwawienie do centralnego układu nerwowego, zaleca się dawkę
100 j./kg mc. w 12-godzinnych odstępach. W indywidualnych przypadkach można podawać
FEIBA NF w 6-godzinnych odstępach do czasu uzyskania wyraźnej poprawy klinicznej. Nie należy
przekraczać maksymalnej dawki dobowej 200 j/kg mc.!
- 2)
Zabiegi chirurgiczne
Podawać 50-100 j./kg mc. w odstępach 6-godzinnych, zwracając uwagę, by nie przekroczyć
maksymalnej dawki dobowej.
- 3)
Profilaktyka
Istnieją ograniczone dane kliniczne dotyczące podawania FEIBA NF w celu profilaktyki krwawień
u pacjentów z hemofilią.
- Leczenie profilaktyczne krwawień u pacjentów z wysokim mianem inhibitora i częstymi krwawieniami, u których indukcja stanu tolerancji immunologicznej (ITI) nie powiodła się lub nie jest rozważana: Zaleca się dawkę 70-100 j./kg mc. co drugi dzień. Jeżeli krwawienie u pacjenta nie ustępuje, dawkę można zwiększyć do 100 j./kg mc. podawanych codziennie, lub stopniowo ją zmniejszać.
- Leczenie profilaktyczne krwawień u pacjentów z wysokim mianem inhibitorów w trakcie indukcji stanu tolerancji immunologicznej (ITI): Lek FEIBA NF można podawać jednocześnie z koncentratami czynnika VIII, w dawkach 50-100 j./kg mc. dwa razy na dobę, aż miano inhibitora czynnika VIII obniży się do <2 j.b.*< li>
*1 jednostka Bethesda definiowana jest jako ilość przeciwciała, które zmniejsza o 50% aktywność czynnika VIII
w świeżym normalnym osoczu ludzkim po 2 godzinach inkubacji w 37°C.
Sposób podawania
Patrz też punkt „FEIBA NF a inne leki” oraz punkt 3 ulotki.
Lek FEIBA NF należy podawać powoli dożylnie (nie szybciej niż 2 j./kg mc. na minutę).
FEIBA NF należy przygotować bezpośrednio przed podaniem.
Roztwór należy użyć natychmiast (nie zawiera środków konserwujących). Nie należy stosować
roztworu, który jest mętny lub zawiera osad.
Nie stosować, jeśli bezigłowy przyrząd przenoszący lub igła dwustronna, system utrzymujący ich
jałowość lub ich opakowanie jest uszkodzone lub popsute.
Niewykorzystane pozostałości roztworu należy usunąć zgodnie z obowiązującą procedurą.
Monitorowanie leczenia
Z uwagi na złożony mechanizm działania, nie jest dostępny żaden sposób bezpośredniego
monitorowania substancji czynnych.
Wyniki badań laboratoryjnych in vitrodo oceny skuteczności leczenia, takie jak aPTT, czas
krzepnięcia krwi i tromboelastogram (TEG) mogą nie odzwierciedlać poprawy klinicznej. Z tego
powodu próby przywrócenia prawidłowych wartości tych parametrów poprzez zwiększanie dawek
FEIBA NF mogą być zawodne i należy ich unikać ze względu na możliwość wystąpienia DIC
spowodowanego przedawkowaniem.
W przypadku niedostatecznej odpowiedzi na leczenie lekiem FEIBA NF zaleca się oznaczenie liczby
płytek krwi, ponieważ wystarczająca liczba czynnościowo sprawnych płytek jest niezbędna do
skuteczności leku FEIBA NF.
Nie należy przekraczać jednorazowych dawek wynoszących 100 j./kg mc. oraz dawki dobowej
200 j./kg mc. Pacjenci otrzymujący więcej niż 100 j./kg mc. muszą być monitorowani pod kątem
wystąpienia DIC i (lub) ostrej choroby wieńcowej. Duże dawki FEIBA NF powinny być podawane
jedynie przez okres niezbędny do zatrzymania krwawienia.
W przypadkach wystąpienia znaczących zmian ciśnienia krwi, szybkości tętna, zaburzeń oddychania,
bólu w klatce piersiowej i kaszlu należy natychmiast przerwać podawanie leku i zastosować
odpowiednie zabiegi diagnostyczne i terapeutyczne.
Wynikami laboratoryjnymi wskazującymi na DIC są: zmniejszenie zawartości fibrynogenu, obniżenie
liczby płytek krwi oraz obecność produktów degradacji fibryny/fibrynogenu (FDP).
Podawanie leku FEIBA NF pacjentom z inhibitorami może skutkować początkowo anamnestycznym
wzrostem poziomów inhibitora. Pod wpływem dalszego podawania FEIBA NF poziom inhibitora
może zmniejszać się z upływem czasu. Dane kliniczne i literaturowe wskazują, że skuteczność FEIBA
NF nie ulega zmniejszeniu.
Podczas podawania FEIBA NF, u pacjentów cierpiących na hemofilię powikłaną obecnością
inhibitora lub u pacjentów z nabytymi inhibitorami czynników krzepnięcia, może wystąpić
równocześnie skłonność do krwawień, jak i zwiększone ryzyko zakrzepicy.
Patrz też punkt „Ostrzeżenia i środki ostrożności”.
Szczegółowe informacje o tym leku są w Charakterystyce Produktu Leczniczego dostępnej na stronie
internetowej Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyTak
- Producent
- ImporterTakeda Manufacturing Austria AG
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki Feiba NFPostać farmaceutyczna: Proszek, 500 j.m. = 500 j. FEIBASubstancja czynna: factor VIII inhibitor bypassing activityProducent: Takeda Manufacturing Austria AGWymaga receptyPostać farmaceutyczna: Proszek, 1000 j. (1000 j. FEIBA), 50 j./mlSubstancja czynna: factor VIII inhibitor bypassing activityProducent: Takeda Manufacturing Austria AGWymaga receptyPostać farmaceutyczna: Proszek, 2 500 j. (2 500 j. FEIBA), 50 j./mlSubstancja czynna: factor VIII inhibitor bypassing activityProducent: Takeda Manufacturing Austria AGWymaga recepty
Odpowiedniki Feiba NF w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Feiba NF – Hiszpania
Lekarze online w sprawie Feiba NF
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Feiba NF – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














