
Biotum
Zapytaj lekarza o receptę na Biotum

Jak stosować Biotum
Ulotka dołączona do opakowania: informacja dla użytkownika
Biotum, 500 mg, proszek do sporządzania roztworu do wstrzykiwań
Ceftazidimum
Należy uważnie zapoznać się z treścią ulotki przed zażyciem leku, ponieważ zawiera ona informacje ważne dla pacjenta.
- Należy zachować tę ulotkę, aby w razie potrzeby móc ją ponownie przeczytać.
- W razie jakichkolwiek wątpliwości należy zwrócić się do lekarza lub pielęgniarki.
- Lek ten przepisano ściśle określonej osobie. Nie należy go przekazywać innym. Lek może zaszkodzić innej osobie, nawet jeśli objawy jej choroby są takie same.
- Jeśli u pacjenta wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione w tej ulotce, należy powiedzieć o tym lekarzowi lub pielęgniarce. Patrz punkt 4.
Spis treści ulotki
- 1. Co to jest lek Biotum i w jakim celu się go stosuje
- 2. Informacje ważne przed zastosowaniem leku Biotum
- 3. Jak stosować lek Biotum
- 4. Możliwe działania niepożądane
- 5. Jak przechowywać lek Biotum
- 6. Zawartość opakowania i inne informacje
1. Co to jest lek Biotum i w jakim celu się go stosuje
Biotum jest antybiotykiem stosowanym u dorosłych i dzieci (w tym u noworodków). Działa on
bakteriobójczo na bakterie wywołujące zakażenia. Należy do grupy leków zwanych cefalosporynami .
Biotum stosuje się w leczeniu ciężkich zakażeń bakteryjnych:
- dolnych dróg oddechowych, w tym płuc
- płuc i oskrzeli u pacjentów z mukowiscydozą
- mózgu (zapalenie opon mózgowo-rdzeniowych)
- ucha
- dróg moczowych
- skóry i tkanek miękkich
- jamy brzusznej i powłok brzusznych (zapalenie otrzewnej)
- kości i stawów.
Biotum można również stosować:
- w zapobieganiu zakażeniom podczas przezcewkowej resekcji gruczołu krokowego u mężczyzn
- w leczeniu pacjentów z małą liczbą białych krwinek (neutropenia), mających gorączkę z powodu zakażenia bakteryjnego.
2. Informacje ważne przed zastosowaniem leku Biotum
Kiedy nie stosować leku Biotum
- Jeśli pacjent ma uczulenie na ceftazydym lub którykolwiek z pozostałych składników tego leku (wymienionych w punkcie 6).
- Jeśli u pacjenta kiedykolwiek występowała ciężka reakcja alergicznana jakikolwiek innyantybiotyk(penicyliny, monobaktamy i karbapenemy), ponieważ pacjent może być również uczulony na Biotum.
➢
Jeśli pacjent przypuszcza, że dotyczą go opisane powyżej okoliczności, powinien
poinformować o tym lekarza prowadzącego przedrozpoczęciem leczenia lekiem Biotum.
Nie podawać pacjentowi leku Biotum.
Ostrzeżenia i środki ostrożności
Przed rozpoczęciem stosowania leku Biotum należy omówić to z lekarzem lub pielęgniarką.
Należy zwracać uwagę, czy w czasie stosowania leku Biotum u pacjenta nie występują szczególne
objawy, takie jak reakcje alergiczne, zaburzenia układu nerwowego i zaburzenia żołądka i jelit, w tym
biegunka. Zmniejszy to ryzyko możliwych problemów. Patrz „Objawy, na które należy zwrócić
uwagę” w punkcie 4. Jeśli u pacjenta kiedykolwiek występowała reakcja alergiczna na inne
antybiotyki, może on być uczulony również na Biotum.
W związku z leczeniem ceftazydymem notowano ciężkie reakcje skórne, w tym zespół Stevensa-
Johnsona, toksyczne martwicze oddzielanie się naskórka, reakcję polekową z eozynofilią i objawami
ogólnoustrojowymi (DRESS) i ostrą uogólnioną osutkę krostkową (AGEP). Jeśli u pacjenta wystąpi
którykolwiek z objawów związanych z tymi ciężkimi reakcjami skórnymi, opisanymi w punkcie 4,
należy natychmiast skontaktować się z lekarzem.
Badania krwi i moczu
Biotum może zmieniać wyniki badania zawartości (stężenia) cukru w moczu oraz badań krwi,
znanych jako test Coombs’a. Jeśli pacjent ma mieć wykonywane takie badania:
- Należy poinformować osobę pobierającą próbki,że pacjent przyjmował lek Biotum.
Biotum a inne leki
Należy powiedzieć lekarzowi o wszystkich lekach stosowanych przez pacjenta obecnie lub ostatnio,
a także o lekach, które pacjent planuje stosować.
Pacjent nie powinien przyjmować leku Biotum bez konsultacji z lekarzem prowadzącym, jeśli
przyjmuje także:
- antybiotyk zwany chloramfenikolem
- antybiotyk z grupy zwanej aminoglikozydami, tj. gentamycynę, tobramycynę
- tabletki moczopędne zawierające furosemid.
➢
Jeśli opisane powyżej okoliczności dotyczą pacjenta, należy poinformować o tym lekarza
prowadzącego.
Ciąża i karmienie piersią
Jeśli pacjentka jest w ciąży lub karmi piersią, przypuszcza że może być w ciąży lub gdy planuje mieć
dziecko, powinna poradzić się lekarza przed zastosowaniem tego leku.
Lekarz prowadzący oceni, czy wynikające z przyjmowania leku Biotum podczas ciąży i karmienia
piersią korzyści dla pacjentki przeważają zagrożenia dla dziecka.
Prowadzenie pojazdów i obsługiwanie maszyn
Biotum może powodować działania niepożądane wpływające na zdolność prowadzenia pojazdów,
takie jak zawroty głowy (patrz punkt 4). Pacjent nie powinien prowadzić pojazdów ani obsługiwać
maszyn, chyba że ma pewność, że nie wystąpiły u niego te działania niepożądane.
Biotum zawiera sód
Każda fiolka leku Biotum 500 mg zawiera 30 mg sodu. Odpowiada to 1,5% maksymalnej zalecanej
dobowej dawki sodu w diecie u osób dorosłych.
Lek zawiera 60 mg sodu (głównego składnika soli kuchennej) w każdym gramie proszku. Odpowiada
to 3% maksymalnej zalecanej dobowej dawki sodu w diecie u osób dorosłych. Należy to wziąć pod
uwagę u pacjentów ze zmniejszoną czynnością nerek i u pacjentów kontrolujących zawartość sodu
w diecie.
Przygotowanie leku do podania - patrz punkt: „Informacje przeznaczone wyłącznie dla fachowego
personelu medycznego” na końcu ulotki. Obliczając całkowitą zawartość sodu w przygotowanym
rozcieńczeniu leku należy uwzględnić sód pochodzący z rozcieńczalnika. W celu uzyskania dokładnej
informacji dotyczącej zawartości sodu w roztworze wykorzystanym do rozcieńczenia leku, należy
zapoznać się z ulotką dla pacjenta stosowanego rozcieńczalnika.
3. Jak stosować lek Biotum
Ten lek należy zawsze stosować zgodnie z zaleceniami lekarza. W razie wątpliwości należy zwrócić
się do lekarza.
Biotum jest zwykle podawany przez lekarza lub pielęgniarkę.Może być podawany w kroplówce
(infuzja dożylna) lub jako wstrzyknięcie bezpośrednio do żyły lub wstrzyknięcie domięśniowe.
Biotum przygotowuje lekarz lub pielęgniarka z użyciem wody do wstrzykiwań lub innego
odpowiedniego płynu infuzyjnego.
Zwykle stosowana dawka
Lekarz prowadzący zdecyduje o odpowiedniej dla pacjenta dawce leku Biotum, biorąc pod uwagę
ciężkość i rodzaj zakażenia, przyjmowanie przez pacjenta jakichkolwiek innych antybiotyków, jego
masę ciała, wiek oraz prawidłowość pracy nerek.
Noworodki i niemowlęta (w wieku 0-2 miesięcy)
Na każdy 1 kg masy ciała niemowlęcia, podaje się w ciągu doby od 25 mg do 60 mg leku Biotum
w dwóch dawkach podzielonych.
Niemowlęta (w wieku powyżej 2 miesięcy) i dziecio masie ciała mniejszej niż 40 kg
Na każdy kg masy ciała niemowlęcia lub dzieckapodaje się w ciągu doby od 100 mg do 150 mg
leku Biotum w trzech dawkach podzielonych. Maksymalnie 6 g na dobę.
Dorośli i młodzieżo masie ciała 40 kg lub więcej
Od 1g do 2 g leku Biotum trzy razy na dobę. Maksymalnie 9 g na dobę.
Pacjenci w wieku powyżej 65 lat
Dawka dobowa zazwyczaj nie powinna być większa niż 3 g na dobę, szczególnie u pacjentów
w wieku powyżej 80 lat.
Pacjenci z chorymi nerkami
Pacjent może otrzymać dawkę inną niż zwykle stosowana. Lekarz lub pielęgniarka zdecyduje jaką
dawkę leku Biotum, w zależności od ciężkości choroby nerek, należy podać pacjentowi. Lekarz będzie
uważnie obserwował pacjenta i może zlecić wykonywanie u pacjenta częstszych badań czynności
nerek.
Zastosowanie większej niż zalecana dawki leku Biotum
W razie przypadkowego zastosowania większej dawki leku Biotum, niż została przepisana należy
natychmiast skontaktować się z lekarzem prowadzącym lub udać do najbliższego szpitala.
Pominięcie zastosowania leku Biotum
Jeśli pacjent nie przyjął wstrzyknięcia, należy podać je najszybciej jak to możliwe.
Nie należy stosować dawki podwójnej (dwa wstrzyknięcia w tym samym czasie) w celu uzupełnienia
pominiętej dawki, lecz zastosować kolejną dawkę o zwykłej porze.
Przerwanie stosowania leku Biotum
Nie należy zaprzestawać przyjmowania dawek Biotum bez zalecenia lekarza.
W razie jakichkolwiek dalszych wątpliwości związanych ze stosowaniem tego leku należy zwrócić się
do lekarza lub pielęgniarki.
4. Możliwe działania niepożądane
Jak każdy lek, lek ten może powodować działania niepożądane, chociaż nie u każdego one wystąpią.
Objawy, na które należy zwrócić uwagę
➢
Opisane niżej ciężkie objawy niepożądane wystąpiły u małej liczby osób, ale ich dokładna
częstość jest nieznana (częstość nie może być określona na podstawie dostępnych danych).
Jeśli u pacjenta wystąpi którykolwiek z następujących objawów, należy natychmiast skontaktować się z lekarzem:
- Ciężka reakcja alergiczna. Objawami są: wypukła, swędząca wysypka obrzęk, czasami twarzy lub ust, który może spowodować trudności w oddychaniu.
- Czerwonawe plamki na tułowiu, plamki przypominające tarczę lub okrągłe, często z centralnymi pęcherzami, łuszczenie się skóry, owrzodzenia jamy ustnej, gardła, nosa, narządów płciowych i oczu. Te ciężkie wysypki skórne mogą być poprzedzone gorączką i objawami grypopodobnymi (zespół Stevensa-Johnsona, toksyczne martwicze oddzielanie się naskórka).
- Rozległa wysypka, wysoka temperatura ciała i powiększone węzły chłonne (zespół DRESS lub zespół nadwrażliwości na lek).
- Czerwona, łuszcząca się, rozległa wysypka z guzkami pod skórą i pęcherzami i jednoczesną gorączką. Objawy występują zwykle na początku leczenia (ostra uogólniona osutka krostkowa).
- Zaburzenia układu nerwowego: drżenia, drgawki i czasami śpiączka. Zaburzenia te występowały u pacjentów, którym podano zbyt duże dawki, szczególnie u pacjentów z chorymi nerkami.
Częste działania niepożądane
Mogą wystąpić nie częściej niż u 1 na 10pacjentów:
- biegunka
- obrzęk i zaczerwienienie wzdłuż żyły
- czerwona wypukła wysypka na skórze, która może swędzieć
- ból, pieczenie, obrzęk lub stan zapalny w miejscu wstrzyknięcia.
➢
Jeśli którykolwiek z powyższych objawów niepokoi pacjenta, powinien powiedzieć o tym lekarzowi prowadzącemu.
Częste działania niepożądane mogące ujawnić się w wynikach badań krwi:
- zwiększenie liczby jednego rodzaju białych krwinek (eozynofilia)
- zwiększenie liczby płytek krwi, które biorą udział w procesie krzepnięcia krwi
- zwiększenie aktywności enzymów wątrobowych.
Niezbyt częste działania niepożądane
Mogą wystąpić nie częściej niż u 1 na 100pacjentów:
- zapalenie jelit, które może powodować ból lub biegunkę, mogącą zawierać krew
- pleśniawki - zakażenia grzybicze jamy ustnej lub pochwy
- ból głowy
- zawroty głowy
- ból brzucha
- nudności lub wymioty
- gorączka i dreszcze.
➢
Należy powiedzieć lekarzowi prowadzącemu, jeśli u pacjenta wystąpił którykolwiek
z powyższych objawów.
Niezbyt częste działania niepożądane mogące ujawnić się w wynikach badań krwi:
- zmniejszenie liczby krwinek białych
- zmniejszenie liczby płytek krwi (komórek biorących udział w krzepnięciu krwi)
- zwiększenie stężenia mocznika, azotu mocznikowego lub kreatyniny w surowicy krwi.
Bardzo rzadkie działania niepożądane
Mogą wystąpić nie częściej niż u 1 na 10 000pacjentów:
- zapalenie lub niewydolność nerek.
Inne działania niepożądane
Inne działania niepożądane, które wystąpiły u małej liczby pacjentów, ale dokładna częstość ich
występowania jest nieznana:
- mrowienie
- nieprzyjemny smak w ustach
- zażółcenie białkówek oczu i skóry.
Inne działania niepożądane mogące ujawnić się w wynikach badań krwi:
- krwinki czerwone rozpadają się zbyt szybko
- zwiększenie liczby jednego rodzaju krwinek białych we krwi
- znacznego stopnia zmniejszenie liczby krwinek białych.
Zgłaszanie działań niepożądanych
Jeśli wystąpią jakiekolwiek objawy niepożądane, w tym wszelkie objawy niepożądane niewymienione
w tej ulotce, należy powiedzieć o tym lekarzowi, farmaceucie lub pielęgniarce. Działania niepożądane
można zgłaszać bezpośrednio do Departamentu Monitorowania Niepożądanych Działań Produktów
Leczniczych Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów
Biobójczych
Al. Jerozolimskie 181C
02-222 Warszawa
Tel.: + 48 22 49 21 301
Faks: + 48 22 49 21 309
Strona internetowa: https://smz.ezdrowie.gov.pl
Działania niepożądane można zgłaszać również podmiotowi odpowiedzialnemu.
Dzięki zgłaszaniu działań niepożądanych można będzie zgromadzić więcej informacji na temat
bezpieczeństwa stosowania leku.
5. Jak przechowywać lek Biotum
Lek należy przechowywać w temperaturze do 25°C. Chronić od światła.
Przygotowany roztwór można przechowywać 24 godziny w lodówce, tj. w temperaturze
od 2°C do 8°C.
Lek należy przechowywać w miejscu niewidocznym i niedostępnym dla dzieci.
Nie stosować tego leku po upływie terminu ważności zamieszczonego na opakowaniu. Termin
ważności oznacza ostatni dzień podanego miesiąca.
Zapis na opakowaniu po skrócie EXP oznacza termin ważności, a po skrócie Lot oznacza numer serii.
Leków nie należy wyrzucać do kanalizacji ani domowych pojemników na odpadki. Należy zapytać
farmaceutę, jak usunąć leki, których się już nie używa. Takie postępowanie pomoże chronić
środowisko.
6. Zawartość opakowania i inne informacje
Co zawiera lek Biotum
- Substancją czynną leku jest ceftazydym. Każda fiolka zawiera 500 mg ceftazydymu w postaci pięciowodzianu buforowanego węglanem sodu.
- Pozostały składnik to: węglan sodu.
Jak wygląda lek Biotum i co zawiera opakowanie
Biały lub jasnożółty proszek umieszczony w szklanej fiolce, zamkniętej gumowym korkiem
i zabezpieczonej aluminiowym kapslem lub aluminiowym kapslem z kapturkiem, w tekturowym
pudełku.
Opakowanie zawiera 1 lub 10 fiolek.
Nie wszystkie wielkości opakowań muszą znajdować się w obrocie.
Podmiot odpowiedzialny i wytwórca
Podmiot odpowiedzialny
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
tel. + 48 22 364 61 01
Wytwórca
Zakłady Farmaceutyczne POLPHARMA S.A.
ul. Pelplińska 19, 83-200 Starogard Gdański
Zakłady Farmaceutyczne POLPHARMA S.A.
Oddział Produkcyjny w Duchnicach
ul. Ożarowska 28/30, 05-850 Ożarów Mazowiecki
Data ostatniej aktualizacji ulotki:
---------------------------------------------------------------------------------------------------------------------------
Informacje przeznaczone wyłącznie dla fachowego personelu medycznego
Biotum, 500 mg, proszek do sporządzania roztworu do wstrzykiwań
Ceftazidimum
Ciśnienie w fiolkach leku Biotum każdej wielkości jest mniejsze od atmosferycznego. Podczas
rozpuszczania proszku ciśnienie zwiększa się wskutek uwalniania dwutlenku węgla. Można
zignorować małe pęcherzyki dwutlenku węgla znajdujące się w przygotowanym roztworze.
Instrukcja dotycząca przygotowania leku do stosowania
Należy zapoznać się z tabelą dodawanych objętości i uzyskiwanych stężeń, co może być przydatne,
gdy potrzebne są dawki częściowe.
| Zawartość fiolki | Droga podania | Objętość rozpuszczalnika do dodania [ml] | Przybliżone stężenie ceftazydymu [mg/ml] |
| 500 mg | wstrzyknięcie domięśniowe | 1,5 ml | 260 |
| wstrzyknięcie dożylne | 5 ml | 90 |
Zabarwienie roztworu od jasnożółtego do bursztynowego zależy od stężenia, rodzaju rozpuszczalnika
i warunków przechowywania. Jeśli spełnione są zalecane warunki, zmienność zabarwienia roztworu
nie wpływa niekorzystnie na skuteczność działania produktu.
Do przygotowania roztworów do infuzji dożylnych o stężeniu ceftazydymu pomiędzy 1 mg/ml
a 40 mg/ml stosuje się:
- 9 mg/ml (0,9%) roztwór chlorku sodu do wstrzykiwań
- M/6 roztwór mleczanu sodu do wstrzykiwań
- wieloskładnikowy roztwór mleczanu sodu do wstrzykiwań (Roztwór Hartmanna)
- 5% roztwór glukozy do wstrzykiwań
- 0,225% roztwór chlorku sodu z 5% roztworem glukozy do wstrzykiwań
- 0,45% roztwór chlorku sodu z 5% roztworem glukozy do wstrzykiwań
- 0,9% roztwór chlorku sodu z 5% roztworem glukozy do wstrzykiwań
- 0,18% roztwór chlorku sodu z 4% roztworem glukozy do wstrzykiwań
- 10% roztwór glukozy do wstrzykiwań
- 10% roztwór dekstranu 40 w 0,9% roztworze chlorku sodu do wstrzykiwań
- 10% roztwór dekstranu 40 w 5% roztworze glukozy do wstrzykiwań
- 6% roztwór dekstranu 70 w 0,9% roztworze chlorku sodu
- 6% roztwór dekstranu 70 w 5% roztworze glukozy do wstrzykiwań.
Ceftazydym w stężeniach pomiędzy 0,05 mg/ml a 0,25 mg/ml jest zgodny z płynem do dializy
otrzewnowej (mleczanowym).
Ceftazydym do wstrzyknięć domięśniowych można rozpuścić w roztworze zawierającym 0,5% lub
1% chlorowodorku lidokainy do wstrzykiwań.
Roztwór 500 mg ceftazydymu w 1,5 ml wody do wstrzykiwań można dodać do roztworu
metronidazolu (500 mg w 100 ml) i oba produkty zachowują swoją aktywność.
Sporządzanie roztworu do szybkiego wstrzyknięcia
- 1. Przebić igłą korek i wstrzyknąć do fiolki zalecaną objętość rozpuszczalnika. W celu nakłucia korka należy użyć igły o średnicy nie większej niż 0,8 mm (21 G w skali Gauge [G]). Igłę należy wbić w centralnie wyznaczonym polu pod kątem 90°, zgodnie z poniższym schematem:
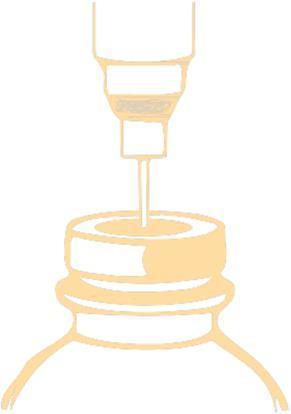
Podciśnienie wewnątrz fiolki może ułatwić wniknięcie rozpuszczalnika. Wycofać igłę ze strzykawką.
- 2. Potrząsać aż do rozpuszczenia: uwalnia się dwutlenek węgla i w ciągu 1 do 2 minut uzyskuje się klarowny roztwór.
- 3. Odwrócić fiolkę. Utrzymując tłok strzykawki w pozycji w pełni wciśniętej, przebić igłą korek fiolki i pobrać całą objętość roztworu do strzykawki (podwyższone ciśnienie w fiolce ułatwi tę czynność). Igłę należy utrzymać wewnątrz roztworu, aby uniknąć zassania powietrza. Roztwór pobrany do strzykawki może zawierać małe pęcherzyki dwutlenku węgla. Te roztwory można podać bezpośrednio do żyły lub do zestawu do infuzji dożylnych, jeśli pacjent otrzymuje płyny dożylnie. Ceftazydym wykazuje zgodność z najczęściej używanymi płynami dożylnymi.
- Kraj rejestracji
- Substancja czynna
- Wymaga receptyNie
- Producent
- ImporterZakłady Farmaceutyczne POLPHARMA S.A. Zakłady Farmaceutyczne POLPHARMA S.A. Oddział Produkcyjny w Duchnicach
- Te informacje mają charakter wyłącznie poglądowy i nie stanowią porady medycznej. Przed zastosowaniem jakiegokolwiek leku zawsze skonsultuj się z lekarzem. Oladoctor nie ponosi odpowiedzialności za decyzje medyczne podjęte na podstawie tych treści.
- Zamienniki BiotumPostać farmaceutyczna: Proszek, 1 gSubstancja czynna: ceftazidimePostać farmaceutyczna: Proszek, 2 gSubstancja czynna: ceftazidimePostać farmaceutyczna: Proszek, 1 gSubstancja czynna: ceftazidimeBez recepty
Odpowiedniki Biotum w innych krajach
Najlepsze odpowiedniki z tą samą substancją czynną i działaniem terapeutycznym.
Odpowiednik Biotum – Hiszpania
Odpowiednik Biotum – Ukraina
Lekarze online w sprawie Biotum
Konsultacja w sprawie dawkowania, działań niepożądanych, interakcji, przeciwwskazań i odnowienia recepty na Biotum – decyzja należy do lekarza, zgodnie z lokalnymi przepisami.














