TAKHZYRO 300 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA

Cómo usar TAKHZYRO 300 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA
Traducción generada por IA
Este contenido ha sido traducido automáticamente y se ofrece solo con fines informativos. No sustituye la consulta con un profesional sanitario.
Ver originalContenido del prospecto
Introducción
Prospecto: información para el usuario
TAKHZYRO300mg solución inyectable en jeringa precargada
lanadelumab
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermero.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico, farmacéutico o enfermero, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es TAKHZYRO y para qué se utiliza
- Qué necesita saber antes de empezar a usar TAKHZYRO
- Cómo usar TAKHZYRO
- Posibles efectos adversos
- Conservación de TAKHZYRO
- Contenido del envase e información adicional
- Instrucciones de uso
1. Qué es TAKHZYRO y para qué se utiliza
TAKHZYRO contiene el principio activo lanadelumab.
Para qué se utiliza TAKHZYRO
TAKHZYRO es un medicamento que se utiliza en pacientes a partir de 2 años de edad con angioedema hereditario (AEH) para prevenir las crisis de angioedema.
Qué es el angioedema hereditario (AEH)
El AEH es una enfermedad hereditaria dentro de una misma familia. Cuando se tiene esta enfermedad, no hay en la sangre una cantidad suficiente de una proteína llamada «C1 inhibidor» o cuando el C1 inhibidor no funciona correctamente. Esto lleva a un exceso de «calicreína plasmática», lo que a su vez produce niveles más altos de «bradicinina» en el torrente sanguíneo. Demasiada bradicinina provoca síntomas de AEH, como hinchazón y dolor en:
- las manos y los pies
- la cara, los párpados, los labios o la lengua
- las cuerdas vocales (laringe), que puede hacer que le cueste respirar
- los genitales
Cómo actúa TAKHZYRO
TAKHZYRO es un tipo de proteína que bloquea la actividad de la calicreína plasmática, lo que ayuda a reducir la cantidad de bradicinina presente en el torrente sanguíneo y previene los síntomas del AEH.
2. Qué necesita saber antes de empezar a usar TAKHZYRO
No use TAKHZYRO
Si es alérgico a lanadelumab o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
Advertencias y precauciones
- Consulte a su médico, farmacéutico o enfermero antes de empezar a usar TAKHZYRO.
- Si tiene una reacción alérgica grave a TAKHZYRO con síntomas como erupción, opresión en el pecho, silbidos al respirar o latidos cardiacos rápidos, informe a su médico, farmacéutico o enfermero inmediatamente.
Llevar un registro
Se recomienda encarecidamente que, cada vez que se administre una dosis de TAKHZYRO, apunte el nombre y el número de lote del medicamento, para que tenga un registro de los lotes utilizados.
Pruebas analíticas
Informe a su médico si está usando TAKHZYRO antes de someterse a pruebas analíticas para evaluar su coagulación sanguínea, ya que la presencia de TAKHZYRO en la sangre puede interferir con ciertas pruebas analíticas y dar lugar a resultados inexactos.
Niños y adolescentes
No se recomienda el uso de TAKHZYRO en niños menores de 2 años, ya que no se ha estudiado en este grupo de edad.
Otros medicamentos y TAKHZYRO
Informe a su médico o farmacéutico si está tomando, ha tomado recientemente o pudiera tener que tomar cualquier otro medicamento.
No se sabe que TAKHZYRO afecte a otros medicamentos ni que se vea afectado por otros medicamentos.
Embarazo y lactancia
Si está embarazada o en periodo de lactancia, cree que podría estar embarazada o tiene intención de quedarse embarazada, consulte a su médico o farmacéutico antes de utilizar este medicamento. La información sobre la seguridad del uso de TAKHZYRO durante el embarazo y la lactancia es limitada. Como medida de precaución, es preferible evitar el uso de lanadelumab durante el embarazo y la lactancia. El médico analizará con usted los riesgos y beneficios de recibir este medicamento.
Conducción y uso de máquinas
La influencia de este medicamento sobre la capacidad para conducir y utilizar máquinas es nula o insignificante.
TAKHZYRO contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por jeringa precargada; esto es, esencialmente “exento de sodio”.
3. Cómo usar TAKHZYRO
TAKHZYRO se presenta en jeringas precargadas de un solo uso como solución lista para usar. Un médico con experiencia en la atención de pacientes con AEH iniciará y supervisará su tratamiento.
Siga exactamente las instrucciones de administración del medicamento contenidas en este prospecto o las indicadas por su médico, farmacéutico o enfermero. En caso de duda u otras preguntas sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
Cuánto TAKHZYRO utilizar
Para adultos y adolescentes de 12 años a menores de 18 años de edad:
- La dosis de inicio recomendada es de 300 mg de lanadelumab cada 2 semanas. Si no ha tenido ninguna crisis durante un periodo de tiempo prolongado, el médico puede modificarle la dosis a 300 mg de lanadelumab cada 4 semanas, en especial si su peso corporal es bajo.
- En pacientes con un peso corporal inferior a 40 kg, también puede considerarse una dosis de inicio de 150 mg de lanadelumab cada 2 semanas. Si no ha tenido ninguna crisis durante un periodo de tiempo prolongado, el médico puede cambiar la dosis a 150 mg de lanadelumab cada 4 semanas.
Para niños de 2 años a menores de 12 años de edad, la dosis de inicio recomendada se basa en el peso corporal:
Peso corporal (kg) | Dosis de inicio recomendada | Ajuste de dosis |
10 a menos de 20 kg | 150 mg de lanadelumab cada 4 semanas | Se puede considerar un aumento de la dosis a 150 mg de lanadelumab cada 3 semanas en pacientes con control insuficiente de los ataques |
20 a menos de 40 kg | 150 mg de lanadelumab cada 2 semanas | Se puede considerar reducir la dosis a 150 mg de lanadelumab cada 4 semanas en pacientes estables y sin crisis bajo tratamiento |
40 kg o más | 300 mg de lanadelumab cada 2 semanas | Se puede considerar reducir la dosis a 300 mg de lanadelumab cada 4 semanas en pacientes estables y sin crisis bajo tratamiento |
- En pacientes con un peso corporal de 20 a menos de 40 kg que no hayan tenido ninguna crisis durante un periodo de tiempo prolongado, el médico puede permitir que su hijo/a o el niño/a que está a su cuidado continúe recibiendo la misma dosis al llegar a los 12 años de edad.
Cómo inyectar TAKHZYRO
Si se auto inyecta TAKHZYRO o si se lo inyecta su cuidador, usted o su cuidador deben leer y seguir atentamente las instrucciones que aparecen en la sección7, «Instrucciones de uso».
- TAKHZYRO se inyecta bajo la piel («inyección subcutánea»).
- La inyección puede ser administrada por usted o un cuidador en pacientes a partir de 12 años de edad.
- La inyección puede ser administrada por un profesional sanitario o por un cuidador en pacientes de 2 años a menores de 12 años de edad.
- Un médico, farmacéutico o enfermero deberá enseñarle a preparar e inyectar TAKHZYRO correctamente antes de que lo utilice por primera vez. No se inyecte ni inyecte a otra persona hasta que le hayan enseñado a inyectarse el medicamento.
- Inserte la aguja en el tejido adiposo del estómago (abdomen), muslo o parte superior del brazo.
- Inyecte el medicamento en un lugar distinto cada vez.
- Use cada jeringa precargada de TAKHZYRO solo una vez.
Si usa más TAKHZYRO del que debe
Informe a su médico, farmacéutico o enfermero si se ha administrado una dosis de TAKHZYRO mayor a la recomendada.
Si olvidó usar TAKHZYRO
Si se salta una dosis de TAKHZYRO, inyecte la dosis lo antes posible. La administración de las siguientes dosis puede requerir un ajuste según la frecuencia de dosificación deseada, asegurándose de:
- dejar pasar al menos 10 días entre una dosis y otra en pacientes con un régimen de dosificación cada 2 semanas,
- dejar pasar al menos 17 días entre una dosis y otra en pacientes con un régimen de dosificación cada 3 semanas,
- dejar pasar al menos 24 días entre una dosis y otra en pacientes con un régimen de dosificación cada 4 semanas.
Si no está seguro de cuándo inyectarse TAKHZYRO después de haberse saltado una dosis, pregunte a su médico, farmacéutico o enfermero.
Si interrumpe el tratamiento con TAKHZYRO
Es importante que siga inyectándose TAKHZYRO como se lo haya indicado el médico, incluso si se siente mejor. Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico, farmacéutico o enfermero.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Si tiene una reacción alérgica grave a TAKHZYRO con síntomas como erupción, opresión en el pecho, silbidos al respirar o latidos cardiacos rápidos, informe a su médico, farmacéutico o enfermero inmediatamente.
Informe a su médico, farmacéutico o enfermero si nota alguno de los siguientes efectos adversos.
Muy frecuentes (pueden afectar a más de 1de cada 10personas):
- Reacciones en el lugar de administración de la inyección: los síntomas son dolor, enrojecimiento de la piel, cardenales, molestias, hinchazón, sangrado, picor, endurecimiento de la piel, hormigueo, calor y erupción.
Frecuentes (pueden afectar hasta 1de cada 10personas):
- Reacciones alérgicas, como picor, molestias y hormigueo en la lengua
- Mareos, sensación de desmayo
- Erupción cutánea abultada
- Dolor muscular
- Resultados de pruebas analíticas que muestran cambios en el hígado
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de TAKHZYRO
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en la etiqueta y en la caja después de CAD. La fecha de caducidad es el último día del mes que se indica.
TAKHZYRO 300 mg solución inyectable en jeringa precargada
Conservar en nevera (entre 2 ?C y 8 ?C). No congelar. Conservar la jeringa precargada en el embalaje exterior para protegerlo de la luz.
Las jeringas precargadas pueden conservarse por debajo de los 25 °C por un solo periodo de 14 días, pero sin sobrepasar la fecha de caducidad.
Después de su conservación a temperatura ambiente, no volver a refrigerar TAKHZYRO para su conservación.
Cuando se retira de la refrigeración una jeringa precargada de un envase múltiple, se deberán volver a colocar las jeringas precargadas restantes en la nevera para cuando haya que usarlas en un futuro.
No utilice este medicamento si observa signos de deterioro, como partículas en la jeringa precargada o un cambio de color en la solución para inyección.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de TAKHZYRO
- El principio activo es lanadelumab. Cada jeringa precargada contiene 300 mg de lanadelumab en solución de 2 ml.
- Los demás componentes son fosfato disódico dihidratado, ácido cítrico monohidratado, histidina, cloruro de sodio, polisorbato 80 y agua para preparaciones inyectables; ver sección 2 «TAKHZYRO contiene sodio»
Aspecto del producto y contenido del envase
TAKHZYRO se presenta en forma de solución inyectable transparente de incolora a amarillo pálido en una jeringa precargada.
TAKHZYRO está disponible como:
- envase unitario que contiene una jeringa precargada de 2 ml en una caja
- envase unitario que contiene dos jeringas precargadas de 2 ml en una caja
- envases múltiples que contienen 3 cajas intermedias, cada una de ellas con dos jeringas precargadas de 2 ml.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Titular de la autorización de comercialización
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublín 2
D02 HW68
Irlanda
Responsable de la fabricación
Takeda Pharmaceuticals International AG Ireland Branch
Block 2 Miesian Plaza
50-58 Baggot Street Lower
Dublin 2
D02 HW68
Irlanda
Shire Pharmaceuticals Ireland Limited
Blocks 2 & 3 Miesian Plaza
50-58 Baggot Street Lower
Dublín 2
Irlanda
Pueden solicitar más información respecto a este medicamento dirigiéndose al representante local del titular de la autorización de comercialización:
België/Belgique/Belgien Takeda Belgium NV Tél/Tel: +32 2 464 06 11 | Lietuva Takeda, UAB Tel: +370 521 09 070 [email protected] |
| Luxembourg/Luxemburg Takeda Belgium NV Tél/Tel: +32 2 464 06 11 [email protected] |
Ceská republika Takeda Pharmaceuticals Czech Republic s.r.o. Tel: + 420 234 722 722 [email protected] | Magyarország Takeda Pharma Kft. Tel.: +36 1 270 7030 [email protected] |
Danmark Takeda Pharma A/S Tlf: +45 46 77 10 10 [email protected] | Malta Drugsales Ltd Tel: +356 21419070 |
Deutschland Takeda GmbH Tel: +49 (0)800 825 3325 [email protected] | Nederland Takeda Nederland B.V. Tel: +31 20 203 5492 [email protected] |
Eesti Takeda Pharma OÜ Tel: +372 6177 669 [email protected] | Norge Takeda AS Tlf.: +47 800 800 30 [email protected] |
Ελλ?δα Τakeda ΕΛΛΑΣ Α.Ε. Tηλ: +30 210 6387800 [email protected] | Österreich Takeda Pharma Ges.m.b.H. Tel: +43 (0) 800-20 80 50 [email protected] |
España Takeda Farmacéutica España, S.A. Tel: +34 917 90 42 22 [email protected] | Polska Takeda Pharma Sp. z o.o. Tel.: +48223062447 [email protected] |
France Takeda France SAS Tél: + 33 1 40 67 33 00 [email protected] | Portugal Takeda Farmacêuticos Portugal, Lda. Tel: + 351 21 120 1457 [email protected] |
Hrvatska Takeda Pharmaceuticals Croatia d.o.o. Tel: +385 1 377 88 96 [email protected] | România Takeda Pharmaceuticals SRL Tel: +40 21 335 03 91 |
Ireland Takeda Products Ireland Ltd Tel: 1800 937 970 [email protected] | Slovenija Takeda Pharmaceuticals farmacevtska družba d.o.o. Tel: + 386 (0) 59 082 480 [email protected] |
Ísland Vistor ehf. Sími: +354 535 7000 [email protected] | Slovenská republika Takeda Pharmaceuticals Slovakia s.r.o. Tel: +421 (2) 20 602 600 [email protected] |
Italia Takeda Italia S.p.A. Tel: +39 06 502601 [email protected] | Suomi/Finland Takeda Oy Puh/Tel: 0800 774 051 [email protected] |
Κ?προς Proton Medical (Cyprus) Ltd Τηλ: +357 22866000 | Sverige Takeda Pharma AB Tel: 020 795 079 |
Latvija Takeda Latvia SIA Tel: +371 67840082 [email protected] | United Kingdom (Northern Ireland) Takeda UK Ltd Tel: +44 (0) 3333 000 181 [email protected] |
Fecha de la última revisión de este prospecto:
Otras fuentes de información
La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: https://www.ema.europa.eu. También existen enlaces a otras páginas web sobre enfermedades raras y medicamentos huérfanos.
- Instrucciones de uso
Asegúrese de leer, comprender y seguir las instrucciones de uso antes de inyectar TAKHZYRO. Contacte a su profesional sanitario si tiene preguntas.
Uso previsto
La jeringa precargada de TAKHZYRO es un dispositivo de inyección con aguja, desechable, listo para su uso con una dosis fija (300 mg/2 ml) destinado a la administración subcutánea del medicamento por profesionales sanitarios y cuidadores o para la autoadministración (para pacientes a partir de 12 años de edad).
Conservación de TAKHZYRO
- Guarde la jeringa precargada de TAKHZYRO en la nevera a 2 °C a 8 °C. Nocongelar.
- Una jeringa precargada que se retire de la refrigeración debe conservarse a menos de 25 °C y utilizarse en un plazo de 14 días. Después de su conservación a temperatura ambiente, no volver a refrigerar TAKHZYRO para su conservación.
- Cuando se retira de la refrigeración una jeringa precargada de un envase múltiple, se deberán volver a colocar las jeringas precargadas restantes en la nevera para cuando haya que usarlas en un futuro.
- Guarde TAKHZYRO en la caja original para proteger la jeringa precargada de la luz.
- Deseche la jeringa precargada de TAKHZYRO si no se ha refrigerado, se ha congelado o no se ha guardado en su envase original protegida de la luz.
- Noagite TAKHZYRO.
- Mantenga TAKHZYRO y todos los medicamentos fuera del alcance de los niños.
Partes de su jeringa precargada de TAKHZYRO antes de su uso (FiguraA).
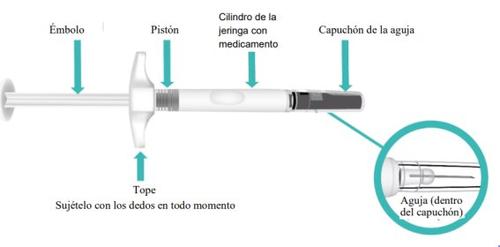
FiguraA: Jeringa precargada de TAKHZYRO
PASO1:Preparación de la inyección
- Tome una toallita con alcohol, una almohadilla de gasa o torunda de algodón, una venda adhesiva y un contenedor para desechar objetos punzocortantes (FiguraB) y colóquelo todo en una superficie plana y limpia en una zona bien iluminada. Estos productos no se incluyen en el envase de TAKHZYRO.

FiguraB: Suministros
- Saque la jeringa precargada de TAKHZYRO de la nevera.
- Noutilice la jeringa precargada de TAKHZYRO si el precinto de seguridad está abierto o roto.
- Antes de preparar la inyección, espere a que la jeringa precargada alcance la temperatura ambiente durante al menos 15minutos.
- Este medicamento es sensible al calor. Nouse fuentes de calor, como el microondas o agua caliente, para calentar la jeringa precargada de TAKHZYRO.
- Noquite el capuchón de la aguja hasta que esté listo para comenzar la inyección.

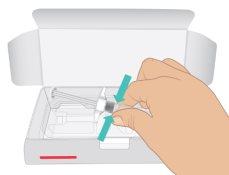
- Abra la caja. Sostenga el cilindro de la jeringa y extraiga la jeringa precargada de TAKHZYRO de la bandeja (FiguraC).
|
FiguraC: Extraer la jeringa precargada |
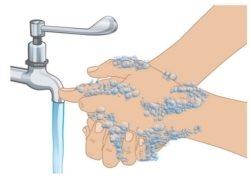
- Lávese las manos con agua y jabón (FiguraD). Séquese completamente las manos.
- Notoque ningunasuperficie o parte del cuerpo después de lavarse las manos antes de comenzar la inyección.
|
FiguraD:Lavado de manos |
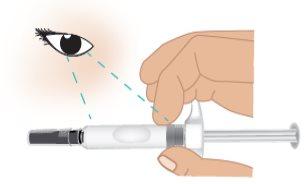
- Verifique la fecha de caducidad(CAD)en el cilindro de la aguja (FiguraE).
Noutilice la jeringa precargada de TAKHZYRO si la fecha de caducidad ha pasado. Si la jeringa precargada TAKHZYRO está caducada, deséchela en un contenedor para objetos punzocortantes y contacte con su profesional sanitario.
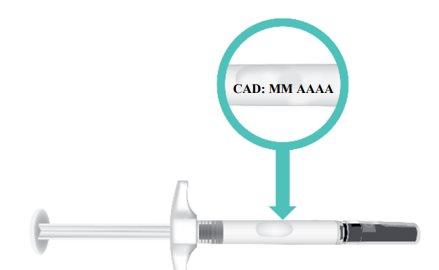
FiguraE: Localización de la fecha de caducidad
- Examinela jeringa precargada de TAKHZYRO para comprobar que no esté dañada y asegúrese de que el medicamento es incoloro o amarillo pálido (FiguraF).
- Nouse el producto si la jeringa está dañada, por ejemplo, si tiene grietas.
- Noutilice la jeringa precargada de TAKHZYRO si el medicamento ha perdido el color, está turbio o presenta partículas o residuos.
- Es posible que vea burbujas de aire en su jeringa precargada de TAKHZYRO. Es algo normal y no afectará a la dosis.
Si no puede usar la jeringa precargada, contacte con su profesional sanitario.
|
FiguraF: Examinar la jeringa precargada |
PASO2: Selección y preparación del lugar de inyección
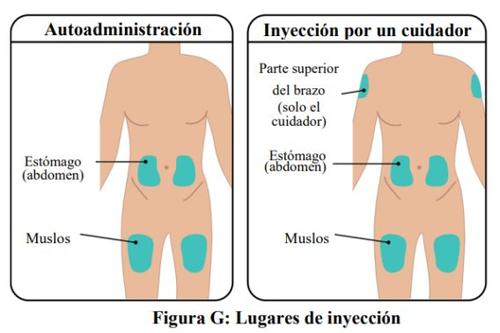
- La jeringa precargada de TAKHZYRO solo se deberá inyectar en los siguientes lugares (Figura G):
- estómago (abdomen)
- muslo
- parte superior del brazo (solo si la inyección la administra un profesional sanitario o cuidador)
- Noaplique la inyección en una zona del cuerpo donde la piel esté irritada, enrojecida, infectada o con hematomas.
- La zona que elija para la inyección debe estar como mínimo a una distancia de 5 cm de cualquier cicatriz o del ombligo.
Importante:
Rotar los lugares de inyección para mantener la piel sana. Cada nueva inyección debe administrarse a una distancia como mínimo de 3 cm del último lugar que utilizó.
- Limpie el lugar de inyección con una toallita con alcohol y espere a que se seque completamente (FiguraH).
- Nosople ni abanique el lugar que ha limpiado.
- Novuelva a tocar esta zona antes de administrar la inyección.
|
Figura H: Limpiar el lugar de inyección |
- Tire con cuidado del capuchón de la aguja con una mano mientras sujeta firmemente la parte central de la jeringa precargada de TAKHZYRO con la otra. Deseche el capuchón de la aguja en la basura o en un contenedor para objetos punzocortantes (FiguraI).
- Notoque ni presione el émbolo hasta que esté listo para comenzar la inyección.
- Para evitar herirse con la aguja, novuelva a tapar la jeringa precargada de TAKHZYRO.
- Nouse la jeringa precargada de TAKHZYRO si se ha dejado caer sin el capuchón de la aguja.
- Noutilice la jeringa precargada de TAKHZYRO si la aguja parece dañada o torcida.
- Notoque la aguja ni deje que la aguja entre en contacto con nada.
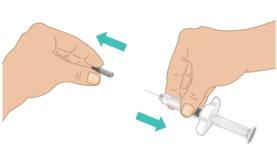
FiguraI: Quitar el capuchón de la aguja
PASO3: Inyección de TAKHZYRO
- Sujete la jeringa precargada de TAKHZYRO con una mano como si fuera un lápiz (FiguraJ). Evite tocar la aguja o empujar el émbolo.
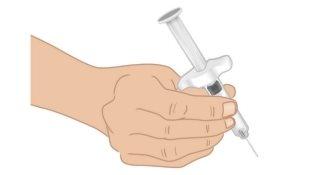
FiguraJ: Sujetar la aguja precargada
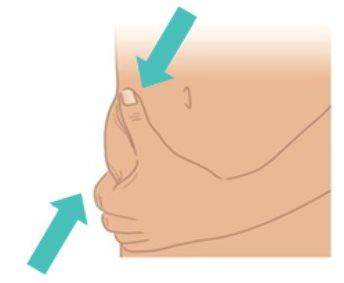
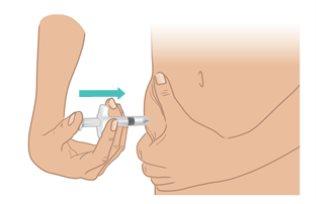
- Utilice la otra mano para pellizcar con cuidado la piel, formando un pliegue de unos 3 cm en el lugar de la inyección que ha limpiado.
- Mantenga el pliegue hasta que la inyección haya terminado y haya extraído la aguja (FiguraK).
|
FiguraK:Pellizcarun pliegue en la piel de 3cm |
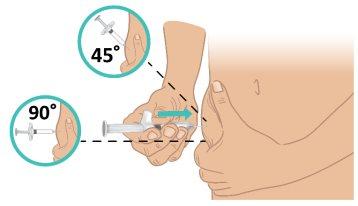
- Con un movimiento breve y rápido, inserte la aguja en la piel en un ángulo de 45 a 90 grados. Asegúrese de que mantiene la aguja en su lugar (FiguraL).
Importante:Inyectar directamente en el tejido adiposo bajo la piel (inyección subcutánea). |
|
FiguraL: Insertar la aguja |
- Empuje lentamenteel émbolo hasta que se detenga(FiguraM).
- Retire lentamente la aguja mientras mantiene la jeringa con el mismo ángulo. Suelte con cuidado el pliegue de piel.
Importante:Noretire la aguja hasta que se haya inyectado todo el líquido y la jeringa se quede vacía. |
| |
FiguraM:Empujarel émbolo hasta que se detenga |
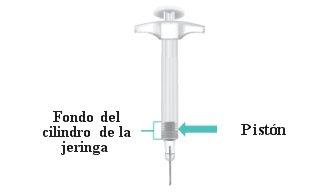
Cuando la inyección se complete, el pistón estará en el fondo del cilindro de la jeringa (FiguraN). |
|
FiguraN:Pistón en el fondo del cilindro de la jeringa |
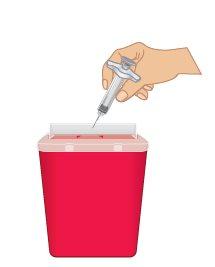
Importante: Mantenga siempre el contenedor para desechar objetos punzocortantes fuera del alcance de los niños. |
|
FiguraO: Desechar en un contenedor para objetos punzocortantes |
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- Esta información es de carácter general y no sustituye la consulta con un profesional sanitario.
- Alternativas a TAKHZYRO 300 MG SOLUCION INYECTABLE EN JERINGA PRECARGADAForma farmacéutica: INYECTABLE, 150 mgPrincipio activo: LanadelumabRequiere recetaForma farmacéutica: INYECTABLE, 300 mgPrincipio activo: LanadelumabRequiere recetaForma farmacéutica: INYECTABLE, 200 mgPrincipio activo: Drugs used in hereditary angioedemaFabricante: Csl Behring GmbhRequiere receta
Médicos online para TAKHZYRO 300 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA
Comenta la dosis, los posibles efectos secundarios, interacciones, contraindicaciones o la revisión de receta de TAKHZYRO 300 MG SOLUCION INYECTABLE EN JERINGA PRECARGADA, sujeto a valoración médica y a la normativa local.
Preguntas frecuentes