
Villfact 500 i.m.
Consulta con un médico sobre la receta médica de Villfact 500 i.m.

Cómo usar Villfact 500 i.m.
HOJA DE INSTRUCCIONES PARA EL PACIENTE: INFORMACIÓN SOBRE WILLFACT
Willfact 500 UI
Polvo y disolvente para la preparación de una solución inyectable
Willfact 1000 UI polvo y disolvente para la preparación de una solución inyectable
Willfact 2000 UI polvo y disolvente para la preparación de una solución inyectable
Factor de von Willebrand humano
Es importante que lea este prospecto antes de tomar este medicamento, ya que contiene información importante para usted.
- Debe conservar este prospecto para poder volver a leerlo más adelante.
- Si tiene alguna duda, consulte a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No lo debe dar a otros. Puede ser perjudicial para ellos, incluso si sus síntomas son los mismos que los suyos.
- Si experimenta cualquier efecto adverso, incluidos los efectos adversos no mencionados en este prospecto, comuníquelo a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice
- 1. Qué es Willfact y para qué se utiliza
- 2. Información importante antes de tomar Willfact
- 3. Cómo tomar Willfact
- 4. Posibles efectos adversos
- 5. Conservación de Willfact
- 6. Contenido del envase y otra información
1. Qué es Willfact y para qué se utiliza
Willfact es un medicamento producido a partir de plasma humano (la parte líquida de la sangre) y contiene una sustancia activa llamada factor de von Willebrand humano (vWF).
El factor vWF participa en la coagulación de la sangre. La falta de este factor, como en el caso de la enfermedad de von Willebrand, provoca que la sangre no se coagule tan rápido como debería, lo que lleva a un aumento del riesgo de sangrado. El reemplazo de vWF con Willfact corrige temporalmente los mecanismos de coagulación de la sangre.
Willfact está indicado para prevenir sangrados asociados con procedimientos quirúrgicos y otros sangrados, así como para tratarlos en pacientes con diagnóstico de enfermedad de von Willebrand, si el tratamiento con desmopresina (DDAVP) es ineficaz o contraindicado.
Willfact puede ser utilizado en todos los grupos de edad.
2. Información importante antes de tomar Willfact
Cuándo no tomar Willfact
- Si es alérgico al factor de von Willebrand humano o a cualquier otro componente de este medicamento (enumerados en el punto 6).
- Si ha sido diagnosticado con hemofilia tipo A.
Advertencias y precauciones
El tratamiento con Willfact debe ser siempre supervisado por un médico con experiencia en el tratamiento de trastornos de coagulación.
Si el paciente experimenta sangrados severos y las pruebas de sangre confirman una disminución de la cantidad de factor VIII, el paciente recibirá un preparado de factor de coagulación VIII y, además, un preparado de vWF dentro de las primeras 12 horas.
Reacciones alérgicas
Pueden ocurrir reacciones de hipersensibilidad de tipo alérgico, similares a las que ocurren con otros medicamentos proteicos administrados por vía intravenosa obtenidos a partir de sangre o plasma humano.
El paciente será monitoreado durante la inyección para detectar signos tempranos de hipersensibilidad.
Estos incluyen erupciones cutáneas (urticaria o urticaria generalizada), sensación de opresión en el pecho, respiración sibilante, disminución de la presión arterial (hipotensión) y reacciones alérgicas graves (anafilaxia).
El médico informará al paciente sobre los signos de advertencia de una reacción alérgica.
Si ocurren signos objetivos o subjetivos de hipersensibilidad, debe interrumpirse el tratamiento y buscar ayuda médica de inmediato.
Seguridad viral
En la producción de medicamentos a partir de sangre o plasma humano, se toman ciertas medidas para prevenir la transmisión de infecciones a los pacientes. Estas incluyen:
- selección cuidadosa de donantes de sangre y plasma para excluir a personas en grupos de riesgo de infección,
- pruebas de cada lote y pool de plasma para detectar la presencia de virus o infecciones,
- incorporación de pasos en el proceso de tratamiento de la sangre o el plasma para inactivar o eliminar los virus.
A pesar de la implementación de estas medidas, no se puede excluir completamente la posibilidad de transmisión de una infección durante la administración de medicamentos producidos a partir de sangre o plasma humano. Esto también se aplica a virus desconocidos o que aparecen recientemente.
Las medidas tomadas se consideran efectivas contra virus envueltos, como el virus de la inmunodeficiencia humana (HIV, que causa el SIDA), el virus de la hepatitis B y el virus de la hepatitis C.
Las medidas tienen un valor limitado contra virus no envueltos, como el virus de la hepatitis A y el parvovirus B19. La infección por parvovirus B19 puede ser grave en mujeres embarazadas (ya que existe el riesgo de infección del feto no nacido) y en pacientes con sistema inmunológico debilitado o ciertos tipos de anemia (como anemia falciforme o anemia hemolítica).
Vacunación
El médico puede recomendar que el paciente reciba vacunas contra la hepatitis A y la hepatitis B si el paciente recibe regularmente factor de von Willebrand humano producido a partir de plasma.
Registro del número de lote
Se recomienda encarecidamente que, al administrar cada dosis de Willfact, se registre el nombre y el número de lote del medicamento para documentar qué lotes se han administrado.
Riesgo de trombosis
Puede ocurrir la formación de coágulos sanguíneos (trombosis). El riesgo es particularmente alto si se han identificado ciertos factores de riesgo en la historia médica o las pruebas de laboratorio. En tales casos, el estado del paciente será monitoreado muy de cerca para detectar signos tempranos de trombosis. También se administrarán medicamentos para prevenir la formación de coágulos sanguíneos.
El médico que administra factor de coagulación VIII que contiene factor de von Willebrand debe recordar que la continuación del tratamiento puede provocar un aumento excesivo de la actividad del factor VIII. Si el paciente recibe un preparado de vWF que contiene factor de coagulación VIII, el médico debe monitorear regularmente la actividad del factor VIII en el suero para evitar una actividad excesiva del factor VIII en el suero, lo que puede aumentar el riesgo de eventos trombóticos.
Limitación de la eficacia
En pacientes con enfermedad de von Willebrand (especialmente tipo 3), pueden desarrollarse proteínas que neutralizan la acción del factor de von Willebrand. Estas proteínas se llaman inhibidores. El médico verificará si se producen inhibidores en el paciente si los resultados de las pruebas de laboratorio muestran una falta de restauración adecuada de los niveles de vWF o si el sangrado no disminuye a pesar de la administración de la dosis adecuada de Willfact. Si hay una gran cantidad de inhibidores, el tratamiento con vWF puede no ser eficaz. En tales casos, se deben considerar otros métodos de tratamiento. Un nuevo tratamiento será realizado por un médico con experiencia en el tratamiento de trastornos de coagulación.
Willfact y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
Embarazo y lactancia
Willfact puede ser utilizado en mujeres embarazadas o en período de lactancia solo si es absolutamente necesario.
No se han realizado estudios clínicos controlados para evaluar la seguridad del uso de Willfact en mujeres embarazadas o en período de lactancia, y los estudios en animales no son suficientes para confirmar la seguridad en el contexto de la fertilidad, el embarazo y el desarrollo del feto durante el embarazo y después del parto.
Si la paciente está embarazada o en período de lactancia, cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de tomar este medicamento.
Conducción de vehículos y uso de máquinas
No se ha observado ningún efecto en la capacidad para conducir vehículos o operar máquinas.
Willfact contiene sodio
Una ampolla de 5 ml (500 UI) de Willfact contiene 0,15 mmol (3,4 mg) de sodio.
Esto equivale al 0,17% del consumo máximo diario recomendado de sodio para un adulto.
Una ampolla de 10 ml (1000 UI) de Willfact contiene 0,3 mmol (6,9 mg) de sodio.
Esto equivale al 0,35% del consumo máximo diario recomendado de sodio para un adulto.
Una ampolla de 20 ml (2000 UI) de Willfact contiene 0,6 mmol (13,8 mg) de sodio.
Esto equivale al 0,69% del consumo máximo diario recomendado de sodio para un adulto.
3. Cómo tomar Willfact
El tratamiento debe ser iniciado y monitoreado por un médico con experiencia en el tratamiento de trastornos hemorrágicos.
Si el médico considera que el paciente puede administrar el medicamento en casa, instruirá al paciente adecuadamente.
Dosis
Este medicamento debe ser siempre tomado según las indicaciones de su médico. Si tiene alguna duda, consulte a su médico.
Es preferible que el médico o la enfermera administren Willfact. Sin embargo, si el paciente ha recibido Willfact para su uso en casa, el médico se asegurará de que el paciente esté informado sobre cómo realizar la inyección y la dosis adecuada del medicamento. Debe seguir las instrucciones del médico y pedir ayuda si tiene problemas con la jeringa. La jeringa solo puede ser utilizada por una persona capacitada.
El médico calculará la dosis adecuada de Willfact (expresada en unidades internacionales - UI).
La dosis depende de:
- peso corporal,
- ubicación del sangrado,
- gravedad del sangrado,
- estado clínico del paciente,
- necesidad de realizar un procedimiento,
- actividad de vWF en la sangre después del procedimiento,
- gravedad de la enfermedad.
La dosis se encuentra en el rango de 40-80 UI/kg de peso corporal.
El médico recomendará la realización de pruebas de sangre durante el tratamiento para:
- concentración de factor VIII (FVIII:C),
- concentración de factor de von Willebrand (vWF:RCo),
- presencia de inhibidores,
- signos iniciales de formación de coágulos - en pacientes con riesgo de desarrollar estas complicaciones.
Basándose en los resultados de estas pruebas, el médico puede ajustar la frecuencia de las inyecciones y la dosis administrada.
En algunos casos, puede ser necesario el uso de un preparado de factor VIII (otra proteína con actividad coagulante) en adición a Willfact para permitir un tratamiento más rápido o prevenir el sangrado (en situaciones de emergencia o en caso de sangrado agudo).
Willfact también puede ser utilizado en la profilaxis a largo plazo, en cuyo caso la dosis también se determina individualmente. La administración de Willfact en una dosis de 40-60 UI/kg de peso corporal, 2-3 veces a la semana, reduce el número de episodios de sangrado.
Si el paciente considera que Willfact está funcionando demasiado fuerte o demasiado débil, debe consultar a su médico.
Uso en niños y adolescentes
La dosis en niños y adolescentes se basa en el peso corporal. En algunos casos, especialmente en pacientes más jóvenes (menores de 6 años), puede ser necesario utilizar dosis más altas (hasta 100 UI/kg de peso corporal).
Método de administración
Las instrucciones detalladas para la reconstitución y administración del producto se encuentran al final de la hoja de instrucciones.
Uso de una dosis mayor que la recomendada de Willfact
No se han reportado signos de sobredosis de Willfact, sin embargo, en caso de administrar una gran cantidad, no se puede excluir el riesgo de trombosis.
Omisión de una dosis de Willfact
Si se omite una dosis de Willfact, debe consultar a su médico.
No debe tomar una dosis doble para compensar la dosis omitida.
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe comunicarse con su médico de inmediato en los siguientes casos:
- Aparición de signos de hipersensibilidad o reacciones alérgicas (observadas con frecuencia no muy alta, pueden afectar hasta 1 de cada 100 pacientes). En algunos casos, estas reacciones pueden convertirse en una reacción alérgica grave (anafilaxia), incluyendo shock anafiláctico (frecuencia desconocida).
Los signos de advertencia de una reacción alérgica incluyen:
- dificultad para respirar y tragar,
- respiración sibilante,
- opresión en el pecho,
- aumento de la frecuencia cardíaca,
- disminución de la presión arterial,
- mareo,
- cansancio extremo,
- ansiedad, nerviosismo,
- dolor de cabeza,
- escalofríos, sensación de frío,
- olores corporales,
- erupciones cutáneas, urticaria generalizada,
- sensación de ardor y picazón en el lugar de la inyección,
- hormigueo,
- vómitos,
- náuseas.
Si ocurre alguno de estos signos, debe interrumpir el tratamiento y comunicarse con su médico de inmediatopara iniciar el tratamiento adecuado, dependiendo del tipo y la gravedad de la reacción.
- Observación de una disminución de la eficacia del medicamento (falta de control del sangrado). Puede deberse a la inhibición del factor de von Willebrand (frecuencia desconocida).
En pacientes con enfermedad de von Willebrand, especialmente tipo 3, es posible que se desarrollen proteínas que neutralizan la acción del vWF. Estas proteínas se llaman inhibidores. Los pacientes tratados con vWF deben ser monitoreados cuidadosamente por su médico para detectar la presencia de inhibidores a través de la observación clínica y las pruebas de laboratorio. Si se detectan inhibidores, el estado puede manifestarse como una respuesta clínica inadecuada. También puede coexistir con reacciones alérgicas graves.
- Observación de signos de trastornos circulatorios en las extremidades (por ejemplo, extremidades frías y pálidas) o órganos vitales (por ejemplo, dolor severo en el pecho). Puede deberse a la formación de coágulos sanguíneos en los vasos sanguíneos (frecuencia desconocida).
Existe un riesgo de formación de coágulos sanguíneos (trombosis), especialmente en pacientes con factores de riesgo. Después de corregir la deficiencia de factor de von Willebrand, los pacientes deben ser monitoreados para detectar signos tempranos de trombosis o coagulación intravascular diseminada y recibir tratamiento para prevenir la trombosis en situaciones en las que el riesgo de trombosis es alto (después de procedimientos quirúrgicos, en pacientes encamados, en caso de deficiencia de inhibidor de la coagulación o enzima fibrinolítico).
Si el paciente recibe preparados de vWF que contienen FVIII, el riesgo de trombosis puede ser mayor debido a los niveles persistentemente elevados de FVIII en el suero.
Los siguientes efectos adversos se han observado con frecuencia(pueden afectar hasta 1 de cada 10 pacientes):
- reacciones en el lugar de la inyección.
Los siguientes efectos adversos se han observado con frecuencia no muy alta(pueden afectar hasta 1 de cada 100 pacientes):
- mareo,
- parestesia, entumecimiento,
- olores corporales,
- picazón,
- opresión en el pecho,
- escalofríos, sensación de frío.
Los siguientes efectos adversos se han observado con frecuencia desconocida:
- fiebre.
Notificación de efectos adversos
Si experimenta cualquier efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe comunicarlo a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 34 00
Fax: +34 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Willfact
Debe conservar este medicamento en un lugar fresco y seco, fuera del alcance de los niños.
No use este medicamento después de la fecha de caducidad que se indica en el envase.
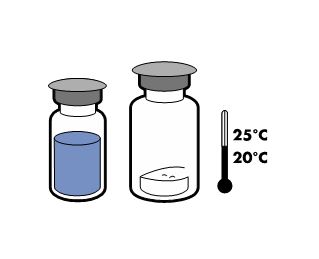
No lo conserve a temperaturas superiores a 25°C. Conservarlo en su envase original para protegerlo de la luz.
No lo congele.
Una vez reconstituido, el producto debe usarse de inmediato. Sin embargo, se ha demostrado la estabilidad química y física del producto durante 24 horas a 25°C.
No use este medicamento si nota que está turbio o contiene partículas.
No lo mezcle con otros medicamentos.
No diluya el producto una vez reconstituido.
Eliminación de residuos y envases
Los medicamentos no se deben tirar por los desagües ni a los contenedores de basura doméstica. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este tipo de medidas ayuda a proteger el medio ambiente.
6. Contenido del envase y otra información
Qué contiene Willfact?
Sustancia activaes factor de von Willebrand humano (500 UI, 1000 UI, 2000 UI) expresado en unidades internacionales de actividad de cofactor de ristocetina (vWF:RCo).
Después de la reconstitución con 5 ml (500 UI), 10 ml (1000 UI) o 20 ml (2000 UI) de agua para inyección, una ampolla contiene aproximadamente 100 UI/ml de factor de von Willebrand humano.
Antes de agregar la albúmina, la actividad específica de la solución es de al menos 60 UI vWF:RCo por 1 mg de proteína total.
Ingredientes inactive:
Polvo: albúmina humana, clorhidrato de arginina, glicina, citrato de sodio y cloruro de calcio dihidratado.
Disolvente: agua para inyección.
Cómo se presenta Willfact y qué contiene el envase?
Willfact se presenta en forma de polvo blanco o ligeramente amarillento y un disolvente transparente y sin color para la preparación de una solución inyectable después de la reconstitución con un sistema de transferencia.
Los tamaños de envase de Willfact son 500 UI/5 ml, 1000 UI/10 ml, 2000 UI/20 ml.
La solución reconstituida debe ser transparente o ligeramente opalescente, sin color o ligeramente amarillenta.
Título del titular de la autorización de comercialización y fabricante
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANCIA
[email protected]
Fabricantes
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANCIA
LFB-BIOMEDICAMENTS
59 Rue de Trévise
59000 LILLE
FRANCIA
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) bajo los siguientes nombres:
Austria
Willfact
República Checa
WILLFACT
Dinamarca
Willfact
Eslovaquia
Willfact
Eslovenia
Willfact
España
Willfact
Francia
WILLFACT
Hungría
Willfact
Irlanda
Willfact
Italia
Willfact
Países Bajos
Willfact
Polonia
Willfact
Portugal
Willfact
Reino Unido
Willfact
Rumania
Willfact
Suecia
Willfact
Fecha de la última revisión de la hoja de instrucciones:
- 01.2024 ________________________________________________________________________________________
INSTRUCCIONES DE USO:
Dosis
En general, la administración de 1 UI/kg de peso corporal de factor de von Willebrand produce un aumento de la actividad de vWF:RCo en sangre de aproximadamente 0,02 UI/ml (2%).
Debe intentarse alcanzar concentraciones de vWF:RCo > 0,6 UI/ml (60%) y FVIII:C > 0,4 UI/ml (40%).
La hemostasia es incierta hasta que se alcanza una actividad coagulante de factor VIII (FVIII:C) de 0,4 UI/ml (40%). La inyección de factor de von Willebrand solo no produce un aumento máximo de la actividad de FVIII:C durante al menos 6-12 horas. No es suficiente para la normalización inmediata de la actividad de FVIII:C. Por lo tanto, si la actividad inicial de FVIII:C del paciente es inferior al valor crítico y es necesario un ajuste rápido de la hemostasia, como en el caso de un sangrado, un trauma grave o durante un procedimiento quirúrgico de emergencia, con la primera inyección de factor de von Willebrand se debe administrar factor VIII para alcanzar una actividad de FVIII:C en sangre que garantice la hemostasia.
Si, sin embargo, no es necesario un aumento inmediato de la actividad de FVIII:C, como en el caso de un procedimiento quirúrgico planificado, o si la actividad inicial de FVIII:C del paciente permite mantener la hemostasia, el médico puede decidir omitir la administración de FVIII con la primera inyección de factor de von Willebrand.
- Inicio del tratamiento: La primera dosis de Willfact es de 40-80 UI/kg de peso corporal en el tratamiento de un sangrado o trauma. Se administra en combinación con la cantidad necesaria de un producto que contiene factor VIII, calculada según la actividad inicial de FVIII:C en la sangre del paciente, para alcanzar la actividad adecuada de FVIII:C en la sangre, inmediatamente antes del procedimiento o lo antes posible después del inicio del episodio de sangrado o trauma. En el caso de un procedimiento quirúrgico, la primera inyección se administra 1 hora antes del procedimiento. La administración de una dosis inicial de 80 UI/kg de peso corporal de Willfact puede ser necesaria, especialmente en pacientes con enfermedad de von Willebrand tipo 3, para mantener la actividad adecuada.
En el caso de un procedimiento quirúrgico planificado, la primera inyección de Willfact se administra 12-24 horas antes del procedimiento, y la segunda inyección se administra inmediatamente antes del procedimiento. En estos casos, no es necesario administrar un producto que contenga factor VIII al mismo tiempo, ya que la concentración de FVIII:C endógeno suele alcanzar un valor crítico de 0,4 UI/ml (40%) antes del procedimiento. Sin embargo, esto debe confirmarse en cada paciente.
- Inicio del tratamiento
- En niños menores de 6 años, la dosis inicial puede establecerse según el aumento de la recuperación (IR) del paciente o, si los datos de IR no están disponibles, puede ser necesaria una dosis inicial de 60-100 UI/kg de peso corporal para aumentar la concentración de vWF:RCo del paciente a 100 UI/dl.
- En niños mayores de 6 años y adolescentes, la dosis es la misma que para los pacientes adultos.
- Dosis posteriores En niños y adolescentes, las dosis posteriores deben establecerse individualmente según el estado clínico y la concentración de vWF:RCo, y ajustarse según la respuesta clínica.
Procedimiento quirúrgico planificado
- En niños menores de 6 años, después de la primera dosis administrada 12-24 horas antes del procedimiento, se puede administrar una segunda dosis 30 minutos antes del procedimiento.
- En niños mayores de 6 años y adolescentes, la dosis es la misma que para los pacientes adultos.
- Profilaxis En niños y adolescentes, la dosis y la frecuencia de administración deben establecerse individualmente según el aumento de la recuperación y la concentración de vWF:RCo del paciente, y ajustarse según la respuesta clínica.
Vía y método de administración
Administración intravenosa
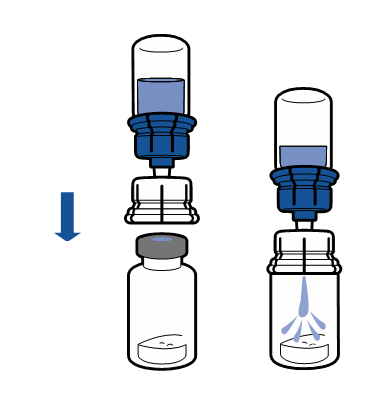
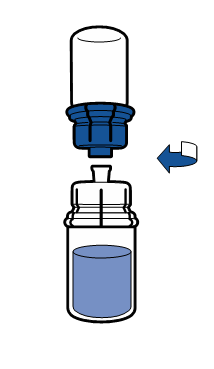
Reconstitución
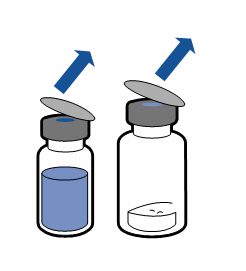
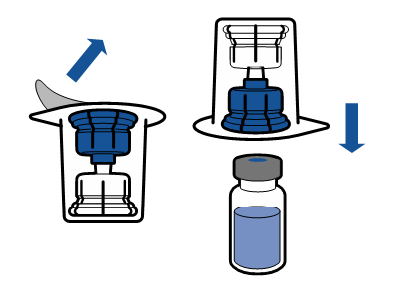
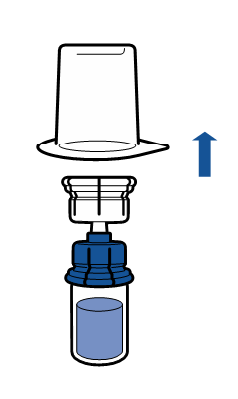
Debe seguirse la técnica aséptica actual. El sistema de transferencia se utiliza solo para la reconstitución del medicamento, según se describe a continuación. El sistema no está diseñado para la administración del medicamento al paciente.
  |
|
    |
|
El polvo debe disolverse en menos de 5 minutos, generalmente se disuelve de inmediato.
La solución resultante debe ser transparente o ligeramente opalescente, sin color o ligeramente amarillenta. Antes de la administración, el producto reconstituido debe ser inspeccionado visualmente para detectar la presencia de partículas o decoloración.
No usar la solución si está turbia o contiene depósitos.
No mezclar con otros medicamentos.
No diluir el producto una vez reconstituido.
Administración
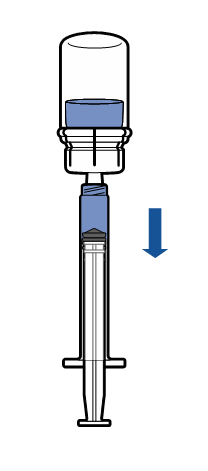 |
|
Conservación después de la reconstitución
Para mantener la esterilidad, el producto debe usarse de inmediato después de la reconstitución. Sin embargo, se ha demostrado la estabilidad química y física del producto durante 24 horas a 25°C.
Los residuos del producto y los materiales de aseo deben eliminarse según las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorLFB-Biomedicamensts LFB-Biomedicaments
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Villfact 500 i.m.Forma farmacéutica: Polvo, 1000 UIPrincipio activo: Factor von willebrandFabricante: LFB-Biomedicamensts LFB-BiomedicamentsNo requiere recetaForma farmacéutica: Polvo, 2000 UI/20 mlPrincipio activo: Factor von willebrandFabricante: LFB-Biomedicamensts LFB-BiomedicamentsNo requiere recetaForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Villfact 500 i.m. en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Villfact 500 i.m. en Іспанія
Médicos online para Villfact 500 i.m.
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Villfact 500 i.m. – sujeta a valoración médica y normativa local.














