
Villfact 1000 i.m.
Consulta con un médico sobre la receta médica de Villfact 1000 i.m.

Cómo usar Villfact 1000 i.m.
HOJA DE INSTRUCCIONES PARA EL PACIENTE: INFORMACIÓN PARA EL USUARIO
Willfact 500 UI
Polvo y disolvente para la preparación de una solución inyectable
Willfact 1000 UI polvo y disolvente para la preparación de una solución inyectable
Willfact 2000 UI polvo y disolvente para la preparación de una solución inyectable
Factor de von Willebrand humano
Es importante que lea cuidadosamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos que los suyos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Willfact y para qué se utiliza
- 2. Información importante antes de tomar Willfact
- 3. Cómo tomar Willfact
- 4. Posibles efectos adversos
- 5. Cómo conservar Willfact
- 6. Contenido del envase y otra información
1. Qué es Willfact y para qué se utiliza
Willfact es un medicamento producido a partir de plasma humano (la parte líquida de la sangre) y contiene una sustancia activa llamada factor de von Willebrand humano (vWF).
El factor vWF participa en la coagulación de la sangre. La falta de este factor, como ocurre en la enfermedad de von Willebrand, hace que la sangre no coagule tan rápido como debería, lo que provoca una mayor tendencia a sangrar. El reemplazo de vWF con Willfact corrige temporalmente los mecanismos de coagulación de la sangre.
Willfact está indicado para prevenir sangrados asociados con procedimientos quirúrgicos y otros sangrados, así como para tratarlos en pacientes con diagnóstico de enfermedad de von Willebrand, si el tratamiento con solo desmopresina (DDAVP) no es efectivo o está contraindicado.
Willfact puede ser utilizado en todas las edades.
2. Información importante antes de tomar Willfact
Cuándo no tomar Willfact
- Si el paciente es alérgico al factor de von Willebrand humano o a cualquier otro componente de este medicamento (enumerados en el punto 6).
- Si el paciente ha sido diagnosticado con hemofilia tipo A.
Precauciones y advertencias
El tratamiento con Willfact debe ser siempre supervisado por un médico con experiencia en el tratamiento de trastornos de coagulación.
Si el paciente experimenta sangrados severos y las pruebas de sangre confirman una disminución de la cantidad de factor VIII, el paciente recibirá un preparado de factor de coagulación VIII y un preparado de vWF dentro de las primeras 12 horas.
Reacciones alérgicas
Pueden ocurrir reacciones de hipersensibilidad de tipo alérgico, similares a las que ocurren con otros medicamentos proteicos administrados por vía intravenosa obtenidos de sangre o plasma humano.
El paciente será monitoreado durante la inyección para detectar signos tempranos de hipersensibilidad.
Estos incluyen erupciones cutáneas (urticaria o urticaria generalizada), sensación de opresión en el pecho, respiración sibilante, disminución de la presión arterial (hipotensión) y reacciones alérgicas graves (anafilaxia).
El médico informará al paciente sobre los signos de advertencia de una reacción alérgica.
Si ocurren signos objetivos o subjetivos de hipersensibilidad, debe interrumpirse el tratamiento y buscar ayuda médica de inmediato.
Seguridad viral
En la producción de medicamentos a partir de sangre o plasma humano, se toman ciertas medidas para prevenir la transmisión de infecciones a los pacientes. Estas incluyen:
- selección cuidadosa de donantes de sangre y plasma para excluir a personas en grupos de riesgo de infección,
- pruebas de cada lote y pool de plasma para detectar la presencia de virus o infecciones,
- introducción de pasos en el proceso de tratamiento de la sangre o el plasma para inactivar o eliminar los virus.
A pesar de la implementación de estas medidas, no se puede excluir completamente la posibilidad de transmisión de una infección durante la administración de medicamentos producidos a partir de sangre o plasma humano. Esto también se aplica a virus desconocidos o que acaban de aparecer, o a infecciones de otro tipo.
Las medidas tomadas se consideran efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia humana (HIV, que causa el SIDA), el virus de la hepatitis B y el virus de la hepatitis C.
Las medidas tomadas tienen un valor limitado contra los virus sin envoltura, como el virus de la hepatitis A y el parvovirus B19. La infección por parvovirus B19 puede ser grave en mujeres embarazadas (ya que existe el riesgo de infección del feto no nacido) y en pacientes con sistema inmunológico debilitado o ciertos tipos de anemia (como anemia falciforme o anemia hemolítica).
Vacunación
El médico puede recomendar que el paciente reciba vacunas contra la hepatitis A y la hepatitis B si el paciente recibe regularmente factor de von Willebrand humano producido a partir de plasma.
Registro del número de lote
Se recomienda encarecidamente que, al administrar cada dosis de Willfact, se registre el nombre y apellido del paciente y el número de lote del medicamento, para documentar qué lotes del medicamento se han administrado.
Riesgo de trombosis
Puede ocurrir la formación de coágulos en los vasos sanguíneos (trombosis). El riesgo es particularmente alto si hay factores de riesgo en la historia médica o en las pruebas de laboratorio. En tal caso, el estado del paciente será monitoreado muy de cerca para detectar signos tempranos de trombosis. También se administrarán medicamentos para prevenir la formación de coágulos en los vasos sanguíneos (profilaxis).
El médico que administra factor de coagulación VIII que contiene factor de von Willebrand debe recordar que la continuación del tratamiento puede provocar un aumento excesivo de la actividad del factor VIII. Si el paciente recibe un preparado de vWF que contiene factor de coagulación VIII, el médico debe monitorear regularmente la actividad del factor VIII en el suero. Esto protegerá al paciente de una actividad excesiva del factor VIII en el suero, lo que puede aumentar el riesgo de eventos trombóticos.
Limitaciones de la eficacia
En pacientes con enfermedad de von Willebrand (especialmente tipo 3), pueden producirse proteínas que neutralizan la acción del factor de von Willebrand. Estas proteínas se llaman anticuerpos neutralizantes o inhibidores. El médico verificará si el paciente produce inhibidores de vWF si los resultados de las pruebas de laboratorio muestran una falta de restauración adecuada de los niveles de vWF o si los sangrados no disminuyen a pesar de la administración de la dosis adecuada de Willfact. Si hay una gran cantidad de inhibidores, el tratamiento con vWF puede no ser efectivo. En tales casos, se deben considerar otros métodos de tratamiento. Un nuevo tratamiento será realizado por un médico con experiencia en el tratamiento de trastornos de coagulación.
Willfact y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
Embarazo y lactancia
Willfact puede ser utilizado en mujeres embarazadas o en período de lactancia solo si es absolutamente necesario.
No se han realizado estudios clínicos controlados para evaluar la seguridad del uso de Willfact en mujeres embarazadas o en período de lactancia, y los estudios en animales no son suficientes para confirmar la seguridad del uso en el contexto de la fertilidad, el embarazo y el desarrollo del feto durante el embarazo y después del parto.
Si la paciente está embarazada o en período de lactancia, cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de tomar este medicamento.
Conducción de vehículos y uso de máquinas
No se ha observado ningún efecto en la capacidad para conducir vehículos o operar máquinas.
Willfact contiene sodio
Un frasco de 5 ml (500 UI) de Willfact contiene 0,15 mmol (3,4 mg) de sodio.
Esto equivale al 0,17% del consumo diario máximo recomendado de sodio para un adulto.
Un frasco de 10 ml (1000 UI) de Willfact contiene 0,3 mmol (6,9 mg) de sodio.
Esto equivale al 0,35% del consumo diario máximo recomendado de sodio para un adulto.
Un frasco de 20 ml (2000 UI) de Willfact contiene 0,6 mmol (13,8 mg) de sodio.
Esto equivale al 0,69% del consumo diario máximo recomendado de sodio para un adulto.
3. Cómo tomar Willfact
El tratamiento debe ser iniciado y monitoreado por un médico con experiencia en el tratamiento de trastornos hemorrágicos.
Si el médico considera que el paciente puede administrar el medicamento en casa, instruirá adecuadamente al paciente.
Dosis
Este medicamento debe ser siempre tomado según las indicaciones del médico. En caso de duda, debe consultar a su médico.
Es preferible que el médico o la enfermera administren Willfact. Sin embargo, si el paciente ha recibido Willfact para su uso en casa, el médico se asegurará de que el paciente esté informado sobre la forma de administrar la inyección y la dosis adecuada del medicamento. Debe seguir las indicaciones del médico y pedir ayuda si tiene problemas con la jeringa. La jeringa solo puede ser utilizada por una persona capacitada.
El médico calculará la dosis adecuada de Willfact (expresada en unidades internacionales - UI).
La dosis depende de:
- peso corporal,
- lugar del sangrado,
- gravedad del sangrado,
- estado clínico del paciente,
- necesidad de realizar un procedimiento,
- actividad de vWF en la sangre después del procedimiento,
- gravedad de la enfermedad.
La dosis se encuentra en el rango de 40-80 UI/kg de peso corporal.
El médico recomendará la realización de pruebas de sangre durante el tratamiento para:
- determinar la concentración de factor VIII (FVIII:C),
- determinar la concentración de factor de von Willebrand (vWF:RCo),
- detectar la presencia de inhibidores,
- detectar signos tempranos de formación de coágulos - en pacientes en grupos de riesgo de desarrollar estas complicaciones.
Basándose en los resultados de estas pruebas, el médico puede ajustar la frecuencia de las inyecciones y la dosis administrada.
En algunos casos, puede ser necesario utilizar un preparado de factor VIII (otra proteína con actividad coagulante) además de Willfact para permitir un tratamiento más rápido o prevenir el sangrado (en situaciones de emergencia o en caso de sangrado agudo).
Willfact también puede ser utilizado para la profilaxis a largo plazo, en cuyo caso la dosis también se determina individualmente. La administración de Willfact en una dosis de 40-60 UI/kg de peso corporal, 2-3 veces a la semana, reduce la frecuencia de los episodios de sangrado.
Si el paciente considera que Willfact está actuando demasiado fuerte o demasiado débil, debe consultar a su médico.
Uso en niños y adolescentes
La dosis en niños y adolescentes se basa en el peso corporal. En algunos casos, especialmente en pacientes más jóvenes (menores de 6 años), puede ser necesario utilizar dosis más altas (hasta 100 UI/kg de peso corporal).
Método de administración
Las instrucciones detalladas para la reconstitución y administración del producto se encuentran al final de la hoja de instrucciones.
Uso de una dosis mayor que la recomendada de Willfact
No se han reportado signos de sobredosis de Willfact, sin embargo, en caso de administrar una gran cantidad, no se puede excluir el riesgo de trombosis.
Omision de la administración de Willfact
En caso de omitir la administración de Willfact, debe consultar a su médico.
No debe tomar una dosis doble para compensar la dosis omitida.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe comunicarse con su médico de inmediato en los siguientes casos:
- Aparición de signos de hipersensibilidad o reacciones alérgicas (observadas con frecuencia no muy alta, pueden afectar hasta 1 de cada 100 pacientes). En algunos casos, estas reacciones pueden convertirse en una reacción alérgica grave (anafilaxia), incluyendo shock anafiláctico (frecuencia desconocida).
Los signos de advertencia de una reacción alérgica incluyen:
- dificultad para respirar y tragar,
- respiración sibilante,
- opresión en el pecho,
- aumento de la frecuencia cardíaca,
- disminución de la presión arterial,
- mareo,
- cansancio extremo,
- ansiedad, nerviosismo,
- dolor de cabeza,
- escalofríos, sensación de frío,
- olas de calor,
- hinchazón de diferentes partes del cuerpo,
- erupciones cutáneas, urticaria generalizada,
- sensación de ardor y picazón en el lugar de la inyección,
- entumecimiento,
- vómitos,
- náuseas.
Si ocurre alguno de estos signos, debe interrumpir el tratamiento de inmediato y comunicarse con su médicopara iniciar el tratamiento adecuado, dependiendo del tipo y gravedad de la reacción.
- Detección de disminución de la eficacia del medicamento (falta de control del sangrado). Esto puede deberse a la inhibición del factor de von Willebrand (frecuencia desconocida).
En pacientes con enfermedad de von Willebrand, especialmente tipo 3, pueden producirse proteínas que neutralizan la acción de vWF. Estas proteínas se llaman anticuerpos neutralizantes o inhibidores. Los pacientes tratados con vWF deben ser monitoreados cuidadosamente por su médico para detectar la presencia de inhibidores a través de la observación clínica y la realización de pruebas de laboratorio. En caso de que aparezcan inhibidores, este estado puede manifestarse como una respuesta clínica inadecuada. También puede coexistir con reacciones alérgicas graves.
- Detección de signos de trastornos circulatorios en las extremidades (por ejemplo, extremidades frías y pálidas) o órganos vitales (por ejemplo, dolor severo en el pecho). Esto puede deberse a la formación de coágulos en los vasos sanguíneos (frecuencia desconocida).
Existe un riesgo de formación de coágulos (trombosis), especialmente en pacientes en grupos de riesgo. Después de corregir la deficiencia de factor de von Willebrand, los pacientes deben ser monitoreados para detectar signos tempranos de trombosis o coagulación intravascular diseminada y recibir tratamiento para prevenir la trombosis en situaciones en las que el riesgo de trombosis es alto (después de procedimientos quirúrgicos, en pacientes encamados, en caso de deficiencia de inhibidor de la coagulación o enzima fibrinolítico).
Si el paciente recibe preparados de vWF que contienen factor VIII, el riesgo de trombosis puede ser mayor debido a los niveles persistentemente elevados de factor VIII en el suero.
Los siguientes efectos adversos se han observado con frecuencia(pueden afectar hasta 1 de cada 10 pacientes):
- reacciones en el lugar de la inyección.
Los siguientes efectos adversos se han observado con frecuencia no muy alta(pueden afectar hasta 1 de cada 100 pacientes):
- mareo,
- parestesia, entumecimiento,
- olas de calor,
- picazón,
- opresión en el pecho,
- escalofríos, sensación de frío.
Los siguientes efectos adversos se han observado con frecuencia desconocida:
- fiebre.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico, o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Willfact
El medicamento debe conservarse en un lugar donde no pueda ser visto o alcanzado por los niños.
No debe utilizarse después de la fecha de caducidad indicada en el etiquetado del frasco y el paquete.
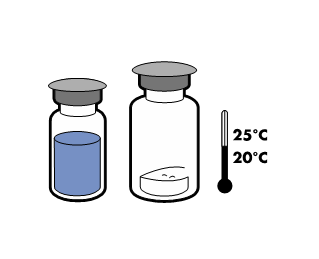
No debe conservarse a una temperatura superior a 25°C. Debe conservarse en el embalaje original para protegerlo de la luz.
No debe congelarse.
Con el fin de mantener la esterilidad, el producto debe utilizarse inmediatamente después de la reconstitución. Sin embargo, se ha demostrado la estabilidad química y física del producto después de 24 horas a 25°C.
No debe utilizarse si se observa turbidez o partículas en la solución.
No debe mezclarse con otros medicamentos.
No debe diluirse el producto después de la reconstitución.
Los medicamentos no deben desecharse por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del envase y otra información
Qué contiene Willfact?
La sustancia activaes factor de von Willebrand humano (500 UI, 1000 UI, 2000 UI) expresado en unidades internacionales de actividad de cofactor de ristocetina (vWF:RCo).
Después de la reconstitución con 5 ml (500 UI), 10 ml (1000 UI) o 20 ml (2000 UI) de agua para inyección, un frasco contiene aproximadamente 100 UI/ml de factor de von Willebrand humano.
Antes de agregar la albúmina, la actividad específica de la solución es de al menos 60 UI vWF:RCo por 1 mg de proteína total.
Los demás componentes son:
Polvo: albúmina humana, clorhidrato de arginina, glicina, citrato de sodio y cloruro de calcio dihidratado.
Disolvente: agua para inyección.
Cómo se presenta Willfact y qué contiene el envase?
Willfact se presenta en forma de polvo blanco o amarillento pálido y un disolvente transparente y sin color para la preparación de una solución inyectable después de la reconstitución mediante un sistema de transferencia.
Los tamaños de envase de Willfact disponibles son 500 UI/5 ml, 1000 UI/10 ml, 2000 UI/20 ml.
La solución después de la reconstitución debe ser transparente o ligeramente opalescente, sin color o ligeramente amarillento.
Título del responsable y fabricante
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANCIA
[email protected]
Fabricantes
LFB-BIOMEDICAMENTS
3, avenue des Tropiques,
ZA de Courtaboeuf,
91940 LES Ulis,
FRANCIA
LFB-BIOMEDICAMENTS
59 Rue de Trévise
59000 LILLE
FRANCIA
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) bajo los siguientes nombres:
Austria
Willfact
República Checa
WILLFACT
Dinamarca
Willfact
Eslovaquia
Willfact
Eslovenia
Willfact
España
Willfact
Finlandia
Willfact
Francia
WILLFACT
Alemania
WILLFACT
Grecia
Willfact
Hungría
Willfact
Irlanda
Willfact
Italia
Willfact
Luxemburgo
Willfact
Noruega
Willfact
Países Bajos
Willfact
Polonia
Willfact
Portugal
Willfact
Reino Unido
Willfact
Suecia
Willfact
Fecha de la última revisión de la hoja de instrucciones:
- 01.2024 ________________________________________________________________________________________
INSTRUCCIONES PARA EL USO:
Dosis
En general, la administración de 1 UI/kg de peso corporal de factor de von Willebrand produce un aumento de la actividad de vWF:RCo en la sangre de aproximadamente 0,02 UI/ml (2%).
Debe buscarse alcanzar concentraciones de vWF:RCo de >0,6 UI/ml (60%) y FVIII:C de >0,4 UI/ml (40%).
La hemostasia es incierta hasta que se alcanza una actividad coagulante de factor VIII (FVIII:C) de 0,4 UI/ml (40%). La inyección de factor de von Willebrand solo no produce un aumento máximo de la actividad de FVIII:C durante al menos 6-12 horas. No es suficiente para la normalización inmediata de la actividad de FVIII:C. Por lo tanto, si la actividad inicial de FVIII:C del paciente es inferior al valor crítico y es necesario un ajuste rápido de la hemostasia, como en el tratamiento de un sangrado o en un procedimiento quirúrgico de emergencia, con la primera inyección de factor de von Willebrand debe administrarse factor VIII para poder alcanzar una actividad de FVIII:C en la sangre que garantice la hemostasia.
Si, sin embargo, no es necesario un aumento inmediato de la actividad de FVIII:C, como en el caso de un procedimiento quirúrgico programado, o si la actividad inicial de FVIII:C del paciente permite mantener la hemostasia, el médico puede decidir omitir la administración de factor VIII con la primera inyección de factor de von Willebrand.
- Inicio del tratamiento: La primera dosis de Willfact es de 40-80 UI/kg de peso corporal en el tratamiento de un sangrado o lesión. Se administra en combinación con la cantidad necesaria de un producto que contenga factor VIII, calculada según la actividad inicial de FVIII:C en la sangre del paciente, para alcanzar la actividad adecuada de FVIII:C en la sangre, inmediatamente antes del procedimiento o lo antes posible después del inicio del episodio de sangrado o lesión. En el caso de un procedimiento quirúrgico, la primera inyección debe administrarse 1 hora antes del procedimiento. La administración de una dosis inicial de 80 UI/kg de peso corporal de Willfact puede ser necesaria, especialmente en pacientes con enfermedad de von Willebrand tipo 3, para lo cual puede ser necesario mantener una actividad más alta que en otros tipos de vWD.
En el caso de un procedimiento quirúrgico programado, la primera inyección de Willfact debe administrarse 12-24 horas antes del procedimiento, y la segunda inyección debe administrarse inmediatamente antes del procedimiento. En estos casos, no es necesario administrar un producto que contenga factor VIII al mismo tiempo, ya que antes del procedimiento la concentración de FVIII:C endógeno suele alcanzar un valor crítico de 0,4 UI/ml (40%). Sin embargo, esto debe confirmarse en cada paciente.
- Inicio del tratamiento
- En niños menores de 6 años, la dosis inicial puede establecerse según el incremento de recuperación (IR) del paciente o, si los datos de IR no están disponibles, puede ser necesaria una dosis inicial de 60-100 UI/kg de peso corporal para aumentar la concentración de vWF:RCo del paciente a 100 UI/dl.
- En niños mayores de 6 años y adolescentes, la dosis es la misma que en adultos.
- Administración de dosis adicionales En niños y adolescentes, las dosis adicionales deben establecerse individualmente según el estado clínico y la concentración de vWF:RCo, y ajustarse según la respuesta clínica.
Procedimiento quirúrgico programado
- En niños menores de 6 años, después de la primera dosis administrada 12-24 horas antes del procedimiento, se puede administrar una segunda dosis 30 minutos antes del procedimiento.
- En niños mayores de 6 años y adolescentes, la dosis es la misma que en adultos.
- Profilaxis En niños y adolescentes, la dosis y la frecuencia de administración deben establecerse individualmente según el incremento de recuperación y la concentración de vWF:RCo del paciente, y ajustarse según la respuesta clínica.
Método y vía de administración
Administración intravenosa
Reconstitución
Debe seguirse la técnica aséptica actual. El sistema de transferencia se utiliza solo para la reconstitución del medicamento, según se describe a continuación. El sistema no está diseñado para la administración del medicamento al paciente.
 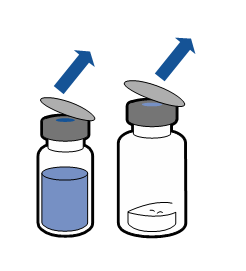 |
|
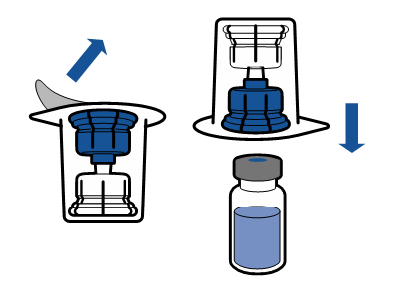 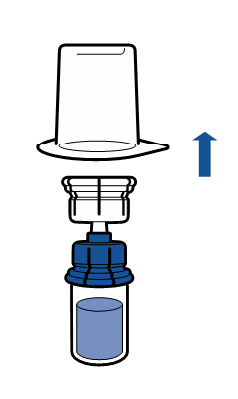 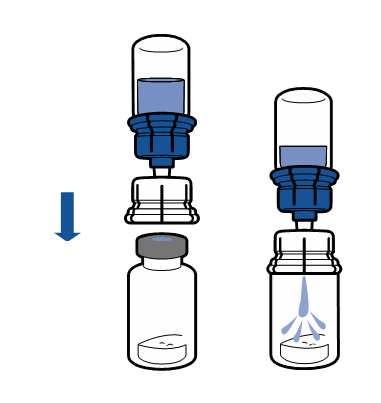 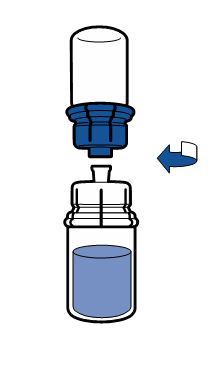 |
|
El polvo debe disolverse en menos de 5 minutos, generalmente se disuelve de inmediato.
La solución resultante debe ser transparente o ligeramente opalescente, sin color o ligeramente amarillenta. Antes de la administración, el producto reconstituido debe ser inspeccionado visualmente para detectar partículas o decoloración.
No debe utilizarse si la solución es turbia o contiene depósitos.
No debe mezclarse con otros medicamentos.
No debe diluirse el producto después de la reconstitución.
Administración
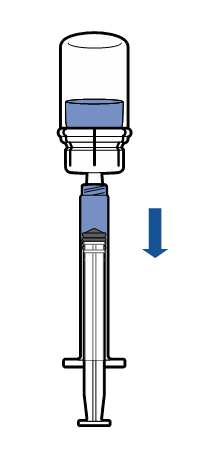 |
|
Almacenamiento después de la reconstitución
Con el fin de mantener la esterilidad, el producto debe utilizarse inmediatamente después de la reconstitución. Sin embargo, se ha demostrado la estabilidad química y física del producto después de 24 horas a 25°C.
Todo el producto no utilizado o los desechos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorLFB-Biomedicamensts LFB-Biomedicaments
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Villfact 1000 i.m.Forma farmacéutica: Polvo, 2000 UI/20 mlPrincipio activo: Factor von willebrandFabricante: LFB-Biomedicamensts LFB-BiomedicamentsNo requiere recetaForma farmacéutica: Polvo, 500 UI/5 mlPrincipio activo: Factor von willebrandFabricante: LFB-Biomedicamensts LFB-BiomedicamentsNo requiere recetaForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Villfact 1000 i.m. en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Villfact 1000 i.m. en España
Médicos online para Villfact 1000 i.m.
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Villfact 1000 i.m. – sujeta a valoración médica y normativa local.














