

Vaxigrip

Consulta con un médico sobre la receta médica de Vaxigrip

Cómo usar Vaxigrip
HOJA DE INSTRUCCIONES DEL PACIENTE: INFORMACIÓN PARA EL USUARIO
Vaxigrip, suspensión para inyección en jeringa precargada
Vacuna triple contra la gripe (virión escindido), inactivada
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de administrar la vacuna, ya que contiene información importante para el paciente adulto o el niño.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico, farmacéutico o enfermera.
- Esta vacuna ha sido recetada específicamente para una persona determinada. No debe ser administrada a otras personas.
- Si el paciente adulto o el niño experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Vaxigrip y para qué se utiliza
- 2. Información importante antes de administrar la vacuna Vaxigrip
- 3. Cómo administrar la vacuna Vaxigrip
- 4. Posibles efectos adversos
- 5. Cómo conservar la vacuna Vaxigrip
- 6. Contenido del envase y otra información
1. Qué es Vaxigrip y para qué se utiliza
Vaxigrip es una vacuna.
Esta vacuna administrada a personas adultas y niños a partir de los 6 meses de edad ayuda
a proteger contra la gripe.
Después de la administración de la vacuna Vaxigrip, el sistema inmunitario (sistema de defensa natural del cuerpo)
produce su propia protección contra la enfermedad (anticuerpos). La vacuna administrada durante el embarazo
ayuda a proteger a las mujeres embarazadas, así como a los niños desde el nacimiento hasta los 6 meses de edad,
transmitiendo la protección de la madre al niño durante el embarazo (véase también los puntos 2 y 3).
Ninguno de los componentes de la vacuna puede causar gripe.
La administración de la vacuna Vaxigrip debe ser de acuerdo con las recomendaciones oficiales.
La gripe es una enfermedad que puede propagarse rápidamente y es causada por muchos diferentes
cepas del virus, que pueden cambiar cada año. Debido a este posible cambio anual de las cepas circulantes,
así como a la duración de la protección proporcionada por la vacuna, se recomienda la vacunación cada año. El mayor riesgo de contraer gripe se produce durante los meses fríos entre octubre y marzo. En el caso de personas
adultas y niños que no han sido vacunados en el otoño, todavía es justificable vacunarse
hasta la primavera, ya que hasta entonces existe el riesgo de contraer gripe. El médico podrá recomendar el mejor momento para vacunarse.
La vacuna Vaxigrip está destinada a proteger a personas adultas y niños contra tres cepas del virus
contenidas en la vacuna, aproximadamente 2-3 semanas después de la vacunación.
Como el período de incubación de la gripe es de varios días, en caso de exposición de un adulto o un niño
a el virus de la gripe justo antes o después de la vacunación, todavía es posible contraer la gripe.
La vacuna no protege contra el resfriado, aunque algunos de sus síntomas son similares a los de la gripe.
2. Información importante antes de administrar la vacuna Vaxigrip
Debe informar a su médico o farmacéutico si alguna de las siguientes afirmaciones se aplica a la persona adulta o el niño a quien se administrará la vacuna Vaxigrip. Si algo no está claro, debe pedir a su médico o farmacéutico que lo explique.
Cuándo no administrar la vacuna Vaxigrip
- Si el paciente adulto o el niño es alérgico a:
- Los principios activos, o
- Cualquiera de los demás componentes de esta vacuna (enumerados en el punto 6), o
- Cualquier componente que pueda estar presente en muy pequeñas cantidades, como residuos de huevo (albumina de huevo de gallina, proteínas de gallina), neomicina, formaldehído o octoxinol-9.
Precauciones y advertencias
Antes de administrar la vacuna Vaxigrip, debe hablar con su médico, farmacéutico o enfermera.
Antes de la vacunación, debe informar a su médico si el paciente adulto o el niño tiene:
- Una respuesta inmunitaria debilitada (causada por una deficiencia inmunitaria o por la ingesta de medicamentos que afectan el sistema inmunitario),
- Hemorragias o tendencia a los moretones. Si el paciente adulto o el niño tiene una enfermedad aguda con fiebre, la vacunación debe retrasarse hasta que la fiebre haya desaparecido. El médico decidirá si el paciente adulto o el niño debe recibir la vacuna. El desmayo puede ocurrir (especialmente en adolescentes) después, o incluso antes, de cualquier inyección. Por lo tanto, debe informar a su médico o enfermera si el paciente o su hijo ha experimentado desmayos con inyecciones anteriores.
Al igual que con cualquier vacuna, la vacuna Vaxigrip puede no proporcionar una protección completa
a todas las personas vacunadas.
No todos los niños menores de 6 meses, nacidos de madres vacunadas durante el embarazo,
estarán protegidos.
Niños
No se recomienda la administración de la vacuna Vaxigrip a niños menores de 6 meses.
La vacuna Vaxigrip y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos o vacunas que el paciente adulto o el niño esté tomando actualmente o haya tomado recientemente, así como sobre cualquier medicamento o vacuna que planeen tomar.
- La vacuna Vaxigrip puede administrarse al mismo tiempo que otras vacunas, pero en diferentes extremidades.
- En caso de tratamiento con medicamentos o terapias que reduzcan la inmunidad, como corticosteroides, medicamentos citotóxicos o radioterapia, la respuesta inmunitaria a la vacunación puede verse debilitada.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o sospecha que puede estar embarazada, debe consultar a su médico o farmacéutico antes de administrar esta vacuna.
La vacuna Vaxigrip puede administrarse en cualquier momento del embarazo.
La vacuna Vaxigrip puede administrarse durante la lactancia.
El médico/farmacéutico decide la posibilidad de administrar la vacuna Vaxigrip.
Conducción de vehículos y uso de máquinas
La vacuna Vaxigrip no tiene efecto o tiene un efecto insignificante en la capacidad de conducir vehículos y usar máquinas.
La vacuna Vaxigrip contiene potasio y sodio
3. Cómo administrar la vacuna Vaxigrip
Dosis
Los adultos reciben una dosis de 0,5 ml.
Uso en niños y adolescentes
Los niños a partir de los 6 meses de edad hasta los 17 años reciben una dosis de 0,5 ml.
Los niños menores de 9 años que no han sido vacunados previamente contra la gripe deben recibir una segunda dosis de 0,5 ml después de al menos 4 semanas.
En el caso de las mujeres embarazadas, una dosis de 0,5 ml administrada durante el embarazo puede proteger al niño desde el nacimiento hasta los 6 meses de edad. Para obtener más información, debe consultar a su médico o farmacéutico.
Cómo tomar la vacuna Vaxigrip
El médico o la enfermera administrarán la dosis recomendada de la vacuna como una inyección en el músculo o bajo la piel.
Uso de una dosis mayor que la recomendada de la vacuna Vaxigrip
En algunos casos, se ha administrado accidentalmente una dosis mayor que la recomendada.
En estos casos, cuando se han notificado efectos adversos, han sido consistentes con los descritos después de la administración de la dosis recomendada (véase el punto 4).
En caso de cualquier duda adicional sobre el uso de esta vacuna, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que cualquier medicamento, esta vacuna puede causar efectos adversos, aunque no todos los experimentarán.
Debe comunicarse de inmediato con su médico o personal de atención médica, o acudir a la sala de emergencias más cercana, si ocurre una reacción alérgica.
Reacciones alérgicas
Pueden ocurrir inmediatamente después de la administración de la vacuna y pueden ser mortales.
Los síntomas pueden incluir:
- erupción, picazón (prurito), dificultad para respirar, disnea, hinchazón (edema) de la cara, los labios, la garganta o la lengua, presión arterial baja, taquicardia y pulso débil, piel fría y húmeda, mareo, debilidad o desmayo (reacción anafiláctica, angioedema, choque).
Otros síntomas pueden incluir:
- áreas de piel picazón, enrojecidas, hinchadas (edema) y agrietadas (dermatitis atópica), enrojecimiento repentino de la piel, sofocos, enrojecimiento y picazón en los ojos (conjuntivitis), irritación de la garganta, dolor de garganta, irritación en la nariz, resfriado, estornudos, nariz congestionada, senos o garganta, entumecimiento o hormigueo en la boca (parestesia en la boca), erupción en la boca (lesiones en la mucosa bucal), asma.
Estas reacciones alérgicas se han notificado como ocasionales (pueden afectar hasta 1 de cada 100 personas) o raras (pueden afectar hasta 1 de cada 1000 personas).Efectos adversos adicionales en adultos y personas mayores
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- dolor de cabeza, dolor muscular, malestar general, dolor en el lugar de la inyección.
Frecuentes (pueden afectar hasta 1 de cada 10 personas):
- fiebre, escalofríos, reacciones en el lugar de la inyección: enrojecimiento (eritema), endurecimiento, hinchazón.
Occasionales (pueden afectar hasta 1 de cada 100 personas):
- enrojecimiento de los ganglios linfáticos en el cuello, las axilas o la ingle (linfadenopatía), debilidad inusual, sensación de cansancio, somnolencia, mareo, sudoración excesiva, dolor articular, diarrea, náuseas, reacciones en el lugar de la inyección: moretones (equimosis), picazón, calor, molestia.
Raras (pueden afectar hasta 1 de cada 1000 personas):
- sensación de entumecimiento o hormigueo (parestesia), vómitos, pérdida de apetito, síntomas similares a los de la gripe.
- entumecimiento (hipoestesia), dolor abdominal, alergia en el lugar de la inyección: se ha observado solo en personas adultas.
- descamación de la piel en el lugar de la inyección: se ha observado solo en personas adultas.
Efectos adversos adicionales en niños de 3 a 17 años
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- dolor de cabeza, dolor muscular, malestar general, escalofríos, reacciones en el lugar de la inyección: dolor, enrojecimiento, hinchazón, endurecimiento.
Frecuentes (pueden ocurrir con menos frecuencia que en 1 de cada 10 personas):
- fiebre, moretón en el lugar de la inyección. Occasionales (pueden afectar hasta 1 de cada 100 personas):
- sensación de cansancio, mareo, diarrea, reacciones en el lugar de la inyección: picazón, calor.
- enrojecimiento de los ganglios linfáticos en el cuello, las axilas o la ingle, dolor abdominal, vómitos, irritabilidad, llanto, dolor articular: se ha observado solo en niños de 3 a 8 años.
- disminución del número de ciertos tipos de células en la sangre llamadas plaquetas; su número bajo puede causar moretones o sangrado excesivo (trombocitopenia): se ha observado solo en un niño de 3 años.
- debilidad inusual, molestia en el lugar de la inyección: se ha observado solo en niños de 9 a 17 años.
Efectos adversos adicionales en niños de 6 a 35 meses
Muy frecuentes (pueden afectar a más de 1 de cada 10 personas):
- irritabilidad, vómitos, dolor muscular, malestar general, fiebre, pérdida de apetito, reacciones en el lugar de la inyección: sensibilidad, enrojecimiento.
- llanto inusual, somnolencia: se ha observado solo en niños menores de 24 meses.
- dolor de cabeza: se ha observado solo en niños mayores de 24 meses.
Frecuentes (pueden ocurrir con menos frecuencia que en 1 de cada 10 personas):
- diarrea, reacciones en el lugar de la inyección: endurecimiento, moretón, hinchazón.
- escalofríos: se ha observado solo en niños mayores de 24 meses. Raras (pueden afectar hasta 1 de cada 1000 personas):
- síntomas similares a los de la gripe, reacciones en el lugar de la inyección: picazón, erupción. En niños de 6 a 8 años que reciben 2 dosis, los efectos adversos después de la primera y la segunda dosis son similares. Puede que ocurran menos efectos adversos después de la administración de la segunda dosis en niños de 6 a 35 meses de edad. La mayoría de los efectos adversos ocurrieron generalmente dentro de los 3 días después de la vacunación y desaparecieron sin tratamiento dentro de 1 a 3 días después de su inicio. La gravedad de la mayoría de estos efectos adversos fue leve a moderada.
La frecuencia de los siguientes efectos adversos es desconocida (no puede ser establecida a partir de los datos disponibles) en toda la población, excepto en la población para la que se menciona el efecto adverso:
- enrojecimiento de los ganglios linfáticos en el cuello, las axilas o la ingle.
- sensación de entumecimiento o hormigueo (parestesia), dolor a lo largo de los nervios (neuralgia), convulsiones, trastornos neurológicos que pueden causar rigidez en el cuello, desorientación, entumecimiento, dolor y debilidad en las extremidades, pérdida de equilibrio, pérdida de reflejos, parálisis de parte o todo el cuerpo (encefalitis, neuritis, síndrome de Guillain-Barré).
- inflamación de los vasos sanguíneos, que puede causar erupciones cutáneas y, en casos muy raros, trastornos temporales de la función renal.
- disminución temporal del número de ciertos tipos de células en la sangre llamadas plaquetas; su número bajo puede causar moretones o sangrado excesivo (trombocitopenia transitoria).
Notificación de efectos adversos
Si el paciente adulto o el niño experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos del Instituto de Salud Pública de [país].
Dirección: [dirección].
Teléfono: [teléfono].
Fax: [fax].
Sitio web: [sitio web].
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.5. Cómo conservar la vacuna Vaxigrip
La vacuna debe conservarse en un lugar no visible y no accesible para los niños.
No debe administrarse esta vacuna después de la fecha de caducidad indicada en el etiquetado y el envase después de "Fecha de caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
Conservar en refrigerador (2 °C-8 °C). No congelar. Conservar la jeringa precargada en el envase exterior para protegerla de la luz.
No debe desecharse el medicamento por el desagüe o los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.6. Contenido del envase y otra información
Qué contiene la vacuna Vaxigrip?
Los principios activos son: Virus de la gripe (inactivado, escindido) de las siguientes cepas*:
A/Victoria/4897/2022 (H1N1)pdm09-similar a la cepa (A/Victoria/4897/2022, IVR-238)
............................................................................................................. 15 microgramos de HA**
A/Croacia/10136RV/2023 (H3N2)-similar a la cepa (A/Croacia/10136RV/2023, X-425A)
............................................................................................................. 15 microgramos de HA**
B/Austria/1359417/2021-similar a la cepa (B/Michigan/01/2021, tipo silvestre)
............................................................................................................. 15 microgramos de HA**
en una dosis de 0,5 ml
*cultivado en embriones de pollo procedentes de granjas sanas
**hemaglutinina
La vacuna es conforme con las recomendaciones de la Organización Mundial de la Salud (OMS) para el hemisferio norte y con las recomendaciones de la Unión Europea para la temporada 2025/2026.
Los demás componentes son: solución tampón que contiene cloruro de sodio, cloruro de potasio, fosfato disódico dihidratado, fosfato de potasio monohidratado, agua para inyección.
Algunos componentes como huevo (albumina de huevo de gallina, proteínas de gallina), neomicina, formaldehído o octoxinol-9 pueden estar presentes en cantidades muy pequeñas (véase el punto 2).Cómo se presenta la vacuna Vaxigrip y qué contiene el envase?
Después de un agitado suave, la vacuna es un líquido incoloro y opalescente.
La vacuna Vaxigrip es una suspensión para inyección en jeringa precargada de 0,5 ml, con aguja incluida, con aguja separada o sin aguja o con aguja separada en una funda de protección, en un envase de 1 o 10, todo en una caja de cartón. No todas las tallas de envase deben estar en circulación.Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización:
Sanofi Winthrop Industrie
82 avenue Raspail
94250 Gentilly, Francia
Fabricante:
Sanofi Winthrop Industrie, 1541 avenue Marcel Mérieux, 69280 Marcy l'Etoile, Francia
Sanofi Winthrop Industrie, Voie de l’Institut - Parc Industriel d'Incarville, B.P. 101, 27100 Val de Reuil, Francia
Sanofi-Aventis Zrt., Edificio Dc5, Campona Utca 1, Budapest XXII, 1225, HungríaEste medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Estado miembro Nombre Austria, Bélgica, Bulgaria, Croacia, República Checa, Dinamarca, Estonia, Finlandia, Francia, España, Países Bajos, Irlanda, Islandia, Lituania, Luxemburgo, Letonia, Malta, Alemania, Noruega, Polonia, Portugal, Rumania, Eslovaquia, Eslovenia, Suecia, Hungría, Italia Vaxigrip Chipre, Grecia Vaxigrip TIV Fecha de la última actualización de la hoja de instrucciones:junio 2025
Otras fuentes de información
La información actualmente aprobada sobre este producto está disponible
en la siguiente dirección URL: https://vaxigrip-nh.info.sanofi
---------------------------------------------------------------------------------------------------------------------Información destinada exclusivamente al personal médico especializado:
Al igual que con todas las vacunas administradas por inyección, es necesario asegurar el tratamiento y la supervisión médica adecuados en caso de una reacción anafiláctica después de la administración de la vacuna.
Antes de la administración, la vacuna debe alcanzar la temperatura ambiente.
Agitar antes de usar. Verificar visualmente antes de la administración.
No debe administrarse la vacuna en caso de presencia de partículas sólidas en la suspensión.
No debe mezclarse la vacuna con otros medicamentos en la misma jeringa.
No debe inyectarse la vacuna directamente en los vasos sanguíneos.
Véase también el punto 3. Cómo administrar la vacuna VaxigripInstrucciones para el uso de la aguja con protector en la jeringa precargada con conector Luer Cerradura: 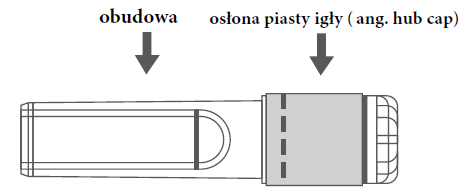
Rycina A: Aguja con protector (en la carcasa) Rycina B: Elementos del protector de la aguja (preparados para su uso) 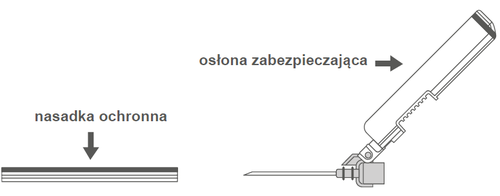
Paso 1: Para fijar la aguja a la jeringa, retire el protector de la punta de la aguja (hub cap), para exponer la punta de la aguja y enrosque suavemente la aguja en el conector Luer Lock de la jeringa, hasta que sienta una ligera resistencia. Paso 2: Retire la carcasa de la aguja. La aguja está protegida por un protector y una punta de protección. 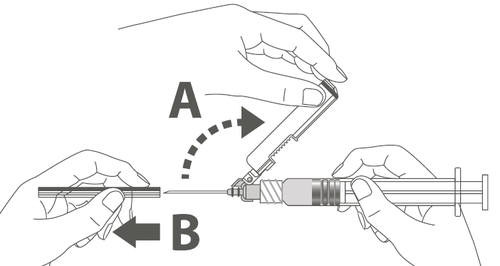
Paso 3: A: Aleje el protector de la aguja en dirección al cuerpo de la jeringa en el ángulo mostrado. B: Retire la punta de protección. 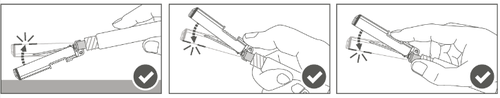
Paso 4: Después de la inyección, bloquee (active) el protector, utilizando una de las tres (3) técnicas de manejo de una mano: activación en una superficie plana, con el pulgar o el dedo índice. Nota: La activación se confirma con un "clic" audible y/o palpable. Paso 5: Verifique visualmente el funcionamiento del protector. El protector debe estar completamente bloqueado (activado), como se muestra en la figura C. La figura D muestra que el protector NO está completamente bloqueado (no está activado). 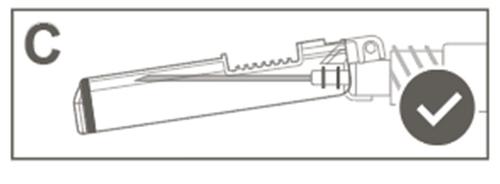
Advertencia: No debe intentar desbloquear (desactivar) el dispositivo de protección empujando la aguja fuera del protector. Todo el producto no utilizado o los residuos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorSanofi Winthrop Industrie Sanofi Winthrop Industrie Sanofi-Aventis Zrt.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a VaxigripForma farmacéutica: Suspensión, 60 mcg HA/cepa, 1 dosis (0.7 ml)Principio activo: influenza, inactivated, split virus or surface antigenRequiere recetaForma farmacéutica: Suspensión, 60 mcg HA/cepa, 1 dosis (0.5 ml)Principio activo: influenza, inactivated, split virus or surface antigenRequiere recetaForma farmacéutica: Suspensión, 1 dosis (0.5 ml)Principio activo: influenza, inactivated, split virus or surface antigenRequiere receta
Alternativas a Vaxigrip en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Vaxigrip en Испания
Alternativa a Vaxigrip en Украина
Médicos online para Vaxigrip
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Vaxigrip – sujeta a valoración médica y normativa local.














