
Efluelda Tetra

Consulta con un médico sobre la receta médica de Efluelda Tetra

Cómo usar Efluelda Tetra
HOJA DE INSTRUCCIONES PARA EL PACIENTE
Hoja de instrucciones del paquete: información para el usuario
Efluelda Tetra, suspensión para inyección en jeringa precargada
Vacuna tetravalente contra la gripe (virión escindido, inactivada),
60 microgramos de HA/dosis
Este producto estará sujeto a una monitorización adicional. Esto permitirá identificar rápidamente
nueva información sobre seguridad. El usuario del medicamento también puede ayudar informando
cualquier reacción adversa que haya ocurrido después de la administración del medicamento. Para saber
cómo informar reacciones adversas, véase el punto 4.
Es importante leer detenidamente el contenido de la hoja de instrucciones antes de administrar la vacuna, ya que contiene información importante para el paciente adulto o el niño.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Esta vacuna ha sido prescrita específicamente para una persona. No debe dársela a otros.
- Si el paciente presenta algún síntoma adverso, incluidos los síntomas adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Efluelda Tetra y para qué se utiliza
- 2. Información importante antes de administrar Efluelda Tetra
- 3. Cómo administrar Efluelda Tetra
- 4. Reacciones adversas posibles
- 5. Cómo conservar Efluelda Tetra
- 6. Contenido del paquete y otra información
1. Qué es Efluelda Tetra y para qué se utiliza
Efluelda Tetra es una vacuna. Esta vacuna ayuda a proteger a las personas mayores de 60 años contra
la gripe. La administración de Efluelda Tetra debe basarse en las recomendaciones oficiales sobre vacunación
contra la gripe.
Después de la administración de Efluelda Tetra, el sistema inmunológico (sistema de defensa natural del cuerpo)
produce su propia protección contra la enfermedad (anticuerpos). Ninguno de los componentes de la vacuna puede
causar gripe.
La gripe es una enfermedad infecciosa del sistema respiratorio causada por los virus de la gripe, que puede ser leve o grave y puede llevar a complicaciones graves, como neumonía, que puede requerir hospitalización e incluso la muerte. La gripe es una enfermedad que puede propagarse rápidamente y es causada por muchos diferentes cepas del virus, que pueden cambiar cada año. Debido a este posible cambio anual de las cepas circulantes, así como a la duración de la protección proporcionada por la vacuna, se recomienda la vacunación cada año. El mayor riesgo de contraer gripe ocurre durante los meses fríos entre octubre y marzo. En el caso de las personas que no se vacunaron en el otoño, todavía es justificable vacunarse hasta la primavera, ya que hasta entonces existe el riesgo de contraer gripe. El médico podrá recomendar el mejor momento para vacunarse.
La vacuna Efluelda Tetra está destinada a proteger contra cuatro cepas del virus contenidas en la vacuna aproximadamente 2 a 3 semanas después de la vacunación. Dado que el período de incubación de la gripe es de varios días, en caso de exposición al virus de la gripe justo antes o después de la vacunación, todavía es posible contraer gripe.

La vacuna no protege contra el resfriado, aunque algunos de sus síntomas son similares a los de la gripe.
2. Información importante antes de administrar Efluelda Tetra
Debe informar a su médico o farmacéutico si alguna de las siguientes afirmaciones se aplica a la persona a quien se administrará Efluelda Tetra. Si algo no está claro, debe pedir a su médico o farmacéutico que lo explique.
Cuándo no administrar Efluelda Tetra:
- Si la persona es alérgica a:
- los principios activos, o
- cualquiera de los demás componentes de esta vacuna (enumerados en el punto 6), o
- cualquier componente que pueda estar presente en cantidades muy pequeñas, como residuos de huevo (albumina de huevo de gallina, proteínas de gallina) y formaldehído.
Advertencias y precauciones
Antes de administrar Efluelda Tetra, debe hablar con su médico, farmacéutico o enfermera.
Antes de la vacunación, debe informar a su médico si el paciente tiene:
- una respuesta inmunitaria debilitada (causada por una deficiencia inmunitaria o por la ingesta de medicamentos que afectan el sistema inmunitario),
- hemorragias o tendencia a los moretones,
- un historial de síndrome de Guillain-Barré (GBS) (una debilidad muscular grave) después de recibir una vacuna contra la gripe,
- una enfermedad con fiebre alta o moderada o una enfermedad aguda. La vacunación debe retrasarse hasta la recuperación. El médico decidirá si se debe administrar la vacuna.
El desmayo puede ocurrir después, o incluso antes, de cualquier inyección. Por lo tanto, debe informar a su médico o enfermera si la persona ha experimentado desmayos con inyecciones anteriores.
Al igual que con cualquier vacuna, Efluelda Tetra puede no proporcionar una protección completa a todas las personas vacunadas.
Debe informar a su médico si el paciente tiene programada una prueba de sangre dentro de los pocos días después de la vacunación contra la gripe, debido a los resultados falsos positivos de las pruebas de sangre observados en algunos pacientes que habían sido vacunados anteriormente.
Niños
Esta vacuna no debe administrarse a niños. Se recomienda el uso de esta vacuna en personas adultas mayores de 60 años.
Efluelda Tetra y otros medicamentos
Debe decirle a su médico o farmacéutico todos los medicamentos o vacunas que el paciente esté tomando actualmente o haya tomado recientemente, así como cualquier medicamento o vacuna que planea tomar.
- En caso de que se administre Efluelda Tetra al mismo tiempo que otras vacunas, siempre deben administrarse en diferentes extremidades.
- Debe tener en cuenta que los efectos adversos pueden ser más graves cuando se administran vacunas simultáneamente.
- En caso de que se estén tomando medicamentos que reducen la inmunidad, como los corticosteroides, los medicamentos citotóxicos o la radioterapia, la respuesta inmunitaria a la vacunación puede ser debilitada.
Embarazo y lactancia
Efluelda Tetra está indicada solo para personas adultas mayores de 60 años.
Si la paciente está embarazada o en período de lactancia, sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de administrar esta vacuna. El médico o farmacéutico ayudará a decidir si la paciente debe recibir Efluelda Tetra.
Conducción de vehículos y uso de máquinas
Efluelda Tetra no tiene efecto o tiene un efecto insignificante en la capacidad de conducir vehículos y usar máquinas.
Efluelda Tetra contiene potasio y sodio
Esta vacuna contiene menos de 1 mmol de sodio (23 mg) por dosis, por lo que es esencialmente "libre de sodio".
3. Cómo administrar Efluelda Tetra
Los adultos mayores de 60 años reciben una dosis de 0,7 ml.
Cómo tomar Efluelda Tetra
El médico o la enfermera administrará la dosis recomendada de la vacuna como una inyección en el músculo o bajo la piel.
En caso de dudas adicionales sobre la administración de esta vacuna, debe consultar a su médico o farmacéutico.
4. Reacciones adversas posibles
Como cualquier medicamento, esta vacuna puede causar reacciones adversas, aunque no todos las experimentarán.
Reacciones alérgicas
Debe CONTACTAR INMEDIATAMENTEa su médico si el paciente presenta:
- Reacciones alérgicas graves:
- que pueden requerir atención médica, con presión arterial baja, dificultad para respirar, sibilancias o problemas para respirar, frecuencia cardíaca rápida y pulso débil, piel fría y húmeda, mareos que pueden llevar a desmayos (anafilaxia [incluyendo edema angioneurótico, es decir, edema más visible en la cabeza y el cuello, incluyendo la cara, los labios, la lengua, la garganta u otras partes del cuerpo, que puede causar dificultad para tragar o respirar]).
Debe contactar a su médico si el paciente presenta:
- Reacciones alérgicas como reacciones cutáneas que pueden afectar todo el cuerpo, incluyendo picazón, urticaria, erupciones. Estas reacciones adversas son raras (pueden afectar hasta 1 de cada 1000 personas).
Otras reacciones adversas
Las siguientes reacciones adversas se han informado en adultos mayores de 60 años.
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 personas):
- Reacciones en el lugar de la inyección: dolor, enrojecimiento (eritema)
- Malestar general (fatiga), dolor de cabeza, dolor muscular
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas):
- Reacciones en el lugar de la inyección: hinchazón, moretones, endurecimiento
- Fiebre, escalofríos
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 personas):
- Reacciones en el lugar de la inyección: picazón
- Fatiga, somnolencia, náuseas, vómitos, diarrea
- Tos, debilidad muscular, dispepsia, faringitis (dolor de la boca y la garganta)
Raras (pueden ocurrir en hasta 1 de cada 1000 personas):
- Falta de energía (debilidad), enrojecimiento, dolor articular, mareos de origen central, sudores nocturnos, erupciones, entumecimiento o sensación de hormigueo (parestesia), rinitis (rinitis alérgica), mareos (trastornos del equilibrio), exceso de sangre en la conjuntiva (enrojecimiento ocular)
- Dolor en las extremidades
Frecuencia desconocida: la frecuencia no puede determinarse a partir de los datos disponibles
- Disminución del número de ciertos tipos de células en la sangre llamadas plaquetas; su nivel bajo puede causar moretones o sangrado excesivo (trombocitopenia)
- Aumento de tamaño de los ganglios linfáticos en el cuello, la ingle o la región pélvica (linfadenopatía)
- Trastornos neurológicos que pueden causar rigidez en el cuello, desorientación, entumecimiento, dolor y debilidad en las extremidades, pérdida del equilibrio, pérdida de reflejos, parálisis de parte o todo el cuerpo (encefalitis y mielitis transversa, neuritis de Bell, neuropatía óptica), parálisis facial (parálisis de Bell), trastornos de la visión causados por disfunción de los nervios ópticos, convulsiones (incluyendo convulsiones febriles), desmayos poco después de la vacunación
- Enfermedad de los vasos sanguíneos que puede llevar a erupciones cutáneas y, en casos muy raros, a trastornos temporales de la función renal, dilatación de los vasos sanguíneos
- Dolor en el pecho
- Respiración sibilante, sensación de opresión en la garganta, dificultad para respirar (disnea)
La mayoría de las reacciones adversas ocurrieron generalmente dentro de los 3 días después de la vacunación y desaparecieron dentro de los 3 días. La gravedad de estas reacciones adversas fue leve a moderada.
Informar reacciones adversas
Si ocurren cualquier síntoma adverso, incluidos los síntomas adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Las reacciones adversas pueden informarse directamente al Departamento de Vigilancia de Reacciones Adversas de Productos Farmacéuticos de la Agencia de Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Las reacciones adversas también pueden informarse al titular de la autorización de comercialización.
Gracias a la notificación de reacciones adversas, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo conservar Efluelda Tetra
La vacuna debe conservarse en un lugar no visible y no accesible para los niños.
No debe administrarse esta vacuna después de la fecha de caducidad que figura en la etiqueta y el paquete después de "Fecha de caducidad (EXP)". La fecha de caducidad es el último día del mes indicado.
Conservar en refrigerador (2 °C - 8 °C). No congelar. Conservar la jeringa precargada en el paquete exterior para protegerla de la luz.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Efluelda Tetra?
- Los principios activos son: Virus de la gripe (inactivado, escindido) de las siguientes cepas*:
A/Victoria/4897/2022 (H1N1)pdm09-similar a la cepa (A/Victoria/4897/2022, IVR-238)
.............................................................................................................................. 60 microgramos de HA**
A/Croacia/10136RV/2023 (H3N2)-similar a la cepa (A/Croacia/10136RV/2023, X-425A)
.............................................................................................................................. 60 microgramos de HA**
B/Austria/1359417/2021-similar a la cepa (B/Michigan/01/2021, tipo salvaje)
……………………………………….. ................................................................ 60 microgramos de HA**
B/Phuket/3073/2013-similar a la cepa (B/Phuket/3073/2013, tipo salvaje)
….…………………………………….. .............................................................. 60 microgramos de HA**
en una dosis de 0,7 ml
*
producido en embriones de pollo
**
hemaglutinina
La vacuna es conforme con las recomendaciones de la Organización Mundial de la Salud (OMS) para el hemisferio norte y con las recomendaciones de la Unión Europea para la temporada 2025/2026.
Los demás componentes son: solución tampón que contiene cloruro de sodio, fosfato monosódico, fosfato disódico, agua para inyección y octoxinol-9.
Algunos componentes, como los residuos de huevo (albumina de huevo de gallina, proteínas de gallina) o el formaldehído, pueden estar presentes en cantidades muy pequeñas (véase el punto 2).
Cómo se presenta Efluelda Tetra y qué contiene el paquete?
Después de un suave agitado, la vacuna es un líquido incoloro y opalescente.
Efluelda Tetra es una suspensión para inyección en jeringa precargada de 0,7 ml, con aguja o sin aguja (en paquetes de 1, 5 o 10) o con aguja con protector de seguridad (en paquetes de 1 o 10).
No todos los tamaños de paquete pueden estar en circulación.
Título del responsable y del importador
Titular de la autorización de comercialización:
Sanofi Winthrop Industrie
82 Avenue Raspail
94250 Gentilly, Francia
Importador:
Sanofi Winthrop Industrie
Voie de l’Institut - Parc Industriel d'Incarville
B.P 101
27100 Val de Reuil, Francia
Este producto farmacéutico está autorizado para su comercialización en los países miembros del Área Económica Europea bajo los siguientes nombres:
Fecha de la última actualización de la hoja de instrucciones:julio 2025
Otras fuentes de información
La información actualmente aprobada sobre este producto está disponible escaneando con un teléfono inteligente el código QR proporcionado en la caja de cartón o en la siguiente dirección URL:
https://eflueldatetra-nh.info.sanofi/
Información destinada exclusivamente al personal médico especializado:
Al igual que con todas las vacunas administradas por inyección, debe asegurarse un tratamiento y supervisión médica adecuados en caso de una reacción anafiláctica después de la administración de la vacuna.
Antes de la administración, la vacuna debe alcanzar la temperatura ambiente.
Agitar antes de usar. Revisar visualmente antes de la administración.
No debe administrarse la vacuna en caso de que haya partículas sólidas en la suspensión.
No debe mezclarse la vacuna con otros productos farmacéuticos en la misma jeringa.
No debe inyectarse la vacuna directamente en los vasos sanguíneos.
Véase también el punto 3. Cómo administrar Efluelda Tetra
| Austria, Bélgica, Bulgaria, Chipre, República Checa, Alemania, Dinamarca, Grecia, Finlandia, Francia, Croacia, Hungría, Irlanda, Italia, Letonia, Países Bajos, Noruega, Polonia, Portugal, Rumania, Suecia, Eslovenia, Eslovaquia, España | Efluelda Tetra |
| Reino Unido (Irlanda del Norte) | Quadrivalent Influenza Vaccine (Split Virion, Inactivated) High Dose |
Preparación para la administración
Instrucciones para el uso de la aguja con protector de seguridad con la jeringa precargada con conector Luer Lock:
| Figura A: Aguja con protector de seguridad (en su envoltura) | Figura B: Componentes del protector de seguridad de la aguja (preparados para su uso) |
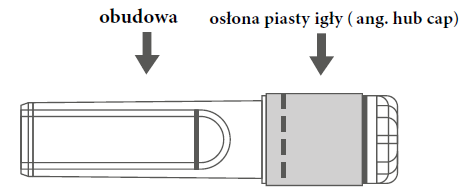 | 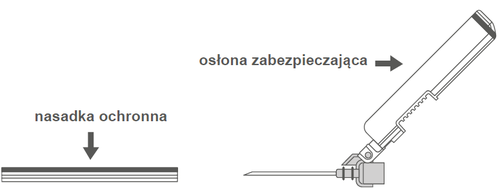 |
| Paso 1: Para fijar la aguja a la jeringa, debe retirar el protector de la punta de la aguja (tapón del hub), para exponer la punta de la aguja y enroscar suavemente la aguja en el conector Luer Lock de la jeringa, hasta que se sienta una ligera resistencia. | |
Paso 2: Retirar el envoltorio de la aguja. La aguja está protegida por un protector de seguridad y un conector de seguridad.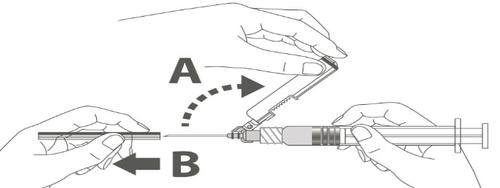 | |
| Paso 3: A: Alejar el protector de seguridad de la aguja en la dirección del cuerpo de la jeringa en el ángulo mostrado. B: Retirar el conector de seguridad. | |
| Paso 4: Después de la inyección, bloquear (activar) el protector de seguridad, utilizando una de las tres (3) técnicas de manejo de una sola mano: activación en una superficie plana, con el pulgar o con el dedo índice. Nota: La activación se confirma con un "click" audible y/o palpable. | 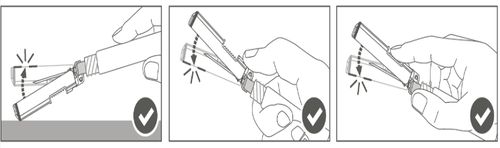 |
| Paso 5: Verificar visualmente el funcionamiento del protector de seguridad. El protector de seguridad debe estar completamente bloqueado (activado), como se muestra en la Figura C. La Figura D muestra que el protector de seguridad NO está completamente bloqueado (no está activado). | 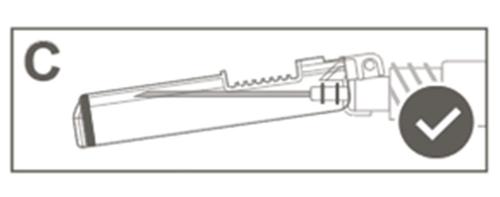 |
Advertencia: No debe intentar desbloquear (desactivar) el dispositivo de seguridad mediante el empuje de la aguja fuera del protector de seguridad.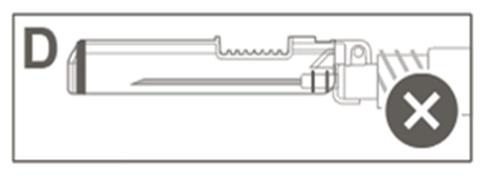 | |
Los residuos no utilizados del producto farmacéutico o sus desechos deben eliminarse de acuerdo con las regulaciones locales.>
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorSanofi Winthrop Industrie
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Efluelda TetraForma farmacéutica: Suspensión, 60 mcg HA/cepa, 1 dosis (0.5 ml)Principio activo: influenza, inactivated, split virus or surface antigenRequiere recetaForma farmacéutica: Suspensión, 1 dosis (0.5 ml)Principio activo: influenza, inactivated, split virus or surface antigenRequiere recetaForma farmacéutica: Suspensión, 1 dosis (0.5 ml)Principio activo: influenza, inactivated, split virus or surface antigenRequiere receta
Alternativas a Efluelda Tetra en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Efluelda Tetra en Spain
Alternativa a Efluelda Tetra en Ukraine
Médicos online para Efluelda Tetra
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Efluelda Tetra – sujeta a valoración médica y normativa local.














