
Smoflipid

Consulta con un médico sobre la receta médica de Smoflipid

Cómo usar Smoflipid
Hoja de instrucciones del paquete: información para el usuario
SMOFlipid, 200 mg/ml, emulsión para infusión
producto compuesto
Es importante leer atentamente el contenido de la hoja de instrucciones antes de administrar el medicamento, ya que contiene información importante para el paciente.
Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
En caso de dudas, debe consultar a un médico o enfermero.
Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermero. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es SMOFlipid y para qué se utiliza
- 2. Información importante antes de administrar SMOFlipid
- 3. Cómo administrar SMOFlipid
- 4. Posibles efectos adversos
- 5. Cómo conservar SMOFlipid
- 6. Contenido del paquete y otra información
1. Qué es SMOFlipid y para qué se utiliza
SMOFlipid contiene cuatro diferentes grasas (lípidos): aceite de soja, triglicéridos de cadena media, aceite de oliva y aceite de pescado rico en ácidos grasos omega-3. El líquido es una mezcla de grasas y agua, es decir, una "emulsión lipídica".
- El efecto del medicamento consiste en proporcionar energía y ácidos grasos al organismo.
- El medicamento se administra en la sangre mediante goteo o bomba de infusión. El personal médico especializado administra SMOFlipid a pacientes para los que otros métodos de nutrición son insuficientes, imposibles o contraindicados.
2. Información importante antes de administrar SMOFlipid
No administrar SMOFlipid si el paciente tiene:
- alergia al aceite de soja, triglicéridos de cadena media, aceite de oliva, aceite de pescado o cualquier otro componente de este medicamento (enumerados en el punto 6);
- alergia a productos que contienen pescado, huevo, soja o cacahuate;
- exceso de grasa en la sangre (hiperlipidemia grave);
- insuficiencia renal o hepática grave;
- trastornos graves de la coagulación de la sangre (trastornos de la coagulación);
- choque agudo;
- líquido en los pulmones (edema pulmonar), exceso de líquido en el organismo (sobrehidratación) o insuficiencia cardíaca (causada por exceso de líquido en el organismo);
- estado general inestable, por ejemplo, trauma grave, infarto de miocardio, accidente cerebrovascular, coágulo de sangre (embolia), acidosis metabólica (trastorno metabólico que causa un alto nivel de ácidos en la sangre) o diabetes descontrolada, infección grave (síndrome de respuesta inflamatoria sistémica - sepsis) y deshidratación.
Advertencias y precauciones
Antes de iniciar el tratamiento con SMOFlipid, debe informar a su médico o enfermero si el paciente tiene un nivel elevado de grasas en la sangre debido a una alteración del metabolismo de las grasas (trastorno del metabolismo lipídico).
Durante el tratamiento en recién nacidos y niños menores de 2 años, la solución (en la bolsa y el conjunto de administración) debe protegerse de la luz hasta el final de la administración. La exposición de SMOFlipid a la luz, especialmente después de la adición de oligoelementos y (o) vitaminas, puede provocar la formación de peróxidos y otros productos de degradación, lo que se puede limitar protegiendo de la luz.
Reacciones alérgicas
Si se produce una reacción alérgica durante el tratamiento con SMOFlipid, debe interrumpirse inmediatamente el tratamiento. Debe informar inmediatamente a su médico o enfermero si durante la infusión se producen los siguientes síntomas:
- fiebre (temperatura alta);
- escalofríos;
- erupción;
- dificultad para respirar.
Niños
Debe consultar a un médico o enfermero si el medicamento se administra a un recién nacido que tiene:
- un nivel elevado de una sustancia llamada "bilirrubina" en la sangre (hiperbilirrubinemia);
- hipertensión pulmonar (presión arterial elevada en los pulmones). Durante el tratamiento prolongado con SMOFlipid en recién nacidos, el médico ordenará análisis de sangre para controlar el estado de salud del paciente.
SMOFlipid y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que el paciente está tomando actualmente o ha tomado recientemente, así como sobre los medicamentos que el paciente planea tomar.
En particular, debe informar a su médico sobre la administración actual o reciente de medicamentos que reducen la coagulación de la sangre, como la warfarina y la heparina.
- SMOFlipid contiene vitamina K, que puede afectar a la warfarina. Sin embargo, la cantidad de vitamina K en SMOFlipid es tan pequeña que no deberían producirse problemas de este tipo.
- La heparina administrada en dosis clínicas puede aumentar temporalmente el nivel de ácidos grasos en la sangre, lo que se debe a la liberación de ácidos grasos por los tejidos en la sangre, seguida de una disminución de la eliminación de ácidos grasos de la sangre (disminución de la depuración de triglicéridos).
Embarazo y lactancia
No hay datos sobre el uso de SMOFlipid en mujeres embarazadas o en período de lactancia. Por lo tanto, SMOFlipid solo se administra a mujeres embarazadas o en período de lactancia si el médico lo considera necesario.
Si la paciente está embarazada o en período de lactancia, cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de tomar este medicamento.
Conducción de vehículos y uso de máquinas
No se aplica, ya que el medicamento se administra en el hospital.
SMOFlipid contiene sodio
Este medicamento contiene 5 mmol (115 mg) de sodio por 1000 ml. Debe tenerse en cuenta en pacientes que controlan su ingesta de sodio.
3. Cómo administrar SMOFlipid
SMOFlipid se administra en la sangre mediante goteo o bomba de infusión.
El médico determina la dosis individual en función de la edad, el peso y la capacidad del paciente para utilizar la grasa administrada.
Durante el tratamiento en recién nacidos y niños menores de 2 años, la solución (en la bolsa y el conjunto de administración) debe protegerse de la luz hasta el final de la administración (véase el punto 2).
La información detallada sobre la dosificación y la administración se encuentra al final de la hoja de instrucciones en el punto "Información destinada exclusivamente al personal médico especializado".
Administración de una dosis mayor de la recomendada de SMOFlipid
En caso de que el paciente reciba una dosis mayor de la recomendada de SMOFlipid, existe el riesgo de recibir una cantidad excesiva de grasa y problemas con el metabolismo de la grasa. Esto se conoce como "síndrome de sobredosis de grasa". Para obtener más información, véase el punto 4. Posibles efectos adversos.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Síndrome de sobredosis de grasa
El síndrome de sobredosis de grasa se produce cuando el organismo tiene problemas para metabolizar las grasas debido a la administración de una cantidad excesiva de SMOFlipid. También puede ocurrir debido a un cambio repentino en el estado de salud del paciente (por ejemplo, problemas renales o infección). Los síntomas posibles incluyen un nivel elevado de grasa en la sangre (hiperlipidemia) y en las células y tejidos, fiebre, trastornos en el funcionamiento de varios órganos y coma. La mayoría de estos síntomas desaparecen después de interrumpir la infusión.
Efectos adversos frecuentes(pueden ocurrir en hasta 1 de cada 10 pacientes):
- aumento leve de la temperatura corporal.
Efectos adversos poco frecuentes(pueden ocurrir en hasta 1 de cada 100 pacientes):
- escalofríos;
- pérdida de apetito;
- náuseas;
- vómitos.
Efectos adversos raros(pueden ocurrir en hasta 1 de cada 1000 pacientes):
- reacciones alérgicas (por ejemplo, fiebre alta, edema, hipotensión, erupción, enrojecimiento, dolor de cabeza);
- sensación de frío o calor;
- palidez;
- coloración azulada de la piel y las mucosas (debida a una baja concentración de oxígeno en la sangre);
- dolor en el cuello, la espalda, los huesos, el pecho y la región lumbar;
- presión arterial elevada o reducida;
- dificultad para respirar.
Efectos adversos muy raros(pueden ocurrir en hasta 1 de cada 10 000 pacientes):
- erección prolongada y dolorosa del pene.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico, farmacéutico o enfermero. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Calles de Alcalá, 56
28071 Madrid
tel.: +34 91 596 24 41
fax: +34 91 596 24 44
correo electrónico: [[email protected]](mailto:[email protected])
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar SMOFlipid
Conservar en un lugar fuera del alcance de los niños.
No conservar a una temperatura superior a 25°C. No congelar.
No administrar el medicamento después de la fecha de caducidad indicada en el paquete. La fecha de caducidad es el último día del mes indicado.
No administrar el medicamento SMOFlipid si el paquete está dañado. Administrar solo si la emulsión es blanca y homogénea. Para un solo uso. No utilizar nuevamente. No conservar.
Durante el tratamiento en recién nacidos y niños menores de 2 años, la solución (en la bolsa y el conjunto de administración) debe protegerse de la luz hasta el final de la administración (véase el punto 2).
6. Contenido del paquete y otra información
Qué contiene SMOFlipid
- Los principios activos del medicamento son: aceite de soja, triglicéridos de cadena media purificados 60 mg/ml, aceite de oliva purificado 50 mg/ml, aceite de pescado rico en ácidos grasos omega-3 30 mg/ml
- Los demás componentes son: lecitina de huevo de gallina, glicerol, oleato de sodio, alfa-tocoferol, hidróxido de sodio, agua para inyección.
Cómo se presenta SMOFlipid y qué contiene el paquete
SMOFlipid es una emulsión blanca y homogénea disponible en botellas de vidrio o bolsas de tipo Biofine.
Tamaños del paquete:
- botella de vidrio: 1 x 100 ml, 10 x 100 ml, 1 x 250 ml, 10 x 250 ml, 1 x 500 ml y 10 x 500 ml;
- bolsa de tipo Biofine: 1 x 100 ml, 10 x 100 ml, 20 x 100 ml, 1 x 250 ml, 10 x 250 ml, 1 x 500 ml, 12 x 500 ml, 1 x 1000 ml y 6 x 1000 ml.
No todos los tamaños del paquete pueden estar disponibles en el mercado.
Título de la autorización de comercialización y fabricante
Título de la autorización de comercialización
Fresenius Kabi AB
SE-75174 Uppsala
Suecia
Fabricante
Fresenius Kabi AB
Rapsgatan 7
SE-75174 Uppsala
Suecia
Fresenius Kabi Austria GmbH
Hafnerstrasse 36
A-8055 Graz
Austria
Para obtener más información, debe consultar a un representante del título de la autorización de comercialización:
Fresenius Kabi España, S.A.
Avda. de la Industria, 32
28108 Alcobendas (Madrid)
tel.: +34 91 661 30 00
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Austria, Bélgica, Finlandia, Francia, Alemania, Islandia, Irlanda, Italia, Países Bajos, Noruega, Eslovenia, Suecia, Reino Unido: SMOFlipid 200 mg/ml
Chipre, República Checa, Estonia, Grecia, Hungría, Letonia, Lituania, Luxemburgo, España: SMOFlipid 20 %
Dinamarca, Polonia, Portugal, Eslovaquia: SMOFlipid
Fecha de la última revisión de la hoja de instrucciones:06.03.2020
-----------------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Advertencias y precauciones
Durante la infusión, la concentración de triglicéridos en suero no debe exceder 3 mmol/l.
La sobredosis puede causar el síndrome de sobredosis de grasa. Debe tenerse especial cuidado en pacientes con un alto riesgo de hiperlipidemia (por ejemplo, pacientes que reciben grandes dosis de grasas, pacientes con sepsis grave y recién nacidos con un peso muy bajo al nacer).
La administración de ácidos grasos de cadena media puede causar acidosis metabólica. La administración simultánea de ácidos grasos de cadena larga contenidos en SMOFlipid reduce significativamente este riesgo. La administración simultánea de carbohidratos puede reducir aún más este riesgo. Por lo tanto, se recomienda administrar carbohidratos o aminoácidos con carbohidratos en la infusión. Debe realizarse regularmente análisis de laboratorio relacionados con el control de la nutrición parenteral. Esto incluye la determinación de la concentración de glucosa en sangre, pruebas de función hepática, equilibrio ácido-base, equilibrio de líquidos, hemograma completo y concentración de electrolitos.
Este medicamento contiene aceite de soja, aceite de pescado y fosfolípidos de huevo, que pueden causar reacciones alérgicas en raras ocasiones. Se han observado reacciones alérgicas cruzadas entre soja y cacahuate.
En caso de que se produzcan síntomas objetivos o subjetivos de reacción anafiláctica (como fiebre, escalofríos, erupción o dificultad para respirar), debe interrumpirse inmediatamente la infusión.
SMOFlipid debe administrarse con precaución en recién nacidos y prematuros con hiperbilirrubinemia y en casos de hipertensión pulmonar. En recién nacidos, especialmente prematuros, en casos de nutrición parenteral prolongada, debe controlarse el recuento de plaquetas, la actividad de enzimas hepáticos y la concentración de triglicéridos en suero.
SMOFlipid contiene hasta 5 mmol de sodio por 1000 ml. Debe tenerse en cuenta en pacientes que controlan su ingesta de sodio.
No debe añadirse ningún otro medicamento ni sustancia adicional a SMOFlipid, a menos que se haya comprobado su compatibilidad.
Vía de administración
Infusión en vena central o periférica.
Durante el tratamiento en recién nacidos y niños menores de 2 años, la solución (en la bolsa y el conjunto de administración) debe protegerse de la luz hasta el final de la administración.
Instrucciones de uso y precauciones especiales para la administración Precauciones especiales para la administración
Utilizar solo si la emulsión es homogénea.
La exposición a la luz de soluciones para nutrición parenteral, especialmente después de la adición de oligoelementos y (o) vitaminas, puede tener efectos no deseados en la respuesta clínica en recién nacidos, debido a la formación de peróxidos y otros productos de degradación. Durante el tratamiento en recién nacidos y niños menores de 2 años, SMOFlipid debe protegerse de la luz hasta el final de la administración.
Se aplica a la bolsa de tipo Biofine: antes de retirar la bolsa exterior de protección, debe comprobarse el indicador de estanqueidad del paquete (Oxalert). Si el indicador es negro, el oxígeno ha penetrado en la bolsa exterior y el medicamento debe desecharse.
Antes de la administración, debe comprobarse que la emulsión es homogénea. Debe asegurarse de que la emulsión preparada para la infusión no muestra signos de separación de fases.
Para un solo uso. No conservar. No utilizar nuevamente.
Después de mezclar con sustancias adicionales, SMOFlipid puede mezclarse con carbohidratos, aminoácidos y electrolitos en condiciones asépticas, con el fin de obtener una mezcla para nutrición parenteral total de "todo en uno".
Se puede obtener información del titular de la autorización de comercialización sobre la compatibilidad del medicamento con sustancias adicionales y sobre los períodos de conservación de las mezclas preparadas. Todas las sustancias adicionales deben mezclarse con el medicamento en condiciones asépticas. Todos los restos no utilizados del medicamento o sus desechos deben eliminarse de acuerdo con las regulaciones locales.
No conservar a una temperatura superior a 25°C. No congelar.
Conservación después de la mezcla
Si SMOFlipid se mezcla con sustancias adicionales, la mezcla resultante debe utilizarse inmediatamente. De lo contrario, el usuario es responsable del período de conservación durante el uso y de las condiciones de conservación antes de la administración. Este período no debe exceder normalmente 24 horas a 2-8°C, a menos que la adición se realice en condiciones asépticas controladas y validadas.
Precauciones especiales para la eliminación y preparación del medicamento para la administración
Durante el tratamiento en recién nacidos y niños menores de 2 años, proteger de la luz hasta el final de la administración. La exposición de SMOFlipid a la luz, especialmente después de la adición de oligoelementos y (o) vitaminas, puede provocar la formación de peróxidos y otros productos de degradación, lo que se puede limitar protegiendo de la luz.
SMOFlipid - Instrucciones para la preparación de la bolsa Biofine para su uso
- 1.
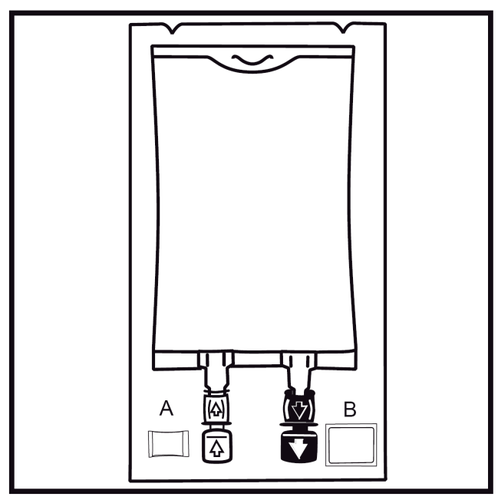
Debe comprobarse el indicador de estanqueidad del paquete (Oxalert) Aantes de retirar la bolsa exterior.
Si el indicador es negro, la bolsa exterior está dañada y el medicamento debe desecharse.
- 2.
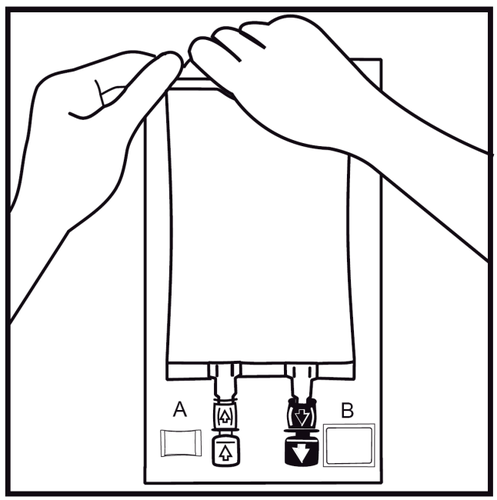
Retirar la bolsa exterior rompiendo el sellado en la parte superior y tirando a lo largo del paquete.
El indicador de estanqueidad del paquete (Oxalert) Ay el absorbente de oxígeno Bdeben retirarse.
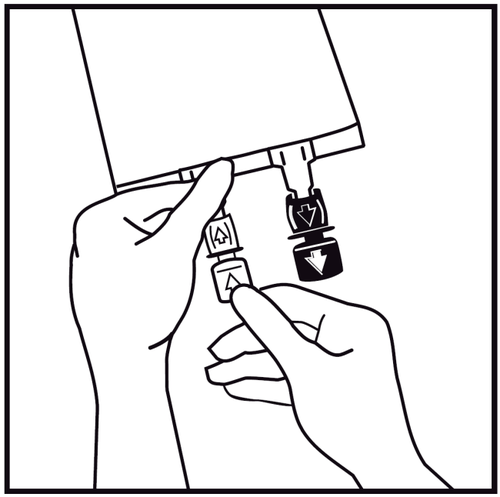
- 3.
En caso de que se vayan a agregar sustancias adicionales, debe quitarse el tapón de un solo uso marcado con una flecha que protege el puerto blanco para agregar estas sustancias.
Si no se agregan sustancias adicionales, debe pasar al punto 5.
- 4.
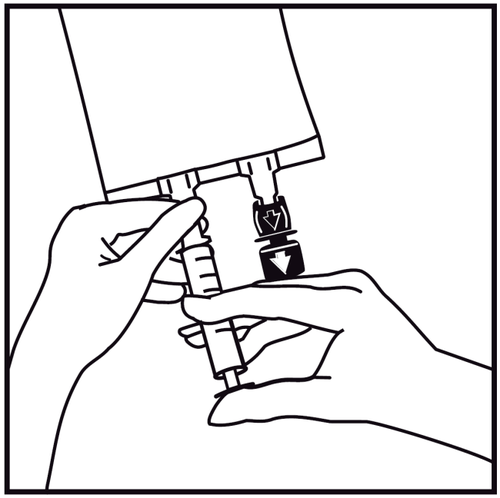
Introducir la aguja horizontalmente a través del centro del lugar de inyección y inyectar las sustancias adicionales (con una compatibilidad establecida). Debe utilizarse una jeringa con agujas de calibre 18 a 23 G y una longitud máxima de 40 mm.
- 5.
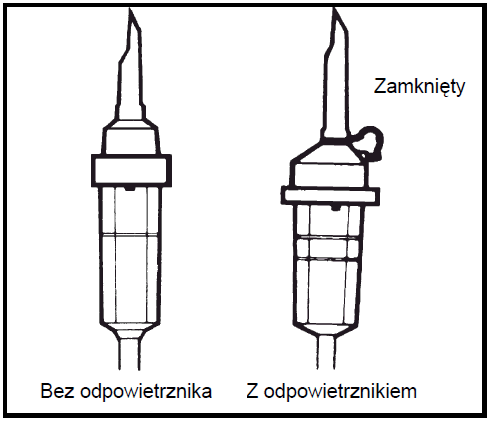
Debe utilizarse un conjunto de infusión sin aireador o cerrar la entrada de aire en caso de un conjunto con aireador. Seguir las instrucciones del conjunto de infusión. Debe utilizarse un conjunto de infusión con un diámetro especificado en la norma ISO 8536-4: 5,6 ± 0,1 mm.
- 6.
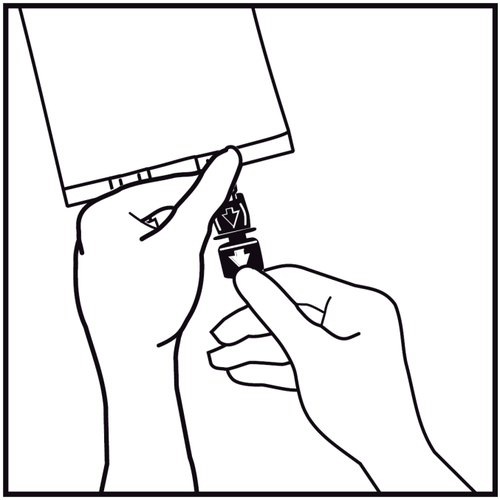
Quitar el tapón de un solo uso que protege el puerto de infusión azul.
- 7.
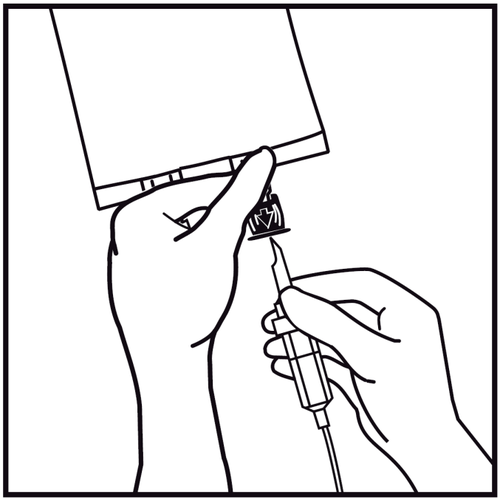
Sostener la base del puerto de infusión. Introducir la punta del conjunto de infusión en el puerto de infusión y girar suavemente hasta que esté completamente introducido.
- 8.
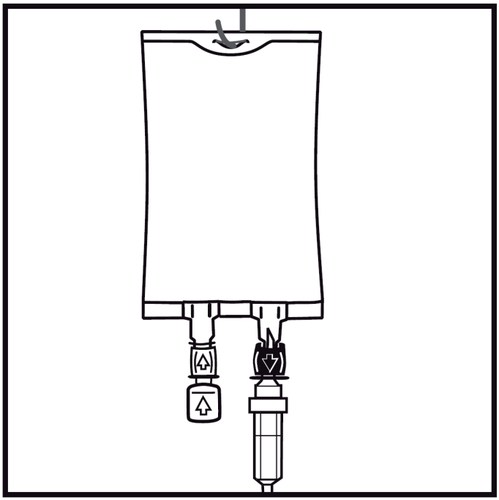
Colgar la bolsa utilizando el agujero preparado para este propósito e iniciar la infusión.
- País de registro
- Requiere recetaNo
- Fabricante
- ImportadorFresenius Kabi AB Fresenius Kabi Austria GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a SmoflipidForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere receta
Alternativas a Smoflipid en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Smoflipid en España
Médicos online para Smoflipid
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Smoflipid – sujeta a valoración médica y normativa local.














