
Prismasol
Consulta con un médico sobre la receta médica de Prismasol

Cómo usar Prismasol
Hoja de instrucciones del paquete: información para el usuario
Prismasol 4 mmol/l de potasio
Solución para hemodiálisis/hemofiltración
Cloruro de calcio dihidratado / cloruro de magnesio hexahidratado / glucosa monohidratada / solución de ácido láctico al 90% p/p / cloruro de sodio / cloruro de potasio / bicarbonato de sodio
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Si el paciente experimenta algún efecto adverso, incluidos los no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Prismasol y para qué se utiliza
- 2. Información importante antes de usar Prismasol
- 3. Cómo usar Prismasol
- 4. Posibles efectos adversos
- 5. Cómo conservar Prismasol
- 6. Contenido del paquete y otra información
1. Qué es Prismasol y para qué se utiliza
Prismasol contiene los principios activos: cloruro de calcio dihidratado, cloruro de magnesio hexahidratado, glucosa monohidratada, solución de ácido láctico al 90% p/p, cloruro de sodio, cloruro de potasio, bicarbonato de sodio.
Prismasol se utiliza para tratar la insuficiencia renal como solución para hemofiltración continua o hemodiafiltración (como solución de sustitución en caso de pérdida de líquido de la sangre que fluye a través del filtro) y hemodiálisis continua o hemodiafiltración (la sangre fluye por un lado de la membrana dializadora, mientras que la solución de diálisis fluye por el otro lado de la membrana).
Prismasol también se puede utilizar en caso de intoxicación por medicamentos que contienen sustancias sometidas a diálisis o filtración.
Prismasol 4 mmol/l de potasio está indicado en pacientes con niveles normales de potasio en la sangre.
2. Información importante antes de usar Prismasol
No debe usarse la solución Prismasol 4 mmol/l de potasio en caso de:
- alergia a alguno de los principios activos o a alguno de los demás componentes de este medicamento (enumerados en el punto 6),
- altos niveles de potasio en la sangre (hiperkaliemia),
- altos niveles de bicarbonato en la sangre (alcalosis metabólica).
No se puede descartar la presencia de antígeno de maíz en la solución Prismasol.
No se debe realizar hemofiltración/diálisis en los siguientes casos:
- insuficiencia renal con hipercatabolismo marcado (crecimiento anormal del catabolismo), si los síntomas de uremia (síntomas causados por altos niveles de urea en la sangre) no pueden ser aliviados mediante hemofiltración;
Prismasol 4 mmol/l de potasio / PL / PL Conector de luer de poliolefina con válvula
1/8
- presión arterial insuficiente en el acceso vascular;
- anticoagulación sistémica (disminución de la coagulación de la sangre) con riesgo de sangrado (hemorragia).
Precauciones y advertencias
Antes de iniciar el tratamiento con la solución Prismasol, debe consultar a su médico, farmacéutico o enfermera.
La solución debe ser utilizada exclusivamente por o bajo la supervisión de un médico calificado en el tratamiento de la insuficiencia renal mediante hemofiltración, hemodiafiltración y hemodiálisis continua.
Antes del tratamiento y durante su duración, se analizará la sangre del paciente, por ejemplo, se monitoreará el equilibrio ácido-base y los niveles de electrolitos (sales en la sangre), incluidos los líquidos administrados (infusiones intravenosas) y los producidos por el organismo (producción de orina), incluso aquellos no relacionados directamente con la terapia.
Es importante monitorear cuidadosamente los niveles de glucosa en la sangre, especialmente si el paciente padece diabetes.
Interacción con otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que el paciente está tomando actualmente o recientemente, así como sobre los medicamentos que el paciente planea tomar.
Los niveles en la sangre de otros medicamentos que se están tomando pueden disminuir durante el tratamiento. El médico decidirá si se requiere un cambio en los medicamentos que se están tomando.
En particular, debe informar a su médico sobre la ingesta de los siguientes medicamentos:
- glicósidos (utilizados en el tratamiento de ciertas enfermedades del corazón), ya que durante la hipocalemia (niveles bajos de potasio en la sangre) aumentan el riesgo de arritmias cardíacas (latido irregular o acelerado del corazón);
- vitamina D y medicamentos que contienen calcio, ya que pueden aumentar el riesgo de hipercalemia (niveles altos de calcio en la sangre);
- cualquier suplemento de bicarbonato de sodio (u otros buffers), ya que puede aumentar el riesgo de alcalosis metabólica (exceso de bicarbonato en la sangre);
- citrate, utilizado como agente anticoagulante (como aditivo protector en el equipo de diálisis), ya que puede disminuir los niveles de calcio en el suero.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o si sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
El médico decidirá sobre la administración de la solución Prismasol a mujeres embarazadas o en período de lactancia.
Conducción de vehículos y uso de máquinas
No se sabe si Prismasol afecta la capacidad de conducir vehículos o utilizar máquinas.
3. Cómo usar Prismasol
Este medicamento debe ser utilizado siempre según las indicaciones de su médico o farmacéutico. En caso de dudas, debe consultar a su médico o farmacéutico.
El volumen de la solución Prismasol utilizada depende del estado clínico del paciente y del balance de líquidos objetivo. Por lo tanto, la decisión sobre el volumen de la dosis la toma el médico responsable del tratamiento.
Vía de administración: para administración intravenosa y hemodiálisis.
Prismasol 4 mmol/l de potasio / PL / PL Conector de luer de poliolefina con válvula
2/8
Uso de una dosis mayor que la recomendada de Prismasol
El paciente tendrá un seguimiento cuidadoso del balance de líquidos, el equilibrio electrolítico y ácido-base.
En el improbable caso de una sobredosis, el médico tomará las medidas necesarias y ajustará la dosis del paciente.
La sobredosis puede provocar:
- sobrecarga de líquidos en la sangre del paciente,
- aumento de los niveles de bicarbonato en la sangre (alcalosis metabólica)
- y (o) disminución de los niveles de sales en la sangre (hipofosfatemia, hipocalemia). La sobredosis puede provocar consecuencias graves, como insuficiencia cardíaca congestiva, trastornos del equilibrio electrolítico o ácido-base.
Las instrucciones de uso se encuentran en la sección "Información destinada exclusivamente al personal médico especializado".
En caso de dudas adicionales relacionadas con el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede provocar efectos adversos, aunque no todos los pacientes los experimentarán.
Se han notificado los siguientes efectos adversos:
Frecuencia desconocida: la frecuencia no puede ser determinada a partir de los datos disponibles
- cambios en los niveles de sales en la sangre (trastornos del equilibrio electrolítico, como hipofosfatemia)
- aumento de los niveles de bicarbonato en el suero (alcalosis metabólica) o disminución de los niveles de bicarbonato en el suero (acidosis metabólica)
- volumen de agua anormalmente alto o bajo en el organismo (hipervolemia o hipovolemia)
- niveles de glucosa anormalmente altos en la sangre (hiperglucemia)
- náuseas
- vómitos
- calambres musculares
- hipotensión (presión arterial baja)
- hipercalcemia (niveles altos de calcio en la sangre).
Notificación de efectos adversos
Si se producen algún efecto adverso, incluidos los no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera.
Los efectos adversos
pueden ser notificados
directamente
a
Departamento de Vigilancia de Efectos Adversos de Medicamentos de la Agencia de Registro de Medicamentos,
Productos Sanitarios y Biocidas
Avenida de Jerusalén 181C
02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden ser notificados al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, se podrán recopilar más información sobre la seguridad del medicamento.
Prismasol 4 mmol/l de potasio / PL / PL Conector de luer de poliolefina con válvula
3/8
5. Cómo conservar Prismasol
El medicamento debe conservarse en un lugar no visible y no accesible para los niños.
No se debe conservar a una temperatura inferior a +4°C.
No se debe usar este medicamento después de la fecha de caducidad indicada en el etiquetado y el paquete. La fecha de caducidad indica el último día del mes indicado.
Se ha demostrado la estabilidad química y física de la solución lista para usar en un plazo de 24 horas a una temperatura de +22°C. Si no se utiliza de inmediato, el usuario es responsable del tiempo y las condiciones de conservación antes de su uso, y este tiempo no debe ser superior a 24 horas, incluyendo el tiempo de tratamiento.
No se deben tirar los medicamentos por el desagüe ni por los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Prismasol?
Principios activos:
Antes de la reconstitución/mezcla:
1000 ml de solución electrolítica (cámara pequeña A) contienen:
Cloruro de calcio dihidratado
5,145 g
Cloruro de magnesio hexahidratado
2,033 g
Glucosa
22,000 g
Ácido láctico (S)-
5,400 g
1000 ml de solución buffer (cámara grande B) contienen:
Cloruro de sodio
6,450 g
Bicarbonato de sodio
3,090 g
Cloruro de potasio
0,314 g
Después de la reconstitución/mezcla:
Las soluciones en las cámaras A (250 ml) y B (4750 ml) se mezclan para obtener una solución única lista para usar (5000 ml) que contiene:
mmol/l
mEq/l
Calcio
Ca
1,75
3,50
Magnesio
Mg
0,50
1,00
Sodio
Na
140,00
140,00
Cloruros
Cl
113,50
113,50
Lactato
3,00
3,00
Bicarbonato
HCO
32,00
32,00
Potasio
K
4,00
4,00
Glucosa
6,10
Osmolalidad teórica:
301 mOsm/l
Los demás componentes del medicamento son:dióxido de carbono (E 290), agua para inyección.
pH de la solución lista para usar: 7,0 a 8,5
Prismasol 4 mmol/l de potasio / PL / PL Conector de luer de poliolefina con válvula
4/8
Cómo se presenta Prismasol y qué contiene el paquete?
Prismasol se presenta en bolsas de dos cámaras que contienen en la cámara pequeña A la solución electrolítica y en la cámara grande B la solución buffer. La solución final lista para usar se obtiene después de romper la soldadura rompible y mezclar las dos soluciones. La solución final lista para usar es transparente y ligeramente amarilla. Cada bolsa (A+B) contiene 5000 ml de solución para hemofiltración y hemodiálisis. La bolsa se encuentra en un paquete exterior transparente.
En cada paquete hay dos bolsas y una hoja de instrucciones.
Titular de la autorización de comercialización y fabricante:
Vantive Belgium SRL
Boulevard d'Angleterre 2
1420 Braine-l'Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.,
Via Stelvio 94,
23035 Sondalo (SO),
Italia
o
Vantive Manufacturing Limited,
Moneen Road,
Castlebar
Condado de Mayo
F23 XR63
Irlanda
Este medicamento está autorizado para su comercialización en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Austria, Bélgica, Bulgaria, Chipre, República Checa, Dinamarca, Estonia, Finlandia, Francia, Alemania, Grecia, Hungría, Islandia, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Países Bajos, Noruega, Polonia, Portugal, Rumania, Eslovaquia, Eslovenia, España, Suecia, Reino Unido (Irlanda del Norte):
Prismasol 4.
Fecha de la última actualización de la hoja de instrucciones: septiembre de 2024
--------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Prismasol 4 mmol/l de potasio solución para hemodiálisis/hemofiltración
Precauciones:
Debe seguirse estrictamente las instrucciones de uso/manipulación del producto medicinal Prismasol.
Las soluciones de ambas cámaras deben ser mezcladas antes de su uso.
La aplicación de una solución contaminada para hemofiltración y hemodiálisis puede provocar sepsis, shock o un estado que amenaza la vida.
Para aumentar la comodidad del paciente, el producto medicinal Prismasol puede ser calentado a una temperatura de 37°C.
El calentamiento de la solución antes de su uso debe realizarse antes de la reconstitución y exclusivamente con una fuente de calor seca. No se deben calentar las soluciones en agua ni en un horno microondas. Antes de la administración, debe verificarse visualmente la solución para detectar la presencia de partículas sólidas y cambios de color, si la solución y el paquete lo permiten. No se debe administrar la solución si no es transparente o si la soldadura ha sido dañada.
Esta solución contiene potasio. No se debe administrar la solución a pacientes con hiperkalemia. Los niveles de potasio en suero deben ser monitorizados antes del procedimiento de hemofiltración y (o) hemodiálisis, así como durante su duración.
Si después del inicio del tratamiento se produce hiperkalemia, debe evaluarse las fuentes adicionales que afectan los niveles de potasio en la sangre. Si la solución se utiliza como solución de sustitución, debe reducirse la velocidad de infusión y confirmarse que se ha alcanzado el nivel de potasio deseado. Si la hiperkalemia no se resuelve, debe interrumpirse de inmediato la infusión.
Si la hiperkalemia se desarrolla en el caso de la aplicación de la solución como diálisis, puede ser necesario administrar diálisis sin potasio para aumentar la velocidad de eliminación del potasio.
Debe medirse regularmente los niveles de fosfatos inorgánicos. En caso de niveles bajos de fosfatos en la sangre, los fosfatos inorgánicos deben ser reemplazados. Se pueden agregar fosfatos a la solución en una cantidad de hasta 1,2 mmol/l. En caso de agregar fosfato a la bolsa, debe utilizarse fosfato de sodio.
Aunque no se han notificado casos de reacciones de hipersensibilidad graves al maíz en relación con el uso del producto medicinal Prismasol, las soluciones que contienen glucosa obtenida de almidón de maíz hidrolizado no deben ser utilizadas en pacientes con alergia conocida al maíz o productos de maíz.
Debe interrumpirse de inmediato la administración en caso de que se produzcan algún síntoma objetivo o subjetivo de una reacción de hipersensibilidad sospechada. Debe aplicarse la terapia adecuada según la indicación clínica.
Como la solución contiene glucosa y lactato, puede desarrollarse hiperglucemia, especialmente en pacientes con diabetes. Debe monitorearse regularmente los niveles de glucosa en la sangre. Si se desarrolla hiperglucemia, puede ser necesario administrar una solución de sustitución/diálisis sin glucosa. Pueden ser necesarias otras medidas para mantener el nivel deseado de glucemia.
El producto medicinal Prismasol contiene bicarbonato (bicarbonato) y lactato (precursores de bicarbonato), que pueden afectar el equilibrio ácido-base del paciente. Si durante el tratamiento con la solución se produce o empeora una alcalosis metabólica, puede ser necesario reducir la velocidad de administración o interrumpir la administración del producto medicinal.
Antes del inicio del tratamiento y durante su duración, debe monitorearse estrictamente los niveles de electrolitos y el equilibrio ácido-base.
En caso de desequilibrio de líquidos, debe monitorearse cuidadosamente el estado clínico del paciente y, si es necesario, corregir el balance de líquidos.
Vía de administración:
Para administración intravenosa y hemodiálisis. Prismasol utilizado como solución de sustitución se administra en el circuito antes del hemofiltro (prediálisis) o después del hemofiltro (postdiálisis).
Dosis:
El volumen y la velocidad de administración de la solución Prismasol utilizada dependen de los niveles de electrolitos en la sangre, el equilibrio ácido-base y el estado clínico general del paciente. Los parámetros de administración (dosis, velocidad de infusión, volumen total) del producto Prismasol deben ser determinados por el médico.
Prismasol 4 mmol/l de potasio / PL / PL Conector de luer de poliolefina con válvula
5/8
Las velocidades de flujo para la solución de sustitución en hemofiltración y hemodiafiltración son:
Adultos:
500 a 3000 ml/hora.
Las velocidades de flujo para la solución de diálisis (diálisis) en hemodiálisis continua y hemodiafiltración continua son:
Adultos:
500 a 2500 ml/hora.
Las velocidades de flujo más comúnmente utilizadas en adultos son de aproximadamente 2000 a 2500 ml/hora, lo que corresponde a un volumen diario de líquido de aproximadamente 48 a 60 litros.
Niños y adolescentes
El rango de velocidades de flujo de la solución de sustitución en hemofiltración y hemodiafiltración, así como la solución de diálisis (diálisis) en hemodiálisis continua y hemodiafiltración continua es:
niños (desde recién nacidos hasta adolescentes de hasta 18 años): 1000 a 2000 ml/hora/1,73 m2.
Las velocidades de flujo requeridas pueden ser de hasta 4000 ml/hora/1,73 m2, especialmente en niños más pequeños (≤10 kg). La velocidad de flujo absoluta (en ml/hora) en niños y adolescentes generalmente no debe exceder la velocidad de flujo máxima utilizada en adultos.
Instrucciones de uso:
Para obtener la solución lista para usar, la solución electrolítica (cámara pequeña A) se agrega a la solución buffer (cámara grande B) a través de la apertura de la soldadura rompible justo antes de su uso.
Debe utilizarse exclusivamente con el equipo adecuado para la terapia de reemplazo renal extracorpórea.
Durante el procedimiento y la administración del producto al paciente, debe utilizarse técnica aséptica.
Únicamente se debe utilizar si el paquete protector no está dañado, todas las soldaduras están intactas, la soldadura rompible no está dañada y la solución es transparente. Apretar firmemente la bolsa para verificar su estanqueidad. Si se detecta una fuga, la solución debe ser descartada de inmediato, ya que ya no se puede garantizar su esterilidad.
La cámara grande B está equipada con un puerto de inyección que, después de la reconstitución de la solución, permite agregar otros productos medicinales necesarios. El médico es responsable de determinar la compatibilidad de los productos medicinales adicionales con la solución Prismasol mediante la verificación de si hay algún cambio de color y (o) precipitación de un sedimento, complejos insolubles o cristales.
Antes de agregar el producto medicinal, debe verificarse si es soluble y estable en agua con un pH similar al de la solución Prismasol (el pH de la solución lista para usar es de 7,0 a 8,5). Los componentes adicionales pueden ser incompatibles. Debe consultarse la hoja de instrucciones del producto medicinal que se va a agregar.
Retirar el líquido del puerto de inyección, sostener la bolsa con la parte inferior hacia arriba, inyectar el producto medicinal a través del puerto y mezclar cuidadosamente. La solución debe administrarse de inmediato. Los componentes adicionales siempre deben agregarse y mezclarse antes de conectar la bolsa con la solución al circuito extracorpóreo.
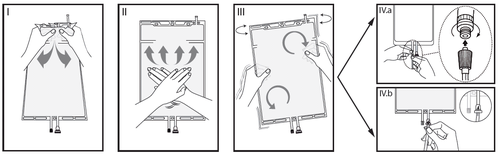
I
Retirar el paquete exterior justo antes de su uso y mezclar las soluciones de las dos cámaras diferentes. Sostener la cámara pequeña con ambas manos y apretar hasta que se cree una abertura en la soldadura rompible que separa las dos cámaras. (Ver figura I a continuación)
II
Apretar la cámara grande con ambas manos hasta que se abra completamente la soldadura rompible entre las dos cámaras. (Ver figura II a continuación)
III
Asegurarse de una mezcla completa mediante un agitado suave de la bolsa. La solución ahora está lista para su uso y la bolsa puede colgarse en un soporte. (Ver figura III a continuación)
IV
Cada uno de los dos puertos de acceso puede conectarse a una línea de diálisis o intercambio.
IV.aSi se utiliza un acceso de tipo luer, retirar el tapón girándolo y tirando, y luego conectar la punta macho de la línea de diálisis o intercambio al conector hembra de tipo luer en la bolsa, empujando y girando. Asegurarse de que la conexión esté completamente asentada y segura. Ahora la conexión está abierta. Verificar que el líquido fluya libremente. (Ver figura IV.a a continuación)
Cuando las líneas de diálisis o intercambio se desconectan del conector de tipo luer, la conexión se cerrará y el flujo de líquido se detendrá. El puerto de tipo luer es sin aguja y puede ser frotado con desinfectantes.
IV.bSi se utiliza un puerto de inyección, primero retirar el tapón rompiéndolo. El puerto de inyección puede ser frotado con desinfectantes. Luego, perforar la membrana de goma con una aguja. Verificar que el líquido fluya libremente. (Ver figura IV.b a continuación)
La solución debe usarse inmediatamente después de retirar el paquete exterior. Si no se utiliza de inmediato, la solución reconstituida debe usarse dentro de las 24 horas, incluyendo el tiempo de tratamiento.
La solución lista para usar está destinada exclusivamente a un uso único. Debe descartarse todo el líquido no utilizado inmediatamente después de su uso.
Todo el producto medicinal no utilizado o sus desechos deben eliminarse de acuerdo con las regulaciones locales.
Prismasol 4 mmol/l de potasio / PL / PL Conector de luer de poliolefina con válvula
6/8
1. Qué es Prismasol y para qué se utiliza?
Prismasol contiene los principios activos: cloruro de calcio dihidratado, cloruro de magnesio hexahidratado, glucosa monohidratada, solución de ácido láctico al 90% p/p, cloruro de sodio, cloruro de potasio, bicarbonato de sodio.
Prismasol se utiliza en el tratamiento de la insuficiencia renal como solución para la hemofiltración continua o la hemodiafiltración (como solución sustitutiva en la pérdida de líquidos de la sangre que pasa a través del filtro) y la hemodiálisis continua o la hemodiafiltración (la sangre pasa por un lado de la membrana de diálisis, mientras que la solución de diálisis pasa por el otro lado de la membrana).
Prismasol también puede utilizarse en caso de intoxicación por medicamentos que contienen sustancias sometidas a diálisis o filtración.
Prismasol 4 mmol/l potasio está indicado en pacientes con concentración normal de potasio en la sangre.
2. Información importante antes de aplicar el medicamento Prismasol
No debe aplicarse la solución Prismasol 4 mmol/l potasio en caso de:
- alergia a uno de los principios activos o a cualquiera de los demás componentes de este medicamento (enumerados en la sección 6),
- concentración alta de potasio en la sangre (hiperkaliemia),
- concentración alta de bicarbonato en la sangre (alcalosis metabólica).
No se puede descartar la presencia de antígeno de maíz en la solución Prismasol.
No debe realizarse la hemofiltración/diálisis en los siguientes casos:
- insuficiencia renal con hiperkatabolismo marcado (crecimiento anormal del catabolismo), si los síntomas de uremia (síntomas causados por una concentración alta de urea en la sangre) no pueden aliviarse mediante hemofiltración;
Prismasol 4 mmol/l Potasio / PL / PL Conector de válvula de luer de PVC 1/8
- presión arterial insuficiente en el acceso vascular;
- anticoagulación sistémica (disminución de la coagulación de la sangre) con riesgo de sangrado (hemorragia).
Precauciones y advertencias
Antes de iniciar el tratamiento con la solución Prismasol, debe consultar a un médico, farmacéutico o enfermera.
La solución debe utilizarse solo por o bajo la supervisión de un médico calificado en el tratamiento de la insuficiencia renal mediante hemofiltración, hemodiafiltración y hemodiálisis continua.
Antes y durante el tratamiento, se analizará la sangre del paciente, por ejemplo, se monitoreará el equilibrio ácido-base y la concentración de electrolitos (sales en la sangre), incluidos los líquidos administrados (infusiones intravenosas) y los producidos por el organismo (producción de orina), incluso si no están directamente relacionados con la terapia.
Debe monitorearse cuidadosamente la concentración de glucosa en la sangre, especialmente si el paciente padece diabetes.
Interacción del medicamento Prismasol con otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que el paciente está tomando actualmente o ha tomado recientemente, así como sobre los medicamentos que el paciente planea tomar.
La concentración en la sangre de otros medicamentos que se están tomando puede disminuir durante el tratamiento. El médico decidirá si se requiere un cambio en los medicamentos que se están tomando.
En particular, debe informar a su médico sobre la ingesta de los siguientes medicamentos:
- glicósidos (utilizados en el tratamiento de ciertas enfermedades del corazón), ya que durante la hipocaliemia (concentración baja de potasio en la sangre) aumentan el riesgo de trastornos del ritmo cardíaco (latido cardíaco irregular o acelerado);
- vitamina D y medicamentos que contienen calcio, ya que pueden aumentar el riesgo de hipercalemia (concentración alta de calcio en la sangre);
- cualquier suplemento de bicarbonato de sodio (o otros buffers), ya que puede aumentar el riesgo de alcalosis metabólica (exceso de bicarbonato en la sangre);
- citrate, utilizado como agente anticoagulante (como aditivo protector en el equipo de diálisis), ya que puede disminuir la concentración de calcio en el suero.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, sospecha que puede estar embarazada o planea tener un hijo, debe consultar a un médico o farmacéutico antes de aplicar este medicamento.
El médico decidirá sobre la administración de la solución Prismasol a mujeres embarazadas o en período de lactancia.
Conducción de vehículos y uso de máquinas
No se sabe si Prismasol afecta la capacidad de conducir vehículos o operar máquinas.
3. Cómo aplicar Prismasol
Este medicamento siempre debe aplicarse según las indicaciones de un médico o farmacéutico. En caso de duda, debe consultar a un médico o farmacéutico.
El volumen de la solución Prismasol utilizada depende del estado clínico del paciente y del balance de líquidos objetivo. Por lo tanto, la decisión sobre el volumen de la dosis la toma el médico responsable del tratamiento.
Vía de administración: para administración intravenosa y diálisis.
Prismasol 4 mmol/l Potasio / PL / PL Conector de válvula de luer de PVC 2/8
Uso de una dosis mayor que la recomendada de Prismasol
Al paciente se le monitoreará cuidadosamente el balance de líquidos, el equilibrio electrolítico y ácido-base.
En caso de sobredosis, el médico tomará las medidas necesarias y ajustará la dosis del paciente.
La sobredosis puede provocar:
- sobrecarga de líquidos en la sangre del paciente,
- aumento de la concentración de bicarbonato en la sangre (alcalosis metabólica)
- y (o) disminución de la concentración de sales en la sangre (hipofosfatemia, hipocaliemia). La sobredosis puede provocar consecuencias graves, como insuficiencia cardíaca congestiva, trastornos del equilibrio electrolítico o ácido-base.
Las instrucciones de uso se encuentran en la sección "Información destinada solo al personal médico especializado".
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a un médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede provocar efectos adversos, aunque no todos los pacientes los experimentarán.
Se han notificado los siguientes efectos adversos:
Frecuencia desconocida: la frecuencia no puede determinarse a partir de los datos disponibles
- cambios en la concentración de sales en la sangre (trastornos del equilibrio electrolítico, como hipofosfatemia)
- aumento de la concentración de bicarbonato en la sangre (alcalosis metabólica) o disminución de la concentración de bicarbonato en la sangre (acidosis metabólica)
- volumen de agua anormal en el organismo (hiper o hipovolemia)
- concentración de glucosa anormalmente alta en la sangre (hiperglucemia)
- náuseas
- vómitos
- calambres musculares
- hipotensión (presión arterial baja)
- hipercalcemia (concentración alta de calcio en la sangre).
Notificación de efectos adversos
Si se producen efectos adversos, incluidos todos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera.
Los efectos adversos
pueden
notificarse
directamente
a
Departamento de Vigilancia de Reacciones Adversas de Medicamentos
Agencia de Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas
Avenida de Jerozolimskie 181C
02-222 Varsovia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
Prismasol 4 mmol/l Potasio / PL / PL Conector de válvula de luer de PVC 3/8
5. Cómo conservar Prismasol
El medicamento debe conservarse en un lugar no visible y no accesible para los niños.
No conservar a una temperatura inferior a +4°C.
No debe utilizarse este medicamento después de la fecha de caducidad indicada en el etiquetado y el paquete. La fecha de caducidad es el último día del mes indicado.
Se ha demostrado la estabilidad química y física de la solución reconstituida durante 24 horas a una temperatura de +22°C. Si no se utiliza de inmediato, el tiempo y las condiciones de conservación antes de la administración son responsabilidad del usuario y no deben exceder las 24 horas, incluido el tiempo del procedimiento.
No debe desecharse el medicamento por el desagüe o los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Prismasol?
Principios activos:
Antes de la reconstitución/mezcla:
1000 ml de solución electrolítica (cámara pequeña A) contienen:
Cloruro de calcio dihidratado
5,145 g
Cloruro de magnesio hexahidratado
2,033 g
Glucosa
22,000 g
Ácido (S)-láctico
5,400 g
1000 ml de solución buffer (cámara grande B) contienen:
Cloruro de sodio
6,450 g
Bicarbonato de sodio
3,090 g
Cloruro de potasio
0,314 g
Después de la reconstitución/mezcla:
Las soluciones en las cámaras A (250 ml) y B (4750 ml) se mezclan para obtener una sola solución lista para usar (5000 ml) que contiene:
mmol/l
mEq/l
Calcio
Ca
1,75
3,50
Magnesio
Mg
0,50
1,00
Sodio
Na
140,00
140,00
Cloruros
Cl
113,50
113,50
Lactato
3,00
3,00
Bicarbonato
HCO
32,00
32,00
Potasio
K
4,00
4,00
Glucosa
6,10
Osmolalidad teórica:
301 mOsm/l
Los demás componentes del medicamento son:dióxido de carbono (E 290), agua para inyección.
pH de la solución lista para usar: 7,0 a 8,5
Prismasol 4 mmol/l Potasio / PL / PL Conector de válvula de luer de PVC 4/8
Cómo se presenta Prismasol y qué contiene el paquete?
Prismasol se presenta en bolsas de dos cámaras que contienen en la cámara pequeña A la solución electrolítica y en la cámara grande B la solución buffer. La solución final lista para usar se obtiene después de romper la tapa frangible y mezclar las dos soluciones. La solución lista para usar es transparente y ligeramente amarilla. Cada bolsa (A+B) contiene 5000 ml de solución para hemofiltración y diálisis. La bolsa se encuentra en un paquete exterior transparente.
Cada paquete contiene dos bolsas y una hoja de instrucciones.
Título del responsable y fabricante:
Vantive Belgium SRL
Boulevard d’Angleterre 2
1420 Braine-l’Alleud
Bélgica
Fabricante:
Bieffe Medital S.p.A.,
Via Stelvio 94,
23035 Sondalo (SO),
Italia
o
Vantive Manufacturing Limited,
Moneen Road,
Castlebar
Condado de Mayo
F23 XR63
Irlanda
Este medicamento está autorizado para su comercialización en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Austria, Bélgica, Bulgaria, Chipre, República Checa, Dinamarca, Estonia, Finlandia, Francia, Alemania, Grecia, Hungría, Islandia, Irlanda, Italia, Letonia, Lituania, Luxemburgo, Malta, Países Bajos, Noruega, Polonia, Portugal, Rumania, Eslovaquia, Eslovenia, España, Suecia, Reino Unido (Irlanda del Norte):
Prismasol 4.
Fecha de la última actualización de la hoja de instrucciones: septiembre 2024
-------------------------------------------------------------------------------------------------------------------------
Información destinada solo al personal médico especializado:
Prismasol 4 mmol/l potasio solución para hemodiálisis/hemofiltración
Precauciones:
Debe seguirse estrictamente las instrucciones de uso y manejo del producto medicinal Prismasol.
Las soluciones de ambas cámaras deben mezclarse antes de usar.
La aplicación de una solución contaminada para hemofiltración y diálisis puede provocar sepsis, shock o un estado que amenaza la vida.
Para aumentar la comodidad del paciente, el producto medicinal Prismasol puede calentarse a una temperatura de 37°C.
El calentamiento de la solución antes de su uso debe realizarse antes de la reconstitución y solo con una fuente de calor seca. No debe calentarse la solución en agua o en un horno microondas. Antes de la administración, debe verificarse visualmente la solución para detectar la presencia de partículas sólidas y cualquier cambio de color, siempre que la solución y el paquete lo permitan. No debe administrarse la solución si no es transparente o si la soldadura está dañada.
Esta solución contiene potasio. La solución no debe administrarse a pacientes con hiperkaliemia. La concentración de potasio en suero debe monitorearse antes del procedimiento de hemofiltración y (o) diálisis y durante su curso.
Si se produce hiperkaliemia después de iniciar el tratamiento, debe evaluarse las fuentes adicionales que afectan la concentración de potasio en la sangre. Si se utiliza la solución como solución sustitutiva, debe reducirse la velocidad de infusión y confirmarse que se ha alcanzado la concentración deseada de potasio. Si la hiperkaliemia no se resuelve, debe interrumpirse de inmediato la infusión.
Si se produce hiperkaliemia al utilizar la solución como dializado, puede ser necesario administrar un dializado sin potasio para aumentar la velocidad de eliminación de potasio.
Debe medirse regularmente la concentración de fosfatos inorgánicos. En caso de concentración baja de fosfatos en la sangre, los fosfatos inorgánicos deben reponerse. Puede agregarse fosfato a la solución en una cantidad de hasta 1,2 mmol/l. Cuando se agrega fosfato a la bolsa, debe utilizarse fosfato de sodio.
Aunque no se han notificado casos de reacciones graves de hipersensibilidad al maíz en relación con el producto medicinal Prismasol, las soluciones que contienen glucosa obtenida de almidón de maíz hidrolizado no deben administrarse a pacientes con alergia conocida al maíz o productos de maíz.
Debe interrumpirse de inmediato la administración en caso de aparición de cualquier síntoma objetivo o subjetivo de sospechada reacción de hipersensibilidad. Debe aplicarse el tratamiento terapéutico adecuado según la indicación clínica.
Dado que la solución contiene glucosa y lactato, puede producirse hiperglucemia, especialmente en pacientes con diabetes. Debe monitorearse regularmente la concentración de glucosa en la sangre. Si se produce hiperglucemia, puede ser necesario administrar una solución sustitutiva/dializado sin glucosa. Pueden ser necesarias otras medidas para mantener el valor deseado de glicemia.
El producto medicinal Prismasol contiene bicarbonato (bicarbonato) y lactato (precursores de bicarbonato), que pueden afectar el equilibrio ácido-base del paciente. Si durante el tratamiento con la solución se produce o empeora la alcalosis metabólica, puede ser necesario reducir la velocidad de administración o suspender la administración del producto medicinal.
Antes de iniciar el tratamiento y durante su curso, debe monitorearse estrictamente la concentración de electrolitos y el equilibrio ácido-base.
En caso de desequilibrio de líquidos, debe monitorearse cuidadosamente el estado clínico del paciente y, si es necesario, corregir el balance de líquidos.
Vía de administración:
Para administración intravenosa y diálisis. Prismasol utilizado como solución sustitutiva se administra en el circuito antes del hemofiltro (predilución) o después del hemofiltro (posdilución).
Dosis:
El volumen y la velocidad de administración de la solución Prismasol utilizada dependen de la concentración de electrolitos en la sangre, el equilibrio ácido-base y el estado clínico general del paciente. Los parámetros de administración (dosis, velocidad de infusión, volumen total) del producto Prismasol deben establecerse por el médico responsable del tratamiento.
Prismasol 4 mmol/l Potasio / PL / PL Conector de válvula de luer de PVC 6/8
Las velocidades de flujo para la solución sustitutiva en hemofiltración y hemodiafiltración son:
Adultos:
500 a 3000 ml/h.
Las velocidades de flujo para la solución de diálisis (dializado) en hemodiálisis continua y hemodiafiltración continua son:
Adultos:
500 a 2500 ml/h.
Las velocidades de flujo más comúnmente utilizadas en adultos son de aproximadamente 2000 a 2500 ml/h, lo que corresponde a un volumen diario de líquido de aproximadamente 48 a 60 l.
Niños y jóvenes
El rango de velocidad de flujo de la solución sustitutiva en hemofiltración y hemodiafiltración y la solución de diálisis (dializado) en hemodiálisis continua es:
niños (desde recién nacidos hasta jóvenes de hasta 18 años): 1000 a 2000 ml/h/1,73 m.
Las velocidades de flujo requeridas pueden alcanzar hasta 4000 ml/h/1,73 m, especialmente en niños más pequeños (≤10 kg). La velocidad de flujo absoluta (en ml/h) en niños y jóvenes generalmente no debe exceder la velocidad de flujo máxima utilizada en adultos.
Instrucciones de procedimiento:
Para obtener una solución lista para usar, la solución electrolítica (cámara pequeña A) se agrega a la solución buffer (cámara grande B) rompiendo la tapa frangible directamente antes de usarla.
Debe usarse exclusivamente con el equipo adecuado para el intercambio renal extracorpóreo.
Durante el procedimiento y la administración del producto al paciente, debe utilizarse la técnica aséptica.
Úsese solo cuando el paquete de protección no esté dañado, todas las soldaduras estén intactas, la tapa frangible no esté rota y la solución sea transparente. Apretar firmemente la bolsa para verificar su estanqueidad. Si se detecta una fuga, la solución debe desecharse inmediatamente, ya que ya no se puede garantizar su esterilidad.
La cámara grande B está equipada con un puerto de inyección que, después de la reconstitución de la solución, permite agregar otros productos medicinales necesarios. El médico es responsable de determinar la compatibilidad de los productos medicinales adicionales con la solución Prismasol verificando si no ha habido un cambio de color y (o) precipitación de sedimento, complejos insolubles o cristales.
Antes de agregar el producto medicinal, debe verificarse si es soluble y estable en agua con un pH similar al de la solución Prismasol (el pH de la solución lista para usar es de 7,0 a 8,5). Los componentes adicionales pueden ser incompatibles. Debe consultarse la instrucción para el uso del producto medicinal que se agrega.
Retirar el líquido del puerto de inyección, sostener la bolsa boca abajo, inyectar el producto medicinal a través del puerto y mezclar cuidadosamente. La solución debe administrarse de inmediato. Los componentes adicionales siempre deben agregarse y mezclarse antes de conectar la bolsa con la solución al circuito extracorpóreo.
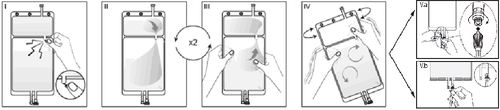
I
Retirar el paquete exterior justo antes de usar y desechar todos los materiales de embalaje restantes. Abrir la tapa rompiendo la tapa frangible ubicada entre las dos cámaras de la bolsa. La tapa frangible permanecerá en la bolsa. (Ver figura I a continuación)
II
Asegurarse de que todo el líquido de la cámara pequeña A se ha transferido a la cámara grande B. (Ver figura II a continuación)
III
Lavar dos vecesla cámara pequeña A, exprimiendo la solución mezclada de regreso a la cámara pequeña A y luego nuevamente a la cámara grande B. (Ver figura III a continuación)
IV
Cuando la cámara pequeña A esté vacía: agitar la cámara grande B para mezclar completamente su contenido. La solución ahora está lista para usar y la bolsa se puede colgar en un soporte. (Ver figura IV a continuación)
Prismasol 4 mmol/l Potasio / PL / PL Conector de válvula de luer de PVC 7/8
V
Cada uno de los dos puertos de acceso puede conectarse a una línea de diálisis o intercambio.
V.a
Si se utiliza el acceso de tipo luer, retirar la tapa girándola y tirando, y luego conectar la punta macho del bloqueo de luer de la línea de diálisis o intercambio a la punta hembra del receptor de luer en la bolsa, empujando y girando. Asegurarse de que la conexión esté completamente asentada y segura. Ahora la conexión está abierta. Verificar que el líquido fluya libremente. (Ver figura V.a a continuación)
Cuando las líneas de diálisis o intercambio se desconecten del conector de luer, la conexión se cerrará y el flujo de líquido se detendrá. El puerto de luer es sin aguja y puede limpiarse con desinfectantes.
V.bSi se utiliza el puerto de inyección, primero retirar la tapa rompiéndola. El puerto de inyección puede limpiarse con desinfectantes. Luego, perforar la barrera de goma con una aguja. Verificar que el líquido fluya libremente. (Ver figura V.b a continuación)
La solución debe usarse inmediatamente después de retirar el paquete exterior. Si no se usa de inmediato, la solución reconstituida debe usarse dentro de las 24 horas, incluido el tiempo del procedimiento después de agregar la solución electrolítica y la solución buffer.
La solución lista para usar está destinada solo para un uso único. Desechar toda la solución no utilizada inmediatamente después de usarla.
Todos los residuos del producto medicinal o desechos deben eliminarse de acuerdo con las regulaciones locales.
Prismasol 4 mmol/l Potasio / PL / PL Conector de válvula de luer de PVC 8/8
- País de registro
- Requiere recetaNo
- ImportadorBieffe Medital S.p.A. Vantive Manufacturing Limited
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a PrismasolForma farmacéutica: Solución, 9 mg/mlPrincipio activo: Sodio cloruroRequiere recetaForma farmacéutica: Solución, 100 mg/mlPrincipio activo: dextranoFabricante: Fresenius Kabi Italia S.r.L.No requiere recetaForma farmacéutica: Concentrado, -Principio activo: electrolytes in combination with other drugsFabricante: Fresenius Kabi Norge ASNo requiere receta
Alternativas a Prismasol en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Prismasol en Ucrania
Alternativa a Prismasol en España
Médicos online para Prismasol
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Prismasol – sujeta a valoración médica y normativa local.














