
Pediaven G25

Consulta con un médico sobre la receta médica de Pediaven G25

Cómo usar Pediaven G25
Hoja de instrucciones del paquete: información para el usuario
Pediaven G25, solución para infusión
producto compuesto
Es importante leer detenidamente el contenido de la hoja de instrucciones antes de administrar el medicamento, ya que contiene información importante para el paciente.
Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
En caso de dudas, debe consultar a un médico o enfermera.
Si el paciente experimenta algún efecto adverso, incluidos los no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Pediaven G25 y para qué se utiliza
- 2. Información importante antes de administrar Pediaven G25
- 3. Cómo administrar Pediaven G25
- 4. Posibles efectos adversos
- 5. Cómo conservar Pediaven G25
- 6. Contenido del paquete y otra información
1. Qué es Pediaven G25 y para qué se utiliza
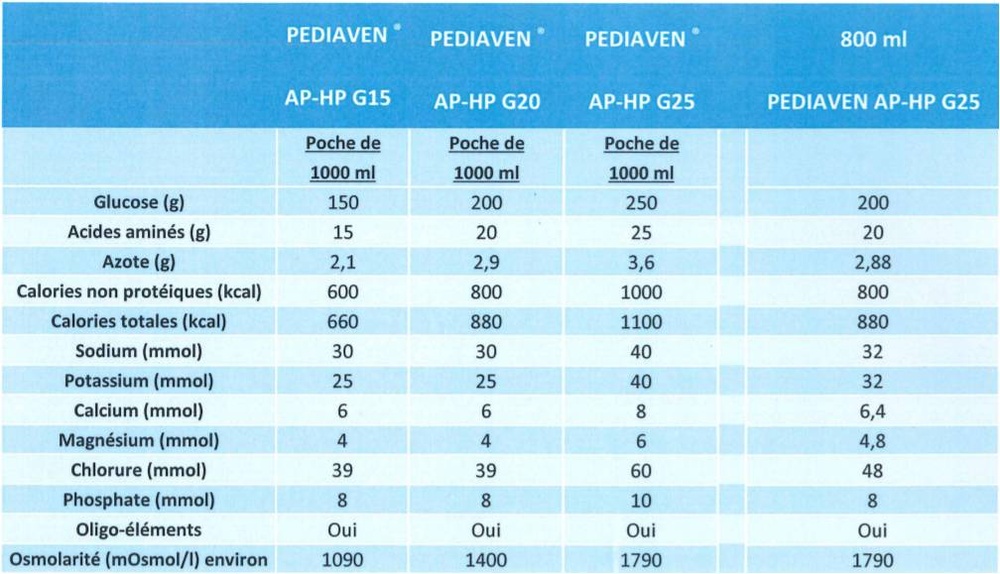
Pediaven G25 es una mezcla nutricional que contiene una solución de aminoácidos (componentes necesarios para la formación de proteínas) y glucosa (carbohidratos) con sales (electrolitos y oligoelementos) disponible en una bolsa de plástico que contiene dos cámaras, cada una con una capacidad de 500 ml.
Este medicamento es una solución destinada a la administración por goteo en una vena (infusión intravenosa).
Puede ser utilizado en lactantes, niños y adolescentes que no pueden recibir alimentación por vía oral.
2. Información importante antes de administrar Pediaven G25
Cuándo no administrar Pediaven G25:
si el paciente es alérgico a los principios activos o a alguno de los demás componentes de este medicamento (enumerados en el punto 6);
si el paciente tiene trastornos congénitos del metabolismo de los aminoácidos (si el organismo utiliza ciertos aminoácidos de manera incorrecta);
si el paciente tiene una enfermedad hepática o renal grave sin posibilidad de diálisis;
si el paciente tiene una hiperglucemia grave (nivel alto de azúcar en la sangre) y esta situación no está controlada;
si la concentración en sangre del paciente (en suero) de una de las sales (electrolitos) presentes en este medicamento es elevada;
si el paciente está en un estado general inestable, por ejemplo, después de un trauma grave o en caso de diabetes no controlada, acidosis metabólica (problema causado por una gran cantidad de sustancias ácidas en la sangre), infección grave (choque séptico), choque agudo o coma;
si el paciente está en un estado de desnutrición grave y existe el riesgo de desarrollar un "síndrome de choque alimentario".
Otras situaciones generales en las que no debe administrarse Pediaven G25:
si el paciente tiene líquido en los pulmones (edema pulmonar agudo);
si el paciente tiene demasiado líquido en el organismo (sobrecarga de líquidos);
si el paciente tiene insuficiencia cardíaca no tratada;
si el paciente tiene una cantidad insuficiente de líquido en el organismo (deshidratación hipotónica).
No debe administrarse Pediaven G25 si alguna de las situaciones anteriores se aplica al paciente.
En caso de dudas, debe consultar a un médico o enfermera antes de administrar Pediaven G25 al paciente.
Precauciones y advertencias
Información importante antes de iniciar el tratamiento con Pediaven G25:
Pediaven G25 debe administrarse con precaución cuando se requiere una restricción de la ingesta de líquidos, por ejemplo, en algunas enfermedades cardíacas, pulmonares o renales.
Debe informar a su médico si durante el tratamiento aparecen efectos adversos como escalofríos, sudoración, fiebre, erupciones cutáneas o problemas respiratorios. La infusión debe interrumpirse.
Durante la administración en niños menores de 2 años, la solución (en la bolsa y el conjunto de administración) debe protegerse de la luz hasta el final de la administración. La exposición de Pediaven G25 a la luz, especialmente después de agregar oligoelementos y (o) vitaminas, conduce a la formación de peróxidos y otros productos de degradación, lo que se puede limitar protegiendo de la luz.
Nivel elevado de magnesio en sangre
La cantidad de magnesio contenida en Pediaven G25 puede causar un aumento en la concentración de magnesio en sangre.
Esto puede manifestarse de la siguiente manera: debilidad, reflejos lentos, náuseas, vómitos, concentración baja de calcio en sangre, problemas respiratorios, presión arterial baja y ritmo cardíaco irregular. Estos síntomas pueden ser difíciles de detectar y, por lo tanto, el médico puede controlar los parámetros sanguíneos del paciente, especialmente si existe un riesgo de aumento de la concentración de magnesio en sangre, en particular trastornos de la función renal. Si la concentración de magnesio en sangre es elevada, la infusión se interrumpirá o reducirá.
El médico controlará el estado del paciente durante todo el período de tratamiento y puede cambiar la dosis administrada o recomendar la administración de medicamentos adicionales si es necesario (principalmente vitaminas, grasas o electrolitos).
Pediaven G25 y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que el paciente está tomando actualmente o recientemente, incluidos los medicamentos sin receta.
3. Cómo administrar Pediaven G25
Dosificación
Pediaven G25 debe administrarse siempre según las indicaciones del médico. El médico decidirá la dosis y la duración del tratamiento, dependiendo de la edad del paciente, el peso corporal, las necesidades metabólicas y energéticas, el estado clínico y la capacidad para metabolizar la alimentación oral y enteral (suministro de nutrientes a través de una sonda en el tracto gastrointestinal).
Si la alimentación se realiza exclusivamente por vía intravenosa (administración en una vena), el médico puede recomendar la administración simultánea de vitaminas y grasas. Si se han agregado vitaminas al medicamento, la bolsa debe protegerse de la luz.
Vía de administración
Pediaven G25 se administra exclusivamente por personal médico y solo por vía intravenosa, en una vena central (en una vena grande).
Durante la administración en niños menores de 2 años, la solución (en la bolsa y el conjunto de administración) debe protegerse de la luz hasta el final de la administración (véase el punto 2).
Administración de una dosis mayor que la recomendada de Pediaven G25
Pediaven G25 debe administrarse siempre según las indicaciones del médico. En caso de dudas sobre si el paciente ha recibido una dosis mayor que la recomendada de Pediaven G25, debe informar a su médico de inmediato.
Omisión de la administración de Pediaven G25
Pediaven G25 debe administrarse siempre según las indicaciones del médico. Debe informar a su médico de inmediato si el paciente no ha recibido la infusión de Pediaven G25. No debe administrarse una dosis doble para compensar la dosis omitida y no debe exceder la velocidad de infusión recomendada.
En caso de dudas adicionales sobre la administración de este medicamento, debe consultar a su médico.
4. Posibles efectos adversos
Como cualquier medicamento, Pediaven G25 puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe ponerse en contacto con su médico de inmediato, quien interrumpirá la infusión, si el paciente experimenta alguno de los siguientes síntomas:
señales o síntomas inusuales de reacción alérgica, como sudoración, fiebre, escalofríos, dolor de cabeza, erupciones cutáneas o problemas respiratorios.
Pueden ocurrir efectos adversos relacionados con la administración de nutrientes por vía intravenosa (alimentación parenteral), especialmente al inicio del tratamiento, que incluyen:
aumento de la concentración de azúcar en sangre (hiperglucemia);
trastornos gastrointestinales (náuseas, vómitos);
exceso de aminoácidos puede causar acidosis metabólica (trastornos del equilibrio de sustancias ácidas y básicas en el organismo). Puede ocurrir hiperazotemia (cantidad excesiva de compuestos nitrogenados en la sangre), especialmente si el paciente tiene problemas renales, hepáticos o respiratorios;
trastornos temporales de la función hepática;
reacciones alérgicas a ciertos aminoácidos.
Un uso inadecuado (sobredosis o infusión demasiado rápida) puede conducir a la aparición de síntomas de hiperglucemia e hiperolemia (aumento del volumen de sangre en las venas).
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos los no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Calle de Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 99
Fax: +34 91 596 24 90
Correo electrónico: [[email protected]](mailto:[email protected])
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, se pueden recopilar más datos sobre la seguridad del medicamento.
5. Cómo conservar Pediaven G25
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe administrarse después de la fecha de caducidad impresa en la etiqueta: VENC.
La fecha de caducidad es el último día del mes indicado.
Conservar a una temperatura inferior a 25°C. No congelar. Conservar en la bolsa exterior. Utilizar inmediatamente después de mezclar el contenido de las dos cámaras.
Durante la administración en niños menores de 2 años, la solución (en la bolsa y el conjunto de administración) debe protegerse de la luz hasta el final de la administración (véase el punto 2).
Plazo de validez del medicamento después de mezclar con otras sustancias
Después de mezclar el contenido de las dos cámaras, pueden agregarse otros componentes a través del puerto de administración de sustancias adicionales. El medicamento debe utilizarse inmediatamente después de agregar otros componentes.
No debe administrarse si el paquete está dañado o muestra signos de deterioro.
No debe desecharse por el desagüe o en contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Pediaven G25?
Los principios activos del medicamento son:
| Principios activos | Solución de aminoácidos 500 ml | Solución de glucosa 500 ml | Solución después de mezclar, lista para usar 1000 ml |
| alanina | 2,41 g | 2,41 g | |
| arginina | 1,57 g | 1,57 g | |
| ácido aspártico | 1,57 g | 1,57 g | |
| acetilcisteína (equivalente a cisteína) | 0,51 g (0,38 g) | 0,51 g (0,38 g) | |
| ácido glutámico | 2,72 g | 2,72 g | |
| glicina | 0,80 g | 0,80 g | |
| histidina | 0,80 g | 0,80 g | |
| isoleucina | 1,19 g | 1,19 g | |
| leucina | 2,68 g | 2,68 g | |
| lisina monohidratada (equivalente a lisina anhidra) | 2,4 g (2,14 g) | 2,4 g (2,14 g) | |
| metionina | 0,50 g | 0,50 g | |
| fenilalanina | 1,03 g | 1,03 g | |
| prolina | 2,14 g | 2,14 g | |
| serina | 1,45 g | 1,45 g | |
| taurina | 0,11 g | 0,11 g | |
| treonina | 1,38 g | 1,38 g | |
| triptófano | 0,54 g | 0,54 g | |
| tirosina | 0,19 g | 0,19 g | |
| valina | 1,38 g | 1,38 g | |
| fosfato dipotásico | 1,74 g | 1,74 g | |
| dióxido de selenio | 0,11 mg | 0,11 mg | |
| glucosa monohidratada (equivalente a glucosa anhidra) | 275,0 g (250,0 g) | 275,0 g (250,0 g) | |
| gluconato de calcio | 3,59 g | 3,59 g | |
| malato de magnesio dihidratado | 1,43 g | 1,43 g | |
| cloruro de sodio | 2,34 g | 2,34 g | |
| cloruro de potasio | 1,49 g | 1,49 g | |
| acetato de cinc dihidratado | 13,43 mg | 13,43 mg | |
| sulfato de cobre pentahidratado | 2,00 mg | 2,00 mg | |
| fluoruro de sodio | 2,21 mg | 2,21 mg | |
| cloruro de manganeso tetrahidratado | 0,72 mg | 0,72 mg | |
| yoduro de potasio | 0,13 mg | 0,13 mg | |
| cloruro de cromo hexahidratado | 0,21 mg | 0,21 mg |
| sulfato ferroso heptahidratado | 4,98 mg | 4,98 mg | |
| cloruro de cobalto hexahidratado | 1,21 mg | 1,21 mg | |
| molibdato de amonio tetrahidratado | 0,18 mg | 0,18 mg |
Los demás componentes (excipientes) son: ácido acético glacial (para ajustar el pH), ácido clorhídrico (para ajustar el pH), agua para inyección.
Osmolalidad de la solución: 1790 mOsmol/l
pH de la solución: 4,8 – 5,5
Valor nutricional en 1000 ml
glucosa
aminoácidos
nitrógeno total
energía total
energía no proteica
250 g
25 g
3,56 g
1100 kcal
1000 kcal
Cómo se presenta Pediaven G25 y qué contiene el paquete?
Este medicamento es una solución para infusión, transparente, incolora a ligeramente amarillenta, libre de partículas sólidas. Está disponible en una bolsa de dos cámaras (cada cámara contiene 500 ml de solución).
Tamaño del paquete: 4 bolsas × 1000 ml.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Fresenius Kabi España, S.A.
Calle de Albacete, 3
28027 Madrid
Fabricante
Fresenius Kabi Austria GmbH
Hafnerstrasse 36
8055 Graz
Austria
Para obtener información más detallada, debe consultar al titular de la autorización de comercialización:
Fresenius Kabi España, S.A.
Calle de Albacete, 3
28027 Madrid
Teléfono: +34 91 388 33 00
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Alemania
Pediaven G25
Austria
Pediaven G25%
Bélgica
Kidiamix G25%
Dinamarca
Pediaven G25
Eslovaquia
Pediaven G25
Eslovenia
Pediaven G25
España
Pediaven G25
Estados miembros de la Unión Europea
Pediaven G25
Francia
Kidiaven G25%
Grecia
Pediaven G25
Hungría
Pediaven G25
Irlanda
Pediaven G25
Italia
Kidiamix G25%
Letonia
Pediaven G25%
Lituania
Pediaven G25%
Luxemburgo
Pediaven G25
Países Bajos
Kidiamix G25%
Polonia
Pediaven G25
Portugal
Pediaven G25
Reino Unido
Pediaven G25
República Checa
Pediaven G25
Rumania
Pediaven G25
Suecia
Pediaven G25
Fecha de la última revisión de la hoja de instrucciones:21/01/2020
--------------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Precauciones y advertencias para la administración
Pediaven G25, solución para infusión, es una solución hipertónica.
Dado que el uso de una vena central para la infusión conlleva un riesgo de infección, es importante seguir estrictamente las normas de asepsia para evitar cualquier infección, especialmente durante la colocación del catéter.
Para evitar el riesgo asociado con la administración de la infusión a una velocidad mayor que la recomendada, es importante administrar la infusión a una velocidad regular y controlada.
Debe controlar la osmolalidad y la concentración de glucosa en suero, así como el equilibrio hidroelectrolítico, el equilibrio ácido-base y la función hepática.
En caso de aparición de cualquier signo o síntoma de reacción anafiláctica (especialmente fiebre, escalofríos, sudoración, erupciones cutáneas o dificultad para respirar), debe interrumpir la infusión de inmediato.
No debe administrarse Pediaven G25 en una vena periférica debido a su alta osmolalidad.
Durante la infusión, es necesaria la observación clínica y de laboratorio, especialmente al inicio de la misma. La observación debe intensificarse en los siguientes casos:
insuficiencia hepática grave,
insuficiencia renal grave,
acidosis metabólica (trastorno causado por una gran cantidad de sustancias ácidas en la sangre),
diabetes o intolerancia a la glucosa.
Extravasación
Al igual que con todos los medicamentos administrados por vía intravenosa, durante la infusión de este medicamento puede ocurrir extravasación (véase el punto 4. Posibles efectos adversos).
Debe verificar regularmente el lugar de colocación del catéter para detectar signos de extravasación.
En caso de extravasación, debe interrumpir la infusión de inmediato, dejando el catéter o la cánula en su lugar para permitir el tratamiento inmediato del paciente, y aspirar el líquido restante antes de retirar el catéter o la cánula.
El tratamiento después de la extravasación puede incluir tratamiento no farmacológico, farmacológico y (o) intervención quirúrgica. En caso de una gran extravasación, debe consultar a un cirujano.
No debe administrarse la infusión de nuevo en la misma vena central.
Vía de administración
Infusión intravenosa, en una vena central.
Para garantizar una nutrición parenteral completa, se recomienda la administración simultánea de vitaminas (la cantidad máxima que se puede agregar al medicamento, véase la ficha técnica del medicamento) y grasas (administración solo a través de un conector en Y, no directamente en la bolsa), a menos que esté contraindicado.
Pediaven G25 ya contiene oligoelementos. En algunos casos, dependiendo de las necesidades del paciente, pueden agregarse soluciones farmacéuticas o de nutrición parenteral al medicamento, pero solo después de verificar la compatibilidad de la mezcla preparada (véase el punto "Compatibilidad farmacéutica").
Velocidad de infusión
La dosis debe determinarse individualmente, dependiendo de la edad del paciente, el peso corporal, las necesidades metabólicas y energéticas, y el estado clínico del paciente.
El médico realizará una evaluación clínica y biológica regular del estado de nutrición y la situación metabólica del paciente, especialmente si la nutrición parenteral dura más de 14 días.
Recomendaciones generales para la dosis: la necesidad de glucosa en niños es de aproximadamente 10-15 g/kg de peso corporal/día con una velocidad de infusión de 1–1,2 g/kg de peso corporal/hora, y la necesidad de nitrógeno es de aproximadamente 200-300 mg/kg de peso corporal/día.
La velocidad de infusión no debe exceder:
en lactantes (1 mes de vida – 2 años): 6 ml/kg de peso corporal/hora (lo que equivale a 1,4 g de glucosa/kg de peso corporal/hora),
en niños (2–11 años): 5 ml/kg de peso corporal/hora (lo que equivale a 1,2 g de glucosa/kg de peso corporal/hora),
en adolescentes (11–18 años): 2 ml/kg de peso corporal/hora (lo que equivale a 0,5 g de glucosa/kg de peso corporal/hora).
Precauciones especiales para la preparación del medicamento para su administración
Antes de su uso, debe retirar la bolsa exterior y verificar que la bolsa interior esté intacta (sellada). No debe administrarse si el paquete está dañado.
Debe administrarse solo cuando las soluciones de aminoácidos y glucosa sean transparentes, incoloras a ligeramente amarillentas, y libres de partículas sólidas. El contenido de las dos cámaras debe mezclarse antes de su uso, y también antes de agregar cualquier otro componente a través del puerto designado para la administración de sustancias adicionales.
La exposición de las soluciones de nutrición parenteral a la luz, especialmente después de agregar oligoelementos y (o) vitaminas, puede conducir a la formación de peróxidos y otros productos de degradación. Durante la administración en niños menores de 2 años, Pediaven G25 debe protegerse de la luz hasta el final de la administración.
Mezcla de las dos cámaras antes de su uso
- 1. Retirar la bolsa exterior y colocar la bolsa en una superficie dura.
- 2. Enrollar suavemente la bolsa desde la parte superior (desde el lado del asa), presionando hasta que se rompa la soldadura vertical. Girar la bolsa varias veces, lo que debe garantizar una mezcla completa de los componentes de la mezcla.
Solo para uso único. El medicamento no utilizado debe eliminarse.
Debe seguir estrictamente las normas de asepsia para el manejo del medicamento y el catéter, así como para la perfusión.
Plazo de validez del medicamento después de mezclar
Se ha demostrado la estabilidad química y física de la bolsa de dos cámaras después de mezclar durante 24 horas a 25°C. Desde el punto de vista microbiológico, el medicamento debe utilizarse de inmediato. Si el medicamento no se utiliza de inmediato, el usuario es responsable del período de conservación durante el uso y de las condiciones de conservación antes de su administración.
Compatibilidad farmacéutica
Pueden agregarse a Pediaven G25 o administrarse a través de la misma línea de infusión solo soluciones farmacéuticas o de nutrición parenteral cuya compatibilidad haya sido establecida.
La información sobre el volumen de sustancias adicionales y su compatibilidad con Pediaven G25 se encuentra en la ficha técnica del medicamento, punto 6.6 Precauciones especiales para la eliminación y preparación del medicamento para su administración. Existe un riesgo de precipitación de sales de calcio.
Cualquier aditivo debe mezclarse con el medicamento en condiciones de asepsia.
Precauciones especiales para la eliminación y preparación del medicamento para su administración
Durante la administración en niños menores de 2 años, proteger de la luz hasta el final de la administración. La exposición de Pediaven G25 a la luz, especialmente después de agregar oligoelementos y (o) vitaminas, conduce a la formación de peróxidos y otros productos de degradación, lo que se puede limitar protegiendo de la luz.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorFresenius Kabi Austria GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Pediaven G25Forma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere receta
Alternativas a Pediaven G25 en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Pediaven G25 en Spain
Alternativa a Pediaven G25 en Ukraine
Médicos online para Pediaven G25
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Pediaven G25 – sujeta a valoración médica y normativa local.














