
Ondansetron Bluefisi

Consulta con un médico sobre la receta médica de Ondansetron Bluefisi

Cómo usar Ondansetron Bluefisi
Hoja de instrucciones del paquete: información para el usuario
Ondansetron Bluefish, 4 mg tabletas que se disuelven en la boca
Ondansetron Bluefish, 8 mg tabletas que se disuelven en la boca
Ondansetron
Es importante leer detenidamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Ondansetron Bluefish y para qué se utiliza
- 2. Información importante antes de tomar Ondansetron Bluefish
- 3. Cómo tomar Ondansetron Bluefish
- 4. Posibles efectos adversos
- 5. Cómo almacenar Ondansetron Bluefish
- 6. Contenido del paquete y otra información
1. Qué es Ondansetron Bluefish y para qué se utiliza
Ondansetron Bluefish se presenta en forma de tableta que se disuelve rápidamente en la boca. Ondansetron Bluefish contiene ondansetron, que pertenece a un grupo de medicamentos que previenen las náuseas y los vómitos, llamados medicamentos antieméticos.
- -para el tratamiento de las náuseas y los vómitos causados por la quimioterapia citotóxica en niños y adultos;
- -para la prevención de las náuseas y los vómitos en el período postoperatorio en niños y adultos;
- -para el tratamiento de las náuseas y los vómitos causados por la radioterapia en adultos.
Si el paciente tiene dudas sobre por qué se le ha recetado este medicamento, debe consultar a su médico.
2. Información importante antes de tomar Ondansetron Bluefish
Cuándo no tomar Ondansetron Bluefish
- si el paciente es alérgico a ondansetron o a cualquier otro componente de este medicamento (enumerados en el punto 6);
- si el paciente está tomando apomorfina (utilizada para tratar la enfermedad de Parkinson).
Precauciones y advertencias
Antes de empezar a tomar Ondansetron Bluefish, debe discutirlo con su médico, farmacéutico o enfermera
- si la paciente está embarazada o planea quedarse embarazada en un futuro próximo;
- si la paciente está amamantando;
- si el paciente tiene enfermedad hepática;
- si el paciente tiene intestinos bloqueados o si el paciente tiene estreñimiento severo;
- en niños menores de 2 años o con una superficie corporal total inferior a 0,6 m
Ondansetron Bluefish y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar, como fenitoína, carbamazepina, rifampicina, tramadol.
Embarazo y lactancia
No debe tomar Ondansetron Bluefish durante el primer trimestre del embarazo. Esto se debe a que Ondansetron Bluefish puede aumentar ligeramente el riesgo de fisura del paladar y/o labio leporino. Si la paciente está embarazada, sospecha que está embarazada o planea quedarse embarazada, debe consultar a su médico o farmacéutico antes de tomar Ondansetron Bluefish. Si la paciente es una mujer en edad reproductiva, se puede recomendar el uso de anticoncepción efectiva.
Conducción de vehículos y uso de máquinas
Ondansetron Bluefish no afecta la capacidad de conducir vehículos o operar máquinas.
Ondansetron Bluefish contiene aspartamo, glucosa, maltodextrina, sorbitol, dióxido de azufre
y sodio
Ondansetron Bluefish contiene aspartamo (E 951). El medicamento contiene 0,88 mg de aspartamo en cada tableta de 4 mg que se disuelve en la boca y 1,76 mg de aspartamo en cada tableta de 8 mg que se disuelve en la boca. El aspartamo es una fuente de fenilalanina. Puede ser perjudicial para los pacientes con fenilcetonuria. Esta es una enfermedad genética rara en la que la fenilalanina se acumula en el cuerpo debido a su eliminación anormal.
Ondansetron Bluefish contiene sorbitol (E 420). El medicamento contiene 8,4 mg de sorbitol en cada tableta de 4 mg que se disuelve en la boca y 16,9 mg de sorbitol en cada tableta de 8 mg que se disuelve en la boca.
Ondansetron Bluefish contiene glucosa y maltodextrina. Si se ha detectado previamente en el paciente intolerancia a algunos azúcares, el paciente debe consultar a su médico antes de tomar este medicamento. Puede afectar negativamente los dientes.
Ondansetron Bluefish contiene dióxido de azufre (E 220). El medicamento puede causar raramente reacciones graves de hipersensibilidad y espasmo bronquial.
Ondansetron Bluefish contiene sodio. El medicamento contiene menos de 1 mmol (23 mg) de sodio por tableta que se disuelve en la boca, es decir, el medicamento se considera "libre de sodio".
3. Cómo tomar Ondansetron Bluefish
Este medicamento debe tomarse siempre según las indicaciones de su médico. En caso de dudas, debe consultar a su médico o farmacéutico.
Después de iniciar el tratamiento:
El efecto de Ondansetron Bluefish debe comenzar dentro de 1 o 2 horas después de tomar la dosis.
Si el paciente experimenta náuseas dentro de una hora después de tomar la dosis de Ondansetron Bluefish, debe tomar nuevamente la misma dosis. Si las náuseas ocurren más de una hora después de tomar el medicamento, no debe tomar más tabletas de las recetadas en la hoja de instrucciones. Si las náuseas persisten, debe consultar a su médico.
Tratamiento y prevención de las náuseas y los vómitos causados por la quimioterapia o la radioterapia:
Adultos:
8 mg 1 a 2 horas antes de iniciar la quimioterapia o la radioterapia, y luego 8 mg cada 12 horas durante 5 días. El médico puede recomendar la administración de la primera dosis en forma de inyección.
Pacientes de edad avanzada:
La dosificación es la misma que para los adultos.
Uso en niños (a partir de 2 años) y adolescentes (menores de 18 años):
La dosis se determina individualmente y depende del tamaño o la superficie corporal del niño. No debe administrarse Ondansetron Bluefish a niños con una superficie corporal total inferior a 0,6 m
Niños mayores de 6 meses y adolescentes
- La dosis habitual es de hasta 4 mg dos veces al día
- El medicamento puede administrarse durante un máximo de 5 días
Tratamiento y prevención de las náuseas y los vómitos en el período postoperatorio:
Adultos, tratamiento y prevención:
16 mg 1 hora antes de la operación o alternativamente 8 mg 1 hora antes de la anestesia, y luego dos dosis adicionales de 8 mg cada 8 horas. El médico puede recomendar la administración de la primera dosis en forma de inyección.
Pacientes de edad avanzada, tratamiento y prevención:
La experiencia con ondansetron en pacientes de edad avanzada es limitada.
Ondansetron es bien tolerado por pacientes de más de 65 años que reciben quimioterapia (ver más arriba).
Pacientes con trastornos hepáticos leves o moderados:
La dosis diaria total no debe exceder los 8 mg.
Pacientes con metabolismo lento de sparteína y debrisoquina:
No se requiere ajuste de la dosis o la frecuencia de administración del medicamento.
La tableta (s) debe tomarse de la siguiente manera:
No debe sacar las tabletas de Ondansetron Bluefish del blister o perforar la cubierta hasta que sea el momento de tomar el medicamento.
Es importante no empujar la tableta fuera de su ranura para evitar que se parta (Fig. A).
En cada blister, las tabletas están separadas por una perforación. Debe arrancar la ranura con una tableta a lo largo de la perforación (Fig. 1). Retire con cuidado la cubierta protectora. La cubierta protectora debe arrancarse desde la esquina marcada con una flecha (Fig. 2 y 3).
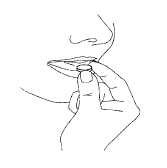
Saquee la tableta del paquete con las manos secas y colóquela en la lengua (Fig. 4). Cuando la tableta se disuelva, puede tragarla con un poco de agua.
Fig. A.
Fig. 1.
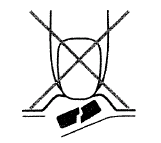
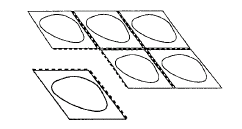
Fig. 2.
Fig. 3.
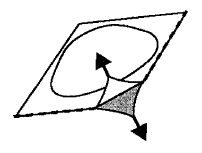
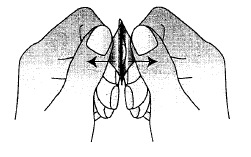
Fig. 4.
Uso de una dosis mayor de la recomendada de Ondansetron Bluefish
Si un adulto o un niño toma una dosis mayor de la recomendada de Ondansetron Bluefish, debe consultar inmediatamente a un médico o acudir a un hospital. Debe llevar el paquete del medicamento consigo.
Omisión de una dosis de Ondansetron Bluefish
No debe tomar una dosis doble para compensar una dosis omitida.
Si se omite una dosis de Ondansetron Bluefish y ocurren náuseas y vómitos, debe tomar Ondansetron Bluefish lo antes posible y tomar las siguientes dosis como de costumbre.
Si se omite una dosis de Ondansetron Bluefish y no ocurren náuseas y vómitos, debe tomar la siguiente dosis como se indica en la hoja de instrucciones.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Algunos pacientes pueden ser alérgicos a ciertos medicamentos. Si alguno de los siguientes efectos adversos ocurre poco después de tomar Ondansetron Bluefish, debe dejar de tomar el medicamento y consultar inmediatamente a un médico:
- Respiración sibilante repentina y dolor o sensación de opresión en el pecho
- Hinchazón de los párpados, cara, labios, boca o lengua
- Erupción cutánea - manchas rojas o urticaria (bultos en la piel) en cualquier parte del cuerpo
- Colapso
Otros posibles efectos adversos:
Muy frecuentes(pueden ocurrir en más de 1 de cada 10 personas)
- Dolor de cabeza.
Frecuentes(pueden ocurrir en hasta 1 de cada 10 personas)
- Estreñimiento.
- Sensación de calor o rubor.
Poco frecuentes(pueden ocurrir en hasta 1 de cada 100 personas)
- Trastornos del ritmo cardíaco, dolor en el pecho con o sin descenso del segmento ST, actividad cardíaca lenta.
- Aumento asintomático de la actividad de las enzimas hepáticas.
- Se han observado convulsiones, trastornos del movimiento, incluyendo síntomas extrapiramidales, como reacciones distónicas, ataques de mirada forzada con rotación de los globos oculares y trastornos del movimiento voluntario sin un efecto clínico significativo y duradero en el paciente.
- Hipercinesis.
- Hipotensión.
Raros(pueden ocurrir en hasta 1 de cada 1.000 personas)
- Reacciones de hipersensibilidad inmediata, a veces graves, incluyendo reacciones anafilácticas.
- Vertigo durante la administración intravenosa, que en la mayoría de los casos puede prevenirse o hacer que desaparezca alargando el tiempo de infusión.
- Trastornos visuales transitorios (por ejemplo, visión borrosa) durante la administración intravenosa.
Muy raros(pueden ocurrir en hasta 1 de cada 10.000 personas)
- -Pérdida transitoria de la visión, principalmente durante la administración intravenosa.
En la mayoría de los casos, la ceguera desapareció en un plazo de 20 minutos. La mayoría de los pacientes recibían quimioterapia, incluyendo cisplatino. En algunos casos de pérdida transitoria de la visión, se describió un origen corneal.
El aroma a fresa contiene dióxido de azufre (E220), que puede causar raramente reacciones graves de hipersensibilidad y espasmo bronquial.
Si alguno de los efectos adversos empeora o si ocurren efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico.
Notificación de efectos adversos
Si ocurren efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social, C/ Alcalá 56, 28071 Madrid, Teléfono: +34 91 596 34 00, Fax: +34 91 596 34 01, Correo electrónico: [[email protected]](mailto:[email protected]), Página web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo almacenar Ondansetron Bluefish
Debe almacenar el medicamento en un lugar donde no pueda ser visto ni alcanzado por los niños.
Debe almacenar el medicamento en su embalaje original para protegerlo de la luz.
Debe almacenar el medicamento a una temperatura inferior a 30°C.
No debe tomar este medicamento después de la fecha de caducidad que figura en el cartón o en la cubierta después de "Caducidad" o "EXP". La fecha de caducidad es el último día del mes indicado.
No debe tomar este medicamento si hay signos de deterioro, como decoloración o rotura de las tabletas.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Ondansetron Bluefish?
- -El principio activo de Ondansetron Bluefish es ondansetron. Cada tableta que se disuelve en la boca contiene 4 mg o 8 mg de ondansetron.
- -Los demás componentes son aspartamo (E 951), crospovidona tipo B, estearato de magnesio, celulosa microcristalina, Pharmaburst TM C1 (que contiene manitol (E 421), sorbitol (E 420), crospovidona (tipo A) y dióxido de silicio coloidal hidratado), aroma a fresa [(que contiene glucosa, maltodextrina de maíz, maltodextrina de patata, goma arábiga (2,3%) y dióxido de azufre (E 220)], fumarato de sodio.
Cómo se presenta Ondansetron Bluefish y qué contiene el paquete?
Tabletas que se disuelven en la boca.
Ondansetron Bluefish 4 mg y 8 mg se presenta en forma de tabletas blancas, planas y redondas con bordes biselados.
Ondansetron Bluefish está disponible en paquetes que contienen 6 x 1, 10 x 1, 14 x 1, 20 x 1, 30 x 1, 50 x 1, 60 x 1, 100 x 1 tabletas en blisters unitarios OPA/Aluminio/PVC/Aluminio.
No todas las tallas de paquete deben estar en circulación.
Título de la autorización de comercialización
Bluefish Pharmaceuticals AB
P.O. Box 49013
100 28 Estocolmo
Suecia
Fabricante
Bluefish Pharmaceuticals AB
Gävlegatan 22
113 30 Estocolmo
Suecia
Sofarimex Industria Química y Farmacéutica S.A.
Av. das Indústrias- Alto do Colaride
Cacem, 2735-213
Portugal
La hoja de instrucciones para pacientes con discapacidad visual estará disponible en otros formatos a petición.
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
| Estado miembro | Nombre del medicamento |
| Dinamarca | Ondansetron Bluefish 4 mg/ 8 mg smeltetabletter |
| Finlandia | Ondansetron Bluefish 4 mg/ 8 mg tabletti, suussa hajoava |
| Finlandia | Ondansetron Bluefish 4 mg/ 8 mg munsönderfallande tabletter |
| Eslovenia | Ondansetron Bluefish 4 mg/ 8 mg tablet, raztopine se v ustih |
| Eslovenia | Ondansetron Bluefish 4 mg/ 8 mg raztopina tabletka |
| Eslovenia | Ondansetron Bluefish 4 mg/ 8 mg tabletka, ki se raztopi v ustih |
| Países Bajos | Ondansetron Bluefish 4 mg/ 8 mg tabletten |
| Polonia | Ondansetron Bluefish |
| Portugal | Ondansetron Bluefish 4 mg/ 8 mg comprimidos bucodispersíveis |
| Reino Unido | Ondansetron 4 mg/ 8 mg orodispersible tablets |
| República Checa | Ondansetron Bluefish 4 mg/ 8 mg tablety, které se rozpadají v ústech |
| Rumania | Ondansetron Bluefish 4 mg/ 8 mg comprimate bucodispersabile |
| Suecia | Ondansetron Bluefish 4 mg/ 8 mg munsönderfallande tabletter |
Fecha de la última revisión de la hoja de instrucciones:24.11.2020
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBluefish Pharmaceuticals AB Sofarimex Industria Quimica e Farmaceutica S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Ondansetron BluefisiForma farmacéutica: Comprimidos, 8 mgPrincipio activo: OndansetronFabricante: Egis Pharmaceuticals PLCRequiere recetaForma farmacéutica: Solución, 2 mg/mlPrincipio activo: OndansetronRequiere recetaForma farmacéutica: Solución, 4 mgPrincipio activo: OndansetronRequiere receta
Alternativas a Ondansetron Bluefisi en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Ondansetron Bluefisi en Spain
Alternativa a Ondansetron Bluefisi en Ukraine
Médicos online para Ondansetron Bluefisi
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Ondansetron Bluefisi – sujeta a valoración médica y normativa local.














