

Olimel N7e

Consulta con un médico sobre la receta médica de Olimel N7e

Cómo usar Olimel N7e
Hoja de instrucciones para el paciente: Información para el usuario
OLIMEL N7E, emulsión para infusión
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de administrar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o enfermera.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es OLIMEL N7E, emulsión para infusión, y para qué se utiliza
- 2. Información importante antes de administrar OLIMEL N7E, emulsión para infusión
- 3. Cómo administrar OLIMEL N7E, emulsión para infusión
- 4. Efectos adversos posibles
- 5. Cómo conservar OLIMEL N7E, emulsión para infusión
- 6. Contenido del envase y otra información
1. Qué es OLIMEL N7E, emulsión para infusión, y para qué se utiliza
OLIMEL es una emulsión para infusión. El medicamento se suministra en una bolsa de tres cámaras.
La primera cámara contiene una solución de glucosa con calcio, la segunda es una emulsión grasosa, y la
tercera es una solución de aminoácidos con otros electrolitos.
OLIMEL se utiliza para la nutrición parenteral de adultos y niños mayores de 2 años, cuando la nutrición oral no es adecuada.
OLIMEL solo debe ser administrado bajo supervisión médica.
2. Información importante antes de administrar OLIMEL N7E, emulsión para infusión
Cuándo no administrar OLIMEL N7E, emulsión para infusión:
- en prematuros, recién nacidos y niños menores de 2 años;
- si el paciente es alérgico a los huevos, la soja, las proteínas de cacahuate, el maíz/productos que contienen maíz (véase también el punto "Advertencias y precauciones" a continuación) o a cualquier otro componente de este medicamento (enumerado en el punto 6);
- si la administración de algunos aminoácidos provoca una reacción anormal en el paciente;
- si el paciente tiene un nivel de grasas en la sangre muy alto;
- si el paciente tiene hiperglucemia (nivel de azúcar en la sangre demasiado alto);
- si el paciente tiene un nivel anormalmente alto de algún electrolito (sodio, potasio, magnesio, calcio y/o fósforo) en la sangre.
En cada caso, el médico decidirá si administrar el medicamento según factores como la edad, el peso corporal del paciente y su estado de salud, incluyendo los resultados de las pruebas realizadas.
Advertencias y precauciones
Antes de iniciar la administración de OLIMEL N7E, debe discutirlo con su médico o enfermera.
La administración demasiado rápida de soluciones para la nutrición parenteral total puede provocar daño o la muerte del paciente.
Si se producen signos o síntomas atípicos de una reacción alérgica (como sudoración, fiebre, escalofríos, dolor de cabeza, erupción cutánea o problemas para respirar), debe interrumpir inmediatamente la infusión. El medicamento contiene aceite de soja y fosfolípidos de huevo de gallina. Las proteínas de la soja y el huevo pueden provocar reacciones de hipersensibilidad. Se han observado reacciones alérgicas cruzadas entre las proteínas de la soja y los cacahuetes.
El medicamento OLIMEL contiene glucosa derivada del maíz, que puede provocar reacciones de hipersensibilidad si el paciente es alérgico al maíz o a productos que contienen maíz (véase el punto "Cuándo no administrar OLIMEL N7E, emulsión para infusión" anterior).
Dificultades para respirar también pueden ser un signo de que se han formado pequeñas partículas que bloquean los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares). Si se producen dificultades para respirar, debe informar a su médico o enfermera. Ellos decidirán sobre la acción adecuada.
Un antibiótico llamado ceftriakson no debe mezclarse ni administrarse al mismo tiempo que cualquier solución que contenga calcio (incluyendo el medicamento OLIMEL) mediante goteo intravenoso.
No se deben administrar estos medicamentos al mismo tiempo, incluso a través de diferentes líneas de infusión o sitios de infusión.
El medicamento OLIMEL y la ceftriakson pueden administrarse secuencialmente uno después del otro, siempre que las líneas de infusión estén insertadas en sitios diferentes o se cambien o se laven cuidadosamente con solución salina fisiológica entre las infusiones para evitar la formación de depósitos (formación de partículas de sales de calcio de ceftriakson).
Algunos medicamentos y enfermedades pueden aumentar el riesgo de infección o sepsis (presencia de bacterias en la sangre). Existe un riesgo especial de infección o sepsis después de la inserción de un catéter (catéter intravenoso) en una vena del paciente. El médico estará atento a cualquier signo de infección en el paciente. Los pacientes que requieren nutrición parenteral (administración de sustancias nutritivas a través de un catéter insertado en una vena) están, debido a su estado clínico, más expuestos a desarrollar infecciones. El uso de procedimientos que garantizan la esterilidad (ausencia de microorganismos) durante la inserción, el manejo del catéter y la preparación del medicamento para la nutrición (nutrición parenteral total) puede reducir el riesgo de infección.
Si el paciente está gravemente desnutrido, de modo que necesita recibir alimento a través de una vena, el médico debe comenzar el tratamiento lentamente. Al mismo tiempo, el médico debe estar atento al paciente para evitar cambios repentinos en el volumen de líquido, la concentración de vitaminas, electrolitos y minerales.
Antes de iniciar la infusión, debe corregir los trastornos del equilibrio hidroelectrolítico y los trastornos metabólicos del paciente. El médico monitoreará al paciente durante la terapia y puede cambiar la dosis o, si lo considera necesario, recetar suplementos nutritivos adicionales como vitaminas, electrolitos y oligoelementos.
En pacientes que reciben terapia de nutrición parenteral, se han informado trastornos de la función hepática, incluyendo dificultades para eliminar la bilis (colestasis), acumulación de grasa (esteatosis hepática), fibrosis, que probablemente conduzcan a insuficiencia hepática, así como inflamación de la vesícula biliar y cálculos biliares. Se considera que las causas de estos trastornos pueden ser variadas en diferentes pacientes. Si el paciente experimenta síntomas como náuseas, vómitos, dolor abdominal, ictericia o enrojecimiento de la piel o los ojos, debe comunicarse con el médico para permitir la identificación de las posibles causas y factores, así como las posibles medidas terapéuticas y preventivas.
El médico debe ser informado:
- sobre enfermedades graves del riñón. También debe informar al médico si el paciente está sometido a diálisis (riñón artificial) u otros métodos de limpieza de la sangre;
- sobre enfermedades graves del hígado;
- sobre trastornos de la coagulación de la sangre;
- sobre trastornos de la función de las glándulas suprarrenales (insuficiencia suprarrenal). Las glándulas suprarrenales son glándulas con forma triangular ubicadas en la parte superior de los riñones;
- sobre insuficiencia cardíaca;
- sobre enfermedad pulmonar;
- sobre acumulación de líquido en el organismo (sobrehidratación);
- sobre falta de líquido en el organismo (deshidratación);
- sobre diabetes no tratada;
- sobre infarto de miocardio o shock causado por insuficiencia cardíaca repentina;
- sobre acidosis metabólica grave (pH de la sangre demasiado ácido);
- sobre sepsis (infección generalizada);
- sobre coma.
Para verificar la eficacia y la seguridad del medicamento, durante la administración del medicamento, el paciente será sometido a pruebas clínicas y de laboratorio ordenadas por el médico. En caso de que el medicamento se administre durante varias semanas, la sangre del paciente será examinada regularmente.
La capacidad reducida del organismo para eliminar los lípidos contenidos en el medicamento administrado puede provocar el llamado síndrome de sobrecarga de grasas (véase el punto 4 - "Efectos adversos posibles").
En caso de que se produzca dolor, ardor o hinchazón en el lugar de la infusión o fugas del líquido administrado durante la infusión, debe informar a su médico o enfermera.
La administración del medicamento se interrumpirá inmediatamente y se reanudará en una vena diferente.
Si el nivel de glucosa en la sangre aumenta excesivamente, el médico debe ajustar la velocidad de administración del medicamento OLIMEL o administrar al paciente un medicamento que corrija el nivel de azúcar en la sangre (insulina).
OLIMEL puede administrarse a través de un catéter (catéter intravenoso) insertado en una vena grande en el tórax del paciente (vena central).
Niños y adolescentes
En caso de administración en niños menores de 18 años, debe tener especial cuidado para administrar la dosis adecuada del medicamento. Debido a la mayor sensibilidad de los niños al riesgo de infección, también deben tomarse medidas de precaución aumentadas. Siempre se requiere enriquecimiento con vitaminas y oligoelementos. Para los niños, deben utilizarse composiciones y cantidades pediátricas.
OLIMEL y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que esté tomando o haya tomado recientemente, así como sobre los medicamentos que planea tomar o administrar.
La administración simultánea de otros medicamentos generalmente no está contraindicada. Sin embargo, debe informar a su médico sobre todos los medicamentos que haya tomado recientemente, incluyendo los que se venden sin receta, para verificar su compatibilidad.
Debe informar a su médico sobre la administración o recepción de:
- insulina,
- heparina.
No se debe administrar el medicamento OLIMEL al mismo tiempo que la sangre a través del mismo conjunto de infusión.
OLIMEL contiene calcio. No debe administrarse junto con el antibiótico ceftriakson ni a través de la misma línea de infusión, ya que pueden formarse partículas. Si estos medicamentos se administran secuencialmente mediante el mismo dispositivo, debe lavarse cuidadosamente.
Debido al riesgo de formación de depósitos, el medicamento OLIMEL no debe administrarse a través de la misma línea de infusión ni agregarse a la ampicilina (antibiótico) o a la fosfenitoína (medicamento anticonvulsivo).
El aceite de oliva y el aceite de soja presentes en el medicamento OLIMEL contienen vitamina K. Generalmente, esto no afecta la acción de los medicamentos anticoagulantes, como la cumarina. Sin embargo, si el paciente está tomando medicamentos anticoagulantes, debe informar a su médico.
Las grasas contenidas en la emulsión pueden alterar los resultados de algunas pruebas de laboratorio, si la muestra de sangre para el análisis se toma antes de que se eliminen las grasas de la circulación sanguínea del paciente (se eliminan de la sangre después de 5 a 6 horas de la administración de las grasas).
OLIMEL contiene potasio. Debe tener especial cuidado en caso de pacientes que toman medicamentos diuréticos, inhibidores de la enzima convertidora de angiotensina (ECA), antagonistas del receptor de angiotensina II (medicamentos utilizados en la hipertensión) o medicamentos inmunosupresores. Estos medicamentos pueden causar un aumento en el nivel de potasio en la sangre.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de administrar este medicamento.
No hay experiencia adecuada sobre el uso del medicamento OLIMEL N7E en mujeres embarazadas o en período de lactancia. Si es necesario, se puede considerar la administración del medicamento OLIMEL N7E durante el embarazo y la lactancia. El medicamento OLIMEL N7E debe administrarse a mujeres embarazadas o en período de lactancia solo después de una cuidadosa consideración.
Conducción de vehículos y uso de máquinas
No aplica.
3. Cómo administrar OLIMEL N7E, emulsión para infusión
Dosis
OLIMEL debe administrarse solo a adultos y a niños mayores de 2 años.
El medicamento tiene la forma de una emulsión para infusión que se administra a través de un catéter (catéter intravenoso) en una vena grande en el tórax del paciente.
Antes de la administración, OLIMEL debe estar a temperatura ambiente.
OLIMEL está destinado solo para un uso único.
La infusión de una bolsa generalmente dura de 12 a 24 horas.
Dosis - Adultos
La velocidad de administración, de acuerdo con las necesidades y el estado clínico del paciente, será determinada por el médico.
El medicamento puede administrarse durante todo el tiempo que sea necesario, dependiendo del estado clínico del paciente.
Dosis - Niños mayores de 2 años y adolescentes
La dosis del medicamento y el período de administración son determinados por el médico. Esto depende de la edad, el peso corporal, la talla, el estado de salud y la capacidad del organismo para descomponer y utilizar los componentes del medicamento OLIMEL N7E.
Administración de una dosis mayor que la recomendada de OLIMEL N7E, emulsión para infusión
En caso de que se administre al paciente una dosis demasiado grande del medicamento o una infusión demasiado rápida, los aminoácidos contenidos pueden contribuir a aumentar la acidez de la sangre y provocar síntomas de hiperolemia (aumento del volumen de sangre circulante). Puede aumentar el nivel de glucosa en la sangre y en la orina, puede ocurrir la formación de un síndrome de hiperosmolaridad (viscosidad excesiva de la sangre), y las grasas contenidas en la emulsión pueden aumentar el nivel de triglicéridos en la sangre. La administración de una infusión demasiado rápida o de un volumen demasiado grande del medicamento OLIMEL puede provocar náuseas, vómitos, escalofríos, dolor de cabeza, sudoración excesiva (hiperhidrosis) y trastornos electrolíticos. En tal caso, debe interrumpir inmediatamente la infusión.
A veces, en casos graves, para ayudar a los riñones del paciente a eliminar el exceso de medicamento, el médico puede estar obligado a someter al paciente a una diálisis renal temporal.
Para evitar tales situaciones, el médico monitoreará regularmente el estado del paciente y verificará los parámetros de la sangre.
En caso de dudas sobre la administración del medicamento, debe consultar a su médico.
4. Efectos adversos posibles
Como cualquier medicamento, este medicamento puede provocar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de que se observen cambios en el estado de ánimo durante el tratamiento o después de su finalización, debe informar inmediatamente a su médico o enfermera.
Las pruebas realizadas por el médico durante la administración del medicamento al paciente deben minimizar el riesgo de efectos adversos.
Si se producen signos o síntomas atípicos de una reacción alérgica, como sudoración excesiva, fiebre, escalofríos, dolor de cabeza, erupción cutánea o problemas para respirar, debe interrumpir inmediatamente la infusión.
Durante la administración del medicamento OLIMEL, se han descrito los siguientes efectos adversos:
Frecuencia - Frecuente: pueden afectar hasta 1 de cada 10 personas
- taquicardia (frecuencia cardíaca acelerada);
- disminución del apetito;
- hipertrigliceridemia (aumento del nivel de grasas en la sangre);
- dolor abdominal;
- diarrea;
- náuseas;
- hipertensión (aumento de la presión arterial).
Frecuencia - Desconocida: la frecuencia no puede determinarse con los datos disponibles
- reacciones de hipersensibilidad, incluyendo sudoración, fiebre, escalofríos, dolor de cabeza, erupción cutánea (eritema, pápulas, pústulas, erupción generalizada), picazón, escalofríos, dificultades para respirar;
- fuga de la infusión al tejido circundante (extravasación) puede provocar dolor, irritación, hinchazón/edema, enrojecimiento (eritema)/calor, necrosis de la piel o ampollas/vesículas, inflamación, engrosamiento o contracción de la piel en el lugar de la infusión:
- vómitos.
Se han descrito los siguientes efectos adversos durante la administración de medicamentos similares para la nutrición parenteral:
Frecuencia - Muy rara: pueden afectar hasta 1 de cada 10,000 personas
- síndrome de sobrecarga de grasas (disminución de la capacidad para eliminar los lípidos) asociado con un empeoramiento repentino del estado de salud del paciente. Los síntomas del síndrome de sobrecarga de grasas mencionados a continuación generalmente desaparecen después de interrumpir la infusión de la emulsión grasosa. o Fiebre o Disminución del número de glóbulos rojos, que puede causar palidez de la piel y ser la causa de debilidad o dificultad para respirar (anemia) o Número bajo de glóbulos blancos, que puede aumentar el riesgo de infecciones (leucopenia) o Número bajo de plaquetas, que puede aumentar el riesgo de moretones y/o hemorragias (trombocitopenia) o Trastornos de la coagulación, que afectan la capacidad de coagulación de la sangre o Hiperlipidemia (aumento del nivel de grasas en la sangre) o Infiltrados grasos en el hígado (hepatomegalia) o Deterioro de la función hepática o Síntomas del sistema nervioso central (por ejemplo, coma).
Frecuencia - Desconocida: la frecuencia no puede determinarse con los datos disponibles
- reacciones alérgicas;
- resultado anormal de la prueba de sangre para la función hepática;
- problemas para eliminar la bilis (colestasis);
- aumento del tamaño del hígado (hepatomegalia);
- enfermedades hepáticas asociadas con la nutrición parenteral (véase "Advertencias y precauciones" en el punto 2);
- ictericia;
- disminución del número de plaquetas (trombocitopenia);
- aumento del nivel de azota en la sangre (azotemia);
- aumento de la actividad de las enzimas hepáticas;
- formación de pequeñas partículas que pueden bloquear los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares) y provocar un tromboembolismo pulmonar y dificultades para respirar (insuficiencia respiratoria).
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Farmacéuticos de la Agencia Reguladora de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas
Avenida de Jerusalén 181C
02-222 Varsovia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo conservar OLIMEL N7E, emulsión para infusión
El medicamento debe conservarse en un lugar no visible y no accesible para los niños.
No debe administrarse después de la fecha de caducidad indicada en el envase y el embalaje exterior (MM/AAAA). La fecha de caducidad es el último día del mes dado.
No congelar.
Conservar en el embalaje protector.
No debe desecharse por el desagüe ni en los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del envase y otra información
Qué contiene OLIMEL N7E, emulsión para infusión?
Los principios activos en cada una de las bolsas de la emulsión preparada son: 11,1% (lo que equivale a 11,1 g/100 ml) de solución de L-aminoácidos (alanina, arginina, glicina, histidina, isoleucina, leucina, lisina (en forma de lisina acetato), metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina, valina, ácido aspártico, ácido glutámico) con electrolitos (sodio, potasio, magnesio, fosfatos, acetatos, cloruros), 20% (lo que equivale a 20 g/100 ml) de emulsión grasosa (aceite de oliva purificado y aceite de soja purificado) y 35% (lo que equivale a 35 g/100 ml) de solución de glucosa (en forma de glucosa monohidratada) con calcio.
Los demás componentes del medicamento son:
| Cámara que contiene emulsión grasosa | Cámara que contiene solución de aminoácidos | Cámara que contiene solución de glucosa |
| Fosfolípidos purificados de huevo de gallina, glicerol, oleato de sodio, hidróxido de sodio (para ajustar el pH), agua para inyección | Ácido acético glacial (para ajustar el pH), agua para inyección | Ácido clorhídrico (para ajustar el pH), agua para inyección |
Cómo se presenta OLIMEL N7E, emulsión para infusión, y qué contiene el envase?
OLIMEL es una emulsión para infusión suministrada en una bolsa de tres cámaras. La primera cámara contiene la emulsión grasosa, la segunda cámara contiene la solución de aminoácidos con electrolitos, y la tercera cámara contiene la solución de glucosa con calcio. Las cámaras están separadas entre sí mediante soldaduras impermeables.
Antes de la administración, debe mezclar el contenido de las cámaras mediante el enrollado de la bolsa hacia sí mismo, comenzando desde la parte superior de la bolsa, hasta que se abran las soldaduras.
Aspecto después de la mezcla: emulsión homogénea de aspecto lechoso.
La bolsa de tres cámaras es una bolsa de plástico multilayer. La capa interna (en contacto) de la bolsa muestra compatibilidad con los componentes y aditivos permitidos.
Para evitar el contacto con el oxígeno del aire, la bolsa está empaquetada en un envase protector que protege contra la entrada de oxígeno con una bolsa de absorción de oxígeno.
Tamaños de los envases
Bolsa de 1000 ml: 1 caja de cartón con 6 bolsas
Bolsa de 1500 ml: 1 caja de cartón con 4 bolsas; 1 caja de cartón con 5 bolsas
Bolsa de 2000 ml: 1 caja de cartón con 4 bolsas; 1 caja de cartón con 5 bolsas
1 bolsa de 1000 ml, 1500 ml y 2000 ml.
No todos los tamaños de envase deben estar en circulación.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Baxter Polska Sp. z o. o.
Calle Kruczkowskiego 8
00-380 Varsovia
Fabricante
BAXTER S.A.
Boulevard René Branquart 80
7860 Lessines, Bélgica
Este producto farmacéutico está autorizado para su comercialización en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Francia, Portugal, Estonia, Polonia, Lituania, Bulgaria, Rumania, Letonia, República Checa, Bélgica, España, Eslovaquia, Países Bajos, Luxemburgo, Eslovenia, Italia, Grecia, Chipre: OLIMEL N7E
En algunos países, está registrado bajo un nombre comercial diferente, como se describe a continuación:
Austria: ZentroOLIMEL 4,4 % con electrolitos
Alemania: Olimel 4,4% E
Dinamarca, Islandia, Suecia, Noruega, Finlandia: Olimel N7E
Reino Unido, Irlanda, Malta: Triomel 7g/l nitrógeno 1140 kcal/l con electrolitos
Fecha de la última actualización de la hoja de instrucciones: abril de 2025
--------------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Grupo farmacoterapéutico: soluciones para la nutrición parenteral/mixtos
Código ATC: B05 BA10.
A. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
OLIMEL tiene la forma de una bolsa de tres cámaras.
Cada bolsa contiene una solución de glucosa con calcio, una emulsión grasosa y una solución de aminoácidos con otros electrolitos:
| Contenido por bolsa | |||
| 1000 ml | 1500 ml | 2000 ml | |
| 35% solución de glucosa (lo que equivale a 35 g/100 ml) | 400 ml | 600 ml | 800 ml |
| 11,1% solución de aminoácidos (lo que equivale a 11,1 g/100 ml) | 400 ml | 600 ml | 800 ml |
| 20% emulsión grasosa (lo que equivale a 20 g/100 ml) | 200 ml | 300 ml | 400 ml |
Composición de la emulsión preparada después de mezclar el contenido de las tres cámaras:
| Principios activos | 1000 ml | 1500 ml | 2000 ml |
| Aceite de oliva purificado + aceite de soja purificado | 40,00 g | 60,00 g | 80,00 g |
| Alanina | 6,41 g | 9,61 g | 12,82 g |
| Arginina | 4,34 g | 6,51 g | 8,68 g |
| Ácido aspártico | 1,28 g | 1,92 g | 2,56 g |
| Ácido glutámico | 2,21 g | 3,32 g | 4,42 g |
| Glicina | 3,07 g | 4,60 g | 6,14 g |
| Histidina | 2,64 g | 3,97 g | 5,29 g |
| Isoleucina | 2,21 g | 3,32 g | 4,42 g |
| Leucina | 3,07 g | 4,60 g | 6,14 g |
| Lisina (lo que equivale a lisina acetato) | 3,48 g (4,88 g) | 5,23 g (7,31 g) | 6,97 g (9,75 g) |
| Metionina | 2,21 g | 3,32 g | 4,42 g |
| Fenilalanina | 3,07 g | 4,60 g | 6,14 g |
| Prolina | 2,64 g | 3,97 g | 5,29 g |
| Serina | 1,75 g | 2,62 g | 3,50 g |
| Treonina | 2,21 g | 3,32 g | 4,42 g |
| Triptófano | 0,74 g | 1,10 g | 1,47 g |
| Tirosina | 0,11 g | 0,17 g | 0,22 g |
| Valina | 2,83 g | 4,25 g | 5,66 g |
| Octanato de sodio trihidratado | 1,50 g | 2,24 g | 2,99 g |
| Glicerofosfato de sodio hidratado | 3,67 g | 5,51 g | 7,34 g |
| Cloruro de potasio | 2,24 g | 3,35 g | 4,47 g |
| Cloruro de magnesio hexahidratado | 0,81 g | 1,22 g | 1,62 g |
| Cloruro de calcio dihidratado | 0,52 g | 0,77 g | 1,03 g |
| Glucosa (lo que equivale a glucosa monohidratada) | 140,00 g (154,00 g) | 210,00 g (231,00 g) | 280,00 g (308,00 g) |
Los componentes auxiliares son:
| Cámara que contiene emulsión grasosa | Cámara que contiene solución de aminoácidos con electrolitos | Cámara que contiene solución de glucosa con calcio |
| Fosfolípidos purificados de huevo de gallina, glicerol, oleato de sodio, hidróxido de sodio (para ajustar el pH), agua para inyección | Ácido acético glacial (para ajustar el pH), agua para inyección | Ácido clorhídrico (para ajustar el pH), agua para inyección |
Valores nutricionales de la emulsión preparada, según el tamaño de las bolsas:
| 1000 ml | 1500 ml | 2000 ml | |
| Grasas | 40 g | 60 g | 80 g |
| Aminoácidos | 44,3 g | 66,4 g | 88,6 g |
| Azota | 7,0 g | 10,5 g | 14,0 g |
| Glucosa | 140,0 g | 210,0 g | 280,0 g |
| Valor energético: Valor energético total aproximado Valor energético no proteico Valor energético de la glucosa Valor energético de las grasas Relación: valor energético no proteico/azota Relación: valor energético de la glucosa/grasas Grasas/valor energético total | 1140 kcal 960 kcal 560 kcal 400 kcal 137 kcal/g 58/42 35% | 1710 kcal 1440 kcal 840 kcal 600 kcal 137 kcal/g 58/42 35% | 2270 kcal 1920 kcal 1120 kcal 800 kcal 137 kcal/g 58/42 35% |
| Electrolitos: Sodio Potasio Magnesio Calcio Fosfatos Octanato Cloruros | 35,0 mmol 30,0 mmol 4,0 mmol 3,5 mmol 15,0 mmol 45 mmol 45 mmol | 52,5 mmol 45,0 mmol 6,0 mmol 5,3 mmol 22,5 mmol 67 mmol 68 mmol | 70,0 mmol 60,0 mmol 8,0 mmol 7,0 mmol 30,0 mmol 89 mmol 90 mmol |
| pH | 6,4 | 6,4 | 6,4 |
| Osmolalidad | 1360 mOsm/l | 1360 mOsm/l | 1360 mOsm/l |
B. DOSIS Y MODO DE ADMINISTRACIÓN
Dosis
OLIMEL no se recomienda para su uso en niños menores de 2 años, debido a su composición y volumen inadecuados (véase los puntos 4.4; 5.1 y 5.2 del prospecto).
No debe exceder la dosis diaria máxima recomendada. Debido a la composición constante de la bolsa de múltiples cámaras, puede que no sea posible satisfacer todas las necesidades nutricionales del paciente al mismo tiempo. Pueden surgir situaciones clínicas en las que los pacientes necesitan diferentes cantidades de nutrientes que las contenidas en la bolsa de composición constante. En tal caso, cualquier cambio en el volumen (dosis) debe tener en cuenta el efecto que tendrá en la dosificación de todos los demás nutrientes del medicamento OLIMEL.
Adultos
La dosis depende del gasto energético del paciente, del estado clínico, del peso corporal y de la capacidad del organismo para metabolizar los componentes del medicamento OLIMEL, así como de los nutrientes energéticos o proteicos administrados adicionalmente por vía oral/enteral; por lo tanto, debe elegirse el tamaño de la bolsa adecuadamente.
El requerimiento diario promedio es:
- 0,16 a 0,35 g de nitrógeno/kg de peso corporal (1-2 g de aminoácidos/kg), dependiendo del estado de nutrición del paciente y del grado de catabolismo,
- 20 a 40 kcal/kg,
- 20 a 40 ml de líquido/kg o 1 a 1,5 ml por kcal consumida.
Para el medicamento OLIMEL, la dosis diaria máxima se ha establecido según la ingesta de calorías totales, 40 kcal/kg en un volumen de 35 ml/kg, lo que equivale a 1,5 g de aminoácidos/kg, 4,9 g de glucosa/kg, 1,4 g de grasas/kg, 1,2 mmol de sodio/kg y 1,1 mmol de potasio/kg. Para un paciente que pesa 70 kg, esto equivaldría a 2450 ml de medicamento OLIMEL al día, lo que significa la ingesta de 108 g de aminoácidos, 343 g de glucosa y 98 g de grasas (es decir, 2352 kcal no proteicas y un total de 2793 kcal).
Generalmente, la velocidad de administración debe aumentar gradualmente durante la primera hora y, a continuación, la velocidad de la infusión debe ajustarse adecuadamente en función de la dosis, el volumen diario del medicamento y la duración de la infusión.
Para el medicamento OLIMEL, la velocidad máxima de infusión es de 1,7 ml/kg/hora, lo que equivale a 0,08 g de aminoácidos/kg/hora, 0,24 g de glucosa/kg/hora y 0,07 g de grasas/kg/hora.
Niños mayores de 2 años y adolescentes
No se han realizado estudios en la población pediátrica.
La dosis depende del gasto energético del paciente, del estado clínico, del peso corporal y de la capacidad del organismo para metabolizar los componentes del medicamento OLIMEL, así como de los nutrientes energéticos o proteicos administrados adicionalmente por vía oral/enteral; por lo tanto, debe elegirse el tamaño de la bolsa adecuadamente.
Además, el requerimiento diario de líquidos, nitrógeno y energía disminuye constantemente con la edad. Se han considerado dos grupos, de 2 a 11 años y de 12 a 18 años.
Para el medicamento OLIMEL N7E, en ambos grupos de edad, el factor limitante para la dosis diaria es la concentración de magnesio. En ambos grupos de edad, el factor limitante para la velocidad de administración por hora es la concentración de glucosa. A continuación, se presentan los valores de ingesta resultantes:
| Componente | 2 a 11 años | 12 a 18 años | ||
| Recomendado | Volumen máximo de OLIMEL N7E | Recomendado | Volumen máximo de OLIMEL N7E | |
| Dosis diaria máxima | ||||
| Líquidos (ml/kg/día) |
| 25 |
| 25 |
| Aminoácidos (g/kg/día) |
| 1,1 |
| 1,1 |
| Glucosa (g/kg/día) | 1,4 – 8,6 | 3,5 | 0,7 – 5,8 | 3,5 |
| Grasas (g/kg/día) | 0,5 - 3 | 1,0 | 0,5 - 2 (hasta 3) | 1,0 |
| Valor energético total (kcal/kg/día) |
| 28,5 |
| 28,5 |
| Velocidad máxima de administración por hora | ||||
| OLIMEL N7E (ml/kg/hora) | 2,6 | 1,7 | ||
| Aminoácidos (g/kg/hora) | 0,20 | 0,11 | 0,12 | 0,08 |
| Glucosa (g/kg/hora) | 0,36 | 0,36 | 0,24 | 0,24 |
| Grasas (g/kg/hora) | 0,13 | 0,10 | 0,13 | 0,07 |
Generalmente, la velocidad de administración debe aumentar gradualmente durante la primera hora y, a continuación, debe ajustarse en función de la dosis, el volumen diario del medicamento y la duración de la infusión.
Por lo general, en niños pequeños, se recomienda comenzar la infusión con una dosis diaria baja y aumentarla gradualmente hasta la dosis máxima (véase arriba).
Modo de administración
Únicamente para un uso único.
Se recomienda que, una vez abierto, se utilice inmediatamente el contenido de la bolsa y no se guarde para la próxima infusión.
Después de la mezcla, se obtiene una mezcla homogénea de aspecto lechoso.
Las instrucciones para la preparación y la administración de la emulsión para infusión, véase el punto 6.6 del prospecto.
Debido a la alta osmolalidad de OLIMEL, solo puede administrarse en una vena central.
La duración recomendada de la infusión en el caso de una bolsa para nutrición parenteral es de 12 a 24 horas.
El tratamiento con nutrición parenteral puede continuar durante todo el tiempo que lo requiera el estado clínico del paciente.
C. INCOMPATIBILIDADES FARMACÉUTICAS
No debe agregar ningún medicamento ni sustancia a none de los componentes de la bolsa o a la emulsión preparada sin antes confirmar su compatibilidad y la estabilidad del producto resultante (especialmente la estabilidad de la emulsión grasosa).
Las incompatibilidades pueden deberse, por ejemplo, a una acidez excesiva (pH bajo) o a una concentración inadecuada de cationes bivalentes (Ca y Mg), que pueden desestabilizar la emulsión grasosa.
Al igual que en la preparación de otras mezclas para la nutrición parenteral, debe considerarse la relación entre la concentración de calcio y fosfatos. Un exceso de calcio y fosfato, especialmente en forma de sales inorgánicas, puede provocar la formación de depósitos de fosfato de calcio.
OLIMEL contiene iones de calcio que pueden aumentar el riesgo de formación de coágulos en los preparados de sangre o componentes sanguíneos con citrato como agente anticoagulante/conservante.
No debe mezclar ni administrar ceftriakson al mismo tiempo que soluciones para infusión que contengan calcio, incluyendo el medicamento OLIMEL, mediante goteo intravenoso.
No se deben administrar estos medicamentos al mismo tiempo, incluso a través de diferentes líneas de infusión o sitios de infusión.
El medicamento OLIMEL y la ceftriakson pueden administrarse secuencialmente uno después del otro, siempre que las líneas de infusión estén insertadas en sitios diferentes o se cambien o se laven cuidadosamente con solución salina fisiológica entre las infusiones para evitar la formación de depósitos (formación de partículas de sales de calcio de ceftriakson).
Debido al riesgo de formación de depósitos, no debe administrar el medicamento OLIMEL a través de la misma línea de infusión ni agregarlo a la ampicilina o la fosfenitoína.
Debe verificar la compatibilidad con las soluciones administradas simultáneamente a través del mismo conjunto de infusión, catéter o cánula.
Debido al riesgo de pseudoaglutinación, no debe administrar este medicamento antes, durante o después de la administración de sangre a través del mismo conjunto de infusión.
D. PRECAUCIONES ESPECIALES PARA LA ELIMINACIÓN Y PREPARACIÓN DEL MEDICAMENTO PARA SU USO
PRODUKTU LECZNICZEGO
Revisión de las etapas de preparación para la administración de OLIMEL antes de su uso.
Abrir
Retirar la bolsa protectora.
Descartar la bolsa que contiene el absorbente de oxígeno.
Asegurarse de que la bolsa o las soldaduras no estén dañadas. Solo utilice si la bolsa no está dañada y las soldaduras están intactas (es decir, el contenido de las 3 cámaras no se ha mezclado), las soluciones de aminoácidos y glucosa son transparentes, incoloras o ligeramente amarillas, prácticamente libres de partículas visibles y la emulsión grasosa es homogénea de aspecto lechoso.
Mezcla de soluciones y emulsiones
Antes de romper las soldaduras, asegurarse de que el producto esté a temperatura ambiente.
Comenzando desde la parte superior de la bolsa (en la parte del asa), enrollar la bolsa con ambas manos. Las soldaduras se abrirán desde el lado de los puertos. Continuar enrollando la bolsa hasta que las soldaduras se abran hasta la mitad de su longitud.
Mezclar, girando la bolsa al menos 3 veces.
Después de la mezcla, el producto tiene la forma de una emulsión homogénea de aspecto lechoso.
Agregar componentes adicionales
El volumen de la bolsa es suficiente para permitir la adición de vitaminas, electrolitos y oligoelementos.
Todos los aditivos (incluyendo las vitaminas) deben introducirse en la emulsión preparada (después de romper las soldaduras y mezclar el contenido de las 3 cámaras).
Las vitaminas también pueden agregarse a la cámara que contiene la glucosa antes de preparar la emulsión (antes de romper las soldaduras y antes de mezclar el contenido de las tres cámaras).
Al agregar componentes adicionales a los productos que contienen electrolitos, debe tener en cuenta la cantidad de electrolitos ya presentes en la bolsa.
Los componentes adicionales deben agregarse por personal calificado en condiciones de asepsia.
Puede agregar electrolitos al medicamento OLIMEL de acuerdo con la siguiente tabla:
| Por 1000 ml | |||
| Contenido | Agregado máximo | Contenido máximo | |
| Sodio | 35 mmol | 115 mmol | 150 mmol |
| Potasio | 30 mmol | 120 mmol | 150 mmol |
| Magnesio | 4,0 mmol | 1,6 mmol | 5,6 mmol |
| Calcio | 3,5 mmol | 1,5 (0,0a) mmol | 5,0 (3,5a) mmol |
| Fosfatos inorgánicos | 0 mmol | 3,0 mmol | 3,0 mmol |
| Fosfatos orgánicos | 15 mmolb | 10 mmol | 25 mmolb |
Oligoelementos y vitaminas:
Se ha demostrado la estabilidad después de agregar productos de vitaminas y oligoelementos disponibles en el mercado (que contienen como máximo 1 mg de hierro).
La compatibilidad con otros componentes adicionales está disponible a petición.
Al agregar componentes adicionales, debe:
- controlar las condiciones de asepsia,
- preparar el lugar de inyección en la bolsa,
- perforar el lugar de inyección y inyectar los componentes adicionales mediante una aguja para inyección o un dispositivo para la preparación del medicamento,
- mezclar el contenido de la bolsa con los componentes adicionales.
Preparación de la infusión
Controlar las condiciones de asepsia.
Colgar la bolsa.
Retirar el protector de plástico del puerto de administración del medicamento.
Introducir con decisión la aguja del conjunto de infusión en el puerto de administración del medicamento.
Figura 1. Etapas de preparación para la administración de OLIMEL.



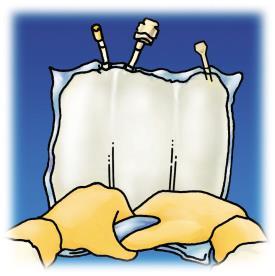
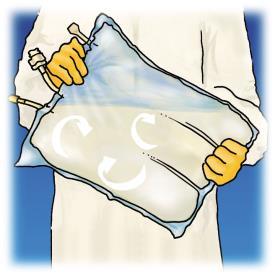
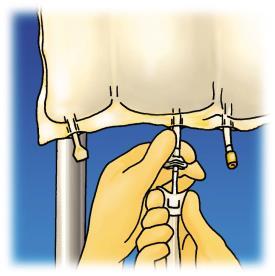
Administración
Únicamente para uso único.
Administrar el producto únicamente después de romper las soldaduras que dividen las 3 cámaras y mezclar su contenido.
Debe asegurarse de que en la emulsión lista para infusión no se produzca separación de fases.
Después de abrir la bolsa, su contenido debe ser utilizado de inmediato. No se debe almacenar
la bolsa abierta para la próxima infusión. No conectar de nuevo las bolsas parcialmente utilizadas.
Para evitar la posibilidad de formación de émbolos aéreos causados por la presencia de gas
contenido en la primera bolsa, no conectar las bolsas en serie.
Cualquier residuo del producto no utilizado o sus desechos y todo el conjunto para infusión deben
ser destruidos.
Extravasación
El lugar de inserción del catéter debe ser monitoreado regularmente en busca de signos de extravasación.
En caso de extravasación, debe interrumpirse de inmediato la administración del preparado, dejando en su lugar
el catéter o la cánula introducida para iniciar de inmediato el tratamiento médico. Si es posible,
antes de retirar el catéter/cánula introducido, debe realizarse una aspiración del líquido a través del
catéter/cánula para reducir la cantidad de líquido en los tejidos.
Dependiendo del tipo de producto extravasado (incluyendo el producto o productos mezclados con el producto
OLIMEL, si corresponde) y del grado o extensión del posible daño, deben tomarse las medidas adecuadas.
Las opciones de tratamiento pueden incluir tratamiento no farmacológico, farmacológico y (o) intervención quirúrgica. En caso de gran extravasación, debe consultarse con un cirujano plástico antes de que transcurran 72 horas.
El lugar de extravasación debe ser monitoreado al menos cada cuatro horas durante las primeras
24 horas, y luego una vez al día.
No se debe reanudar la infusión en la misma vena central.
Baxter y Olimel son marcas registradas de Baxter International Inc.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBaxter S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Olimel N7eForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere receta
Alternativas a Olimel N7e en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Olimel N7e en España
Alternativa a Olimel N7e en Ucrania
Médicos online para Olimel N7e
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Olimel N7e – sujeta a valoración médica y normativa local.














