

Olimel N5e

Consulta con un médico sobre la receta médica de Olimel N5e

Cómo usar Olimel N5e
Hoja de instrucciones para el paciente: Información para el usuario
OLIMEL N5E, emulsión para infusión
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de administrar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico o enfermero.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermero. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es OLIMEL N5E, emulsión para infusión, y para qué se utiliza
- 2. Información importante antes de administrar OLIMEL N5E, emulsión para infusión
- 3. Cómo administrar OLIMEL N5E, emulsión para infusión
- 4. Efectos adversos posibles
- 5. Cómo almacenar OLIMEL N5E, emulsión para infusión
- 6. Contenido del envase y otra información
1. Qué es OLIMEL N5E, emulsión para infusión, y para qué se utiliza
OLIMEL es una emulsión para infusión. El medicamento se suministra en un bolsa de tres cámaras.
La primera cámara contiene una solución de glucosa con calcio, la segunda una emulsión grasosa, y la tercera una solución de aminoácidos con otros electrolitos.
OLIMEL se utiliza para la nutrición parenteral de adultos y niños mayores de 2 años, cuando la nutrición oral no es adecuada.
OLIMEL solo debe ser administrado bajo supervisión médica.
2. Información importante antes de administrar OLIMEL N5E, emulsión para infusión
Cuándo no administrar OLIMEL N5E, emulsión para infusión:
- -en prematuros, recién nacidos y niños menores de 2 años;
- -si el paciente es alérgico a los huevos, la soja, las proteínas de cacahuate, el maíz/productos que contienen maíz (véase también el punto "Precauciones y advertencias" a continuación) o a alguno de los demás componentes de este medicamento (enumerados en el punto 6);
- -si la administración de algunos aminoácidos provoca una reacción anormal en el organismo del paciente;
- -si el paciente tiene un nivel de grasas en la sangre muy alto;
- si el paciente tiene hiperglucemia (un nivel de azúcar en la sangre demasiado alto);
- si el paciente tiene un nivel anormalmente alto de algún electrolito (sodio, potasio, magnesio, calcio y/o fosforo) en la sangre.
En cada caso, el médico tomará la decisión de administrar el medicamento en función de factores como la edad, el peso del paciente y su estado de salud, incluyendo los resultados de las pruebas realizadas.
Precauciones y advertencias
Antes de iniciar la administración de OLIMEL N5E, debe discutirlo con su médico o enfermero.
La administración demasiado rápida de soluciones para la nutrición parenteral total puede provocar daño o la muerte del paciente.
Si se producen signos o síntomas atípicos de una reacción alérgica (como sudoración, fiebre, escalofríos, dolor de cabeza, erupción cutánea o problemas para respirar), debe interrumpir inmediatamente la infusión. El medicamento contiene aceite de soja y fosfolípidos de huevo de gallina. Las proteínas de la soja y el huevo pueden provocar reacciones de hipersensibilidad. Se han observado reacciones alérgicas cruzadas entre las proteínas de la soja y los cacahuetes.
El medicamento OLIMEL contiene glucosa obtenida del maíz, que puede provocar reacciones de hipersensibilidad si el paciente es alérgico al maíz o a productos que contienen maíz (véase el punto "Cuándo no administrar OLIMEL N5E, emulsión para infusión:" anterior).
Las dificultades para respirar también pueden ser un signo de que se han formado pequeñas partículas que bloquean los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares). Si se producen dificultades para respirar, debe informar a su médico o enfermero. Ellos decidirán sobre la acción adecuada.
Un antibiótico llamado ceftriakson no debe mezclarse ni administrarse al mismo tiempo que cualquier solución que contenga calcio (incluyendo el medicamento OLIMEL) mediante goteo intravenoso.
No debe administrarse estos medicamentos al mismo tiempo, incluso a través de diferentes líneas de infusión o sitios de infusión.
El medicamento OLIMEL y la ceftriakson pueden administrarse secuencialmente uno después del otro, si las líneas de infusión están insertadas en diferentes sitios o se intercambian o se limpian cuidadosamente con una solución salina fisiológica entre las infusiones, para evitar la formación de depósitos (precipitación de sales de calcio de ceftriakson).
Algunos medicamentos y enfermedades pueden aumentar el riesgo de infección o sepsis (presencia de bacterias en la sangre). Un riesgo especial de infección o sepsis existe después de la inserción de un catéter (catéter intravenoso) en una vena del paciente. El médico supervisará cuidadosamente al paciente para detectar cualquier signo de infección. Los pacientes que requieren nutrición parenteral (administración de sustancias nutritivas a través de un catéter insertado en una vena) están, debido a su estado clínico, más expuestos al desarrollo de infecciones. La aplicación de procedimientos que garantizan la esterilidad (ausencia de microorganismos) durante la inserción, el manejo del catéter y la preparación del producto para la nutrición (nutrición parenteral total) puede reducir el riesgo de infección.
Si el paciente está gravemente desnutrido, de modo que debe recibir alimento a través de una vena, el médico debe iniciar el tratamiento de manera gradual. Al mismo tiempo, el médico debe supervisar cuidadosamente al paciente para evitar cambios repentinos en el volumen de líquido, la concentración de vitaminas, electrolitos y minerales.
Antes de iniciar la infusión, debe corregir los trastornos del equilibrio hidroelectrolítico y los trastornos metabólicos del paciente. El médico supervisará al paciente durante la terapia y puede ajustar la dosis o, si lo considera necesario, recetar suplementos nutritivos adicionales, como vitaminas, electrolitos y oligoelementos.
En pacientes que reciben terapia de nutrición parenteral, se han informado trastornos de la función hepática, incluyendo dificultades para eliminar la bilis (colestasis), acumulación de grasa (esteatosis hepática), fibrosis, que pueden provocar insuficiencia hepática, así como inflamación de la vesícula biliar y cálculos biliares. Se considera que las causas de estos trastornos pueden ser variadas en diferentes pacientes. Si el paciente experimenta síntomas como náuseas, vómitos, dolor abdominal, ictericia o decoloración de la piel y los ojos, debe comunicarse con el médico para permitir la identificación de las causas y factores posibles, así como las medidas terapéuticas y preventivas.
El médico debe ser informado sobre:
- enfermedades renales graves. También debe informar al médico si el paciente está sometido a diálisis (riñón artificial) u otros métodos de limpieza de la sangre;
- enfermedades hepáticas graves;
- trastornos de la coagulación de la sangre;
- disfunción suprarrenal (insuficiencia suprarrenal). Las glándulas suprarrenales son glándulas con forma triangular que se encuentran en la parte superior de los riñones;
- insuficiencia cardíaca;
- enfermedad pulmonar;
- acumulación de líquido en el organismo (sobrehidratación);
- falta de líquido en el organismo (deshidratación);
- glucemia no tratada (diabetes);
- infarto de miocardio o choque causado por una insuficiencia cardíaca repentina;
- acidosis metabólica grave (pH de la sangre demasiado ácido);
- infección generalizada (sepsis);
- coma.
Para verificar la eficacia y la seguridad del medicamento, durante la administración del medicamento, el paciente será sometido a pruebas clínicas y de laboratorio ordenadas por el médico. En caso de que el medicamento se administre durante varias semanas, se analizará regularmente la sangre del paciente.
La capacidad reducida del organismo para eliminar los lípidos contenidos en el medicamento puede provocar el síndrome de sobrecarga de grasas (véase el punto 4 - "Efectos adversos posibles").
En caso de que se produzca dolor, ardor o hinchazón en el sitio de infusión o fugas del líquido administrado durante la infusión, debe informar a su médico o enfermero.
La administración del medicamento se interrumpirá de inmediato y se reanudará en una vena diferente.
Si el nivel de glucosa en la sangre aumenta excesivamente, el médico debe ajustar la velocidad de administración del medicamento OLIMEL o administrar al paciente un medicamento que regule el nivel de azúcar en la sangre (insulina).
OLIMEL puede administrarse a través de un catéter (catéter intravenoso) insertado en una vena grande en el tórax del paciente (vena central).
Niños y adolescentes
En caso de que se administre a niños menores de 18 años, debe tener especial cuidado para administrar la dosis adecuada del medicamento. Debido a la mayor sensibilidad de los niños al riesgo de infección, también deben tomarse medidas de precaución aumentadas. Siempre se requiere enriquecimiento con vitaminas y oligoelementos. Para los niños, deben utilizarse composiciones y cantidades pediátricas.
OLIMEL y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que esté tomando o haya tomado recientemente, así como sobre los medicamentos que planea tomar o administrar.
La administración simultánea de otros medicamentos generalmente no está contraindicada. Sin embargo, debe informar a su médico sobre todos los medicamentos que haya tomado recientemente, incluyendo los que se venden sin receta, para verificar su compatibilidad.
Debe informar a su médico sobre la administración o recepción de:
- insulina,
- heparina.
No debe administrarse el medicamento OLIMEL al mismo tiempo que la sangre a través del mismo conjunto de infusión.
OLIMEL contiene calcio. No debe administrarse junto con el antibiótico ceftriakson ni a través de la misma línea de infusión, ya que pueden formarse partículas. Si estos medicamentos se administran secuencialmente a través del mismo dispositivo, debe limpiarse cuidadosamente.
Debido al riesgo de precipitación, no debe administrarse el medicamento OLIMEL a través de la misma línea de infusión ni agregar a la ampicilina (antibiótico) o a la fosfenitoína (medicamento anticonvulsivo).
El aceite de oliva y el aceite de soja presentes en el medicamento OLIMEL contienen vitamina K. Generalmente, no tiene efecto sobre la acción de los medicamentos anticoagulantes, como la cumarina. Si el paciente está tomando medicamentos anticoagulantes, debe informar a su médico.
Las grasas contenidas en la emulsión pueden alterar los resultados de algunas pruebas de laboratorio, si la muestra de sangre para el análisis se toma antes de que se eliminen las grasas de la circulación sanguínea del paciente (se eliminan de la sangre después de 5 a 6 horas de la administración de las grasas).
OLIMEL contiene potasio. Debe tener especial cuidado en caso de que el paciente esté tomando medicamentos diuréticos, inhibidores de la enzima convertidora de angiotensina (ECA), antagonistas del receptor de angiotensina II (medicamentos utilizados en la hipertensión) o medicamentos inmunosupresores. Estos medicamentos pueden provocar un aumento del nivel de potasio en la sangre.
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de administrar este medicamento.
No hay experiencia adecuada sobre el uso del medicamento OLIMEL N5E en mujeres embarazadas o en período de lactancia. Si es necesario, se puede considerar la administración del medicamento OLIMEL N5E durante el embarazo y la lactancia. El medicamento OLIMEL N5E debe administrarse a mujeres embarazadas o en período de lactancia solo después de una consideración cuidadosa.
Conducción de vehículos y uso de máquinas
No aplica.
3. Cómo administrar OLIMEL N5E, emulsión para infusión
Dosis
OLIMEL debe administrarse solo a adultos y niños mayores de 2 años.
El medicamento tiene la forma de una emulsión para infusión que se administra a través de un catéter (catéter intravenoso) en una vena grande en el tórax del paciente.
Antes de la administración, OLIMEL debe estar a temperatura ambiente.
OLIMEL está destinado solo para un uso único.
La infusión de 1 bolsa generalmente dura de 12 a 24 horas.
Dosis - Adultos
La velocidad de administración, de acuerdo con las necesidades y el estado clínico del paciente, será determinada por el médico.
El medicamento puede administrarse durante todo el tiempo que sea necesario, dependiendo del estado clínico del paciente.
Dosis - Niños mayores de 2 años y adolescentes
La dosis del medicamento y el período de administración serán determinados por el médico. Dependen del edad, peso, crecimiento, estado de salud y capacidad del organismo para descomponer y utilizar los componentes del medicamento OLIMEL N5E.
Administración de una dosis mayor que la recomendada de OLIMEL N5E, emulsión para infusión
En caso de que se administre al paciente una dosis demasiado grande del medicamento o una infusión demasiado rápida, los aminoácidos contenidos pueden provocar un aumento de la acidez de la sangre y la aparición de síntomas de hiperolemia (aumento del volumen de sangre en circulación). Puede aumentar el nivel de glucosa en la sangre y en la orina, puede producirse un síndrome de hiperosmolaridad (viscosidad excesiva de la sangre), y las grasas contenidas en la emulsión pueden aumentar el nivel de triglicéridos en la sangre. La administración de una infusión con una velocidad excesiva o un volumen excesivo del medicamento OLIMEL puede provocar náuseas, vómitos, escalofríos, dolor de cabeza, sudoración excesiva (hiperhidrosis) y trastornos electrolíticos. En tal caso, debe interrumpir inmediatamente la infusión.
A veces, en casos graves, para ayudar a los riñones del paciente a eliminar el exceso de medicamento, el médico puede estar obligado a someter al paciente a una diálisis renal temporal.
Para evitar tales situaciones, el médico supervisará regularmente el estado del paciente y verificará los parámetros de la sangre.
En caso de dudas sobre la administración del medicamento, debe consultar a su médico.
4. Efectos adversos posibles
Como cualquier medicamento, este medicamento puede provocar efectos adversos, aunque no todos los pacientes los experimentarán.
En caso de que se produzcan cambios en el estado de ánimo durante el tratamiento o después de su finalización, debe informar inmediatamente a su médico o enfermero.
Las pruebas realizadas por el médico durante la administración del medicamento al paciente deben minimizar el riesgo de efectos adversos.
Si se producen signos o síntomas atípicos de una reacción alérgica, como sudoración excesiva, fiebre, escalofríos, dolor de cabeza, erupción cutánea o problemas para respirar, debe interrumpir inmediatamente la infusión.
Durante la administración del medicamento OLIMEL, se han descrito los siguientes efectos adversos:
Frecuencia - Frecuente: pueden afectar hasta 1 de cada 10 personas
- taquicardia (frecuencia cardíaca acelerada);
- disminución del apetito;
- hipertrigliceridemia (aumento del nivel de grasas en la sangre);
- dolor abdominal;
- diarrea;
- náuseas;
- hipertensión (aumento de la presión arterial).
Frecuencia - Desconocida: la frecuencia no puede determinarse a partir de los datos disponibles
- Reacciones de hipersensibilidad, incluyendo sudoración, fiebre, escalofríos, dolor de cabeza, erupción cutánea (eritematosa, papulosa, pustulosa, maculosa, erupción generalizada), picazón, escalofríos, dificultades para respirar;
- Fuga de la infusión al tejido circundante (extravasación) puede provocar dolor, irritación, hinchazón/edema, enrojecimiento (eritema)/calor, necrosis de la piel o ampollas/vesículas, inflamación, engrosamiento o contracción de la piel en el sitio de administración de la infusión;
- Vómitos.
Durante la administración de medicamentos similares para la nutrición parenteral, se han descrito los siguientes efectos adversos:
Frecuencia - Muy rara: pueden afectar hasta 1 de cada 10,000 personas
- Síndrome de sobrecarga de grasas (disminución de la capacidad para eliminar los lípidos) asociado con un empeoramiento repentino del estado de salud del paciente. Los síntomas del síndrome de sobrecarga de grasas mencionados a continuación generalmente desaparecen después de interrumpir la infusión de la emulsión grasosa. o Fiebre o Disminución del número de glóbulos rojos, que puede causar palidez de la piel y ser la causa de debilidad o dificultades para respirar (anemia) o Número bajo de glóbulos blancos, que puede aumentar el riesgo de infecciones (leucopenia) o Número bajo de plaquetas, que puede aumentar el riesgo de moretones y/o hemorragias (trombocitopenia) o Trastornos de la coagulación, que afectan la capacidad de coagulación de la sangre o Hiperlipidemia (aumento del nivel de grasas en la sangre) o Infiltrados grasos en el hígado (hepatomegalia) o Deterioro de la función hepática o Síntomas del sistema nervioso central (por ejemplo, coma).
Frecuencia - Desconocida:la frecuencia no puede determinarse a partir de los datos disponibles
- -reacciones alérgicas;
- resultado anormal de la prueba de sangre para la función hepática;
- problemas para eliminar la bilis (colestasis);
- aumento del tamaño del hígado (hepatomegalia);
- enfermedades hepáticas asociadas con la nutrición parenteral (véase "Precauciones y advertencias" en el punto 2);
- ictericia;
- disminución del número de plaquetas (trombocitopenia);
- aumento del nivel de azota en la sangre (azotemia);
- aumento de la actividad de las enzimas hepáticas;
- formación de pequeñas partículas que pueden bloquear los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares) y provocar un tromboembolismo pulmonar y dificultades para respirar (insuficiencia respiratoria).
Notificación de efectos adversos
Si se producen efectos adversos, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o enfermero. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Farmacéuticos de la Agencia de Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181C
02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo almacenar OLIMEL N5E, emulsión para infusión
El medicamento debe almacenarse en un lugar no visible y no accesible para los niños.
No debe administrarse este medicamento después de la fecha de caducidad indicada en el envase y en el embalaje exterior (MM/RRRR). La fecha de caducidad es el último día del mes dado.
No congelar.
Almacenar en el embalaje protector.
No debe desecharse los medicamentos por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del envase y otra información
Qué contiene OLIMEL N5E, emulsión para infusión?
Los principios activos en cada una de las bolsas de emulsión preparada son: 8,2% (lo que equivale a 8,2 g/100 ml) de solución de L-aminoácidos (alanina, arginina, glicina, histidina, isoleucina, leucina, lisina (en forma de lisina acetato), metionina, fenilalanina, prolina, serina, treonina, triptófano, tirosina, valina, ácido aspártico, ácido glutámico) con electrolitos (sodio, potasio, magnesio, fosfatos, acetatos, cloruros), 20% (lo que equivale a 20 g/100 ml) de emulsión grasosa (aceite de oliva purificado y aceite de soja purificado) y 28,75% (lo que equivale a 28,75 g/100 ml) de solución de glucosa (en forma de glucosa monohidratada) con calcio.
Los demás componentes del medicamento son:
| Cámara que contiene emulsión grasosa | Cámara que contiene solución de aminoácidos | Cámara que contiene solución de glucosa |
| Fosfolípidos purificados de huevo de gallina, glicerol, oleato de sodio, hidróxido de sodio (para ajustar el pH), agua para inyección | Ácido acético glacial (para ajustar el pH), agua para inyección | Ácido clorhídrico (para ajustar el pH), agua para inyección |
Cómo se ve OLIMEL N5E, emulsión para infusión, y qué contiene el envase?
OLIMEL es una emulsión para infusión suministrada en una bolsa de tres cámaras. La primera cámara contiene la emulsión grasosa, la segunda cámara contiene la solución de aminoácidos con electrolitos, y la tercera cámara contiene la solución de glucosa con calcio. Las cámaras están separadas entre sí mediante soldaduras impermeables.
Antes de la administración, debe mezclar el contenido de las cámaras respectivas mediante el enrollado de la bolsa hacia sí mismo, comenzando desde la parte superior de la bolsa, hasta la apertura de las soldaduras.
Aspecto antes de mezclar:
- Las soluciones de aminoácidos y glucosa son transparentes, incoloras o ligeramente amarillas.
- La emulsión grasosa es homogénea con un aspecto lechoso.
Aspecto después de mezclar: emulsión homogénea con un aspecto lechoso.
La bolsa de tres cámaras es una bolsa de plástico multilayer. La capa interior (de contacto) de la bolsa es compatible con los componentes y aditivos permitidos.
Para evitar el contacto con el oxígeno del aire, la bolsa está empaquetada en un envase protector que protege contra la entrada de oxígeno con una bolsa que absorbe el oxígeno.
Tamaños de los envases
bolsa de 1500 ml: 1 caja de cartón con 4 bolsas
bolsa de 2000 ml: 1 caja de cartón con 4 bolsas
bolsa de 2500 ml: 1 caja de cartón con 2 bolsas
1 bolsa de 1500 ml, 2000 ml y 2500 ml.
No todos los tamaños de envase deben estar en circulación.
Título del responsable y fabricante
Titular de la autorización de comercialización
Baxter Polska Sp. z o.o.
Ul. Kruczkowskiego 8
00-380 Varsovia
Fabricante
BAXTER S.A.
Boulevard Rene Branquart 80
7860 Lessines, Bélgica
Este producto farmacéutico está autorizado para su comercialización en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Francia, Portugal, Estonia, Polonia, Lituania, Bulgaria, Rumania, Letonia, República Checa, Bélgica, España, Eslovaquia, Países Bajos, Luxemburgo, Eslovenia, Italia, Grecia, Chipre: OLIMEL N5E
En algunos países, está registrado bajo un nombre comercial diferente, como se describe a continuación:
Austria: ZentroOLIMEL 3,3 % con electrolitos
Alemania: Olimel 3,3% E
Dinamarca, Islandia, Suecia, Noruega, Finlandia: Olimel N5E
Reino Unido, Irlanda, Malta: Triomel 5g/l nitrógeno 990 kcal/l con electrolitos
Fecha de la última actualización de la hoja de instrucciones: 21.04.2020
---------------------------------------------------------------------------------------------------------------------
Informaciones destinadas exclusivamente al personal médico especializado:
Grupo farmacoterapéutico: soluciones para la nutrición parenteral/mezclas
Código ATC: B05 BA10.
A. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
OLIMEL tiene la forma de una bolsa de tres cámaras.
Cada bolsa contiene una solución de glucosa con calcio, una emulsión grasosa y una solución de aminoácidos con otros electrolitos:
| Contenido por bolsa | |||
| 1500 ml | 2000 ml | 2500 ml | |
| 28,75% solución de glucosa (lo que equivale a 28,75 g/100 ml) | 600 ml | 800 ml | 1000 ml |
| 8,2% solución de aminoácidos (lo que equivale a 8,2 g/100 ml) | 600 ml | 800 ml | 1000 ml |
| 20% emulsión grasosa (lo que equivale a 20 g/100 ml) | 300 ml | 400 ml | 500 ml |
Composición de la emulsión preparada después de mezclar el contenido de las tres cámaras:
| Principios activos | 1500 ml | 2000 ml | 2500 ml |
| Aceite de oliva purificado + aceite de soja purificado | 60,00 g | 80,00 g | 100,00 g |
| Alanina | 7,14 g | 9,52 g | 11,90 g |
| Arginina | 4,84 g | 6,45 g | 8,06 g |
| Ácido aspártico | 1,43 g | 1,90 g | 2,38 g |
| Ácido glutámico | 2,47 g | 3,29 g | 4,11 g |
| Glicina | 3,42 g | 4,56 g | 5,70 g |
| Histidina | 2,95 g | 3,93 g | 4,91 g |
| Isoleucina | 2,47 g | 3,29 g | 4,11 g |
| Leucina | 3,42 g | 4,56 g | 5,70 g |
| Lisina (lo que equivale a lisina acetato) | 3,88 g (5,48 g) | 5,18 g (7,30 g) | 6,47 g (9,13 g) |
| Metionina | 2,47 g | 3,29 g | 4,11 g |
| Fenilalanina | 3,42 g | 4,56 g | 5,70 g |
| Prolina | 2,95 g | 3,93 g | 4,91 g |
| Serina | 1,95 g | 2,60 g | 3,25 g |
| Treonina | 2,47 g | 3,29 g | 4,11 g |
| Triptófano | 0,82 g | 1,10 g | 1,37 g |
| Tirosina | 0,13 g | 0,17 g | 0,21 g |
| Valina | 3,16 g | 4,21 g | 5,26 g |
| Octanato de sodio trihidratado | 2,24 g | 2,99 g | 3,74 g |
| Glicerofosfato de sodio hidratado | 5,51 g | 7,34 g | 9,18 g |
| Cloruro de potasio | 3,35 g | 4,47 g | 5,59 g |
| Cloruro de magnesio hexahidratado | 1,22 g | 1,62 g | 2,03 g |
| Cloruro de calcio dihidratado | 0,77 g | 1,03 g | 1,29 g |
| Glucosa (lo que equivale a glucosa monohidratada) | 172,50 g (189,75 g) | 230,00 g (253,00 g) | 287,50 g (316,25 g) |
Los componentes auxiliares son:
| Cámara que contiene emulsión grasosa | Cámara que contiene solución de aminoácidos con electrolitos | Cámara que contiene solución de glucosa con calcio |
| Fosfolípidos purificados de huevo de gallina, glicerol, oleato de sodio, hidróxido de sodio (para ajustar el pH), agua para inyección | Ácido acético glacial (para ajustar el pH), agua para inyección | Ácido clorhídrico (para ajustar el pH), agua para inyección |
Valores nutricionales de la emulsión preparada, según el tamaño de las bolsas:
| 1500 ml | 2000 ml | 2500 ml | |
| Grasas | 60 g | 80 g | 100 g |
| Aminoácidos | 49,4 g | 65,8 g | 82,3 g |
| Azote | 7,8 g | 10,4 g | 13,0 g |
| Glucosa | 172,5 g | 230,0 g | 287,5 g |
| Valor energético: Valor energético total aproximado Valor energético no proteico Valor energético de la glucosa Valor energético de las grasas Relación: valor energético no proteico/azote Relación: valor energético de la glucosa/grasas Grasas/valor energético total | 1490 kcal 1290 kcal 690 kcal 600 kcal 165 kcal/g 53/47 40% | 1980 kcal 1720 kcal 920 kcal 800 kcal 165 kcal/g 53/47 40% | 2480 kcal 2150 kcal 1150 kcal 1000 kcal 165 kcal/g 53/47 40% |
| Electrolitos: Sodio Potasio Magnesio Calcio Fosfatos Octanato Cloruros | 52,5 mmol 45,0 mmol 6,0 mmol 5,3 mmol 22,5 mmol 55 mmol 68 mmol | 70,0 mmol 60,0 mmol 8,0 mmol 7,0 mmol 30,0 mmol 73 mmol 90 mmol | 87,5 mmol 75,0 mmol 10,0 mmol 8,8 mmol 37,5 mmol 91 mmol 113 mmol |
| pH | 6,4 | 6,4 | 6,4 |
| Osmolalidad | 1120 mOsm/l | 1120 mOsm/l | 1120 mOsm/l |
B. DOSIS Y MODO DE ADMINISTRACIÓN
Dosis
OLIMEL no se recomienda para su uso en niños menores de 2 años, debido a su composición y volumen inadecuados (véase los puntos 4.4; 5.1 y 5.2 del prospecto).
No debe exceder la dosis diaria máxima recomendada. Debido a la composición fija de la bolsa de múltiples cámaras, puede que no sea posible satisfacer todas las necesidades nutricionales del paciente al mismo tiempo. Pueden ocurrir situaciones clínicas en las que los pacientes necesitan diferentes cantidades de nutrientes que las que se encuentran en la bolsa de composición fija. En tal caso, cualquier cambio en el volumen (dosis) debe tener en cuenta el efecto que tendrá en la dosificación de todos los demás nutrientes del producto farmacéutico OLIMEL.
Adultos
La dosis depende del gasto energético del paciente, del estado clínico, del peso y de la capacidad del paciente para metabolizar los componentes del producto OLIMEL, así como de los nutrientes energéticos o proteicos administrados adicionalmente por vía oral/enteral; por lo tanto, debe elegirse el tamaño de la bolsa adecuadamente.
El requerimiento diario promedio es:
- 0,16 a 0,35 g de nitrógeno/kg de peso corporal (1-2 g de aminoácidos/kg), dependiendo del estado de nutrición del paciente y del grado de catabolismo,
- 20 a 40 kcal/kg,
- 20 a 40 ml de líquido/kg o 1 a 1,5 ml por kcal consumida.
Para el producto OLIMEL, la dosis diaria máxima se ha establecido según la ingesta de 40 ml de líquido/kg, lo que equivale a 1,3 g de aminoácidos/kg, 4,6 g de glucosa/kg, 1,6 g de grasas/kg, 1,4 mmol de sodio/kg y 1,2 mmol de potasio/kg. Para un paciente que pesa 70 kg, esto equivaldría a 2800 ml del producto OLIMEL por día, lo que significa la ingesta de 92 g de aminoácidos, 322 g de glucosa y 112 g de grasas (es decir, 2408 kcal no proteicas y un total de 2772 kcal).
Por lo general, la velocidad de administración debe aumentarse gradualmente durante la primera hora y, a continuación, la velocidad de la infusión debe ajustarse adecuadamente en función de la dosis, el volumen diario del producto farmacéutico administrado y la duración de la infusión.
Para el producto OLIMEL, la velocidad máxima de infusión es de 2,1 ml/kg/hora, lo que equivale a 0,07 g de aminoácidos/kg/hora, 0,24 g de glucosa/kg/hora y 0,08 g de grasas/kg/hora.
Niños mayores de 2 años y adolescentes
No se han realizado estudios en la población pediátrica.
La dosis depende del gasto energético del paciente, del estado clínico, del peso y de la capacidad del paciente para metabolizar los componentes del producto OLIMEL, así como de los nutrientes energéticos o proteicos administrados adicionalmente por vía oral/enteral; por lo tanto, debe elegirse el tamaño de la bolsa adecuadamente.
Además, el requerimiento diario de líquido, nitrógeno y energía disminuye constantemente con la edad. Se han considerado dos grupos, de 2 a 11 años y de 12 a 18 años.
Para el producto OLIMEL N5E, en ambos grupos de edad, el factor limitante para la dosis diaria es la concentración de magnesio. En el grupo de edad de 2 a 11 años, los factores limitantes para la velocidad de administración por hora son las concentraciones de glucosa y grasas. En el grupo de edad de 12 a 18 años, el factor limitante para la velocidad de administración por hora es la concentración de glucosa. Los consumos resultantes se presentan a continuación:
| Componente | 2 a 11 años | 12 a 18 años | ||
| Recomendado | Volumen máximo de OLIMEL N5E | Recomendado | Volumen máximo de OLIMEL N5E | |
| Dosis diaria máxima | ||||
| Líquido (ml/kg/día) |
| 33 |
| 33 |
| Aminoácidos (g/kg/día) |
| 1,1 |
| 1,1 |
| Glucosa (g/kg/día) | 1,4 -8,6 | 3,8 | 0,7 – 5,8 | 3,8 |
| Grasas (g/kg/día) | 0,5 - 3 | 1,3 | 0,5 - 2 (hasta 3) | 1,3 |
| Valor energético total (kcal/kg/día) |
| 32,7 |
| 32,7 |
| Velocidad máxima de administración por hora | ||||
| OLIMEL N5E (ml/kg/hora) | 3,1 | 2,1 | ||
| Aminoácidos (g/kg/hora) | 0,20 | 0,1 | 0,12 | 0,07 |
| Glucosa (g/kg/hora) | 0,36 | 0,36 | 0,24 | 0,24 |
| Grasas (g/kg/hora) | 0,13 | 0,13 | 0,13 | 0,08 |
Por lo general, la velocidad de administración debe aumentarse gradualmente durante la primera hora y, a continuación, debe ajustarse adecuadamente en función de la dosis, el volumen diario del producto farmacéutico administrado y la duración de la infusión.
En general, en niños pequeños, se recomienda comenzar la infusión con una dosis diaria baja y aumentarla gradualmente hasta la dosis máxima (véase arriba).
Modo de administración
Solo para uso único.
Se recomienda que, una vez abierto, se utilice inmediatamente el contenido de la bolsa y no se almacene para la siguiente infusión.
Después de mezclar, se obtiene una mezcla homogénea con un aspecto lechoso.
Las instrucciones para la preparación y la administración de la emulsión para infusión, véase el punto 6.6 del prospecto.
Debido a la alta osmolalidad de OLIMEL, solo se puede administrar en una vena central.
El tiempo de infusión recomendado para la bolsa de nutrición parenteral es de 12 a 24 horas.
El tratamiento con nutrición parenteral puede continuar durante todo el tiempo que lo requiera el estado clínico del paciente.
C. INCOMPATIBILIDADES FARMACÉUTICAS
No debe agregar ningún producto farmacéutico ni sustancia a ninguno de los componentes de la bolsa o a la emulsión preparada sin haber verificado previamente su compatibilidad y la estabilidad del producto resultante (especialmente la estabilidad de la emulsión grasosa).
Las incompatibilidades pueden deberse, por ejemplo, a una acidez excesiva (pH bajo) o a una concentración inadecuada de cationes bivalentes (Ca y Mg), que pueden desestabilizar la emulsión grasosa.
Al igual que en la preparación de otras mezclas para la nutrición parenteral, debe tenerse en cuenta la relación entre la concentración de calcio y fosfatos. Un exceso de calcio y fosfato, especialmente en forma de sales inorgánicas, puede provocar la formación de depósitos de fosfato de calcio.
OLIMEL contiene iones de calcio que pueden aumentar el riesgo de formación de coágulos en los productos sanguíneos o componentes sanguíneos con citrato como anticoagulante/conservante.
No debe mezclarse ni administrarse ceftriakson al mismo tiempo que soluciones para infusión que contengan calcio, incluyendo el producto OLIMEL, a través de la misma línea de infusión (por ejemplo, a través de un conector en forma de Y) debido al riesgo de precipitación de sales de calcio de ceftriakson (véase los puntos 4.4 y 4.5 del prospecto). Ceftriakson y soluciones que contengan calcio pueden administrarse secuencialmente uno después del otro, si las líneas de infusión están insertadas en diferentes sitios o se intercambian o se limpian cuidadosamente con una solución salina fisiológica entre las infusiones, para evitar la formación de depósitos.
Debido al riesgo de precipitación, no debe administrarse el producto farmacéutico OLIMEL a través de la misma línea de infusión ni agregar a la ampicilina o a la fosfenitoína.
Debe verificar la compatibilidad con las soluciones administradas simultáneamente a través del mismo conjunto de infusión, catéter o cánula.
Debido al riesgo de pseudoaglutinación, no debe administrarse este producto antes, durante o después de la administración de sangre a través del mismo conjunto de infusión.
D. PRECAUCIONES ESPECIALES DE ELIMINACIÓN Y PREPARACIÓN DEL PRODUCTO FARMACÉUTICO PARA SU ADMINISTRACIÓN
PREPARACIÓN DEL PRODUCTO FARMACÉUTICO PARA SU ADMINISTRACIÓN
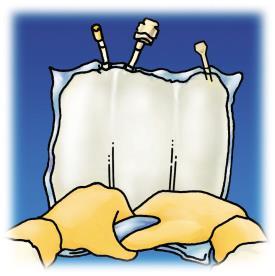
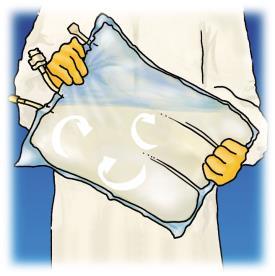
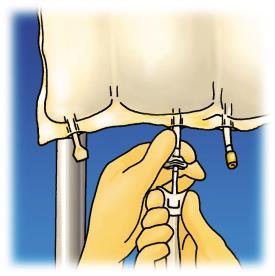
Revisión de las etapas de preparación para la administración de OLIMEL en la Figura 1.
Abrir
Retirar la bolsa de protección.
Descartar la bolsa que contiene el absorbente de oxígeno.
Asegurarse de que la bolsa o las soldaduras no estén dañadas. Solo debe utilizarse si la bolsa está sin dañar y las soldaduras están intactas (es decir, el contenido de las 3 cámaras no se ha mezclado), las soluciones de aminoácidos y glucosa son transparentes, incoloras o ligeramente amarillas, y prácticamente no contienen partículas visibles, y la emulsión grasosa es homogénea con un aspecto lechoso.
Mezclar las soluciones y la emulsión
Antes de romper las soldaduras, debe asegurarse de que el producto esté a temperatura ambiente.
Comenzando desde la parte superior de la bolsa (en el asa), enrollar la bolsa con ambas manos. Las soldaduras desaparecerán desde el lado de los puertos. Continuar enrollando la bolsa hasta que las soldaduras se rompan hasta la mitad de su longitud.
Mezclar, girando la bolsa al menos 3 veces.
Después de mezclar, el producto tiene la forma de una emulsión homogénea con un aspecto lechoso.
Componentes adicionales
El volumen de la bolsa es suficiente para permitir la adición de vitaminas, electrolitos y oligoelementos.
Todos los aditivos (incluyendo las vitaminas) deben introducirse en la emulsión preparada (después de romper las soldaduras y mezclar el contenido de las 3 cámaras).
Las vitaminas también pueden agregarse a la cámara que contiene la glucosa antes de preparar la emulsión (antes de romper las soldaduras y antes de mezclar el contenido de las tres cámaras).
Al introducir componentes adicionales en los productos que contienen electrolitos, debe tenerse en cuenta la cantidad de electrolitos ya presentes en la bolsa.
Los componentes adicionales deben introducirse por personal calificado en condiciones asépticas.
Puede agregar electrolitos al producto OLIMEL de acuerdo con la siguiente tabla:
| Por 1000 ml | |||
| Contenido | Agregado máximo | Contenido máximo | |
| Sodio | 35 mmol | 115 mmol | 150 mmol |
| Potasio | 30 mmol | 120 mmol | 150 mmol |
| Magnesio | 4,0 mmol | 1,6 mmol | 5,6 mmol |
| Calcio | 3,5 mmol | 1,5 (0,0a) mmol | 5,0 (3,5a) mmol |
| Fosfatos inorgánicos | 0 mmol | 3,0 mmol | 3,0 mmol |
| Fosfatos orgánicos | 15 mmolb | 10 mmol | 25 mmolb |
Oligoelementos y vitaminas:
Se ha demostrado la estabilidad después de agregar productos de vitaminas y oligoelementos disponibles en el mercado (que contienen como máximo 1 mg de hierro).
La compatibilidad con otros componentes adicionales está disponible a petición.
Al agregar componentes adicionales, debe:
- controlar las condiciones de asepsia,
- preparar el lugar de inyección en la bolsa,
- perforar el lugar de inyección y inyectar los componentes adicionales mediante una aguja para inyección o un dispositivo para preparar el producto farmacéutico,
- mezclar el contenido de la bolsa con los componentes adicionales.
Preparación de la infusión
Controlar las condiciones de asepsia.
Colgar la bolsa.
Retirar el protector de plástico del puerto de administración del producto farmacéutico.
Introducir firmemente la aguja del conjunto de infusión en el puerto de administración del producto farmacéutico.
Figura 1. Etapas de preparación para la administración de OLIMEL.
2. 3.



5. 6.
Administración
Únicamente para uso único.
Administrar el producto únicamente después de romper las soldaduras que dividen las 3 cámaras y mezclar su contenido.
Debe asegurarse de que en la emulsión lista para infusión no se produzca separación de fases.
Después de abrir la bolsa, su contenido debe ser utilizado de inmediato. No se debe almacenar
la bolsa abierta para la siguiente infusión. No conectar de nuevo las bolsas parcialmente utilizadas.
Para evitar la posibilidad de formación de émbolos aéreos causados por la presencia de gas
contenido en la primera bolsa, no conectar las bolsas en serie.
Todos los restos del producto no utilizado o sus desechos y el conjunto completo para infusión deben
ser destruidos.
Extravasación
El lugar de inserción del catéter debe ser monitoreado regularmente en busca de signos de extravasación.
En caso de extravasación, debe interrumpirse de inmediato la administración del preparado, dejando en su lugar
el catéter o la cánula introducida para iniciar de inmediato el tratamiento médico. Siempre que
sea posible, antes de retirar el catéter/cánula introducido, debe realizarse una aspiración del líquido a través
del catéter/cánula para reducir la cantidad de líquido en los tejidos.
Dependiendo del tipo de producto extravasado (incluido el producto o productos mezclados con el producto
OLIMEL, si corresponde) y del grado o extensión del posible daño, deben tomarse las medidas adecuadas
de rescate. Las opciones de tratamiento médico pueden incluir tratamiento no farmacológico,
farmacológico y (o) intervención quirúrgica. En caso de gran extravasación, debe consultarse con un cirujano plástico
antes de que transcurran 72 horas.
El lugar de extravasación debe ser monitoreado al menos cada cuatro horas durante el primer
período de 24 horas, y luego una vez al día.
No se debe reanudar la infusión en la misma vena central.
Baxter y Olimel son marcas registradas de Baxter International Inc.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBaxter S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Olimel N5eForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere receta
Alternativas a Olimel N5e en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Olimel N5e en España
Alternativa a Olimel N5e en Ucrania
Médicos online para Olimel N5e
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Olimel N5e – sujeta a valoración médica y normativa local.














