
Octanine F 1000

Consulta con un médico sobre la receta médica de Octanine F 1000

Cómo usar Octanine F 1000
Hoja de instrucciones del paquete: información para el usuario
OCTANINE F 500/OCTANINE F 1000, 500 UI / 1000 UI, polvo
y disolvente para la preparación de una solución para inyección
Factor de coagulación sanguínea humano IX
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de utilizar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es OCTANINE F y para qué se utiliza
- 2. Información importante antes de utilizar OCTANINE F
- 3. Cómo utilizar OCTANINE F
- 4. Posibles efectos adversos
- 5. Cómo conservar OCTANINE F
- 6. Contenido del paquete y otra información
1. Qué es OCTANINE F y para qué se utiliza
OCTANINE F pertenece a un grupo de medicamentos llamados factores de coagulación y contiene factor de coagulación sanguínea humano IX. Es una proteína especial que aumenta la capacidad de la sangre para coagular.
OCTANINE F se utiliza para el tratamiento y la prevención de hemorragias en pacientes con trastorno de coagulación (hemofilia B). Es una condición médica en la que la sangre tarda más de lo normal en coagularse.
OCTANINE F se suministra como polvo y disolvente para la preparación de una solución para inyección. Después de la reconstitución, se administra por vía intravenosa (inyección en una vena).
2. Información importante antes de utilizar OCTANINE F
Cuándo no utilizar OCTANINE F:
- si el paciente es alérgico al factor de coagulación sanguínea humano IX o a cualquier otro componente de este medicamento (enumerado en el punto 6),
- si el paciente ha experimentado trombocitopenia inducida por heparina de tipo II, que se caracteriza por una disminución del número de plaquetas en la sangre después de la administración de heparina. Las plaquetas son células sanguíneas que ayudan a detener el sangrado. La heparina se utiliza para prevenir la formación de coágulos sanguíneos.
Precauciones y advertencias
Antes de comenzar a utilizar OCTANINE F, debe discutirlo con su médico o farmacéutico.
- Todos los medicamentos que contienen proteínas administrados por vía intravenosa pueden causar una reacción de hipersensibilidad alérgica. OCTANINE F contiene muy pequeñas cantidades de otras proteínas que no sean el factor IX y la heparina. Los síntomas tempranos de una reacción de hipersensibilidad incluyen:
- urticaria,
- erupción (urticaria)
- sensación de opresión en el pecho,
- respiración sibilante,
- caída de la presión arterial,
- reacción alérgica grave (anafilaxia en caso de que alguno o todos los síntomas mencionados se desarrollen rápidamente y sean severos).
En caso de que ocurran los síntomas anteriores, debe detener inmediatamente la inyección y comunicarse con su médico. En caso de anafilaxia, el médico debe iniciar el tratamiento recomendado lo antes posible.
- Se recomienda la vacunación contra la hepatitis viral A y B en caso de uso regular o repetido de productos que contienen factor IX de coagulación sanguínea obtenido de plasma humano.
- Es conocido el fenómeno de la formación de inhibidores (anticuerpos neutralizantes) del factor IX, producidos por las células inmunitarias en pacientes con hemofilia B. Los inhibidores pueden aumentar el riesgo de reacciones alérgicas graves (anafilaxia). Por lo tanto, se recomienda realizar pruebas para detectar la presencia de inhibidores en pacientes con reacciones alérgicas. Los pacientes con inhibidores del factor IX están expuestos a un mayor riesgo de anafilaxia después de la administración del factor IX. Por lo tanto, la primera administración del factor IX, según la decisión del médico, debe realizarse bajo supervisión médica en un lugar donde se pueda proporcionar la ayuda adecuada en caso de reacciones alérgicas.
- Durante el uso de concentrados de proteínas que contienen factor IX, puede ocurrir la formación de coágulos en los vasos sanguíneos. Debido a este riesgo, que es mayor en el caso de productos poco purificados, los pacientes deben ser monitoreados para detectar signos de coágulos sanguíneos después de la administración de productos que contienen factor IX en caso de:
- aparición de signos de fibrinólisis (disolución de coágulos),
- pacientes con coagulación intravascular diseminada (coagulación sanguínea en los vasos sanguíneos),
- pacientes con enfermedades hepáticas diagnosticadas,
- existen factores de riesgo cardiovascular documentados
- pacientes después de cirugías recientes,
- pacientes con un mayor riesgo de coágulos o coagulación intravascular diseminada.
En caso de que ocurran alguno de los trastornos anteriores en un paciente determinado, el médico decidirá sobre la administración de OCTANINE F después de evaluar los beneficios potenciales del tratamiento en relación con el riesgo asociado con el uso del medicamento.
- Después del tratamiento repetido con productos que contienen factor IX de coagulación sanguínea humano, los pacientes deben ser monitoreados para detectar el desarrollo de anticuerpos neutralizantes (inhibidores), cuya cantidad se determina en unidades de Bethesda (BU), utilizando pruebas biológicas adecuadas.
Protección de los medicamentos derivados de la sangre contra la transmisión de agentes infecciosos
o En el caso de los medicamentos derivados de la sangre o el plasma humano, se utilizan métodos adecuados para prevenir la transmisión de infecciones a los pacientes.
Estos incluyen: una selección estricta de donantes de sangre y plasma para eliminar a los portadores de infecciones, pruebas de donaciones individuales y pools de plasma para detectar marcadores virales específicos. Los fabricantes de estos medicamentos también incorporan métodos en el proceso de producción para inactivar o eliminar los virus.
A pesar de esto, en el caso de la administración de medicamentos derivados de la sangre o el plasma humano, no se puede excluir completamente la transmisión de un agente infeccioso.
Esto se aplica también a los virus desconocidos o que acaban de aparecer, así como a otros tipos de infecciones.
o Estos métodos se consideran efectivos contra los virus con envoltura, como el virus de la inmunodeficiencia adquirida (VIH), el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), así como contra el virus de la hepatitis A (VHA) sin envoltura.
Los métodos utilizados pueden tener una eficacia limitada contra los virus sin envoltura, como el parvovirus B19.
La infección por parvovirus B19 puede ser grave en mujeres embarazadas (infección del feto) y en pacientes con deficiencias inmunitarias y ciertos tipos de anemia (por ejemplo, anemia falciforme o anemia hemolítica).
Se recomienda firmemente que, en cada administración de una dosis de OCTANINE F, se registre el nombre y el número de lote del producto para mantener un registro de los lotes utilizados.
Niños
En el caso de la administración de OCTANINE F a recién nacidos, deben ser monitoreados estrechamente para detectar signos de coagulación intravascular diseminada.
OCTANINE F y otros medicamentos
- No se conocen interacciones del factor IX de coagulación sanguínea humano con otros medicamentos.
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
Embarazo y lactancia
No hay experiencia con el uso del factor IX durante el embarazo y la lactancia.
Por lo tanto, el factor IX debe utilizarse durante el embarazo y la lactancia solo cuando esté estrictamente indicado.
Antes de tomar cualquier medicamento, debe consultar a su médico o farmacéutico.
OCTANINE F contiene sodio
El producto medicinal contiene hasta 69 mg de sodio (principal componente de la sal común) en una ampolla de OCTANINE F 500 UI, lo que equivale a un 3,45% de la dosis diaria máxima recomendada para adultos, y
hasta 138 mg de sodio en una ampolla de OCTANINE F 1000 UI, lo que equivale a un 6,9% de la dosis diaria máxima de 2 g de sodio para adultos.
Esto debe tenerse en cuenta en pacientes con una dieta con restricción de sodio.
Conducción de vehículos y uso de máquinas
No se ha observado ningún efecto en la capacidad de conducir vehículos o utilizar máquinas.
3. Cómo utilizar OCTANINE F
OCTANINE F debe utilizarse siempre según las indicaciones de su médico. En caso de dudas, debe consultar a su médico o farmacéutico.
OCTANINE F debe administrarse por vía intravenosa (inyección en una vena) después de la reconstitución en el disolvente suministrado.
Debe utilizar solo el conjunto de infusión suministrado. El uso de otros conjuntos para inyecciones/infusiones puede causar riesgos adicionales y fracaso del tratamiento.
El tratamiento debe iniciarse bajo la supervisión de un médico experimentado en el tratamiento de la hemofilia B. La dosis de OCTANINE F y la duración del tratamiento dependen del grado de deficiencia del factor IX. También depende del lugar y la extensión de la hemorragia, así como del estado clínico del paciente.
Cálculo de la dosis:
La dosis y la frecuencia de administración de OCTANINE F serán determinadas por su médico.
La cantidad de unidades del factor IX administradas se expresa en unidades internacionales (UI). La actividad del factor IX en el suero sanguíneo es equivalente al contenido de factor IX en el suero sanguíneo. Puede expresarse como un porcentaje (en relación con el suero sanguíneo humano normal) o en unidades internacionales (en relación con el estándar internacional para el factor IX en el suero sanguíneo).
Una unidad internacional (UI) de actividad del factor IX es equivalente a la cantidad de factor IX en 1 ml de suero sanguíneo humano normal. El cálculo de la dosis requerida se basa en la experiencia empírica que demuestra que 1 UI de factor IX por kilogramo de peso corporal aumenta la actividad del factor IX en el suero sanguíneo en un 1% de la actividad normal. Para calcular la dosis requerida, debe determinar la actividad del factor IX en el suero sanguíneo del paciente. Esto permitirá determinar cuánto debe aumentar la actividad.
Fórmula para calcular la dosis requerida:
Dosis requerida = peso corporal (kg) x aumento requerido de la actividad del factor IX (%) x 0,8
La dosis que debe administrarse y la frecuencia de administración del medicamento deben depender siempre de la eficacia clínica en cada paciente individual. Los medicamentos que contienen factor IX rara vez requieren administración más frecuente que una vez al día.
La respuesta al factor IX puede variar entre pacientes, por lo que es necesario determinar el nivel del factor durante el tratamiento para establecer la dosis administrada y la frecuencia de las infusiones. Especialmente en el caso de cirugías importantes, es necesario monitorear la actividad del factor IX en el suero sanguíneo durante el tratamiento sustitutivo.
Profílaxis de hemorragias:
En la profilaxis a largo plazo de hemorragias en pacientes con hemofilia B grave, se debe administrar el factor IX en una dosis de 20 a 40 UI por kilogramo de peso corporal dos veces a la semana. La dosis debe adaptarse a la respuesta individual del paciente al tratamiento. En algunos casos, especialmente en pacientes más jóvenes, puede ser necesario administrar el medicamento en intervalos de tiempo más cortos o en dosis más altas.
Uso en niños:
En un estudio clínico realizado en niños menores de 6 años, la dosis diaria promedio fue de 40 UI/kg de peso corporal.
Falta de control de la hemorragia debido a la presencia de inhibidores:
Si no se logra la actividad deseada del factor IX después de la inyección o la hemorragia no se detiene después de la administración de la dosis adecuada, debe informar a su médico. En tal caso, el médico recomendará realizar pruebas para detectar la presencia de inhibidores (anticuerpos) del factor IX. Los inhibidores pueden causar una disminución de la actividad del factor IX. En tal caso, puede ser necesario elegir un método de tratamiento alternativo. El médico decidirá sobre el tratamiento adicional si es necesario.
Uso de una dosis mayor que la recomendada de OCTANINE F
No se conocen síntomas de sobredosis del factor IX de coagulación sanguínea humano.
Sin embargo, no debe exceder la dosis recomendada.
Instrucciones para el tratamiento en el hogar se encuentran en el paquete del equipo.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
- Las reacciones de hipersensibilidad o alérgicas no se han observado con frecuencia en pacientes tratados con productos que contienen factor IX. Incluyeron:
espasmo de los vasos sanguíneos (espasmo) con hinchazón de la cara, la boca y la garganta,
dolor ardiente y picazón en el lugar de la inyección,
escalofríos,
enrojecimiento de la cara,
erupción,
dolor de cabeza,
urticaria,
caída de la presión arterial,
sensación de fatiga,
náuseas,
ansiedad,
latido cardíaco rápido,
sensación de opresión en el pecho,
sensación de hormigueo,
vómitos,
respiración sibilante.
En algunos casos, estas reacciones pueden conducir a una reacción grave llamada anafilaxia, incluyendo el choque. Estas reacciones están principalmente relacionadas con el desarrollo de inhibidores del factor IX. Debe informar a su médico si experimenta alguno de los síntomas mencionados.
- En pacientes con hemofilia B, pueden aparecer anticuerpos neutralizantes (inhibidores) contra el factor IX. Estos anticuerpos pueden ser responsables de la disminución de la eficacia del tratamiento. El médico debe discutir esto con el paciente y determinar el tratamiento adicional si es necesario. Se realizó un estudio clínico en 25 niños con hemofilia B, de los cuales 6 no habían sido tratados previamente. No se observó la formación de inhibidores durante el estudio. La tolerancia a todas las inyecciones se consideró "muy buena" y "buena".
- Algunos pacientes con hemofilia B con inhibidores del factor IX, a los que se les administró inducción de tolerancia inmunológica, desarrollaron síndrome nefrótico (enfermedad grave de los riñones).
- La fiebre puede ocurrir en casos raros.
- Los productos que contienen factor IX de baja pureza pueden causar, en casos raros, la formación de coágulos en los vasos sanguíneos. Esto puede conducir a las siguientes complicaciones:
infarto de miocardio,
síndrome de coagulación intravascular diseminada (CID),
coágulos en las venas (trombosis venosa),
coágulos en los pulmones (embolia pulmonar).
Estas complicaciones ocurren con más frecuencia en el caso de uso de productos de factor IX de baja pureza y son raras en el caso de uso de productos de alta pureza como OCTANINE F.
- La heparina contenida en el producto puede causar una disminución repentina del número de plaquetas por debajo de 100.000/µl o un 50% en relación con el número inicial. Esta es una reacción alérgica llamada "trombocitopenia inducida por heparina de tipo II". En casos raros, en pacientes sin alergia previa a la heparina, esta disminución del número de plaquetas puede ocurrir entre el 6º y el 14º día después del inicio del tratamiento. En pacientes con alergia previa a la heparina, este cambio puede ocurrir después de unas horas del inicio del tratamiento. Esta disminución grave del número de plaquetas puede causar o estar asociada con:
coágulos sanguíneos en las arterias y venas,
obstrucción del vaso sanguíneo por un coágulo que se ha formado en otro lugar,
trastorno grave de la coagulación llamado coagulopatía de consumo de factores de coagulación,
gangrena de la piel en el lugar de la inyección,
sangrado puntiforme,
moretones,
heces negras.
En caso de que ocurran estas reacciones alérgicas, debe detener inmediatamente la inyección de OCTANINE F y no utilizar en el futuro medicamentos
que contengan heparina.Debido a este efecto raro de la heparina en las plaquetas, el número de plaquetas en el paciente debe ser controlado con frecuencia, especialmente al iniciar el tratamiento.
Información relacionada con la protección contra los agentes infecciosos transmitidos, véase el punto 2 (debe tenerse especial cuidado al utilizar OCTANINE F).
Notificación de efectos adversos
Si ocurren efectos adversos, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Farmacéuticos de la Agencia de Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181C
- 02 - 222 Varsovia Tel.: + 48 22 49 21 301 Fax: + 48 22 49 21 309 correo electrónico: [email protected]
El efecto adverso también puede notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo conservar OCTANINE F
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No conservar a una temperatura superior a 25°C.
No congelar.
Conservar la ampolla en el paquete exterior para protegerla de la luz.
No utilizar este medicamento después de la fecha de caducidad indicada en la etiqueta y el paquete. La fecha de caducidad es el último día del mes indicado.
Se recomienda utilizar el producto reconstituido de inmediato, no más tarde de 8 horas después de la reconstitución, en un lugar a temperatura ambiente (25°C).
OCTANINE F solo debe utilizarse durante una administración. No debe utilizarse si se observa que las soluciones son turbias o no están completamente disueltas.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos.
Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene OCTANINE F?
El principio activo de este medicamento es el factor de coagulación sanguínea humano IX.
Los demás componentes son: heparina, cloruro de sodio, citrato de sodio, clorhidrato de arginina y clorhidrato de lisina.
Cómo se presenta OCTANINE F y qué contiene el paquete?
OCTANINE F se presenta en 2 tamaños de paquete con las siguientes potencias:
- OCTANINE F 500 se presenta en forma de polvo y disolvente para la preparación de una solución para inyección que contiene nominalmente 500 UI de factor de coagulación sanguínea humano IX en una ampolla.
Después de la reconstitución en 5 ml de agua para inyección, el producto contiene aproximadamente 100 UI/ml de factor de coagulación sanguínea humano IX.
- OCTANINE F 1000 se presenta en forma de polvo y disolvente para la preparación de una solución para inyección que contiene nominalmente 1000 UI de factor de coagulación sanguínea humano IX en una ampolla.
Después de la reconstitución en 10 ml de agua para inyección, el producto contiene aproximadamente 100 UI/ml de factor de coagulación sanguínea humano IX.
El producto OCTANINE F se fabrica a partir de plasma humano.
La actividad (en UI) se determina mediante una prueba de coagulación de un solo paso, de acuerdo con la Farmacopea Europea, en comparación con el estándar internacional de la Organización Mundial de la Salud (OMS). La actividad específica de OCTANINE F es de aproximadamente 100 UI/mg de proteína.
Descripción del paquete:
OCTANINE F se vende en un paquete que contiene dos cajas unidas por una tira de plástico.
Una caja contiene una ampolla con polvo para la preparación de una solución para inyección y la hoja de instrucciones para el paciente.
La otra caja contiene una ampolla con disolvente (agua para inyección); 5 ml para OCTANINE F 500 o 10 ml para OCTANINE F 1000.
El paquete también contiene los siguientes productos médicos:
- 1 paquete con equipo para inyección intravenosa (1 conjunto de transferencia, 1 conjunto de infusión, 1 jeringa de un solo uso),
- 2 algodones empapados en alcohol.
Título del responsable y fabricante
Para obtener más información sobre este medicamento, debe ponerse en contacto con el representante local del titular de la autorización de comercialización.
Octapharma (IP) SPRL
Allée de la Recherche 65
1070 Anderlecht
Bélgica
Fabricante:
Octapharma S.A.S
70-72 Rue du Maréchal Foch
67380 Lingolsheim
Francia
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235
1100 Viena
Austria
Fecha de la última actualización de la hoja de instrucciones: Marzo 2021
Instrucciones para el uso en el hogar
¡Lea todas las instrucciones y sígalas cuidadosamente!
¡Mantenga las condiciones estériles durante el procedimiento descrito a continuación!
No utilice el producto OCTANINE F después de la fecha de caducidad indicada en la etiqueta.
Antes de la administración, verifique visualmente que la solución preparada del producto no contenga partículas sólidas ni decoloración.
La solución debe ser transparente o ligeramente opalescente. No utilice soluciones que estén turbias o contengan partículas sólidas.
La solución preparada debe utilizarse de inmediato para evitar la contaminación microbiológica.
Utilice solo el conjunto de infusión suministrado. El uso de otros conjuntos para inyecciones/infusiones puede causar riesgos adicionales y fracaso del tratamiento.
Instrucciones para la preparación de la solución:
- 1. No utilice el producto directamente después de sacarlo del refrigerador. Deje el disolvente y el polvo en las ampollas cerradas hasta que alcancen la temperatura ambiente.
- 2. Retire los tapones de las dos ampollas y limpie los tapones de goma con uno de los algodones empapados en alcohol suministrados.
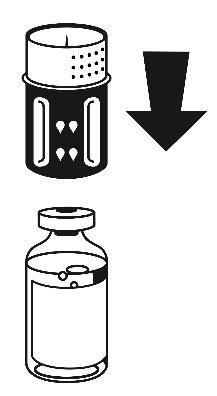
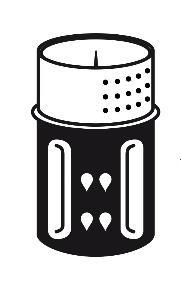
- 3. El conjunto de transferencia se muestra en la figura 1. Coloque la ampolla con disolvente en una superficie plana y sujétela firmemente. Tome el conjunto de transferencia y gírelo hacia arriba. Coloque la parte azul del conjunto de transferencia en la parte superior de la ampolla con disolvente y presione firmemente hasta que se bloquee (figura 2 + 3). No gire durante la conexión.
- 4. Coloque la ampolla con polvo en una superficie plana y sujétela firmemente
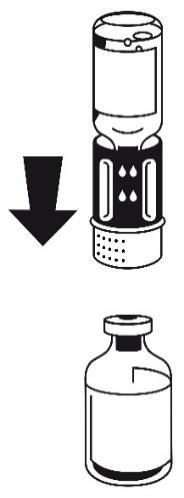
figura 1
figura 2
figura 3
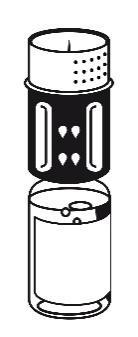
sujétela firmemente. Tome la ampolla con disolvente con el conjunto de transferencia conectado y gírela hacia arriba. Coloque la parte blanca del conjunto de transferencia en la parte superior de la ampolla con polvo y presione firmemente hasta que se bloquee (figura 4). No gire durante la conexión. El disolvente fluye automáticamente hacia la ampolla con polvo.
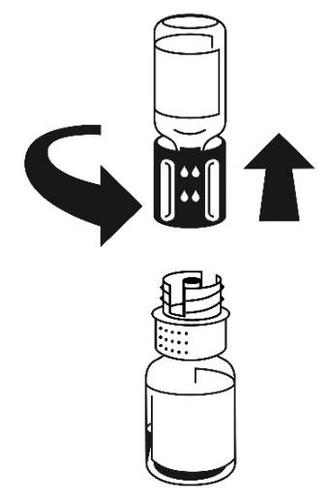
- 5. Con las dos ampollas aún conectadas, gire suavemente la ampolla con polvo hasta que el producto se disuelva. La disolución ocurrirá en menos de 10 minutos a temperatura ambiente. Durante la preparación, puede formarse una pequeña cantidad de espuma. Desenrosque el conjunto de transferencia en dos partes (figura 5). La espuma desaparecerá.
Deseche la ampolla vacía con disolvente junto con la parte azul del conjunto de transferencia.
Instrucciones para la administración de la inyección:
Como medida de precaución, antes de la inyección y durante la inyección, debe controlar el pulso. En caso de un aumento significativo de la frecuencia cardíaca, debe reducir la velocidad de inyección o interrumpir la administración del medicamento durante un corto período de tiempo.
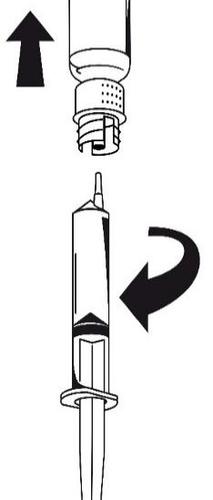
- 1. Conecte la jeringa al conjunto de transferencia blanco. Gire la ampolla hacia arriba y aspire la solución hacia la jeringa (figura 6).
La solución en la jeringa debe ser transparente o ligeramente opalescente.
Después de transferir la solución, sujete firmemente el émbolo de la jeringa (sosteniéndolo hacia abajo) y retire la jeringa del conjunto de transferencia (figura 7). Deseche la ampolla vacía junto con la parte blanca del conjunto de transferencia.
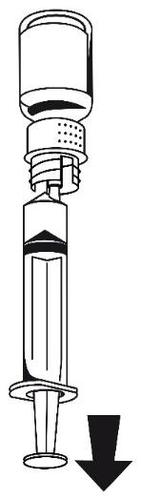
- 2. Limpie el lugar de la inyección elegido con uno de los algodones empapados en alcohol suministrados.
- 3. Conecte el conjunto de infusión suministrado a la jeringa.
- 4. Introduzca la aguja en la vena elegida. En caso de que se utilice una banda de compresión para hacer visible la vena, debe aflojar la banda antes de iniciar la inyección de OCTANINE F. La sangre no debe entrar en la jeringa debido al riesgo de formación de coágulos de fibrina.
- 5. Inyecte la solución lentamente en la vena, no más rápido de 2-3 ml por minuto.
En caso de que se utilicen más de una ampolla de polvo de OCTANINE F para un solo ciclo de tratamiento, es posible reutilizar la misma aguja y jeringa. El conjunto de transferencia está diseñado para un solo uso.
Todo el producto no utilizado o los desechos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorOctapharma Pharmazeutika Produktionsgesellschaft mbH (OPG) Octapharma S.A.S.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Octanine F 1000Forma farmacéutica: Polvo, 1000 UI/vialPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: LFB-Biomedicaments LFB-BiomedicamentsRequiere recetaForma farmacéutica: Polvo, 250 UI/vialPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: LFB-Biomedicaments LFB-BiomedicamentsRequiere recetaForma farmacéutica: Polvo, 500 UI/vialPrincipio activo: Factor de coagulación de la sangre humana IXFabricante: LFB-Biomedicaments LFB-BiomedicamentsRequiere receta
Alternativas a Octanine F 1000 en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Octanine F 1000 en España
Alternativa a Octanine F 1000 en Ucrania
Médicos online para Octanine F 1000
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Octanine F 1000 – sujeta a valoración médica y normativa local.














