
Numeta G16%e

Consulta con un médico sobre la receta médica de Numeta G16%e

Cómo usar Numeta G16%e
Hoja de instrucciones del paquete: información para el usuario
NUMETA G16%E, emulsión para infusión
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de administrar el medicamento, ya que contiene
información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico, farmacéutico o enfermera.
- Si su hijo presenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es NUMETA G16%E y para qué se utiliza
- 2. Información importante antes de administrar NUMETA G16%E a su hijo
- 3. Cómo administrar NUMETA G16%E
- 4. Efectos adversos
- 5. Cómo conservar NUMETA G16%E
- 6. Contenido del paquete y otra información
1. Qué es NUMETA G16%E y para qué se utiliza
NUMETA G16%E es una emulsión especializada para nutrición, destinada a recién nacidos a término y niños hasta 2 años. Se administra a través de un tubo introducido en una vena del niño, cuando el niño no puede ingerir todos los nutrientes por vía oral.
NUMETA se presenta en un bolsa de tres cámaras, donde cada cámara contiene:
solución de glucosa al 50%;
solución pediátrica de aminoácidos con electrolitos al 5,9%;
emulsión grasosa al 12,5%.
Según las necesidades del niño, se mezclan dos o tres de estas soluciones en la bolsa antes de administrarla al niño.
NUMETA G16%E solo debe utilizarse bajo control médico.
2. Información importante antes de administrar NUMETA G16%E a su hijo
Cuándo no debe administrarse NUMETA G16%E a su hijo:
En caso de 2 soluciones mezcladas en la bolsa ("2 en 1"):
- si su hijo es alérgico a las proteínas de la yema de huevo, la soja, los cacahuetes o alguno de los componentes presentes en la cámara de glucosa o aminoácidos (enumerados en el punto 6);
- si el cuerpo de su hijo no puede utilizar los componentes de construcción de las proteínas;
- si su hijo tiene un nivel elevado de alguno de los electrolitos presentes en NUMETA G16%E en la sangre;
- en el caso de un recién nacido (≤28 días de vida), NUMETA G16%E (o otras soluciones que contienen calcio) no debe administrarse al mismo tiempo que ceftriaxona (un antibiótico), incluso si se utilizan líneas de infusión separadas. Existe un riesgo de formación de partículas en la circulación del recién nacido, que pueden provocar la muerte.
- si su hijo tiene hiperglucemia (un nivel elevado de azúcar en la sangre).
En caso de 3 soluciones mezcladas en la bolsa ("3 en 1"):
- en todos los casos mencionados anteriormente para la solución "2 en 1" y, además:
- si su hijo tiene un nivel elevado de grasas en la sangre.
En todos los casos, el médico decide si se administra el medicamento, teniendo en cuenta la edad, el peso y el estado clínico del niño. El médico también considerará los resultados de todas las pruebas realizadas.
Precauciones y advertencias
Antes de comenzar a administrar NUMETA G16%E, debe discutirlo con su médico o enfermera.
En el caso de recién nacidos y niños menores de 2 años, la solución (en bolsas y conjuntos de administración) debe protegerse de la luz hasta el final de la administración. La exposición de NUMETA G16%E a la luz ambiental, especialmente después de mezclar con oligoelementos y/o vitaminas, provoca la formación de peróxidos y otros productos de degradación, lo que se puede reducir protegiendo de la luz.
Reacciones alérgicas:
Si aparecen signos o síntomas de reacción alérgica (como fiebre, sudoración, escalofríos, dolor de cabeza, erupciones cutáneas o dificultad para respirar), la infusión debe interrumpirse de inmediato.
Este medicamento contiene aceite de soja, que puede provocar reacciones de hipersensibilidad en personas alérgicas a las proteínas de la soja. NUMETA G16%E contiene glucosa producida a partir de almidón de maíz. Por lo tanto, NUMETA G16%E debe administrarse con precaución en pacientes con alergia conocida al maíz o productos que contienen maíz.
Riesgo de formación de depósitos con ceftriaxona (antibiótico):
Un antibiótico llamado ceftriaxona no debe mezclarse ni administrarse al mismo tiempo que ninguna solución que contenga calcio (incluido NUMETA G16%E) por infusión intravenosa.
El médico es consciente de esto y no administrará estos medicamentos al mismo tiempo, incluso a través de líneas de infusión o lugares de infusión diferentes.
Sin embargo, el médico puede administrar calcio y ceftriaxona secuencialmente, una después de la otra, si las líneas de infusión están insertadas en lugares diferentes o se intercambian o se lavan cuidadosamente con solución salina fisiológica entre las infusiones para evitar la formación de depósitos.
Formación de pequeñas partículas en los vasos sanguíneos de los pulmones:
Las dificultades para respirar también pueden ser un signo de que se han formado pequeñas partículas que bloquean los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares). Si su hijo experimenta dificultades para respirar, debe informar a su médico o enfermera. Ellos decidirán qué acción tomar.
Infección y sepsis:
El médico estará atento a los signos de infección en su hijo. El cumplimiento de las normas de asepsia (procedimientos que protegen contra los microorganismos) al introducir y mantener el catéter, así como durante la preparación de la mezcla nutricional, puede reducir el riesgo de infección.
A veces, si se coloca un tubo en una vena (catéter venoso), su hijo puede desarrollar una infección y sepsis (presencia de bacterias en la sangre). Algunos medicamentos y enfermedades pueden aumentar el riesgo de infección o sepsis. Los pacientes que requieren nutrición parenteral (administración de alimentos a través de un tubo en una vena) debido a su estado de salud pueden ser más propensos a desarrollar infecciones.
Síndrome de sobrecarga de grasas:
Se ha informado de la ocurrencia de síndrome de sobrecarga de grasas durante el uso de medicamentos similares.
La capacidad reducida o limitada del cuerpo para eliminar las grasas presentes en NUMETA G16%E o la sobredosis puede provocar el llamado síndrome de sobrecarga de grasas (véase los puntos 3 y 4).
Cambios en la composición química de la sangre:
El médico controlará y seguirá el estado de los fluidos en su hijo, la composición química de la sangre y el contenido de otras sustancias, ya que a veces la nutrición de personas gravemente desnutridas puede provocar cambios en la composición química de la sangre. También puede aparecer líquido adicional en los tejidos y edema. Se recomienda comenzar la nutrición parenteral de manera lenta y cuidadosa.
Nivel elevado de magnesio en la sangre:
La cantidad de magnesio presente en NUMETA G16%E puede provocar un nivel elevado de magnesio en la sangre. En este caso, pueden ocurrir los siguientes síntomas: debilidad, reacciones lentas, náuseas, vómitos, nivel bajo de calcio en la sangre, problemas para respirar, presión arterial baja y ritmo cardíaco irregular. Los síntomas pueden ser difíciles de detectar, por lo que el médico puede controlar el nivel de magnesio en la sangre de su hijo, especialmente en niños con factores de riesgo de nivel elevado de magnesio en la sangre, como trastornos renales. Si el nivel de magnesio en la sangre es elevado, se interrumpirá o reducirá la velocidad de administración del medicamento.
Monitoreo y ajuste:
El médico controlará y ajustará la administración de NUMETA según las necesidades individuales de su hijo en las siguientes circunstancias:
- Lesiones graves;
- Diabetes grave;
- Choque;
- Ataque al corazón;
- Infección grave;
- Ciertos tipos de coma.
Uso con precaución:
NUMETA debe administrarse con precaución si su hijo tiene:
- Edema pulmonar (líquido en los pulmones) o insuficiencia cardíaca;
- Trastornos hepáticos graves;
- Trastornos de absorción de nutrientes;
- Nivel elevado de azúcar en la sangre;
- Enfermedades renales;
- Trastornos graves del metabolismo (cuando el proceso de descomposición de sustancias no se produce de manera normal);
- Trastornos de coagulación de la sangre.
Se controlará cuidadosamente el contenido de fluidos en el cuerpo de su hijo, los resultados de las pruebas hepáticas y (o) sanguíneas.
NUMETA G16%E y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que su hijo esté tomando actualmente o haya tomado recientemente, así como sobre los medicamentos que su hijo tomará.
NUMETA no debe administrarse al mismo tiempo que:
- Ceftriaxona(antibiótico), incluso a través de líneas de infusión separadas, debido al riesgo de formación de partículas sólidas;
- Sangrea través del mismo conjunto de infusión, debido al riesgo de pseudoaglutinación (glóbulos rojos que se pegan);
- Ampicilina, fosfenitoína o furosemidaa través de la misma línea de infusión, debido al riesgo de formación de partículas sólidas.
Anticoagulantes como la warfarina:
El médico controlará a su hijo si está tomando warfarina.
La vitamina K1 es un componente natural del aceite de oliva y el aceite de soja. La vitamina K1 puede interactuar con medicamentos como la warfarina. Estos medicamentos son anticoagulantes que se utilizan para prevenir la coagulación de la sangre.
Pruebas de laboratorio:
Las lipoproteínas presentes en esta emulsión pueden afectar los resultados de ciertas pruebas de laboratorio.
Las pruebas de laboratorio deben realizarse después de 5 a 6 horas de la última administración de lipoproteínas.
Interacciones de NUMETA G16%E con medicamentos que pueden afectar el nivel de potasio/metabolismo:
NUMETA contiene potasio. Los niveles elevados de potasio en la sangre pueden provocar un ritmo cardíaco anormal. Se debe prestar atención especial a los pacientes que toman diuréticos (medicamentos que reducen la retención de líquidos) o inhibidores de la enzima convertidora de angiotensina (medicamentos utilizados para la hipertensión) o antagonistas del receptor de angiotensina II (medicamentos utilizados para la hipertensión) o medicamentos inmunosupresores (medicamentos que pueden reducir la respuesta inmune normal del cuerpo). Estos medicamentos pueden aumentar el nivel de potasio.
3. Cómo administrar NUMETA G16%E
NUMETA G16%E debe administrarse siempre a su hijo según las indicaciones de su médico. En caso de dudas, debe consultar a su médico.
Grupo de edad
NUMETA G16%E está diseñado para satisfacer las necesidades nutricionales de los recién nacidos a término y los niños hasta 2 años.
El médico de su hijo decidirá si este medicamento es adecuado para él.
Administración
Este medicamento es una emulsión para infusión. Se administra a través de un tubo de plástico en una vena del brazo o en una vena grande del tórax de su hijo.
El médico puede decidir no administrar lípidos a su hijo. La bolsa de NUMETA G16%E está diseñada para que, si es necesario, se puedan romper las paredes solo entre la cámara de aminoácidos/electrolitos y la cámara que contiene glucosa. En este caso, la pared entre la cámara de aminoácidos y los lípidos permanece intacta. De esta manera, el contenido de la bolsa se puede administrar sin lípidos.
En el caso de recién nacidos y niños menores de 2 años, la solución (en bolsas y conjuntos de administración) debe protegerse de la luz hasta el final de la administración (véase el punto 2).
Dosis y duración del tratamiento
El médico decidirá la dosis del medicamento y durante cuánto tiempo se administrará. La dosis depende de las necesidades nutricionales de su hijo. La dosis se determinará según el peso de su hijo, su estado clínico y la capacidad de su cuerpo para descomponer y utilizar los componentes de NUMETA G16%E. También se pueden administrar nutrientes adicionales o proteínas por vía oral/enteral.
Administración de una dosis mayor de la recomendada de NUMETA G16%E a su hijo
Síntomas
Una dosis excesiva del medicamento o una administración demasiado rápida puede provocar:
- náuseas;
- vómitos;
- convulsiones;
- trastornos electrolíticos (niveles anormales de electrolitos en la sangre);
- síntomas de hiperolemia (volumen aumentado de sangre en circulación);
- acidosis (aumento de la acidez de la sangre).
En estos casos, debe interrumpirse de inmediato la infusión. El médico decidirá si se requieren medidas adicionales.
La sobredosis de grasas presentes en NUMETA G16%E puede provocar la aparición del "síndrome de sobrecarga de grasas", que generalmente cede después de interrumpir la infusión. En recién nacidos (lactantes) y niños pequeños (hasta 2 años), el síndrome de sobrecarga de grasas se asocia con trastornos respiratorios que provocan una disminución del nivel de oxígeno en el cuerpo (insuficiencia respiratoria) y estados que provocan una mayor acidez de la sangre (acidosis).
Para prevenir estas situaciones, el médico controlará cuidadosamente el estado de su hijo y realizará pruebas de sangre durante el tratamiento.
4. Efectos adversos
Como cualquier medicamento, NUMETA G16%E puede provocar efectos adversos, aunque no todos los niños los experimentarán.
Si su hijo presenta algún cambio en su estado de salud durante o después del tratamiento, debe informar de inmediato a su médico o enfermera.
Las pruebas realizadas por el médico durante el tratamiento de su hijo deben minimizar el riesgo de efectos adversos.
Si aparecen síntomas de reacción alérgica, la infusión debe interrumpirse y debe consultar de inmediato a su médico. Puede ser grave y los síntomas pueden incluir:
- sudoración;
- escalofríos;
- dolor de cabeza;
- erupciones cutáneas;
- dificultad para respirar.
Otros efectos adversos observados:
Frecuentes: pueden afectar a 1 de cada 10 personas
- Nivel bajo de fosfatos en la sangre (hipofosfatemia)
- Nivel elevado de azúcar en la sangre (hiperglucemia)
- Nivel elevado de calcio en la sangre (hipercalcemia)
- Nivel elevado de triglicéridos en la sangre (hipertrigliceridemia)
- Trastornos electrolíticos (hiponatremia)
Poco frecuentes: pueden afectar a 1 de cada 100 personas
- Nivel elevado de lípidos en la sangre (hiperlipidemia)
- Estado en el que la bilis no puede fluir del hígado al duodeno (colestasis). El duodeno es una parte del intestino.
Frecuencia desconocida: no puede determinarse con los datos disponibles(Estos efectos adversos se han notificado solo después de la administración parenteral de NUMETA G13%E Preterm y NUMETA G16%E con un diluyente inadecuado).
- Necrosis de la piel
- Daño a los tejidos blandos
- Extravasación
Los siguientes efectos adversos se han notificado para otros medicamentos de nutrición parenteral:
La capacidad reducida o limitada para eliminar las grasas presentes en NUMETA G16%E puede provocar la aparición del síndrome de sobrecarga de grasas. Los siguientes signos y síntomas de este síndrome generalmente ceden después de interrumpir la infusión de la emulsión grasosa:
- Empeoramiento repentino y grave del estado clínico del paciente
- Nivel elevado de grasas en la sangre (hiperlipidemia)
- Fiebre
- Hepatomegalia (hígado agrandado)
- Disfunción hepática
- Disminución del recuento de glóbulos rojos, que puede provocar palidez y ser la causa de debilidad o disnea (anemia)
- Disminución del recuento de glóbulos blancos, que puede aumentar el riesgo de infección (leucopenia)
- Disminución del recuento de plaquetas, que puede aumentar el riesgo de moretones y (o) sangrado (trombocitopenia)
- Trastornos de coagulación de la sangre, que afectan la capacidad de la sangre para formar coágulos
- Trastornos respiratorios que provocan una disminución del nivel de oxígeno en el cuerpo (insuficiencia respiratoria)
- Estados que provocan una mayor acidez de la sangre (acidosis)
- Coma que requiere hospitalización
La formación de pequeñas partículas que pueden bloquear los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares) o dificultades para respirar.
Notificación de efectos adversos
Si su hijo presenta algún efecto adverso, debe consultar a su médico o enfermera. Esto incluye cualquier efecto adverso no mencionado en esta hoja de instrucciones.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Farmacéuticos de la Agencia de Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181 C
PL 02-222 Varsovia
Tel.: +48 22 49 21 301
Fax: +48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar NUMETA G16%E
El medicamento debe conservarse en un lugar donde no sea visible y no esté al alcance de los niños cuando no se esté administrando.
En el caso de recién nacidos y niños menores de 2 años, la solución (en bolsas y conjuntos de administración) debe protegerse de la luz hasta el final de la administración (véase el punto 2).
No debe administrarse este medicamento después de la fecha de caducidad indicada en la bolsa y el paquete exterior (MM/RRRR). La fecha de caducidad es el último día del mes indicado.
No debe congelarse.
Debe conservarse en la bolsa de protección.
No debe desecharse el medicamento por el desagüe o los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Cómo se presenta NUMETA G16%E y qué contiene el paquete
NUMETA se presenta en una bolsa de tres cámaras. El contenido de cada bolsa es estéril y consiste en una solución de glucosa, una solución de aminoácidos para niños con electrolitos y una emulsión grasosa, según se describe a continuación.
| Tamaño del recipiente | 50% solución de glucosa | 5,9% solución de aminoácidos con electrolitos | 12,5% emulsión grasosa |
| 500 ml | 155 ml | 221 ml | 124 ml |
Apariencia antes de la preparación:
- Las soluciones en las cámaras que contienen aminoácidos y glucosa son transparentes, incoloras o ligeramente amarillas
- La cámara de emulsión grasosa es un líquido blanco lechoso y homogéneo
Apariencia después de la preparación:
- Las soluciones para infusión "2 en 1" son transparentes, incoloras o ligeramente amarillas
- La emulsión para infusión "3 en 1" es un líquido blanco lechoso y homogéneo









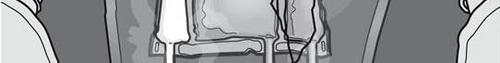
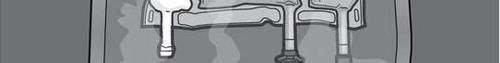
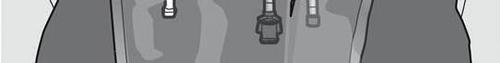




Figura 1
Figura 2
Preparación de la emulsión mezclada:
- Antes de romper las soldaduras, asegurarse de que el medicamento esté a temperatura ambiente.
- Colocar la bolsa en una superficie plana y limpia.
Activación de la bolsa de tres cámaras (mezcla de 3 soluciones abriendo dos soldaduras)
Paso 1: Comenzar a enrollar la bolsa desde el lado del gancho.
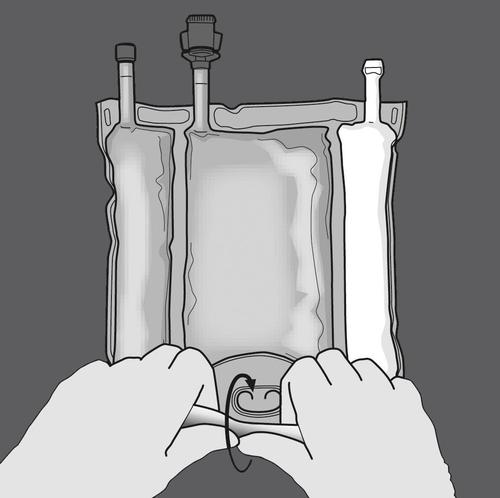
Paso 2: Presionar hasta que se abran las soldaduras.
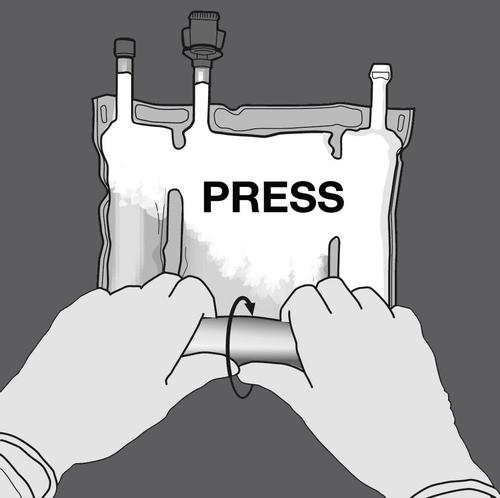
PRESIONAR
Paso 3: Cambiar la dirección enrollando la bolsa hacia el gancho.
Continuar hasta que se abra completamente la soldadura.
Repetir el mismo procedimiento para abrir completamente la segunda soldadura.
PRESIONAR
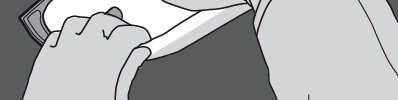

Paso 4: Girar la bolsa al menos tres veces para mezclar completamente el contenido.
La solución mezclada debe tener una apariencia de emulsión blanco lechosa.

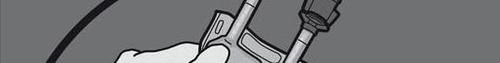






Paso 5: Retirar el tapón de protección del lugar de administración y conectar el conjunto de administración intravenosa.








Activación de la bolsa de dos cámaras (mezcla de 2 soluciones abriendo una soldadura)
Paso 1: Para mezclar solo 2 soluciones, enrollar la bolsa comenzando desde la esquina superior (con el gancho) junto a la soldadura que separa las soluciones.
Presionar para abrir la soldadura que separa las cámaras de glucosa y aminoácidos.
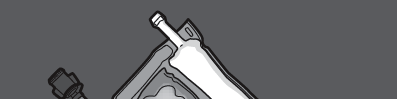
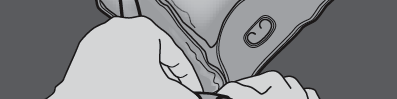
PRESIONAR

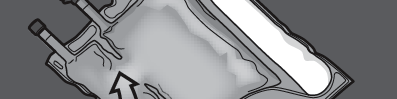
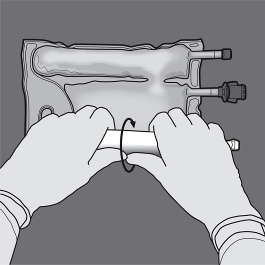
Paso 2: Colocar la bolsa de manera que la cámara de emulsión grasosa esté más cerca del usuario.
Enrollar la bolsa, protegiendo con las manos la cámara de emulsión grasosa.
Paso 3: Presionar con una mano y enrollar la bolsa hacia los tubos.

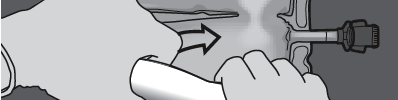
PRESIONAR


Paso 4: Cambiar la dirección enrollando la bolsa hacia la esquina superior (con el gancho).
Presionar con la segunda mano hasta que se abra completamente la soldadura que separa las soluciones de aminoácidos y glucosa.

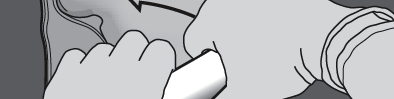
Información destinada exclusivamente al personal médico o de atención sanitaria
*En algunos casos, este medicamento puede administrarse en el hogar por los padres u otros cuidadores.
En estos casos, los padres/cuidadores deben leer la siguiente información.
No debe introducirse ningún componente adicional en la bolsa sin verificar antes la compatibilidad.
Esto puede provocar la formación de partículas sólidas o la desestabilización de la emulsión grasosa. Esto puede provocar la obstrucción de los vasos.
NUMETA G16%E debe alcanzar la temperatura ambiente antes de su uso.
Antes de administrar NUMETA G16%E, la bolsa se prepara como se muestra a continuación.
Debe asegurarse de que la bolsa no esté dañada. La bolsa solo se puede utilizar si no está dañada. A continuación, se indican las características de una bolsa no dañada:
- Las soldaduras están intactas. Esto indica que no se ha producido la mezcla del contenido de ninguna de las tres cámaras.
- Las soluciones que contienen aminoácidos y glucosa son transparentes, incoloras o ligeramente amarillas, sin partículas visibles.
- La emulsión grasosa es un líquido blanco lechoso y homogéneo.
Antes de abrir la bolsa de protección, debe verificar el color del absorbente de oxígeno.
- Debe compararlo con el color de referencia impreso junto al símbolo OK y mostrado en el área impresa de la etiqueta del indicador.
- No debe administrarse el medicamento si el color del indicador de oxígeno no coincide con el color de referencia impreso junto al símbolo OK.
Las figuras 1 y 2 muestran cómo retirar la bolsa de protección. Desechar la bolsa de protección, el indicador de oxígeno y el absorbente de oxígeno.
Paso 1: Comenzar a enrollar la bolsa desde el lado del gancho.
Paso 2: Presionar hasta que se abran las soldaduras.
PRESIONAR
Paso 3: Cambiar la dirección enrollando la bolsa hacia el gancho.
Continuar hasta que se abra completamente la soldadura.
Repetir el mismo procedimiento para abrir completamente la segunda soldadura.
PRESIONAR
Paso 4: Girar la bolsa al menos tres veces para mezclar completamente el contenido.
La solución mezclada debe tener una apariencia de emulsión blanco lechosa.
Paso 5: Retirar el tapón de protección del lugar de administración y conectar el conjunto de administración intravenosa.
Activación de la bolsa de dos cámaras (mezcla de 2 soluciones abriendo una soldadura)
Paso 1: Para mezclar solo 2 soluciones, enrollar la bolsa comenzando desde la esquina superior (con el gancho) junto a la soldadura que separa las soluciones.
Presionar para abrir la soldadura que separa las cámaras de glucosa y aminoácidos.
PRESIONAR
Paso 2: Colocar la bolsa de manera que la cámara de emulsión grasosa esté más cerca del usuario.
Enrollar la bolsa, protegiendo con las manos la cámara de emulsión grasosa.
Paso 3: Presionar con una mano y enrollar la bolsa hacia los tubos.
PRESIONAR
Paso 4: Cambiar la dirección enrollando la bolsa hacia la esquina superior (con el gancho).
Presionar con la segunda mano hasta que se abra completamente la soldadura que separa las soluciones de aminoácidos y glucosa.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Varsovia
Fabricante
Baxter S.A.
Boulevard Rene Branquart 80
7860 Lessines
Bélgica
Este producto farmacéutico está autorizado para su comercialización en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Países:
| Austria, Alemania | Numeta G 16 % E Emulsión para infusión |
| Bélgica, Luxemburgo | NUMETZAH G16%E, emulsión para perfusión |
| Francia | NUMETAH G16 %E, emulsión para perfusión |
| Dinamarca, Noruega, Suecia | Numeta G16E |
| República Checa, Grecia | NUMETA G 16 % E |
| Países Bajos | NUMETA G16%E emulsión para infusión |
| Irlanda, Reino Unido | Numeta G16%E, emulsión para infusión |
| Italia | NUMETA G16%E emulsión para infusión |
| Finlandia | Numeta G16E infusión, emulsión |
| Polonia | NUMETA G16%E |
| Portugal | Numeta G16%E |
| España | NUMETA G16%E, emulsión para perfusión |
Fecha de la última actualización de la hoja de instrucciones: mayo 2024
PULSAR


Paso 5: Girar el bolsillo al menos tres veces para mezclar bien el contenido.
La solución mezclada debe ser transparente, incolora o ligeramente amarilla.







Paso 6: Retirar el tapón protector del lugar de administración del medicamento e introducir el conjunto de administración intravenosa.
Durante la primera hora, la velocidad de flujo debe aumentarse gradualmente. La velocidad de flujo de administración debe ajustarse según los siguientes factores:








- dosis administrada
- volumen diario consumido
- tiempo de infusión.
Método de administración:
En caso de uso en recién nacidos y niños menores de 2 años, la solución (en bolsillos y conjuntos de administración) debe protegerse de la luz hasta el final de la administración.
Se recomienda el uso de un filtro de 1,2 micras para la administración del medicamento NUMETA G16%E.
Debido a la alta osmolalidad, el medicamento NUMETA G16%E no diluido solo se puede administrar a través de una vena central. La dilución adecuada del medicamento NUMETA G16%E con agua para inyección reduce la osmolalidad y permite la infusión en un vaso periférico.
La siguiente fórmula muestra el efecto de la dilución en la osmolalidad del medicamento.
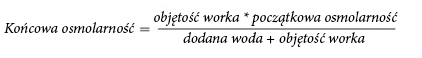
En la siguiente tabla se presentan ejemplos de osmolalidad de un bolsillo de dos cámaras activado y un bolsillo de tres cámaras activado después de agregar agua para inyección:
| Aminocidos y glucosa (bolsillo W2K activado) | Aminocidos, glucosa y lípidos (bolsillo W3K activado) | |
| Volumen inicial en el bolsillo (ml) | 376 | 500 |
| Osmolalidad inicial (mOsm/l aproximadamente) | 1585 | 1230 |
| Volumen de agua agregada (ml) | 376 | 500 |
| Volumen final después de agregar (ml) | 752 | 1000 |
| Osmolalidad después de agregar (mOsm/l aproximadamente) | 792,5 | 615 |
Introducción de componentes adicionales:
La exposición a la luz de soluciones para nutrición parenteral, especialmente después de mezclar con oligoelementos y (o) vitaminas, puede tener un efecto adverso en los resultados clínicos en recién nacidos, debido a la producción de peróxidos y otros productos de degradación. En caso de uso en recién nacidos y niños menores de 2 años, el medicamento NUMETA G16%E debe protegerse de la luz ambiental hasta el final de la administración.
Los componentes adicionales compatibles se pueden agregar a la mezcla reconstituida a través del lugar de inyección (después de abrir las soldaduras rompibles y mezclar el contenido de dos o tres cámaras).
Las vitaminas también se pueden agregar a la cámara que contiene glucosa antes de reconstituir la mezcla (antes de abrir las soldaduras rompibles y antes de mezclar las soluciones y emulsiones).
Se presentan a continuación los aditivos posibles de soluciones listas de oligoelementos (identificados como TE1, TE2 y TE4), vitaminas (identificados como liofilizado V1 y emulsión V2) y electrolitos en cantidades específicas antes de la administración.
- 1.Compatibilidad con TE4, V1 y V2
Tabla 1: Compatibilidad 3-en-1 (bolsillo W3K activado) con dilución con agua y sin dilución
| Para 500 ml (después de mezclar 3 cámaras, con lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 12,0 | 25,6 | 37,6 | 12,0 | 25,6 | 37,6 |
| Potasio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 26,2 | 37,6 |
| Magnesio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 3,6 | 5,2 |
| Calcio (mmol) | 3,1 | 16,4 | 19,5 | 3,1 | 8,2 | 11,3 |
| Fosfatos* (mmol) | 4,4 | 6,9 | 11,3 | 4,4 | 6,9 | 11,3 |
| Oligoelementos y vitaminas | 10 ml TE4 + 1 vial V1 + 30 ml V2 | 10 ml TE4 + 1 vial V1 + 30 ml V2 | 5 ml TE4 + ½ vial V1 + 5 ml V2 | 5 ml TE4 + ½ vial V1 + 5 ml V2 | ||
| Agua para inyección | 350 ml | 350 ml | ||||
Tabla 2: Compatibilidad 2-en-1 (bolsillo W2K activado) con dilución con agua y sin dilución
| Para 376 ml (después de mezclar 2 cámaras, sin lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potasio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnesio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Calcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 3,2 |
| 11,3 | 3,2 | 0,0 | 3,2 |
| Oligoelementos y vitaminas | 5 ml TE4 + ½ vial V1 | 5 ml TE4 + ½ vial V1 | 5 ml TE4 + ½ vial V1 | 5 ml TE4 + ½ vial V1 | ||
| Agua para inyección | 450 ml | 450 ml | ||||
- 2.Compatibilidad con TE1, V1 y V2Tabla 3: Compatibilidad 3-en-1 (bolsillo W3K activado) con dilución con agua y sin dilución
| Para 500 ml (después de mezclar 3 cámaras, con lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Potasio (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnesio (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Calcio (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Oligoelementos y vitaminas | 5 ml TE1 + ½ vial V1 + 5 ml V2 | 5 ml TE1 + ½ vial V1 + 5 ml V2 | 5 ml TE1 + ½ vial V1 + 5 ml V2 | 5 ml TE1 + ½ vial V1 + 5 ml V2 | ||
| Agua para inyección | 350 ml | 350 ml | ||||
Tabla 4: Compatibilidad 2-en-1 (bolsillo W2K activado) con dilución con agua y sin dilución
| Para 376 ml (después de mezclar 2 cámaras, sin lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potasio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnesio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Calcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Oligoelementos y vitaminas | 5 ml TE1 + ½ vial V1 | 5 ml TE1 + ½ vial V1 | 5 ml TE1 + ½ vial V1 | 5 ml TE1 + ½ vial V1 | ||
| Agua para inyección | 450 ml | 450 ml | ||||
- 3.Compatibilidad con TE2, V1 y V2Tabla 5: Compatibilidad 3-en-1 (bolsillo W3K activado) con dilución con agua y sin dilución
| Para 500 ml (después de mezclar 3 cámaras, con lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 12,0 | 4,0 | 16,0 | 12,0 | 0,0 | 12,0 |
| Potasio (mmol) | 11,4 | 6,2 | 17,6 | 11,4 | 0,0 | 11,4 |
| Magnesio (mmol) | 1,6 | 0 | 1,6 | 1,6 | 0,0 | 1,6 |
| Calcio (mmol) | 3,1 | 2,1 | 5,2 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 4,4 | 2,0 | 6,4 | 4,4 | 0,0 | 4,4 |
| Oligoelementos y vitaminas | 5 ml TE2 + ½ vial V1 + 5 ml V2 | 5 ml TE2 + ½ vial V1 + 5 ml V2 | 5 ml TE2 + ½ vial V1 + 5 ml V2 | 5 ml TE2 + ½ vial V1 + 5 ml V2 | ||
| Agua para inyección | 350 ml | 350 ml | ||||
Tabla 6: Compatibilidad 2-en-1 (bolsillo W2K activado) con dilución con agua y sin dilución
| Para 376 ml (después de mezclar 2 cámaras, sin lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 11,6 | 26,0 | 37,6 | 11,6 | 0,0 | 11,6 |
| Potasio (mmol) | 11,4 | 26,2 | 37,6 | 11,4 | 0,0 | 11,4 |
| Magnesio (mmol) | 1,6 | 3,6 | 5,2 | 1,6 | 0,0 | 1,6 |
| Calcio (mmol) | 3,1 | 8,2 | 11,3 | 3,1 | 0,0 | 3,1 |
| Fosfatos* (mmol) | 3,2 | 8,1 | 11,3 | 3,2 | 0,0 | 3,2 |
| Oligoelementos y vitaminas | 5 ml TE2 + ½ vial V1 | 5 ml TE2 + ½ vial V1 | 5 ml TE2 + ½ vial V1 | 5 ml TE2 + ½ vial V1 | ||
| Agua para inyección | 450 ml | 450 ml | ||||
Composición de los preparados que contienen vitaminas y oligoelementos presentados en la Tabla 7 y 8.
Tabla 7: Composición del preparado listo que contiene oligoelementos:
| Composición por vial de 10 ml | TE1 | TE2 | TE4 |
| Hierro | 8,9 µmol o 0,5 mg | ||
| Cinc | 38,2 µmol o 2,5 mg | 15,3 µmol o 1 mg | 15,3 µmol o 1 mg |
| Selenio | 0,253 µmol o 0,02 mg | 0,6 µmol o 0,05 mg | 0,253 µmol o 0,02 mg |
| Cobre | 3,15 µmol o 0,2 mg | 4,7 µmol o 0,3 mg | 3,15 µmol o 0,2 mg |
| Yodo | 0,0788 µmol o 0,01 mg | 0,4 µmol o 0,05 mg | 0,079 µmol o 0,01 mg |
| Flúor | 30 µmol o 0,57 mg | 26,3 µmol o 0,5 mg | |
| Molibdeno | 0,5 µmol o 0,05 mg | ||
| Manganeso | 0,182 µmol o 0,01 mg | 1,8 µmol o 0,1 mg | 0,091 µmol o 0,005 mg |
| Cobalto | 2,5 µmol o 0,15 mg | ||
| Cromo | 0,4 µmol o 0,02 mg 18 |
Tabla 8: Composición del preparado listo que contiene vitaminas:
Introducción de componentes adicionales:
- Debe mantenerse la esterilidad.
- Preparar el lugar de inyección en el bolsillo.
- Perforar el lugar de inyección y agregar los componentes adicionales mediante una aguja para inyección o un dispositivo para preparar medicamentos.
- Mezclar el contenido del bolsillo con los componentes adicionales.
Preparación de la infusión:
- Debe mantenerse la esterilidad.
- Colgar el bolsillo.
- Retirar el protector de plástico del puerto de administración del medicamento.
- Introducir decididamente la aguja del conjunto de infusión en el puerto de administración del medicamento.
Administración de la infusión:
- Solo para uso único.
- Administrar el medicamento solo después de romper las soldaduras entre dos o tres cámaras y mezclar el contenido de dos o tres cámaras.
- Debe asegurarse de que en la emulsión lista del bolsillo de tres cámaras activado para infusión no se produzca separación de fases o en la solución lista del bolsillo de dos cámaras para infusión no haya partículas sólidas.
- Se recomienda el uso inmediato después de abrir las soldaduras rompibles. No debe almacenarse el medicamento NUMETA G16%E para la próxima infusión.
- No conectar bolsillos parcialmente utilizados.
- Para evitar la formación de un émbolo aéreo causado por el aire residual contenido en el primer bolsillo, no conectar los bolsillos en serie.
- Se recomienda el uso de un filtro de 1,2 micras para la administración del medicamento NUMETA G16%E.
- En caso de uso en recién nacidos y niños menores de 2 años, debe protegerse de la luz hasta el final de la administración. La exposición del medicamento NUMETA G16%E a la luz ambiental, especialmente después de mezclar con oligoelementos y (o) vitaminas, produce la formación de peróxidos y otros productos de degradación, lo que se puede reducir protegiendo de la luz.
- Debe eliminarse adecuadamente cualquier residuo de medicamento no utilizado o desecho y todo el conjunto de uso único requerido.
| Composición por vial | V1 | V2 |
| Vitamina B1 | 2,5 mg | |
| Vitamina B2 | 3,6 mg | |
| Nicotinamida | 40 mg | |
| Vitamina B6 | 4,0 mg | |
| Ácido pantoténico | 15,0 mg | |
| Biotina | 60 µg | |
| Ácido fólico | 400 µg | |
| Vitamina B12 | 5,0 µg | |
| Vitamina C | 100 mg | |
| Vitamina A | 2300 UI | |
| Vitamina D | 400 UI | |
| Vitamina E | 7 UI | |
| Vitamina K | 200 µg |
Período de validez después de mezclar las soluciones:
El medicamento debe usarse inmediatamente después de abrir las soldaduras rompibles entre dos o tres cámaras.
Los estudios de estabilidad de las mezclas se realizaron durante 7 días a una temperatura de 2°C a 8°C, y luego durante 48 horas a 30°C.
Período de validez después de agregar componentes adicionales (electrolitos, oligoelementos, vitaminas, agua)
Para los componentes adicionales específicos, se demostró la estabilidad física del medicamento NUMETA durante 7 días a una temperatura de 2°C a 8°C, y luego durante 48 horas a 30°C.
Desde el punto de vista microbiológico, el medicamento debe usarse inmediatamente. Si no se usa inmediatamente, el usuario es responsable del tiempo y las condiciones de almacenamiento hasta su uso, pero estándarmente no debe exceder las 24 horas a una temperatura de 2°C a 8°C, a menos que la preparación/dilución/agregado de componentes adicionales se realice en condiciones asépticas controladas y validadas.
No debe administrarse el medicamento NUMETA G16%E si el bolsillo está dañado. A continuación, se presentan las características de un bolsillo dañado:
- Las soldaduras rompibles están abiertas
- Cualquiera de las cámaras contiene una mezcla de soluciones
- Las soluciones que contienen aminocidos y glucosa no son transparentes, incoloras o ligeramente amarillas y (o) contienen partículas visibles
- La emulsión lipídica no es un líquido homogéneo de apariencia lechosa.
No debe desecharse el medicamento por el desagüe o los contenedores de residuos domésticos. Debe preguntar al farmacéutico qué hacer con los medicamentos que ya no se necesitan. Este procedimiento ayudará a proteger el medio ambiente.
Qué contiene el medicamento NUMETA G16%E
Principios activos:
| Composición | ||
| Principio activo | Bolsillo W2K activado (376 ml) | Bolsillo W3K activado (500 ml) |
| Cámara con aminocidos | ||
| Alanina | 1,03 g | 1,03 g |
| Arginina | 1,08 g | 1,08 g |
| Ácido aspártico | 0,77 g | 0,77 g |
| Cisteina | 0,24 g | 0,24 g |
| Ácido glutámico | 1,29 g | 1,29 g |
| Glicina | 0,51 g | 0,51 g |
| Histidina | 0,49 g | 0,49 g |
| Isoluecina | 0,86 g | 0,86 g |
| Leucina | 1,29 g | 1,29 g |
| Lisina monohidratada (equivalente a lisina) | 1,59 g (1,42 g) | 1,59 g (1,42 g) |
| Metionina | 0,31 g | 0,31 g |
| Ornina clorhidrato (equivalente a ornitina) | 0,41 g (0,32 g) | 0,41 g (0,32 g) |
| Fenilalanina | 0,54 g | 0,54 g |
| Prolina | 0,39 g | 0,39 g |
| Serina | 0,51 g | 0,51 g |
| Taurina | 0,08 g | 0,08 g |
| Treonina | 0,48 g | 0,48 g |
| Triptófano | 0,26 g | 0,26 g |
| Tirosina | 0,10 g | 0,10 g |
| Valina | 0,98 g | 0,98 g |
| Cloruro de sodio | 0,30 g | 0,30 g |
| Acetato de potasio | 1,12 g | 1,12 g |
| Cloruro de calcio dihidratado | 0,46 g | 0,46 g |
| Acetato de magnesio tetrahidratado | 0,33 g | 0,33 g |
| Glicerofosfato de sodio hidratado | 0,98 g | 0,98 g |
| Cámara con glucosa | ||
| Glucosa monohidratada (equivalente a glucosa anhidra) | 85,25 g (77,50 g) | 85,25 g (77,50 g) |
| Cámara con lípidos | ||
| Aceite de oliva purificado (aproximadamente 80%) + aceite de soja purificado (aproximadamente 20%) | 15,5 g | |
La solución/emulsión después de mezclar contiene los siguientes componentes:
| Composición | |||||||||||||||||||
| Bolsillo W2K activado | Bolsillo W3K activado | ||||||||||||||||||
| Por unidad de volumen (ml) | Azot (g) | Aminocidos (g) | Glucosa (g) | Lípidos (g) | Valor energético | Valor energético total (kcal) | Valor energético no proteico (kcal) | Valor energético de la glucosa (kcal) | Valor energético lipídico (kcal) | Valor energético no proteico/azot (kcal/g N) | Valor energético lipídico/valor energético no proteico (%) | Valor energético lipídico/valor energético total (%) | Electrolitos | Sodio (mmol) | Potasio (mmol) | Magnesio (mmol) | Calcio (mmol) | Fosfatos* (mmol) | |
| 376 | 2,0 | 13,0 | 77,5 | 0 | 362 | 310 | 310 | 0 | 158 | No aplica | No aplica | 11,6 | 11,4 | 1,6 | 3,1 | 3,2 | |||
| 100 | 0,52 | 3,5 | 20,6 | 0 | 96 | 82 | 82 | 0 | 158 | No aplica | No aplica | 3,1 | 3,0 | 0,41 | 0,82 | 0,85 | |||
| 500 | 2,0 | 13,0 | 77,5 | 15,5 | 517 | 465 | 310 | 155 | 237 | 33 | 30 | 12,0 | 11,4 | 1,6 | 3,1 | 4,4 | |||
| 100 | 0,39 | 2,6 | 15,5 | 3,1 | 103 | 93 | 62 | 31 | 237 | 33 | 30 | 2,4 | 2,3 | 0,31 | 0,62 | 0,87 | |||
| Octanatos (mmol) | Jablonatos (mmol) | Cloruros (mmol) | pH (aproximadamente) | Osmolalidad (aproximadamente) (mOsm/l) |
| 14,5 | 4,3 | 13,8 | 5,5 | 1585 |
| 3,9 | 1,1 | 3,7 | 5,5 | 1585 |
| 14,5 | 4,3 | 13,8 | 5,5 | 1230 |
| 2,9 | 0,86 | 2,8 | 5,5 | 1230 |
En este caso, el valor energético de los fosfolípidos del huevo para inyección.
En este caso, los fosfatos de los fosfolípidos del huevo para inyección que son un componente de la emulsión lipídica.
Componentes no activos:
Ácido L-málico
Ácido clorhídrico
Fosfolípidos del huevo para inyección
Glicerol
Oleinato de sodio
Hidróxido de sodio
Agua para inyección
para ajustar el pH
Baxter, Numeta, Numetzah y Numetah son marcas registradas de Baxter International Inc.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBaxter S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Numeta G16%eForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere receta
Alternativas a Numeta G16%e en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Numeta G16%e en España
Alternativa a Numeta G16%e en Ucrania
Médicos online para Numeta G16%e
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Numeta G16%e – sujeta a valoración médica y normativa local.














