
Numeta G13%e Preterm

Consulta con un médico sobre la receta médica de Numeta G13%e Preterm

Cómo usar Numeta G13%e Preterm
Hoja de instrucciones del paquete: información para el usuario
NUMETA G13%E Preterm, emulsión para infusión
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
Información importante para el paciente.
- Conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, consultar al médico del niño, farmacéutico o enfermera.
- Si el niño experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, informar al médico que lo está tratando o a la enfermera. Ver sección 4.
Índice de la hoja de instrucciones
- 1. Qué es NUMETA G13%E Preterm y para qué se utiliza
- 2. Información importante antes de administrar NUMETA G13%E Preterm al niño
- 3. Cómo usar NUMETA G13%E Preterm
- 4. Posibles efectos adversos
- 5. Cómo conservar NUMETA G13%E Preterm
- 6. Contenido del paquete y otra información
1. Qué es NUMETA G13%E Preterm y para qué se utiliza
NUMETA G13%E Preterm es una emulsión especializada para nutrición, destinada a recién nacidos prematuros. Se administra a través de un tubo introducido en una vena del niño, cuando el niño no puede ingerir todos los nutrientes por vía oral.
El medicamento NUMETA se presenta en un paquete de tres cámaras, donde cada cámara contiene:
- solución de glucosa al 50%;
- solución pediátrica de aminoácidos con electrolitos al 5,9%;
- emulsión grasosa al 12,5%.
Según las necesidades del niño, se mezclan dos o tres de estas soluciones en el paquete antes de administrarlas al niño.
El medicamento NUMETA G13%E Preterm debe usarse únicamente bajo el control de un médico.
2. Información importante antes de administrar NUMETA G13%E Preterm al niño
Cuándo no debe administrarse NUMETA G13%E Preterm al niño:
En el caso de las soluciones de glucosa y aminoácidos con electrolitos mezcladas en el paquete („2 en 1”):
- si el niño es alérgico a los huevos, la soja, los cacahuetes o cualquier otro componente de este medicamento o a los componentes del paquete (enumerados en el punto 6);
- si el organismo del niño no puede utilizar los componentes de construcción de las proteínas;
- si en la sangre del niño hay una concentración alta de alguno de los electrolitos presentes en NUMETA G13%E Preterm;
- el medicamento NUMETA G13%E Preterm (o otras soluciones que contienen calcio) no debe administrarse al mismo tiempo que la ceftriaxona (un antibiótico), incluso si se utilizan líneas de infusión separadas. Existe el riesgo de formación de partículas en la circulación del recién nacido, que pueden provocar la muerte.
- si el niño tiene hiperglucemia (una concentración particularmente alta de azúcar en la sangre).
En el caso de las soluciones con glucosa, aminoácidos con electrolitos y emulsión grasosa mezcladas en el paquete („3 en 1”):
En todos los casos mencionados anteriormente para el medicamento „2 en 1” y, además:
- si el niño tiene una concentración particularmente alta de grasas en la sangre.
En todos los casos, el médico decide si se administra el medicamento, teniendo en cuenta la edad, el peso y el estado clínico del niño. El médico también tendrá en cuenta los resultados de todas las pruebas realizadas.
Precauciones y advertencias
Antes de comenzar a administrar NUMETA G13%E Preterm, debe discutirlo con el médico que lo está tratando o con la enfermera.
En el caso de recién nacidos y niños menores de 2 años, la solución (en paquetes y conjuntos para administración) debe protegerse de la luz hasta el final de la administración. La exposición del medicamento NUMETA G13%E Preterm a la luz ambiental, especialmente después de mezclarlo con oligoelementos y (o) vitaminas, provoca la formación de peróxidos y otros productos de degradación, lo que se puede reducir protegiéndolo de la luz.
Reacciones alérgicas:
Debe interrumpirse inmediatamente la infusión si se producen signos o síntomas de reacción alérgica (como fiebre, sudoración, escalofríos, dolor de cabeza, erupciones cutáneas o dificultad para respirar). Este medicamento contiene aceite de soja, que puede provocar reacciones de hipersensibilidad en casos raros. En algunas personas alérgicas a las proteínas de los cacahuetes, también se han observado reacciones de hipersensibilidad a las proteínas de la soja.
El medicamento NUMETA G13%E Preterm contiene glucosa producida a partir de almidón de maíz. Por lo tanto, el medicamento NUMETA G13%E Preterm debe usarse con precaución en pacientes con alergia conocida al maíz o productos que contienen maíz.
Riesgo de formación de depósitos con ceftriaxona (antibiótico):
No se debe mezclar ni administrar simultáneamente el antibiótico ceftriaxona con ninguna solución que contenga calcio (incluido el medicamento NUMETA G13%E Preterm) mediante infusión intravenosa.
El médico es consciente de esto y no administrará estos medicamentos al mismo tiempo, incluso a través de líneas de infusión separadas o en diferentes lugares de infusión.
Formación de pequeñas partículas en los vasos sanguíneos de los pulmones:
Las dificultades para respirar también pueden ser un signo de que se han formado pequeñas partículas que bloquean los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares). Si el niño experimenta dificultades para respirar, debe informar al médico o a la enfermera. Ellos decidirán qué medidas tomar.
Infección y sepsis:
El médico estará atento a los signos de infección en el niño.
El uso de técnicas de asepsia (procedimientos que protegen contra los microorganismos) al introducir y mantener el catéter, así como durante la preparación de la mezcla nutricional, puede reducir el riesgo de infección.
A veces, si se coloca un tubo en una vena (catéter venoso), el niño puede desarrollar una infección y sepsis (presencia de bacterias en la sangre). Algunos medicamentos y enfermedades pueden aumentar el riesgo de infección o sepsis. Los pacientes que requieren nutrición parenteral (administración de alimentos a través de un tubo en una vena) debido a su estado de salud pueden ser más propensos a desarrollar infecciones.
Síndrome de sobrecarga de grasas:
Se ha informado de la ocurrencia de síndrome de sobrecarga de grasas durante el uso de medicamentos similares.
La capacidad reducida o limitada del organismo para eliminar las grasas presentes en NUMETA G13%E Preterm o la sobredosis puede provocar un síndrome de sobrecarga de grasas (ver secciones 3 y 4).
Cambios en la composición química de la sangre:
El médico controlará y seguirá el estado de los líquidos en el niño, la composición química de la sangre y el contenido de otras sustancias durante el tratamiento con NUMETA G13%E Preterm.
A veces, la nutrición de personas gravemente desnutridas puede provocar cambios significativos en la composición química de la sangre, que pueden requerir ajustes. También puede ocurrir un exceso de líquido en los tejidos y edema. Se recomienda comenzar la nutrición parenteral de manera lenta y cuidadosa.
Monitoreo y ajuste:
El médico estará atento y ajustará la administración de NUMETA G13%E Preterm según las necesidades individuales del niño, especialmente en las siguientes situaciones:
- estados graves después de un trauma;
- diabetes grave;
- choque;
- ataque al corazón;
- infección grave;
- ciertos tipos de coma.
Uso con precaución:
NUMETA G13%E Preterm debe usarse con precaución si el niño tiene:
- edema pulmonar (líquido en los pulmones) o insuficiencia cardíaca;
- trastornos graves de la función hepática;
- trastornos de la absorción de nutrientes;
- concentraciones altas de azúcar en la sangre;
- problemas renales;
- trastornos graves del metabolismo (cuando el proceso de descomposición de las sustancias no se produce de manera normal);
- trastornos de la coagulación de la sangre.
El estado de los líquidos en el organismo del niño, los resultados de las pruebas hepáticas y (o) otros resultados de las pruebas de sangre serán verificados cuidadosamente.
La información sobre el uso de este medicamento en recién nacidos prematuros menores de 28 semanas de gestación es limitada.
NUMETA G13%E Preterm y otros medicamentos
Debe informar al médico sobre todos los medicamentos que el niño está tomando actualmente o recientemente, así como sobre los medicamentos que se administrarán.
NUMETA G13%E Preterm no debe administrarse al mismo tiempo que:
- ceftriaxona(antibiótico), incluso a través de líneas de infusión separadas, debido al riesgo de formación de partículas sólidas;
- sangrea través del mismo conjunto de infusión, debido al riesgo de pseudoaglutinación (glóbulos rojos que se pegan);
- ampicilina, fosfenitoína o furosemidaa través de la misma línea de infusión, debido al riesgo de formación de partículas sólidas.
Anticoagulantes como la warfarina:
El médico estará atento al niño si se administra warfarina. Este medicamento es un anticoagulante que se utiliza para prevenir la coagulación de la sangre. La vitamina K1 es un componente natural del aceite de oliva y del aceite de soja. La vitamina K1 puede interactuar con medicamentos como la warfarina.
Pruebas de laboratorio:
Las lipidas presentes en esta emulsión pueden afectar los resultados de ciertas pruebas de laboratorio.
Las pruebas de laboratorio pueden realizarse después de 5 a 6 horas de la administración de las lipidas o después de la última administración.
Interacciones de NUMETA G13%E Preterm con medicamentos que pueden afectar la concentración de potasio/metabolismo:
NUMETA G13%E Preterm contiene potasio. Las concentraciones altas de potasio en la sangre pueden provocar un ritmo cardíaco anormal. Es necesario tener especial cuidado con los pacientes que toman diuréticos (medicamentos que reducen la retención de líquidos) o inhibidores de la enzima convertidora de angiotensina (medicamentos utilizados para la hipertensión) o antagonistas del receptor de angiotensina II (medicamentos utilizados para la hipertensión) o medicamentos inmunosupresores (medicamentos que pueden reducir la respuesta inmune normal del organismo). Este tipo de medicamentos puede aumentar la concentración de potasio.
3. Cómo usar NUMETA G13%E Preterm
NUMETA G13%E Preterm debe administrarse siempre al niño según las indicaciones del médico.
En caso de dudas, debe consultar al médico.
Grupo de edad
NUMETA G13%E Preterm está diseñado para satisfacer las necesidades nutricionales de los recién nacidos prematuros.
NUMETA G13%E Preterm puede no ser adecuado para algunos prematuros, ya que su estado puede requerir una composición individualizada para satisfacer sus necesidades nutricionales específicas. El médico decidirá si este medicamento es adecuado para el niño.
Administración
Este medicamento es una emulsión para infusión. Se administra a través de un tubo de plástico en una vena del brazo o en una vena grande del tórax del niño.
El médico puede decidir no administrar lipidos al niño. El paquete de NUMETA G13%E Preterm está diseñado para que, si es necesario, se puedan romper las particiones solo entre la cámara con aminoácidos/electrolitos y la cámara que contiene glucosa. En este caso, la partición entre la cámara con aminoácidos y la cámara con lipidos permanece intacta. De esta manera, el contenido del paquete puede administrarse sin lipidos.
Dosis y duración del tratamiento
El médico decidirá la dosis del medicamento y durante cuánto tiempo se administrará. La dosis depende de las necesidades nutricionales del niño. La dosis se determinará en función del peso del niño, su estado clínico y su capacidad para descomponer y utilizar los componentes de NUMETA G13%E Preterm.
También se pueden administrar nutrientes adicionales o proteínas por vía oral o enteral.
Uso de una dosis mayor de la recomendada de NUMETA G13%E Preterm en el niño
Síntomas
Una dosis excesiva del medicamento o una administración demasiado rápida puede provocar:
- náuseas (vómitos);
- vómitos;
- convulsiones;
- trastornos electrolíticos (cantidades anormales de electrolitos en la sangre);
- síntomas de hiperolemia (volumen aumentado de sangre en circulación, exceso de líquido en los vasos sanguíneos);
- acidosis (aumento de la acidez de la sangre). En estos casos, debe interrumpirse inmediatamente la infusión. El médico decidirá si se requieren medidas adicionales.
La sobredosis de grasas presentes en NUMETA G13%E Preterm puede provocar la aparición de un „síndrome de sobrecarga de grasas”, que generalmente se resuelve después de interrumpir la infusión. En recién nacidos (lactantes) y niños pequeños (menores de 2 años), el síndrome de sobrecarga de grasas se ha asociado con trastornos respiratorios que provocan una disminución de la cantidad de oxígeno en el organismo (insuficiencia respiratoria) y estados que provocan una mayor acidez de la sangre (acidosis).
Para prevenir estas situaciones, el médico controlará sistemáticamente el estado del niño y realizará pruebas de sangre durante el tratamiento.
4. Posibles efectos adversos
Como cualquier medicamento, NUMETA G13%E Preterm puede provocar efectos adversos, aunque no todos los niños los experimentarán.
Si se observan cambios en el estado del niño durante el tratamiento o después de su finalización, debe informar inmediatamente al médico o a la enfermera.
Las pruebas realizadas por el médico durante el tratamiento del niño deben minimizar el riesgo de efectos adversos.
Si se producen síntomas de reacción alérgica, debe interrumpirse la infusión y consultar inmediatamente al médico. Puede ser grave, y los síntomas pueden incluir:
- sudoración
- escalofríos
- dolor de cabeza
- erupciones cutáneas
- dificultad para respirar
Otros efectos adversos observados:
Frecuentes: pueden afectar a 1 de cada 10 personas
- concentración baja de fosfatos en la sangre (hipofosfatemia)
- concentración alta de azúcar en la sangre (hiperglucemia)
- concentración alta de calcio en la sangre (hipercalcemia)
- concentración alta de triglicéridos en la sangre (hipertriglicéridemia)
- trastornos electrolíticos (hiponatremia)
Poco frecuentes: pueden afectar a 1 de cada 100 personas
- concentración alta de lípidos en la sangre (hiperlipidemia)
- estado en el que la bilis no puede fluir del hígado al duodeno (colestasis). El duodeno es una parte del intestino.
Frecuencia no conocida: la frecuencia no puede determinarse a partir de los datos disponibles(estos efectos adversos se han notificado solo después de la administración parenteral de NUMETA G13%E Preterm y NUMETA G16%E sin diluir adecuadamente).
- necrosis de la piel
- daño del tejido blando
- extravasación
Los siguientes efectos adversos se han notificado para otros medicamentos para nutrición parenteral:
- la capacidad reducida o limitada para eliminar las grasas presentes en NUMETA puede provocar la aparición de un síndrome de sobrecarga de grasas. Los siguientes signos y síntomas de este síndrome generalmente se resuelven después de interrumpir la infusión de la emulsión grasosa:
- empeoramiento repentino y grave del estado clínico del paciente
- concentración alta de grasas en la sangre (hiperlipidemia)
- fiebre
- hepatomegalia (hígado agrandado)
- empeoramiento de la función hepática
- disminución del número de glóbulos rojos, que puede provocar palidez de la piel y ser la causa de debilidad o disnea (anemia)
- disminución del número de glóbulos blancos, que puede aumentar el riesgo de infección (leucopenia)
- disminución del número de plaquetas, que puede aumentar el riesgo de moretones y (o) sangrado (trombocitopenia)
- trastornos de la coagulación de la sangre, que afectan la capacidad de la sangre para formar coágulos
- trastornos respiratorios que provocan una disminución de la cantidad de oxígeno en el organismo (insuficiencia respiratoria)
- estados que provocan una mayor acidez de la sangre (acidosis)
- coma que requiere hospitalización
- formación de pequeñas partículas que pueden bloquear los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares) o dificultad para respirar.
Notificación de efectos adversos
Si el niño experimenta algún efecto adverso, debe consultar al médico o a la enfermera.
Esto incluye cualquier efecto adverso no mencionado en esta hoja de instrucciones.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Productos Farmacéuticos de la Agencia de Registro de Productos Farmacéuticos, Dispositivos Médicos y Productos Biocidas
Al. Jerozolimskie 181 C
PL 02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar NUMETA G13%E Preterm
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños cuando no se esté administrando.
En el caso de recién nacidos y niños menores de 2 años, la solución (en paquetes y conjuntos para administración) debe protegerse de la luz hasta el final de la administración (ver sección 2).
No usar este medicamento después de la fecha de caducidad indicada en el paquete y en el paquete exterior (MM/RRRR). La fecha de caducidad es el último día del mes indicado.
No congelar.
Conservar en el paquete protector.
No desechar los medicamentos por el desagüe o en los contenedores de basura domésticos. Debe preguntar al farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Cómo es NUMETA G13%E Preterm y qué contiene el paquete
NUMETA G13%E Preterm se presenta en un paquete de tres cámaras. El contenido de cada paquete es estéril y consiste en una solución de glucosa, una solución de aminoácidos para niños con electrolitos y una emulsión grasosa, según se describe a continuación.
| Tamaño del contenedor | 50% solución de glucosa | 5,9% solución de aminoácidos con electrolitos | 12,5% emulsión grasosa |
| 300 ml | 80 ml | 160 ml | 60 ml |
Apariencia antes de la preparación:
- Las soluciones en las cámaras que contienen aminoácidos y glucosa son transparentes, incoloras o ligeramente amarillas
- La emulsión grasosa es un líquido homogéneo y blanco lechoso
Apariencia después de la preparación:
- Las soluciones para infusión „2 en 1” (aminoácidos/electrolitos y glucosa) son transparentes, incoloras o ligeramente amarillas
- La emulsión para infusión „3 en 1” es homogénea y blanco lechosa
El paquete de tres cámaras es un paquete de plástico mult capa.
Para protegerlo del aire, el paquete NUMETA G13%E Preterm se envuelve en un paquete protector que protege del oxígeno, que también contiene un absorbente de oxígeno y un indicador de oxígeno.
Tamaños de los paquetes
paquetes de 300 ml: 10 paquetes en una caja de cartón
1 paquete de 300 ml
No todos los tipos de paquetes pueden estar en circulación.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Baxter Polska Sp. z o.o.
ul. Kruczkowskiego 8
00-380 Varsovia
Fabricante
Baxter S.A.
Boulevard René Branquart 80
7860 Lessines
Bélgica
Este producto farmacéutico está autorizado para su comercialización en los países miembros del Espacio Económico Europeo bajo los siguientes nombres:
| País | Nombre |
| Austria, Alemania | Numeta G 13 % E Emulsión para infusión |
| Bélgica, Luxemburgo | NUMETZAH G13%E, emulsión para perfusión |
| Francia | NUMETAH G13%E PREMATURES, emulsión para perfusión |
| Dinamarca, Noruega, Suecia | Numeta G13E |
| República Checa | NUMETA G 13 % E |
| Grecia | NUMETA Preterm G 13 E |
| Países Bajos | NUMETA G13%E emulsie voor infusie |
| Irlanda, Malta, Reino Unido | Numeta G13%E Preterm, Emulsión para infusión |
| Italia | NUMETA G13E emulsione per infusione |
| Finlandia | Numeta G13E infusión, emulsión |
| Polonia | NUMETA G13%E Preterm |
| Portugal | Numeta G13%E |
| España | NUMETA G13%E, emulsión para perfusión |
Fecha de la última actualización de la hoja de instrucciones: mayo de 2024
Información destinada exclusivamente al personal médico especializado o a los trabajadores de la salud
*En algunos casos, este medicamento puede administrarse en el hogar por los padres u otros cuidadores.
En estos casos, los padres/cuidadores deben leer la siguiente información.
No se deben agregar componentes adicionales al paquete sin verificar antes su compatibilidad.
Esto puede provocar la formación de partículas sólidas o la desestabilización de la emulsión grasosa. Esto puede provocar la obstrucción de los vasos sanguíneos.
El medicamento NUMETA G13%E Preterm debe alcanzar la temperatura ambiente antes de su administración.
Antes de la administración de NUMETA G13%E Preterm, el paquete se prepara como se muestra a continuación.
Debe asegurarse de que el paquete no esté dañado. El paquete solo puede usarse si no está dañado. A continuación, se presentan las características de un paquete no dañado:
- Las particiones están intactas. Esto se indica por la falta de mezcla de los contenidos de cualquiera de las tres cámaras.
- Las soluciones que contienen aminoácidos y glucosa son transparentes, incoloras o ligeramente amarillas, sin partículas visibles.
- La emulsión grasosa es un líquido homogéneo de color blanco lechoso.
Antes de abrir el paquete protector, debe verificar el color del indicador de oxígeno.
- Debe compararlo con el color de referencia impreso junto al símbolo OK y mostrado en el área impresa de la etiqueta del indicador.
- No se debe usar el medicamento si el color del indicador de oxígeno no coincide con el color de referencia impreso junto al símbolo OK. Las figuras 1 y 2 muestran cómo quitar el paquete protector. Desechar el paquete protector, el indicador de oxígeno y el absorbente de oxígeno.









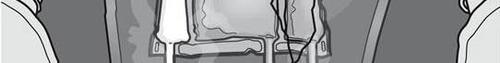
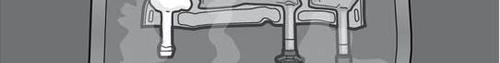
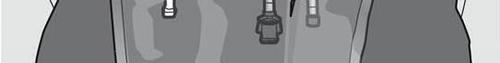




Paso 1: Para preparar la mezcla, debe asegurarse de que el medicamento esté a temperatura ambiente.
Paso 2: Colocar el paquete en una superficie plana y limpia.
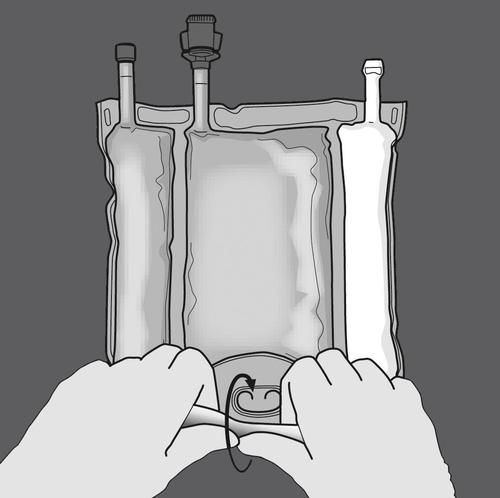
Paso 3: Romper las particiones para mezclar las soluciones.
Paso 4: Girar el paquete al menos tres veces para mezclar bien el contenido.
La solución mezclada debe tener un aspecto de emulsión blanco lechoso.
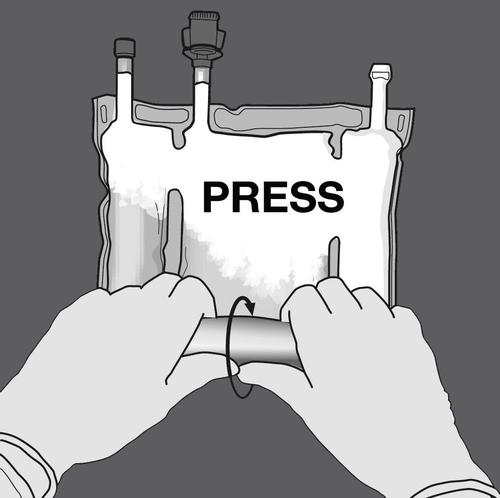
PRESIONAR
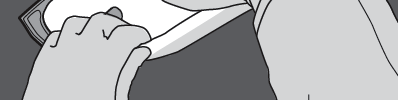

Paso 5: Retirar el tapón de protección del lugar de administración del medicamento e introducir el conjunto de infusión.

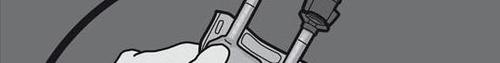






PREPARACIÓN


Paso 5: Girar el bolsillo al menos tres veces para mezclar bien el contenido.
La solución mezclada debe ser transparente, incolora o ligeramente amarilla.

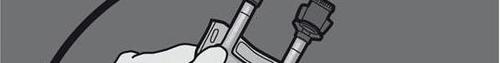






Paso 6: Retirar el tapón protector del lugar de administración del medicamento e introducir el conjunto de administración intravenosa.








Durante la primera hora, la velocidad de flujo debe aumentarse gradualmente. La velocidad de flujo de administración debe ajustarse según los siguientes factores:
- dosis administrada;
- volumen diario recibido;
- tiempo de infusión.
Método de administración:
En el caso de recién nacidos y niños menores de 2 años, la solución (en bolsillos y conjuntos de administración) debe protegerse de la luz hasta el final de la administración.
Se recomienda utilizar un filtro de 1,2 micras para la administración del medicamento NUMETA G13%E Preterm.
Debido a la alta osmolalidad, el medicamento NUMETA G13%E Preterm no diluido solo se puede administrar a través de una vena central. La dilución adecuada del medicamento NUMETA G13%E Preterm con agua para inyección reduce la osmolalidad y permite la infusión en un vaso periférico. La siguiente fórmula muestra el efecto de la dilución en la osmolalidad del medicamento.
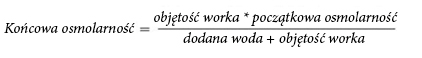
En la siguiente tabla se presentan ejemplos de osmolalidad de un bolsillo de dos cámaras activado y un bolsillo de tres cámaras activado después de agregar agua para inyección:
| Aminocidos y glucosa (bolsillo de 2 cámaras activado) | Aminocidos, glucosa y lípidos (bolsillo de 3 cámaras activado) | |
| Volumen inicial en el bolsillo (ml) | 240 | 300 |
| Osmolalidad inicial (mOsm/l aproximadamente) | 1400 | 1150 |
| Volumen de agua agregada (ml) | 240 | 300 |
| Volumen final después de agregar (ml) | 480 | 600 |
| Osmolalidad después de agregar (mOsm/l aproximadamente) | 700 | 575 |
Adición de componentes adicionales:
La exposición a la luz de las soluciones para nutrición parenteral, especialmente después de mezclar con oligoelementos y (o) vitaminas, puede tener un efecto adverso en los resultados clínicos en recién nacidos, debido a la producción de peróxidos y otros productos de degradación. En el caso de recién nacidos y niños menores de 2 años, el medicamento NUMETA G13%E Preterm debe protegerse de la luz ambiental hasta el final de la administración.
Los componentes adicionales compatibles se pueden agregar a la mezcla reconstituida a través del lugar de inyección (después de abrir las soldaduras rompibles y mezclar el contenido de dos o tres cámaras).
Las vitaminas también se pueden agregar a la cámara que contiene glucosa antes de reconstituir la mezcla (antes de abrir las soldaduras rompibles y antes de mezclar las soluciones y emulsiones).
Los posibles aditivos de soluciones listas de oligoelementos (identificados como TE1 y TE4), vitaminas (identificados como liofilizado V1 y emulsión V2) y electrolitos en cantidades específicas se presentan en las Tablas 1-4.
- 1.Compatibilidad con TE4, V1 y V2
Tabla 1: Compatibilidad 3-en-1 (bolsillo de 3 cámaras activado) con dilución en agua y sin dilución
| Para 300 ml (después de mezclar 3 cámaras, con lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 6,6 | 5,0 | 11,6 | 6,6 | 5,0 | 11,6 |
| Potasio (mmol) | 6,2 | 4,2 | 10,4 | 6,2 | 4,2 | 10,4 |
| Magnesio (mmol) | 0,47 | 0,83 | 1,3 | 0,47 | 0,83 | 1,3 |
| Calcio (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 3,5 | 7,3 |
| Fosfatos* (mmol) | 3,8 | 2,5 | 6,3 | 3,8 | 2,5 | 6,3 |
| Oligoelementos y vitaminas | 15 ml TE4 + 1,5 ampollas V1 + 25 ml V2 | 15 ml TE4 + 1,5 ampollas V1 + 25 ml V2 | 15 ml TE4 + 1,5 ampollas V1 + 25 ml V2 | 15 ml TE4 + 1,5 ampollas V1 + 25 ml V2 | ||
| Agua para inyección | 300 ml | 300 ml | ||||
Tabla 2: Compatibilidad 2-en-1 (bolsillo de 2 cámaras activado) con dilución en agua y sin dilución
| Para 240 ml (después de mezclar 2 cámaras, sin lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 6,4 | 17,6 | 24 | 6,4 | 0,0 | 6,4 |
| Potasio (mmol) | 6,2 | 17,8 | 24 | 6,2 | 0,0 | 6,2 |
| Magnesio (mmol) | 0,47 | 2,13 | 2,6 | 0,47 | 0,0 | 0,47 |
| Calcio (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 0,0 | 3,8 |
| Fosfatos* (mmol) | 3,2 | 4,0 | 7,2 | 3,2 | 0,0 | 3,2 |
| Oligoelementos y vitaminas | 2,5 ml TE4 + ¼ ampolla V1 | 2,5 ml TE4 + ¼ ampolla V1 | 2,5 ml TE4 + ¼ ampolla V1 | 2,5 ml TE4 + ¼ ampolla V1 | ||
| Agua para inyección | 240 ml | 240 ml |
- 2.Compatibilidad con TE1, V1 y V2Tabla 3: Compatibilidad 3-en-1 (bolsillo de 3 cámaras activado) con dilución en agua y sin dilución
| Para 300 ml (después de mezclar 3 cámaras, con lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 6,6 | 5,0 | 11,6 | 6,6 | 0,0 | 6,6 |
| Potasio (mmol) | 6,2 | 4,2 | 10,4 | 6,2 | 0,0 | 6,2 |
| Magnesio (mmol) | 0,47 | 0,83 | 1,3 | 0,47 | 0,0 | 0,47 |
| Calcio (mmol) | 3,8 | 1,9 | 5,7 | 3,8 | 0,0 | 3,8 |
| Fosfatos* (mmol) | 3,8 | 2,5 | 6,3 | 3,8 | 0,0 | 3,8 |
| Oligoelementos y vitaminas | 2,5 ml TE1 + ¼ ampolla V1 + 2,5 ml V2 | 2,5 ml TE1 + ¼ ampolla V1 + 2,5 ml V2 | 2,5 ml TE1 + ¼ ampolla V1 + 2,5 ml V2 | 2,5 ml TE1 + ¼ ampolla V1 + 2,5 ml V2 | ||
| Agua para inyección | 300 ml | 300 ml | ||||
Tabla 4: Compatibilidad 2-en-1 (bolsillo de 2 cámaras activado) con dilución en agua y sin dilución
| Para 240 ml (después de mezclar 2 cámaras, sin lípidos) | ||||||
| Adición sin dilución | Adición con dilución | |||||
| Componentes adicionales | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total | Cantidad contenida | Cantidad máxima agregada | Cantidad máxima total |
| Sodio (mmol) | 6,4 | 17,6 | 24 | 6,4 | 0,0 | 6,4 |
| Potasio (mmol) | 6,2 | 17,8 | 24 | 6,2 | 0,0 | 6,2 |
| Magnesio (mmol) | 0,47 | 2,13 | 2,6 | 0,47 | 0,0 | 0,47 |
| Calcio (mmol) | 3,8 | 3,5 | 7,3 | 3,8 | 0,0 | 3,8 |
| Fosfatos* (mmol) | 3,2 | 4,0 | 7,2 | 3,2 | 0,0 | 3,2 |
| Oligoelementos y vitaminas | 2,5 ml TE1 + ¼ ampolla V1 | 2,5 ml TE1 + ¼ ampolla V1 | 2,5 ml TE1 + ¼ ampolla V1 | 2,5 ml TE1 + ¼ ampolla V1 | ||
| Agua para inyección | 240 ml | 240 ml | ||||
Composición de los preparados que contienen vitaminas y oligoelementos se presentan en la Tabla 5 y 6.
Tabla 5: Composición del preparado listo que contiene oligoelementos:
Tabla 6: Composición del preparado listo que contiene vitaminas:
Adición de componentes adicionales:
- Debe mantenerse la esterilidad.
- Preparar el lugar de inyección en el bolsillo.
- Perforar el lugar de inyección e inyectar los componentes adicionales mediante una aguja para inyección o un dispositivo para preparar medicamentos.
- Mezclar el contenido del bolsillo con los componentes adicionales.
Preparación de la infusión:
- Debe mantenerse la esterilidad.
- Colgar el bolsillo.
- Retirar el protector de plástico del puerto de administración del medicamento.
- Introducir con firmeza la aguja del conjunto de infusión en el puerto de administración del medicamento.
Administración de la infusión:
- Solo para uso único.
- Administrar el medicamento solo después de romper las soldaduras entre dos o tres cámaras y mezclar el contenido de dos o tres cámaras.
- Debe asegurarse de que en la emulsión lista del bolsillo de tres cámaras activado no se produzca separación de fases o en la solución lista del bolsillo de dos cámaras no haya partículas sólidas.
- Se recomienda utilizar inmediatamente después de abrir las soldaduras. No debe almacenarse el medicamento NUMETA G13%E Preterm para la próxima infusión.
- No conectar bolsillos parcialmente utilizados.
| Composición por ampolla | TE1 (10 ml) | TE4 (10 ml) |
| Cinc | 38,2 µmol o 2,5 mg | 15,3 µmol o 1 mg |
| Selenio | 0,253 µmol o 0,02 mg | 0,253 µmol o 0,02 mg |
| Cobre | 3,15 µmol o 0,2 mg | 3,15 µmol o 0,2 mg |
| Yodo | 0,0788 µmol o 0,01 mg | 0,079 µmol o 0,01 mg |
| Flúor | 30 µmol o 0,57 mg | |
| Manganeso | 0,182 µmol o 0,01 mg | 0,091 µmol o 0,005 mg |
| Composición por ampolla | V1 | V2 |
| Vitamina B1 | 2,5 mg | |
| Vitamina B2 | 3,6 mg | |
| Nicotinamida | 40 mg | |
| Vitamina B6 | 4,0 mg | |
| Ácido pantoténico | 15,0 mg | |
| Biotina | 60 µg | |
| Ácido fólico | 400 µg | |
| Vitamina B12 | 5,0 µg | |
| Vitamina C | 100 mg | |
| Vitamina A | 2300 UI | |
| Vitamina D | 400 UI | |
| Vitamina E | 7 UI | |
| Vitamina K | 200 µg |
- Para evitar la formación de un émbolo de aire causado por el aire residual contenido en el primer bolsillo, no conectar los bolsillos en serie.
- Se recomienda utilizar un filtro de 1,2 micras para la administración del medicamento NUMETA G13%E Preterm.
- En el caso de recién nacidos y niños menores de 2 años, debe protegerse de la luz hasta el final de la administración. La exposición del medicamento NUMETA G13%E Preterm a la luz ambiental, especialmente después de mezclar con oligoelementos y (o) vitaminas, puede producir peróxidos y otros productos de degradación, lo que se puede reducir protegiendo de la luz.
- Todos los restos del medicamento no utilizado o sus desechos, así como todo el conjunto de uso único requerido, deben eliminarse adecuadamente.
Período de validez después de la mezcla de las soluciones
El medicamento debe utilizarse inmediatamente después de abrir las soldaduras rompibles entre dos o tres cámaras.
Los estudios de estabilidad de las mezclas se realizaron durante 7 días a una temperatura de 2°C a 8°C, y luego durante 48 horas a 30°C.
Período de validez después de la adición de componentes adicionales (electrolitos, oligoelementos, vitaminas, agua)
Para los componentes adicionales específicos, se ha demostrado la estabilidad física del medicamento NUMETA durante 7 días a una temperatura de 2°C a 8°C, y luego durante 48 horas a 30°C.
La información sobre estos componentes adicionales se encuentra en el punto 6.6 de la ficha técnica del producto.
Desde el punto de vista microbiológico, el medicamento debe utilizarse inmediatamente. Si no se utiliza inmediatamente, el tiempo y las condiciones de almacenamiento hasta su uso son responsabilidad del usuario, pero no debe exceder las 24 horas a una temperatura de 2°C a 8°C, a menos que la preparación/dilución/adición de componentes adicionales se haya realizado en condiciones asépticas controladas y validadas.
No utilizar el medicamento NUMETA G13%E Preterm si el bolsillo está dañado. A continuación, se presentan las características de un bolsillo dañado:
- Las soldaduras rompibles están abiertas
- Cualquiera de las cámaras contiene una mezcla de soluciones
- Las soluciones que contienen aminocidos y glucosa no son transparentes, incoloras o ligeramente amarillas y (o) contienen partículas visibles
- La emulsión lipídica no es un líquido homogéneo de color blanco lechoso.
No desechar los medicamentos por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico qué hacer con los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
Qué contiene el medicamento NUMETA G13%E Preterm
Principios activos:
| Principio activo | Bolsillo de 2 cámaras activado (240 ml) | Bolsillo de 3 cámaras activado (300 ml) |
| Cámara con aminocidos | ||
| Alanina | 0,75 g | 0,75 g |
| Arginina | 0,78 g | 0,78 g |
| Ácido aspártico | 0,56 g | 0,56 g |
| Cisteina | 0,18 g | 0,18 g |
| Ácido glutámico | 0,93 g | 0,93 g |
| Glicina | 0,37 g | 0,37 g |
| Histidina | 0,35 g | 0,35 g |
| Isoleucina | 0,62 g | 0,62 g |
| Leucina | 0,93 g | 0,93 g |
| Lisina monohidratada (corresponde a lisina) | 1,15 g (1,03 g) | 1,15 g (1,03 g) |
| Metionina | 0,22 g | 0,22 g |
| Ornitiina clorhidrato (corresponde a ornitina) | 0,30 g (0,23 g) | 0,30 g (0,23 g) |
| Fenilalanina | 0,39 g | 0,39 g |
| Prolina | 0,28 g | 0,28 g |
| Serina | 0,37 g | 0,37 g |
| Taurina | 0,06 g | 0,06 g |
| Treonina | 0,35 g | 0,35 g |
| Triptófano | 0,19 g | 0,19 g |
| Tirosina | 0,07 g | 0,07 g |
| Valina | 0,71 g | 0,71 g |
| Octanoato de potasio | 0,61 g | 0,61 g |
| Cloruro de calcio dihidratado | 0,55 g | 0,55 g |
| Octanoato de magnesio tetrahidratado | 0,10 g | 0,10 g |
| Glicerofosfato de sodio monohidratado | 0,98 g | 0,98 g |
| Cámara con glucosa | ||
| Glucosa monohidratada (corresponde a glucosa anhidra) | 44,00 g (40,00 g) | 44,00 g (40,00 g) |
| Cámara con lípidos | ||
| Aceite de oliva purificado (aprox. 80%) + aceite de soja purificado (aprox. 20%) | 7,5 g | |
La solución/emulsión después de la mezcla contiene los siguientes componentes:
| Composición | ||||
| Bolsillo de 2 cámaras activado | Bolsillo de 3 cámaras activado | |||
| Por unidad de volumen (ml) Nitrógeno (g) Aminocidos (g) Glucosa (g) Lípidos (g) Valor energético Valor energético total (kcal) | 240 1,4 9,4 40,0 0 198 | 100 0,59 3,9 16,7 0 82 | 300 1,4 9,4 40,0 7,5 273 | 100 0,47 3,1 13,3 2,5 91 |
| Valor energético no proteico (kcal) Valor energético de la glucosa (kcal) Valor energético lipídico (kcal) Valor energético no proteico/nitrógeno (kcal/g N) Valor energético lipídico/valor energético no proteico (%) Valor energético lipídico/valor energético total (%) Electrolitos Sodio (mmol) Potasio (mmol) Magnesio (mmol) Calcio (mmol) Fosfatosb (mmol) Octanoatos (mmol) Jablonatos (mmol) Cloruros (mmol) | 160 160 0 113 No aplica No aplica 6,4 6,2 0,47 3,8 3,2 7,2 3,2 9,3 | 67 67 0 113 No aplica No aplica 2,7 2,6 0,20 1,6 1,3 3,0 1,3 3,9 | 235 160 75 165 32 28 6,6 6,2 0,47 3,8 3,8 7,2 3,2 9,3 | 78 53 25 165 32 28 2,2 2,1 0,16 1,3 1,3 2,4 1,1 3,1 |
| pH (aproximadamente) Osmolalidad aproximada (mOsm/l) | 5,5 1400 | 5,5 1400 | 5,5 1150 | 5,5 1150 |
En este valor se incluye el valor energético de los fosfolípidos de huevo para inyección.
En este valor se incluye el fosfato de los fosfolípidos de huevo para inyección, que es un componente de la emulsión lipídica.
Componentes no activos:
Ácido L-málico
Ácido clorhídrico
Fosfolípidos de huevo para inyección
Glicerol
Oléato de sodio
Hidróxido de sodio
Agua para inyección
para ajustar el pH
Baxter, Numeta, Numetzah y Numetah son marcas registradas de Baxter International Inc.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorBaxter S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Numeta G13%e PretermForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere receta
Alternativas a Numeta G13%e Preterm en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Numeta G13%e Preterm en España
Alternativa a Numeta G13%e Preterm en Ucrania
Médicos online para Numeta G13%e Preterm
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Numeta G13%e Preterm – sujeta a valoración médica y normativa local.














