
Lutrate Depot

Consulta con un médico sobre la receta médica de Lutrate Depot

Cómo usar Lutrate Depot
Hoja de instrucciones del paquete: información para el paciente
Lutrate Depot, 22,5 mg, polvo y disolvente para suspensión inyectable de liberación prolongada
de liberación prolongada
Leuprorelina
Es importante leer atentamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda adicional, consulte a su médico o farmacéutico .
- Este medicamento ha sido recetado específicamente para usted. No lo debe dar a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Lutrate Depot y para qué se utiliza
- 2. Información importante antes de tomar Lutrate Depot
- 3. Cómo tomar Lutrate Depot
- 4. Posibles efectos adversos
- 5. Cómo conservar Lutrate Depot
- 6. Contenido del paquete y otra información
1. Qué es Lutrate Depot y para qué se utiliza
Lutrate Depot es un medicamento que se presenta en forma de polvo blanco en un frasco, que se convierte en una suspensión para inyección intramuscular. Lutrate Depot contiene el principio activo leuprorelina (también conocida como leuprolida), que pertenece a un grupo de medicamentos llamados agonistas del hormona liberador de hormona luteinizante (LHRH). Estos medicamentos reducen los niveles de la hormona sexual testosterona.
2. Información importante antes de tomar Lutrate Depot
Cuándo no tomar Lutrate Depot
- si el paciente es alérgico a la LHRH, medicamentos del grupo de agonistas de la LHRH o cualquier otro componente de este medicamento (enumerados en el punto 6). Las reacciones alérgicas pueden causar: erupciones, picazón en la piel, dificultades para respirar o hinchazón de la cara, los labios, la garganta o la lengua.
- si el paciente ha sido sometido a una orquiectomía (extirpación de los testículos)
- en mujeres y niños
- si el paciente tiene compresión de la médula espinal o metástasis en la columna vertebral, no debe tomar Lutrate Depot como monoterapia (es decir, como único medicamento) para el tratamiento del cáncer de próstata
Precauciones y advertencias
- Antes de comenzar a tomar Lutrate Depot, consulte a su médico o farmacéutico.
- El estado del paciente puede empeorar durante las primeras semanas de tratamiento, pero debe mejorar a medida que continúe el tratamiento. Los síntomas objetivos y subjetivos incluyen: un aumento transitorio de los niveles de testosterona (hormona sexual masculina), sofocos, dolor óseo, trastornos del sistema nervioso (incluyendo depresión) o dificultades para orinar.
- Si el paciente cree que ha experimentado una reacción alérgica (dificultad para respirar, asma, congestión nasal, hinchazón de la cara, urticaria, erupciones), debe dejar de tomar el medicamento y informar a su médico.
- Debe informar a su médico si se encuentra en un grupo de riesgo o si actualmente padece alguna de las siguientes afecciones, ya que su médico puede ordenar controles más frecuentes:
- si el paciente tiene moretones o sangrado de origen desconocido o se siente generalmente mal. Aunque estos síntomas son raros, pueden indicar un cambio en el recuento de glóbulos rojos o blancos.
- si el paciente tiene una enfermedad metabólica
- si el paciente tiene problemas cardíacos o arritmias
- si el paciente tiene diabetes
- Debe informar a su médico si ha tenido un tumor pituitario (adenoma pituitario) en el pasado. Se han reportado casos de apoplejía pituitaria (destrucción parcial del tejido pituitario) después de comenzar a tomar este tipo de medicamentos en pacientes con adenoma pituitario. Los síntomas de apoplejía pituitaria pueden incluir: dolor de cabeza repentino, visión doble, visión borrosa o pérdida de visión, y ocasionalmente, trastornos de la conciencia.
- Debe informar a su médico si tiene trastornos de coagulación, trombocitopenia o si está tomando anticoagulantes. Es posible que sea necesario controlar más frecuentemente la función hepática del paciente, ya que se han reportado trastornos de la función hepática y ictericia (decoloración amarilla de la piel y los ojos) durante el tratamiento con leuprorelina.
- Se han reportado fracturas de la columna vertebral, parálisis, disminución de la presión arterial y aumento de la presión arterial durante el tratamiento con leuprorelina.
- En pacientes que toman Lutrate Depot, se ha observado la aparición de depresión, que puede ser grave. Si se presenta un estado de ánimo depresivo, debe informar a su médico.
- Se ha reportado una disminución de la densidad ósea (fragilidad o adelgazamiento de los huesos) después de tomar leuprorelina. Su médico puede considerar la administración de un medicamento antiandrogénico durante el tratamiento con Lutrate Depot. En este caso, debe prestar especial atención a la aparición de trombosis y otros síntomas de trastornos de coagulación, así como edemas (en las manos, los pies o las articulaciones), ya que el riesgo de estos aumenta cuando se administra un antiandrogénico y Lutrate Depot juntos.
- Si el paciente tiene compresión de la médula espinal y (o) trastornos de la micción y (o) hematuria (presencia de sangre en la orina), su médico puede iniciar un tratamiento adicional para prevenir complicaciones neurológicas (como entumecimiento en las manos y los pies, parálisis) o obstrucción de la uretra (tubo que lleva la orina desde la vejiga hasta el exterior del cuerpo). El paciente debe tener una atención médica constante durante las primeras semanas de tratamiento.
- Los pacientes pueden experimentar cambios metabólicos (como intolerancia a la glucosa o empeoramiento de la diabetes existente), cambios de peso y trastornos cardiovasculares.
- Durante el tratamiento con leuprorelina, es importante controlar a los pacientes con enfermedades metabólicas o cardiovasculares, especialmente aquellos con antecedentes de insuficiencia cardíaca congestiva (enfermedad en la que el corazón no puede bombear suficiente sangre a otras partes del cuerpo).
- Antes de tomar Lutrate Depot, debe discutir con su médico, farmacéutico o enfermera si tiene hígado graso.
- Es posible que sea necesario realizar análisis de sangre en el paciente durante el tratamiento para asegurarse de la eficacia de Lutrate Depot.
- Puede ocurrir una disminución del interés sexual, sofocos y, a veces, una disminución del tamaño de los testículos y una disminución de su función. Después de terminar el tratamiento con Lutrate Depot, el paciente puede recuperar su fertilidad.
- Como Lutrate Depot puede alterar los resultados de algunos análisis de laboratorio, el paciente debe informar a su médico que lo prescribe sobre la ingesta de este medicamento.
- En pacientes que han tenido convulsiones en el pasado, pacientes con epilepsia, trastornos de la circulación cerebral, anomalías o tumores del sistema nervioso central, y pacientes que toman medicamentos que pueden causar convulsiones, así como, aunque en menor medida, en pacientes que no pertenecen a ninguno de estos grupos, pueden ocurrir convulsiones durante el tratamiento.
- Debe informar a su médico si tiene enfermedades cardíacas o vasculares, incluyendo arritmias, o si está tomando medicamentos para estas afecciones. La administración de Lutrate Depot puede aumentar los trastornos del ritmo cardíaco.
- Si el paciente experimenta dolores de cabeza fuertes o recurrentes, dificultades para ver o zumbido en los oídos, debe consultar a su médico de inmediato.
- Se han reportado erupciones cutáneas graves, incluyendo síndrome de Stevens-Johnson y necrosis tóxica epidermal (SJS/TEN), asociadas con la administración de leuprorelina. Si se observan alguno de los síntomas asociados con reacciones cutáneas graves descritas en el punto 4, se debe suspender la administración de leuprorelina y contactar de inmediato a un médico.
Lutrate Depot y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que está tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar. Es posible que puedan seguir tomándose con Lutrate Depot, pero la decisión la tomará su médico.
Lutrate Depot puede interferir con la acción de algunos medicamentos utilizados para trastornos del ritmo cardíaco (como la quinidina, procainamida, amiodarona y sotalol) o puede aumentar el riesgo de trastornos del ritmo cardíaco cuando se administra con otros medicamentos, como metadona (utilizada para reducir el dolor o como parte del tratamiento para la adicción a los opiáceos), moxifloxacina (antibiótico), medicamentos antipsicóticos utilizados para enfermedades mentales graves.
Embarazo y lactancia
Lutrate Depot no está indicado para su uso en mujeres.
Este medicamento está contraindicado en mujeres embarazadas. Su administración durante el embarazo puede causar un aborto espontáneo.
Conducción de vehículos y uso de máquinas
No se ha estudiado el efecto de Lutrate Depot en la capacidad para conducir vehículos o operar máquinas.
Durante el tratamiento, pueden ocurrir trastornos de la visión y mareos. Si ocurren, el paciente no debe conducir vehículos ni operar máquinas.
Lutrate Depot contiene sodio
El medicamento contiene menos de 1 mmol (23 mg) de sodio por frasco, es decir, el medicamento se considera "exento de sodio".
3. Cómo tomar Lutrate Depot
Dosis
Lutrate Depot debe ser administrado exclusivamente por un médico o enfermera, quienes también se encargarán de preparar la solución.
Adultos, incluyendo pacientes de edad avanzada
La dosis recomendada de Lutrate Depot es una inyección cada tres meses. Después de reconstituir el polvo en suspensión, se administra en una sola inyección intramuscular cada tres meses.
El lugar de inyección debe cambiarse a intervalos regulares.
Lutrate Depot debe administrarse exclusivamente por vía intramuscular. No debe administrarse por otra vía.
La intensidad del tratamiento la decide el médico.
Uso en niños
Lutrate Depot no está indicado para su uso en niños.
Uso de una dosis mayor que la recomendada de Lutrate Depot
No es probable que un médico o enfermera no conozca la dosis correcta. Sin embargo, si el paciente sospecha que ha recibido una dosis mayor de la que debía, debe informar a su médico de inmediato para que se puedan tomar las medidas adecuadas.
Omision de la administración de Lutrate Depot
Es importante no omitir la administración de una dosis de Lutrate Depot. Si el paciente olvidó la inyección, debe contactar a su médico lo antes posible para que se pueda administrar la siguiente inyección.
Suspensión del tratamiento con Lutrate Depot
Como el tratamiento con Lutrate Depot es a largo plazo, su suspensión puede causar un empeoramiento de los síntomas de la enfermedad. Por lo tanto, no debe suspender el tratamiento sin el consentimiento de su médico.
Si tiene alguna duda adicional sobre el uso de este medicamento, consulte a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Debe informar a su médico de inmediato si experimenta:
respiración sibilante repentina, dificultades para respirar, hinchazón de los párpados, la cara o los labios, erupciones o picazón en la piel (especialmente si se extienden por todo el cuerpo).
Se han reportado los siguientes efectos adversos:
Muy frecuentes(pueden ocurrir en más de 1 de cada 10 personas):
sofocos y reacciones en el lugar de la inyección
Frecuentes(pueden ocurrir en menos de 1 de cada 10 personas):
sudores fríos, sudoración excesiva, picazón, fatiga, insomnio, disminución del deseo sexual, mareos, rubor, náuseas, diarrea, disminución del apetito, trastornos de la erección, debilidad, dolor óseo, dolor articular y reacciones en el lugar de la inyección, como dolor, endurecimiento, rubor y moretones,
dolor en el sistema urinario, disminución del flujo urinario, necesidad frecuente de orinar, cambios de humor y depresión después de un tratamiento prolongado con leuprorelina, cambios en la actividad de las enzimas hepáticas y aumento de los triglicéridos en la sangre, aumento de la glucosa en la sangre
Poco frecuentes(pueden ocurrir en menos de 1 de cada 100 personas):
niveles altos de colesterol en la sangre, trastornos del sueño, ansiedad, trastornos del gusto, entumecimiento, dolor de cabeza, somnolencia, trastornos de la visión, inflamación de la pleura, zumbido en los oídos, dolor en la parte superior del abdomen, estreñimiento, erupciones, rubor, picazón generalizada, sudores nocturnos, dolor de espalda, dolor muscular, dolor de cuello, dolor en los pechos, dolor en la pelvis, atrofia testicular, trastornos testiculares, sensación de calor, cambios de humor y depresión después de un tratamiento breve con leuprorelina, cambios en los resultados de los análisis de sangre y cambios en el electrocardiograma (prolongación del intervalo QT) y reacciones en el lugar de la inyección, como urticaria, sensación de calor y hemorragia
Frecuencia desconocida(frecuencia no puede determinarse a partir de los datos disponibles):
inflamación pulmonar, enfermedad pulmonar, hipertensión intracraneal idiopática (aumento de la presión dentro del cráneo, caracterizado por dolor de cabeza, visión doble y otros síntomas visuales, así como zumbido o pitido en un oído o ambos), manchas rojizas, no elevadas, redondas o ovaladas en el tronco, a menudo con ampollas en el centro, descamación de la piel, úlceras en la boca, la garganta, la nariz, los genitales y los ojos - estas erupciones cutáneas graves pueden estar precedidas por fiebre y síntomas similares a los de la gripe (síndrome de Stevens-Johnson, necrosis tóxica epidermal), enrojecimiento de la piel y erupción cutánea picazosa (erupciones cutáneas tóxicas), reacción cutánea que causa la aparición de puntos o manchas rojas en la piel, que pueden parecer un blanco de tiro con un centro rojo más oscuro rodeado de anillos rojos más claros (eritema multiforme)
Notificación de efectos adversos
Si ocurren cualquier efecto adverso, incluidos cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe consultar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social, o a la autoridad reguladora del medicamento de su país.
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización o a su representante en su país.
5. Cómo conservar Lutrate Depot
El médico y el farmacéutico están informados sobre cómo conservar este medicamento.
El medicamento debe conservarse en un lugar donde no pueda ser visto o alcanzado por los niños.
No conservar a una temperatura superior a 25°C. No congelar.
No usar este medicamento después de la fecha de caducidad que se indica en el paquete, el frasco y la jeringa precargada después de "EXP". La fecha de caducidad en la jeringa precargada es la misma que en el frasco. La fecha de caducidad indica el último día del mes indicado.
No desechar los medicamentos por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Lutrate Depot?
El principio activo de Lutrate Depot es leuprorelina. Cada frasco contiene 22,5 mg de leuprorelina.
La concentración del medicamento reconstituido es de 11,25 mg/ml.
Los demás componentes son:
polvo (frasco): poli(ácido láctico) (PLA), citrato de trietilo, manitol, carmelosa sódica, polisorbato 80
disolvente (en la jeringa precargada): manitol, ácido clorhídrico (para ajustar el pH), hidróxido de sodio (para ajustar el pH), agua para inyección
Cómo se presenta Lutrate Depot y qué contiene el paquete?
Cada paquete contiene un frasco que contiene 22,5 mg de leuprorelina, 1 jeringa precargada con 2 ml de disolvente, 1 conector y 1 aguja estéril de 20 G.
Título del titular de la autorización de comercialización
+pharma arzneimittel gmbh
Hafnerstrasse 211
8054 Graz
Austria
Fabricante
GP-Pharm S.A.
Poligono Industrial Els Vinyets - Els Fogars, Sector 2
Carretera Comarcal C-244, Km. 22
08777 Sant Quintí de Mediona (Barcelona)
Eslovenia
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Austria
Lutrate Depot 22.5 mg Pulver und Lösungsmittel zur Herstellung einer Depot-Injektionssuspension
Bulgaria
Лутрат Депо 22,5 mg прах и разтворител за инжекционна суспензия с удължено освобождаване
República Checa
Lutrate Depot 22.5 mg
Grecia
Lutrate Depot 22.5 mg Κόνις και διαλύτης για παρασκευή ενεσίμου εναιωρήματος παρατεταμένης αποδέσμευσης
Eslovenia
Leuprorelina GP-Pharm Depot Trimestral 22.5 mg polvo y disolvente para suspensión inyectable de liberación prolongada
Alemania
Lutrate Depot 22.5 mg Pulver und Lösungsmittel zur Herstellung einer Depot-Injektionssuspension
Polonia
Lutrate Depot
Portugal
Lutrate Depot 22.5 mg / 2 ml pó e veículo para suspensão injectável de libertação prolongada
Hungría
Politrate Depot 22.5 mg
Italia
Politrate
Para obtener más información sobre este medicamento, consulte a su representante del titular de la autorización de comercialización en su país:
+pharma Polska sp. z o.o.
ul. Podgórska 34
31-536 Cracovia, Polonia
tel.: +48 12 262 32 36
correo electrónico: [email protected]
Fecha de la última revisión de la hoja de instrucciones:mayo 2025
Información destinada exclusivamente al personal médico especializado
Preparación del medicamento para la inyección
IMPORTANTE: Leer atentamente antes de administrar el producto ("Instrucciones de uso" también están incluidas en el soporte que contiene los componentes del conjunto de productos).
Preparar para su uso inmediato antes de la administración en forma de una sola inyección intramuscular.
Utilizar exclusivamente el disolvente suministrado con el conjunto.
El producto está destinado a una sola inyección.
Cualquier suspensión restante debe ser desechada.
1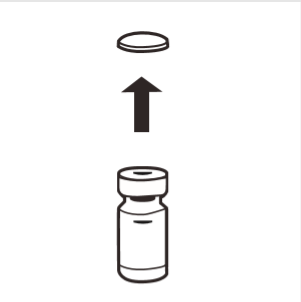 | Retirar completamente la tapa de goma del frasco, exponiendo el tapón de goma. Asegurarse de que no queden partes de la tapa en el frasco. |
2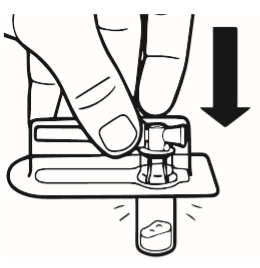 | Colocar el frasco en una superficie plana, en posición vertical. Retirar la cubierta del blister que contiene el conector del frasco (MIXJECT). No retirar el conector del frasco del blister. Colocar el blister con el conector del frasco firmemente en la parte superior del frasco, perforando el frasco que se encuentra en posición completamente vertical. Presionar suavemente hasta que se sienta que el conector ha saltado a su lugar. |
3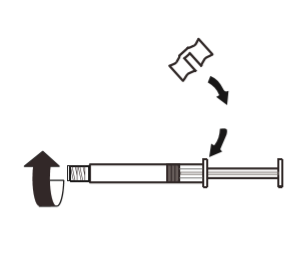 | Unir el mango blanco a la jeringa para que encaje. Retirar la tapa de goma de la jeringa en el sentido contrario a las agujas del reloj. Luego, retirar el embalaje del blister del sistema MIXJECT. |
4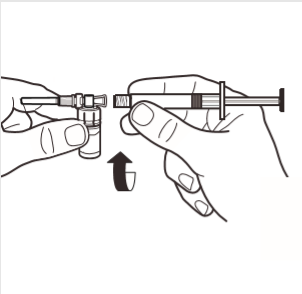 | Conectar la jeringa al adaptador del frasco enroscándolo en el sentido de las agujas del reloj en el orificio lateral del adaptador. Presionar suavemente la jeringa hasta que deje de girar, para asegurar una conexión segura. |
5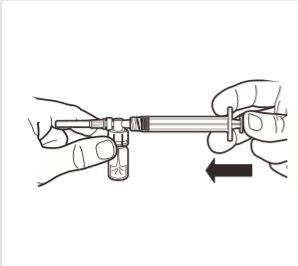 | Mantener la jeringa y el frasco en posición vertical, presionar lentamente el émbolo para transferir todo el disolvente al frasco. |
6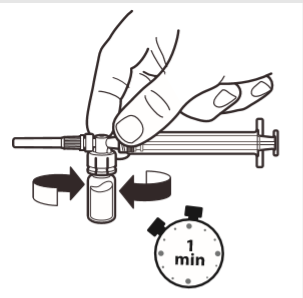 | Cuando la jeringa todavía esté conectada al frasco, agitar suavemente el frasco durante aproximadamente un minuto hasta obtener una suspensión blanca y homogénea. Para evitar la separación de la suspensión, debe proceder de inmediato a los siguientes pasos. |
7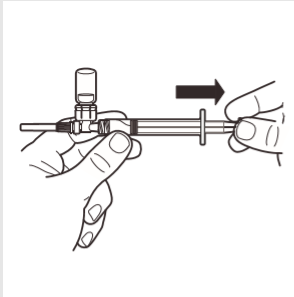 | Invertir el sistema MIXJECT de manera que el frasco quede en la parte superior. Agarrar firmemente el sistema MIXJECT por la jeringa y retirar lentamente el émbolo para introducir el producto preparado en la jeringa. Parte del producto puede precipitarse o adherirse a las paredes del frasco. Esto es un fenómeno normal. |
8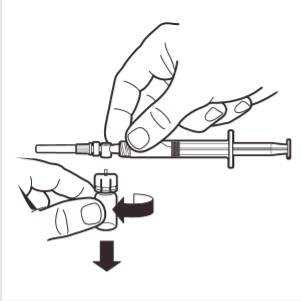 | Separar el adaptador del frasco del sistema MIXJECT conectado a la jeringa: agarrar firmemente la jeringa y girar el frasco (sosteniendo la parte superior del adaptador) en el sentido de las agujas del reloj. |
9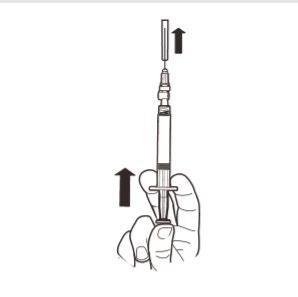 | Sostener la jeringa en posición VERTICAL. Con la otra mano, retirar la cubierta de la aguja hacia arriba. Presionar el émbolo para eliminar el aire de la jeringa. La jeringa que contiene el producto está lista para su administración inmediata. |
10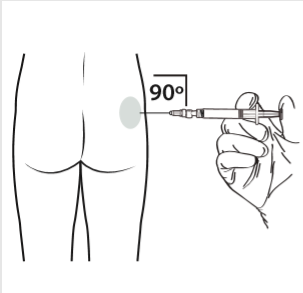 | Realizar la inyección intramuscular introduciendo la aguja a 90 grados en la zona de la nalga. Asegurarse de que se ha inyectado toda la cantidad del producto. Los lugares de inyección deben alternarse. |
Instrucciones de uso
Lutrate Depot - Instrucciones de uso
Leer atentamente antes de administrar el producto.
Preparar para su uso inmediato antes de la administración en forma de una sola inyección intramuscular.
Utilizar exclusivamente el disolvente suministrado con el conjunto.
El producto está destinado a una sola inyección.
Cualquier suspensión restante debe ser desechada.
1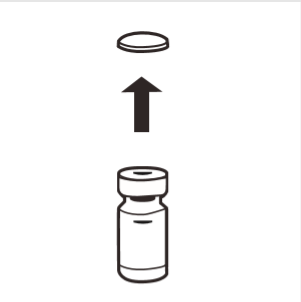 | Retirar completamente la tapa de goma del frasco, exponiendo el tapón de goma. Asegurarse de que no queden partes de la tapa en el frasco. |
2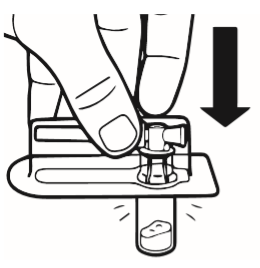 | Colocar el frasco en una superficie plana, en posición vertical. Retirar la cubierta del blister que contiene el conector del frasco (MIXJECT). No retirar el conector del frasco del blister. Colocar el blister con el conector del frasco firmemente en la parte superior del frasco, perforando el frasco que se encuentra en posición completamente vertical. Presionar suavemente hasta que se sienta que el conector ha saltado a su lugar. |
3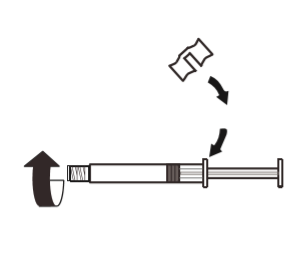 | Unir el mango blanco a la jeringa para que encaje. Retirar la tapa de goma de la jeringa en el sentido contrario a las agujas del reloj. Luego, retirar el embalaje del blister del sistema MIXJECT. |
4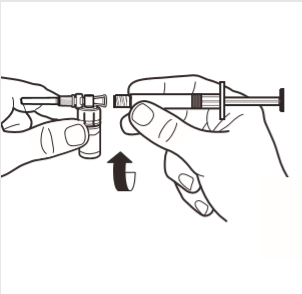 | Conectar la jeringa al adaptador del frasco enroscándolo en el sentido de las agujas del reloj en el orificio lateral del adaptador. Presionar suavemente la jeringa hasta que deje de girar, para asegurar una conexión segura. |
5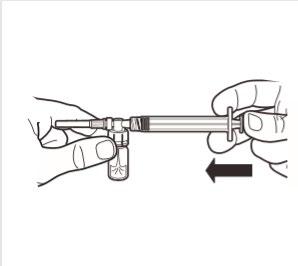 | Mantener la jeringa y el frasco en posición vertical, presionar lentamente el émbolo para transferir todo el disolvente al frasco. |
6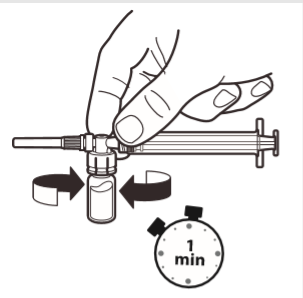 | Cuando la jeringa todavía esté conectada al frasco, agitar suavemente el frasco durante aproximadamente un minuto hasta obtener una suspensión blanca y homogénea. Para evitar la separación de la suspensión, debe proceder de inmediato a los siguientes pasos. |
7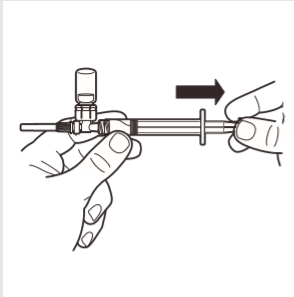 | Invertir el sistema MIXJECT de manera que el frasco quede en la parte superior. Agarrar firmemente el sistema MIXJECT por la jeringa y retirar lentamente el émbolo para introducir el producto preparado en la jeringa. Parte del producto puede precipitarse o adherirse a las paredes del frasco. Esto es un fenómeno normal. |
8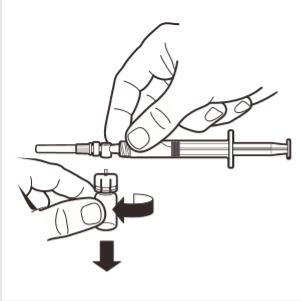 | Separar el adaptador del frasco del sistema MIXJECT conectado a la jeringa: agarrar firmemente la jeringa y girar el frasco (sosteniendo la parte superior del adaptador) en el sentido de las agujas del reloj. |
9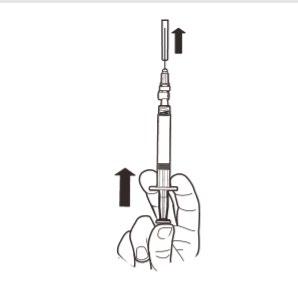 | Sostener la jeringa en posición VERTICAL. Con la otra mano, retirar la cubierta de la aguja hacia arriba. Presionar el émbolo para eliminar el aire de la jeringa. La jeringa que contiene el producto está lista para su administración inmediata. |
10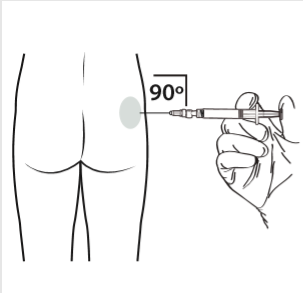 | Realizar la inyección intramuscular introduciendo la aguja a 90 grados en la zona de la nalga. Asegurarse de que se ha inyectado toda la cantidad del producto. Los lugares de inyección deben alternarse. |
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorGP-PHARM S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Lutrate DepotForma farmacéutica: Polvo, 22,5 mgPrincipio activo: leuprorelinRequiere recetaForma farmacéutica: Polvo, 45 mgPrincipio activo: leuprorelinRequiere recetaForma farmacéutica: Polvo, 7,5 mgPrincipio activo: leuprorelinRequiere receta
Alternativas a Lutrate Depot en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Lutrate Depot en Іспанія
Alternativa a Lutrate Depot en Україна
Médicos online para Lutrate Depot
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Lutrate Depot – sujeta a valoración médica y normativa local.











