

Eligard 22,5 mg

Consulta con un médico sobre la receta médica de Eligard 22,5 mg

Cómo usar Eligard 22,5 mg
Hoja de instrucciones del paquete: información para el usuario
Eligard 22,5 mg,
polvo y disolvente para preparar una solución para inyección
Octanato de leuprorelina
Es importante leer atentamente el contenido de la hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico, farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Eligard y para qué se utiliza
- 2. Información importante antes de tomar Eligard
- 3. Cómo tomar Eligard
- 4. Posibles efectos adversos
- 5. Cómo conservar Eligard
- 6. Contenido del paquete y otra información
1. Qué es Eligard y para qué se utiliza
El principio activo de Eligard pertenece a un grupo de medicamentos llamados gonadolibéricos. Estos medicamentos se utilizan para inhibir la producción de ciertas hormonas sexuales (testosterona).
Eligard se utiliza en hombres adultos para tratar el cáncer de próstatacon metástasis, sensible a la terapia hormonal, y en combinación con radioterapia - para tratar el cáncer de próstata de alto riesgo sin metástasis, sensible a la terapia hormonal.
2. Información importante antes de tomar Eligard
Cuándo no tomar Eligard
- En mujeres y niños.
- Si el paciente es alérgicoal principio activo - octanato de leuprorelina, a cualquier otro medicamento que actúe de manera similar a la hormona natural - gonadotropina, o a cualquier otro componente de Eligard (enumerado en el punto 6).
- Después de la extirpación quirúrgica de los testículos, ya que Eligard no causa una disminución adicional de la concentración de testosterona en suero.
- Como único tratamiento, si el paciente tiene síntomas asociados con la compresión de la médula espinal o metástasis en la columna vertebral. En este caso, Eligard solo se puede utilizar en combinación con otros medicamentos utilizados para tratar el cáncer de próstata.
Advertencias y precauciones
Antes de comenzar a tomar Eligard, debe discutirlo con su médico, farmacéutico o enfermera:
- Si ocurre alguno de los siguientes casos: cualquier enfermedad cardíaca o vascular, incluyendo trastornos del ritmo cardíaco (arritmia) o si el paciente está tomando
medicamentos para estas enfermedades. El riesgo de trastornos del ritmo cardíaco puede aumentar durante el tratamiento con Eligard.
- Si hay dificultades para orinar. En este caso, se debe controlar el estado del paciente durante las primeras semanas de tratamiento.
- Si la compresión de la médula espinal o las dificultades para orinar empeoran. Durante el tratamiento concomitante con medicamentos con un efecto similar al de Eligard, se han observado casos graves de compresión de la médula espinal y estrechamiento de los uréteres, lo que puede causar síntomas como la parálisis. En este caso, es necesario aplicar un tratamiento estándar.
- Si el paciente experimenta un dolor de cabeza repentino, vómitos, cambios en el estado mental o colapso circulatorio dentro de las dos semanas después de la administración de Eligard. En este caso, debe notificar inmediatamente a su médico o personal médico. Estos son síntomas de un estado raro llamado apoplejía pituitaria, que se ha informado en relación con la ingesta de OTROS MEDICAMENTOScon un efecto similar al de Eligard.
- Si el paciente tiene diabetes(aumento de la concentración de azúcar en la sangre). En este caso, se debe controlar el estado del paciente durante el tratamiento.
- El tratamiento con Eligard puede aumentar el riesgo de fracturas causadas por osteoporosis (disminución de la densidad ósea).
- Se han informado casos de depresión en pacientes que tomaron Eligard. Si durante el tratamiento con Eligard aparecen sentimientos depresivos, debe informar a su médico.
- Se han informado casos de enfermedades cardiovasculares en pacientes que tomaron medicamentos similares a Eligard - no se sabe si su aparición está relacionada con el uso de estos medicamentos. Si durante el tratamiento con Eligard aparecen síntomas de enfermedades cardiovasculares, debe informar a su médico.
- Se han informado casos de convulsiones en pacientes a quienes se les administró Eligard. Si durante el tratamiento con Eligard aparecen convulsiones, debe informar a su médico.
- Si el paciente experimenta dolores de cabeza fuertes o recurrentes, dificultades para ver y zumbido o pitido en los oídos, debe acudir inmediatamente a su médico.
- Si el paciente tiene hígado graso
En relación con el uso de leuprorelina, se han informado reacciones cutáneas graves, incluyendo el síndrome de Stevens-Johnson y la necrosis tóxica epidermal (SJS/TEN). En caso de observar alguno de los síntomas asociados con reacciones cutáneas graves descritas en el punto 4, se debe interrumpir el uso de leuprorelina y contactar inmediatamente a un médico.
Complicaciones que ocurren en el primer período de tratamiento con Eligard
Durante la primera semana de tratamiento con Eligard, se observa un aumento transitorio de la concentración de testosterona en la sangre, lo que puede causar un empeoramiento temporalde los síntomas de la enfermedad o la aparición de nuevos síntomas que no se habían presentado anteriormente. Estos síntomas incluyen, en particular, dolor óseo, trastornos de la micción, compresión de la médula espinal y aparición de sangre en la orina.
Estos síntomas suelen desaparecer durante el tratamiento continuado. Si los síntomas no desaparecen, debe contactar a su médico.
Falta de efecto de Eligard
En algunos pacientes, se detectan tumores que no son sensibles a la disminución de la concentración de testosterona en suero. Si se siente que Eligard no tiene el efecto deseado, debe informar a su médico.
Eligard y otros medicamentos
Eligard puede afectar la acción de algunos medicamentos utilizados para tratar trastornos del ritmo cardíaco (por ejemplo, quinidina, procaína, amiodarona y sotalol) o aumentar el riesgo de trastornos del ritmo cardíaco cuando se utiliza con otros medicamentos (por ejemplo, metadona (utilizada para aliviar el dolor y la desintoxicación en adictos), moxifloxacina (antibiótico), medicamentos antipsicóticos utilizados para tratar enfermedades mentales graves).
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, incluyendo aquellos que se venden sin receta.
Embarazo y lactancia
Eligard está contraindicado en mujeres.
Conducción de vehículos y uso de máquinas
La fatiga, los mareos y los trastornos de la visión pueden ser efectos adversos de Eligard o pueden deberse a la enfermedad subyacente. Si ocurren estos efectos adversos, debe tener cuidado al conducir vehículos y operar máquinas.
3. Cómo tomar Eligard
Dosis
Este medicamento siempre debe tomarse según las indicaciones de su médico o farmacéutico. En caso de duda, debe consultar a su médico o farmacéutico.
Si su médico no indica lo contrario, Eligard 22,5 mg se administra una vez cada 3 meses.
La solución inyectada crea un depósito de principio activo, del que se libera continuamente el principio activo - octanato de leuprorelina, durante 3 meses.
Exámenes adicionales
La respuesta al tratamiento con Eligard debe ser controlada por su médico según los síntomas clínicos y la concentración de antígeno específico de la próstata (PSA) en la sangre.
Método de administración
Eligard debe ser administrado exclusivamente por un médicoo enfermera, quienes también se encargarán de preparar el producto.
Después de la preparación, Eligard se administra en forma de inyección subcutánea (inyección en el tejido bajo la piel). Debe evitarse absolutamente la inyección intrarterial (en una arteria) o intravenosa (en una vena). Al igual que con otros principios activos utilizados en inyecciones subcutáneas, debe cambiar periódicamente el lugar de la inyección.
Uso de una dosis mayor de la recomendada de Eligard
El medicamento se administra generalmente por un médico o personal médico capacitado, por lo que no parece probable que se administre una dosis mayor de la recomendada.
Si se administra una dosis mayor de la recomendada, su médico decidirá la observación del paciente y el tratamiento adecuado, si es necesario.
Omisión de la administración de Eligard
Si se sospecha que se ha omitido una dosis de 3 meses, debe informar a su médico.
Interrupción del tratamiento con Eligard
El tratamiento de la forma avanzada de cáncer de próstata requiere la administración a largo plazo de Eligard.
Por lo tanto, no debe interrumpir el tratamiento, incluso si su estado mejora o los síntomas de la enfermedad desaparecen.
Si se interrumpe el tratamiento prematuramente, los síntomas de la enfermedad pueden empeorar.
No debe interrumpir el tratamiento sin consultar antes a su médico.
Si tiene alguna duda adicional sobre el uso de este medicamento, debe consultar a su médico, farmacéutico o enfermera.
4. Posibles efectos adversos
Como cualquier medicamento, Eligard puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los efectos adversos observados durante el tratamiento con Eligard se deben principalmente al efecto específico del octanato de leuprorelina, que aumenta o disminuye las concentraciones de ciertas hormonas. Los efectos adversos más comúnmente observados son sofocos (en aproximadamente el 58% de los pacientes), náuseas, malestar y fatiga, así como irritaciones transitorias en el lugar de la inyección.
Efectos adversos que ocurren en el primer período de tratamiento
Durante las primeras semanas de tratamiento con Eligard, puede ocurrir un empeoramiento de los síntomas de la enfermedad, asociado con el aumento inicial y transitorio de la concentración de la hormona sexual masculina - testosterona en la sangre. Por lo tanto, su médico puede recomendar la ingesta de un antiandrógeno (sustancia que reduce el efecto de la testosterona) en la fase inicial del tratamiento, con el fin de reducir el efecto mencionado del medicamento (véase también el punto 2. Información importante antes de tomar Eligard; Complicaciones que ocurren en el primer período de tratamiento con Eligard).
Efectos adversos locales
Los efectos adversos locales descritos después de la inyección de Eligard son similares a los que ocurren con frecuencia después de la inyección subcutánea (inyección en el tejido bajo la piel) de medicamentos similares. La sensación de ardor leve inmediatamente después de la inyección es muy frecuente.
La sensación de pinchazo y dolor después de la inyección, así como la equimosis en el lugar de la inyección, son frecuentes. La eritema en el lugar de la inyección se ha informado con frecuencia. La induración del tejido y las úlceras en el lugar de la inyección son poco frecuentes.
Los efectos adversos locales mencionados anteriormente que ocurren después de la inyección subcutánea son leves y se describen como de corta duración. No reaparecen entre las inyecciones sucesivas.
Efectos adversos que ocurren muy frecuentemente (pueden ocurrir en más de 1 de cada 10 personas)
- Sofocos
- Hemorragias espontáneas de la piel y las mucosas, eritema
- Fatiga, efectos adversos en el lugar de la inyección (véase anteriormente:Efectos adversos locales)
Efectos adversos que ocurren frecuentemente (pueden ocurrir con menos frecuencia que en 1 de cada 10 personas)
- Faringitis (síntomas de resfriado)
- Náuseas, malestar, diarrea, gastritis (inflamación del estómago y los intestinos)
- Picazón, sudores nocturnos
- Dolor articular
- Visitas frecuentes al baño para orinar (también durante la noche), dificultades para orinar, dolor al orinar, disminución de la cantidad de orina
- Sensibilidad en los senos, aumento del tamaño de los senos, atrofia testicular, dolor testicular, infertilidad, trastornos de la erección, disminución del tamaño del pene
- Escalofríos (episodios de temblor con fiebre alta), debilidad
- Prolongación del tiempo de sangrado, cambios en los parámetros sanguíneos, disminución del recuento de glóbulos rojos/anemia
Efectos adversos que ocurren poco frecuentemente (pueden ocurrir con menos frecuencia que en 1 de cada 100 personas)
- Infecciones del tracto urinario, infecciones locales de la piel
- Empeoramiento de la diabetes
- Sueños extraños, depresión, disminución de la libido
- mareos, dolor de cabeza, trastornos de la sensación en la piel, insomnio, trastornos del gusto, trastornos del olfato
- Hipertensión (presión arterial elevada), hipotensión (presión arterial baja)
- Dificultad para respirar
- Estreñimiento, sequedad en la boca, dispepsia (trastornos de la digestión con sensación de plenitud del estómago, dolor abdominal, eructos, náuseas, vómitos, sensación de ardor en el estómago), vómitos
- Aumento de la humedad de la piel, sudores excesivos
- Dolor de espalda, calambres musculares
- Hematuria (presencia de sangre en la orina)
- Espasmo de la vejiga, visitas frecuentes al baño para orinar, imposibilidad de orinar
- Aumento del tamaño de los senos en hombres, impotencia
- Somnolencia (somnolencia), dolor, fiebre
- Aumento de peso
- Pérdida del equilibrio, sensación de vacío en la cabeza
- Atrofia muscular/pérdida de tejido muscular después de un uso prolongado
Efectos adversos que ocurren raramente (pueden ocurrir con menos frecuencia que en 1 de cada 1000 personas)
- Movimientos involuntarios
- Pérdida repentina de conciencia, desmayo
- Distensión abdominal con flatulencia, eructos
- Pérdida de cabello, erupciones cutáneas (forúnculos en la piel)
- Dolor en el pecho
- Úlcera en el lugar de la inyección
Efectos adversos que ocurren muy raramente (pueden ocurrir con menos frecuencia que en 1 de cada 10 000 personas)
- Necrosis en el lugar de la inyección
Frecuencia desconocida (no puede determinarse a partir de los datos disponibles)
- Cambios en el electrocardiograma (prolongación del intervalo QT)
- Neumonitis, enfermedad pulmonar
- Hipertensión endocraneal idiopática (aumento de la presión dentro del cráneo, caracterizado por dolor de cabeza, visión doble y otros
síntomas relacionados con la visión y zumbido o pitido en un oído o ambos).
- Manchas rojizas, no elevadas, en forma de placa en el tronco, a menudo con ampollas en el centro, descamación de la piel, úlceras en la boca, la garganta, la nariz, los genitales y los ojos. Estas reacciones cutáneas graves pueden estar precedidas por fiebre y síntomas similares a los de la gripe (síndrome de Stevens-Johnson, necrosis tóxica epidermal).
- Enrojecimiento de la piel y erupción cutánea pruriginosa (erupciones cutáneas tóxicas)
- Reacción cutánea que causa la aparición de puntos o manchas rojas en la piel, que pueden parecer una diana con un centro rojo oscuro rodeado de anillos rojos más claros (eritema polimorfo)
Otros efectos adversos
Otros efectos adversos descritos en la literatura como relacionados con el tratamiento con leuprorelina - el principio activo contenido en Eligard - son: edema periférico (acumulación de líquido en los tejidos, que se manifiesta como hinchazón de las manos y los pies), tromboembolismo pulmonar (que se manifiesta como falta de aliento, dificultad para respirar y dolor en el pecho), taquicardia (latido del corazón perceptible),
disminución de la fuerza muscular, escalofríos, erupciones cutáneas y trastornos de la memoria y la visión. En caso de tratamiento a largo plazo con Eligard, puede esperarse un aumento de la frecuencia de aparición de síntomas de disminución de la densidad ósea (osteoporosis). La osteoporosis aumenta el riesgo de fracturas.
Después del uso de productos que pertenecen al mismo grupo que Eligard, se han informado reacciones alérgicas graves, que causan dificultad para respirar o mareos.
Después del uso de productos que pertenecen al mismo grupo que Eligard, se han informado convulsiones.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluyendo cualquier efecto adverso no mencionado en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Alonso Martínez, 5
28071 Madrid
Tel.: +34 91 596 34 00
Fax: +34 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Eligard
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe tomar este medicamento después de la fecha de caducidad que se indica en el paquete después de EXP.
La fecha de caducidad es el último día del mes indicado.
Instrucciones de conservación
Conservar en nevera (2°C - 8°C).
Conservar en el embalaje original para protegerlo de la humedad.
Antes de la inyección, el producto debe tener la temperatura ambiente. Debe sacarlo de la nevera unos 30 minutos antes de la preparación. Después de sacar el producto de la nevera, puede conservarlo en el embalaje original a temperatura ambiente (por debajo de 25°C) durante 4 semanas.
Después de la primera apertura de la bandeja de plástico cerrada con una lámina, debe preparar la solución y administrarla al paciente lo antes posible. El producto está diseñado para un solo uso.
Instrucciones para el manejo de medicamentos no utilizados o caducados de Eligard
No debe tirar los medicamentos por el desagüe ni por los contenedores de residuos domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Eligard?
El principio activo de Eligard es el octanato de leuprorelina.
Una ampolla- jeringa (Jeringa B) contiene 22,5 mg de octanato de leuprorelina.
Los demás componentes del medicamento son el ácido poli (DL-láctico-co-glicólico) (75:25) y la N-metil-2-pirrolidona contenidos en la ampolla-jeringa con disolvente para preparar la solución para inyección (Jeringa A).
Cómo se presenta Eligard y qué contiene el paquete?
Eligard es un polvo y un disolvente para preparar una solución para inyección.
Eligard 22,5 mg está disponible en los siguientes paquetes:
- Un conjunto que consiste en una bandeja de plástico termoformado cerrada con una lámina y una aguja estéril de 20G, en una caja de cartón. La bandeja contiene una bolsa con un agente deshumidificador y un sistema de jeringas conectadas que consiste en: una ampolla-jeringa A que contiene el disolvente y una ampolla-jeringa B que contiene el polvo, un conector con un botón de seguridad para las jeringas A y B.
- Un paquete colectivo que contiene 2 conjuntos, cada uno con un sistema de jeringas conectadas.
No todos los tamaños de paquete pueden estar en circulación.
Título del titular de la autorización de comercialización y fabricante
Recordati Industria Chimica e Farmaceutica S.p.A.
Via Civitali, 1
20148 Milán
Italia
Para obtener información más detallada, debe ponerse en contacto con el representante local del titular de la autorización de comercialización:
Recordati España, S.A.
Avda. de Burgos, 12
28036 Madrid
Tel: +34 91 302 64 00
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Alemania:
Eligard Depot 22,5 mg
Austria:
Eligard Depot 22,5 mg
Bélgica:
Depo-Eligard 22,5 mg
Chipre:
Eligard
República Checa:
Eligard
Dinamarca:
Eligard
Estonia:
Eligard
Finlandia:
Eligard
Francia:
Eligard 22,5 mg
Grecia:
Eligard 22,5 mg
Hungría:
Eligard 22,5 mg
Islandia:
Eligard
Irlánda:
Eligard 22,5 mg
Italia:
Eligard
Letonia:
Eligard 22,5 mg
Lituania:
Eligard 22,5 mg
Luxemburgo:
Depo-Eligard 22,5 mg
Países Bajos:
Eligard 22,5 mg
Noruega:
Eligard
Polonia:
Eligard 22,5 mg
Portugal:
Eligard 22,5 mg
Reino Unido:
Eligard 22,5 mg
Rumania:
Eligard 22,5 mg
Eslovaquia:
Eligard 22,5 mg
Eslovenia:
Eligard 22,5 mg
España:
Eligard Trimestral 22,5 mg
Suecia:
Eligard
Fecha de la última revisión de la hoja de instrucciones: 10/2024
Información destinada exclusivamente al personal médico especializado:
Antes de abrir, debe llevar el producto a temperatura ambiente sacándolo de la nevera unos 30 minutos antes de su uso.
Primero, debe preparar al paciente para la administración del producto y, a continuación, preparar la solución según las instrucciones a continuación. Si no se prepara la solución utilizando la técnica adecuada, no debe administrarse al paciente, ya que puede ocurrir una falta de eficacia clínicadebido a la mala reconstitución del producto.Paso 1
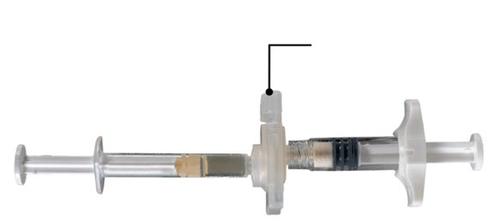
Sobre una superficie limpia, abrir la bandeja retirando la lámina que la cubre y sacar el contenido. Retirar la bolsa con el agente deshumidificador. Sacar el sistema de jeringas conectadas (Fig. 1.1) de la bandeja. Abrir el paquete que contiene la aguja con la cubierta de seguridad (Fig. 1.2), desgarrando la parte de papel del paquete.
Atención: Las jeringas A y B no deben estar aún alineadas.
Fig. 1.1
Contenido de la bandeja: sistema de jeringas conectadas
Fig. 1.2
Debajo de la bandeja: aguja con cubierta de seguridad y conector

Paso 2
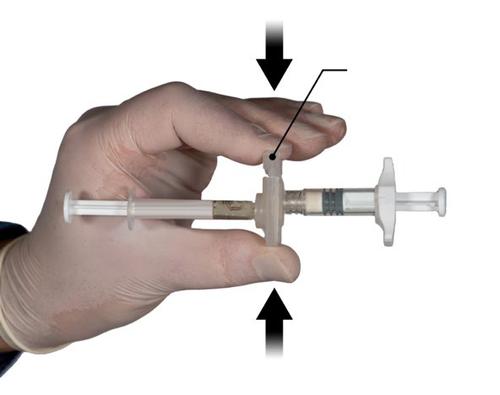
Con el dedo y el pulgar, sujetar el botón de seguridad en el conector y presionar (Fig. 2), hasta que se escuche un clic. Las dos jeringas se alinearán. La activación del conector no requiere ninguna posición especial del sistema de jeringas conectadas. No debe doblar el sistema de jeringas conectadas (debe tener en cuenta que esto puede causar una fuga, ya que las jeringas pueden estar parcialmente desenroscadas).
Paso 3
Manteniendo las jeringas en posición horizontal, transferir el contenido líquido de la jeringa A al polvo de octanato de leuprorelina en la jeringa B. Mezclar bien el producto durante 60 ciclos, moviendo suavemente el contenido de ambas jeringas (un ciclo es una presión del émbolo de la jeringa A y una presión del émbolo de la jeringa B) con las jeringas alineadas en posición horizontal, hasta obtener una solución homogénea y viscosa (Fig. 3). No debe doblar el sistema de jeringas conectadas (debe tener en cuenta que esto puede causar una fuga, ya que las jeringas pueden estar parcialmente desenroscadas).
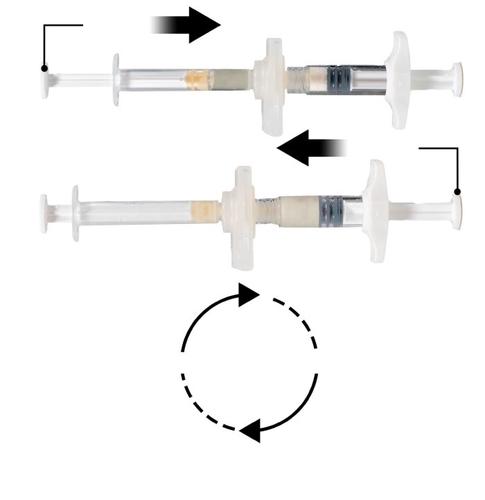
Repetir 60 veces
Después de mezclar bien, la solución viscosa tiene un color incoloro o blanco o ligeramente amarillento (tonos blancos a ligeramente amarillentos).
Importante: Después de la mezcla, debe proceder inmediatamente al siguiente paso, ya que a medida que pasa el tiempo, aumenta la viscosidad del producto. No debe congelar el producto mezclado.
Atención: El producto debe mezclarse según las instrucciones; el agitado NOgarantiza una mezcla adecuada del producto.
Paso 4
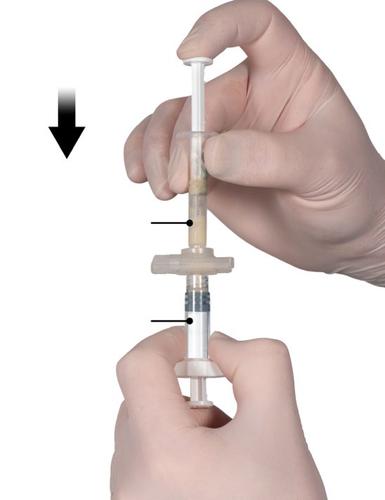
Después de la mezcla, sostener las jeringas en posición vertical, de modo que la jeringa B esté en la parte inferior. Las jeringas deben permanecer conectadas correctamente. Transferir todo el producto mezclado a la jeringa B (jeringa corta y ancha) presionando el émbolo de la jeringa A y tirando ligeramente del émbolo de la jeringa B (Fig. 4).
Fig. 4
Paso 5
Asegurándose de que el émbolo de la jeringa A esté completamente presionado, sostener el conector y girarlo para separarlo de la jeringa B. La jeringa A permanecerá conectada al conector (Fig. 5). Asegurarse de que el producto no se escape, ya que de lo contrario, la aguja, después de colocarla, no protegerá adecuadamente la jeringa.
Atención: En la mezcla pueden quedar un gran bulto o varios bultos pequeños de aire - esto es normal.
No debe eliminar los bultos de aire de la jeringa B en este momento, ya que esto puede causar la pérdida del producto.
Fig. 5
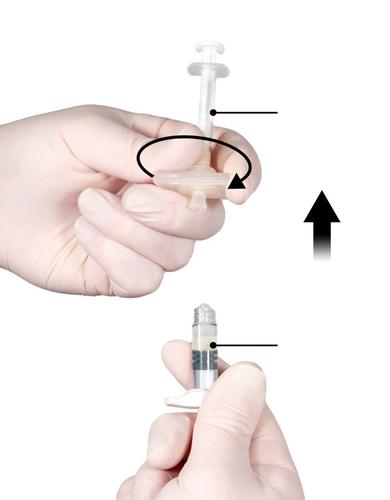
Paso 6
- Sostener la jeringa B en posición vertical y sujetar el émbolo blanco para evitar la pérdida del producto.
- Colocar la aguja con la cubierta de seguridad en la jeringa B, sosteniendo la jeringa, y girarla suavemente en el sentido de las agujas del reloj, hasta que se fije la aguja (Fig. 6). No debe apretar demasiado, ya que esto puede causar la rotura del conector de la aguja y, como consecuencia, la fuga del producto durante la inyección. Si se aprieta la aguja con demasiada fuerza, también puede dañarse la cubierta de seguridad.
Si el conector de la aguja está roto o parece dañado, o si se observa una fuga, no debe administrar el producto. No debe reemplazar la aguja dañada ni administrar el producto. Debe eliminar todos los componentes del producto no utilizado de manera segura.
En caso de daño en el conector de la aguja, debe administrar un nuevo producto.
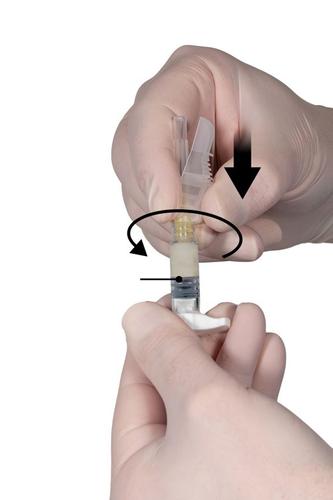
Paso 7
Retirar la cubierta de seguridad de la aguja y quitar la cubierta que cubre la punta de la aguja justo antes de la administración del producto (Fig. 7).
Importante: Antes de la administración, no debe manipular el mecanismo de la cubierta de seguridad de la aguja. Si el conector de la aguja parece dañado o se observa una fuga, NOdebe usar el producto. No debe reemplazar la aguja dañada, y NOdebe administrar el producto. En caso de daño en el conector de la aguja, debe usar un nuevo conjunto de producto Eligard.Fig. 7
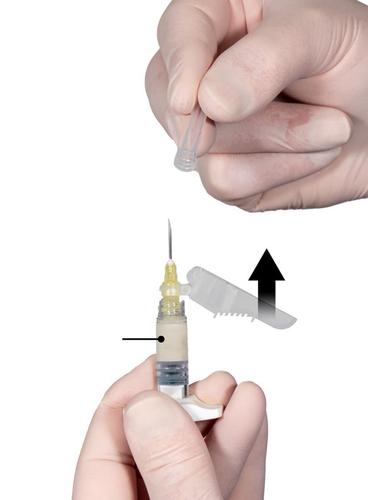
Paso 8
Después de la mezcla, sostener las jeringas en posición vertical, de modo que la jeringa B esté en la parte inferior. Las jeringas deben permanecer conectadas correctamente. Retirar todos los grandesbultos de aire de la jeringa B. Administrar el producto por vía subcutánea, de modo que la cubierta de seguridad permanezca retirada de la aguja. Procedimiento de administración:
Fig. 8
- Seleccionar el lugar de la inyección, que no haya sido utilizado recientemente, en el abdomen, en la parte superior de los glúteos o en otra zona con suficiente tejido subcutáneo y sin decoloración, bultos, lesiones o vello.
- Limpie el área del lugar de la inyección con un hisopo empapado en alcohol (no suministrado).
- Sostener el área de la piel alrededor del lugar de la inyección con el dedo pulgar y el índice.
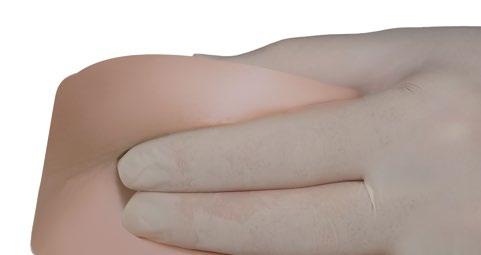
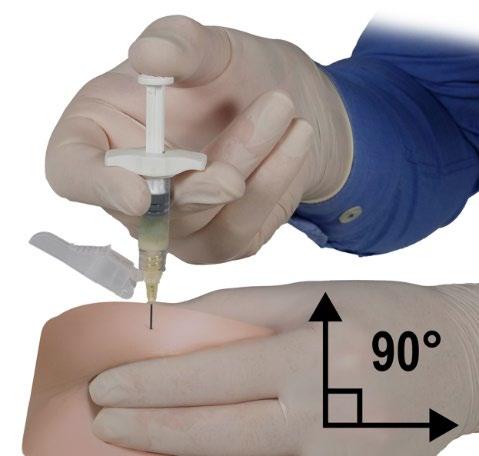
- Con la mano dominante, introducir rápidamente la aguja en un ángulo de 90° con respecto a la superficie de la piel. La profundidad de la penetración dependerá de la cantidad y la densidad del tejido subcutáneo, así como de la longitud de la aguja. Después de la introducción de la aguja, soltar la piel.
- Administrar el producto lentamente y de manera uniforme, presionando el émbolo hasta que se vacíe la jeringa. Antes de retirar la aguja, asegurarse de que se ha inyectado toda la cantidad de producto de la jeringa B.
- Manteniendo la presión sobre el émbolo, retirar rápidamente la aguja en el mismo ángulo de 90° que se utilizó para la introducción.
Paso 9
Después de la administración del producto, debe cerrar la cubierta de seguridad de la aguja utilizando uno de los métodos que se describen a continuación.
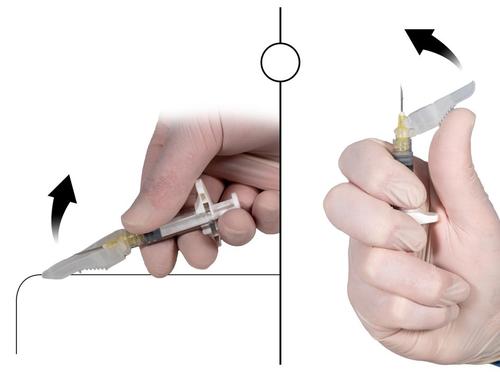
1. Cierre sobre una superficie plana
Presionar la cubierta de seguridad, con la palanca hacia abajo, sobre una superficie plana (Fig. 9a), para cubrir la aguja y cerrar la cubierta de seguridad.
La cubierta está cerrada si se escucha y se siente un clic. En la posición cerrada, la punta de la aguja estará completamente cubierta.
2. Cierre con el pulgar
Colocar el pulgar en la cubierta de seguridad (Fig. 9b), cubrir la punta de la aguja y cerrar la cubierta de seguridad.
La cubierta está cerrada si se escucha y se siente un clic. En la posición cerrada, la punta de la aguja estará completamente cubierta.
Fig. 9a
Cierre sobre una superficie plana
Fig. 9b
Cierre con el pulgar
Después de cerrar la cubierta de seguridad, debe eliminar inmediatamente la aguja y la jeringa en un contenedor para objetos punzantes.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorRecordati Industria Chimica e Farmaceutica S.p.A
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Eligard 22,5 mgForma farmacéutica: Polvo, 45 mgPrincipio activo: leuprorelinRequiere recetaForma farmacéutica: Polvo, 7,5 mgPrincipio activo: leuprorelinRequiere recetaForma farmacéutica: Implante, 3,6 mgPrincipio activo: leuprorelinRequiere receta
Alternativas a Eligard 22,5 mg en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Eligard 22,5 mg en España
Alternativa a Eligard 22,5 mg en Ucrania
Médicos online para Eligard 22,5 mg
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Eligard 22,5 mg – sujeta a valoración médica y normativa local.











