
Librexa
Consulta con un médico sobre la receta médica de Librexa

Cómo usar Librexa
HOJA DE INSTRUCCIONES PARA EL PACIENTE
Hoja de instrucciones incluida en el embalaje: información para el paciente
LIBREXA, 11,25 mg, implante en jeringa precargada
Leuprorelina
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o farmacéutico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es LIBREXA y para qué se utiliza
- 2. Información importante antes de tomar LIBREXA
- 3. Cómo tomar LIBREXA
- 4. Posibles efectos adversos
- 5. Cómo conservar LIBREXA
- 6. Contenido del embalaje y otra información
1. Qué es LIBREXA y para qué se utiliza
El principio activo de LIBREXA (acetato de leuprorelina) pertenece a un grupo de medicamentos que reducen los niveles de ciertas hormonas sexuales.
LIBREXA actúa en la glándula pituitaria, estimulándola brevemente y luego inhibiendo la producción
de hormonas que regulan la producción de hormonas sexuales masculinas en los testículos.
Esto significa que el nivel de hormonas sexuales disminuye y se mantiene en el mismo nivel durante el tratamiento. Después de suspender el tratamiento con LIBREXA, los niveles de hormonas producidas por la pituitaria y las hormonas sexuales vuelven a los valores normales.
LIBREXA se utiliza en hombres:
- para el tratamiento sintomático del cáncer de próstata avanzado que depende de las hormonas (cáncer de próstata);
- como tratamiento complementario durante y después de la radioterapia, en el tratamiento del cáncer de próstata localmente avanzado y dependiente de las hormonas.
2. Información importante antes de tomar LIBREXA
Cuándo no tomar LIBREXA:
- si el paciente es alérgico a la leuprorelina o a alguno de los demás componentes de este medicamento (enumerados en el punto 6);
- si el cáncer diagnosticado en el paciente no depende de las hormonas;
- el medicamento no está indicado para su uso en mujeres, en particular durante el embarazo y la lactancia.
Precauciones y advertencias
En relación con el uso de leuprorelina, se han notificado reacciones cutáneas graves, incluyendo el síndrome de Stevens-Johnson y la necrosis tóxica epidermal (SJS/TEN). En caso de observar alguno de los síntomas asociados con reacciones cutáneas graves descritas en el punto 4
debe suspenderse el uso de leuprorelina y ponerse en contacto de inmediato con un médico.
Antes de iniciar el tratamiento con LIBREXA, debe discutir con su médico:
- si el paciente tiene presión arterial alta. En este caso, el médico controlará atentamente al paciente.
- si el paciente tiene hígado graso
Hay informes de depresión en pacientes que toman leuprorelina. Si durante el tratamiento con LIBREXA aparecen síntomas depresivos, debe informar a su médico.
si ocurre alguno de los siguientes casos: cualquier enfermedad cardíaca o vascular, incluyendo trastornos del ritmo cardíaco (arritmia) o si el paciente toma medicamentos para estas enfermedades, debe informar a su médico. El riesgo de trastornos del ritmo cardíaco puede aumentar durante el tratamiento con LIBREXA.
si el paciente se ha sometido a una orquiectomía (extirpación de los testículos). En este caso, LIBREXA no causa una disminución adicional del nivel de hormona sexual masculina en la sangre.
si antes de iniciar el tratamiento el paciente tiene síntomas neurológicos (compresión de la médula espinal, metástasis en la columna vertebral) o siente molestias al orinar debido a cambios en las vías urinarias. Debe informar a su médico, quien controlará atentamente al paciente durante las primeras semanas de tratamiento en un entorno hospitalario, si es posible.
si los síntomas de la enfermedad reaparecen (es decir, dolor, dificultades para orinar o debilidad en las piernas durante el tratamiento prolongado con LIBREXA). En este caso, el médico controlará regularmente la eficacia del tratamiento realizando las pruebas adecuadas (exploración rectal de la próstata, pruebas de imagen) y controlando los parámetros sanguíneos (actividad de la fosfatasa y nivel de antígeno específico de la próstata (PSA) y nivel de hormona sexual masculina (testosterona).
si el paciente tiene un mayor riesgo de pérdida de densidad ósea (osteoporosis).
si el paciente tiene diabetes. En este caso, el médico controlará atentamente al paciente.
si el paciente experimenta dolores de cabeza severos o recurrentes, dificultades para ver y zumbido o pitido en los oídos, debe ponerse en contacto de inmediato con un médico.
Efectos de un uso inadecuado con fines de dopaje
El uso de LIBREXA puede dar resultados positivos en las pruebas de dopaje.
LIBREXA y otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
LIBREXA puede interactuar con algunos medicamentos utilizados para tratar trastornos del ritmo cardíaco (como la quinidina, el procaína, la amiodarona y el sotalol) o aumentar el riesgo de trastornos del ritmo cardíaco cuando se administra junto con otros medicamentos, como la metadona (utilizada como analgésico y en el tratamiento de desintoxicación de personas adictas a los opiáceos), la moxifloxacina (antibiótico) o los medicamentos antipsicóticos (utilizados para tratar trastornos psiquiátricos graves).
Embarazo, lactancia y fertilidad
LIBREXA no está indicado para su uso en mujeres y no debe administrarse a mujeres embarazadas o en período de lactancia (véase el punto 2 "Cuándo no tomar LIBREXA").
Conducción de vehículos y uso de maquinaria
La fatiga es un efecto adverso común que puede ocurrir, especialmente al inicio del tratamiento, y también puede estar relacionado con la enfermedad subyacente. Hasta obtener más información, debe considerar las siguientes precauciones: el medicamento, incluso cuando se utiliza según las recomendaciones, puede alterar las reacciones del paciente de manera que afecte su capacidad para conducir vehículos o operar maquinaria. Esto es más probable cuando se consume alcohol durante el tratamiento con el medicamento.
3. Cómo tomar LIBREXA
LIBREXA debe ser administrado exclusivamente por un médico o enfermera.
La dosis recomendada es:
LIBREXA se inyecta bajo la piel del abdomen una vez cada tres meses.
El tratamiento del cáncer de próstata avanzado y dependiente de las hormonas con LIBREXA suele ser un tratamiento a largo plazo.
LIBREXA no debe ser administrado por vía intravenosa (en los vasos sanguíneos que transportan sangre rica en oxígeno).
No debe suspenderse el tratamiento sin consultar previamente a un médico.
Uso de una dosis mayor que la recomendada de LIBREXA
El medicamento es administrado por un médico, por lo que no es probable que se administre una dosis mayor que la recomendada.
Incluso en caso de administrar una dosis de 20 mg de acetato de leuprorelina al día durante dos años, no se han observado síntomas de sobredosis.
En caso de duda sobre el uso de este medicamento, debe consultar a un médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Frecuencia desconocida(frecuencia que no puede determinarse a partir de los datos disponibles):
Si observa alguno de los siguientes síntomas, debe ponerse en contacto de inmediato con un médico:
- Manchas rojizas, no elevadas, en forma de placa o redondas en el tronco, a menudo con ampollas en el centro, descamación de la piel, úlceras en la boca, garganta, nariz, genitales y ojos. Estas reacciones cutáneas graves pueden estar precedidas por fiebre y síntomas similares a los de la gripe (síndrome de Stevens-Johnson, necrosis tóxica epidermal)
- Enrojecimiento de la piel y erupción cutánea picazosa (erupciones cutáneas tóxicas)
- Reacción cutánea que causa la aparición de puntos o manchas rojas en la piel, que pueden parecer un blanco de tiro con un centro rojo oscuro rodeado de anillos rojos más claros (eritema multiforme)
Otros efectos adversos
Al inicio del tratamiento, los pacientes suelen experimentar un aumento en el nivel de hormona sexual masculina (testosterona) en la sangre, lo que puede causar un empeoramiento temporal de los síntomas asociados con la enfermedad, como:
aparición o empeoramiento del dolor óseo
dificultades para orinar debido a la estrechez de las vías urinarias
compresión de la médula espinal
debilidad en las piernas
hinchazón de los tejidos debido a la retención de líquidos (edema), también conocido como edema linfático
El empeoramiento de estos síntomas suele desaparecer sin necesidad de suspender el tratamiento con LIBREXA.
Al inicio del tratamiento, el médico puede recomendar la administración de un antagonista de las hormonas sexuales (también conocido como antiandrógeno) para aliviar los posibles trastornos asociados con el aumento inicial del nivel de hormona sexual masculina.
Durante el tratamiento, el nivel de testosterona disminuye hasta valores muy bajos. Como resultado, algunos pacientes experimentan los siguientes efectos adversos:
Muy frecuentes(pueden ocurrir con más frecuencia que en 1 de cada 10 personas):
- Calores
- Debilidad o pérdida del deseo sexual y la potencia
- Disminución del tamaño de los testículos
- Dolor óseo
- Sudoración excesiva
- Reacciones en el lugar de la inyección, como enrojecimiento, dolor, hinchazón, picazón, que suelen desaparecer durante el tratamiento
- Aumento de peso
Frecuentes(pueden ocurrir con menos frecuencia que en 1 de cada 10 personas):
- Aumento del tamaño de los senos en hombres
- Aumento del apetito
- Disminución del apetito
- Cambios de humor
- Depresión
- Trastornos del sueño
- Dolor de cabeza
- Sensaciones anormales (parestesias) / entumecimiento
- Náuseas, vómitos
- Dolor en las articulaciones y (o) la espalda
- Debilidad muscular
- Aumento de la frecuencia de micción nocturna
- Problemas para orinar
- Necesidad frecuente de orinar en pequeñas cantidades
- Cansancio
- Acumulación de líquido en los tejidos (edema)
- Pérdida de peso
- Aumento de la actividad de las enzimas hepáticas (ALAT, ASAT, gamma-GT) y otras enzimas (LDH, fosfatasa alcalina), que también pueden estar relacionadas con la enfermedad.
No muy frecuentes(pueden ocurrir con menos frecuencia que en 1 de cada 100 personas):
- Reacciones alérgicas generalizadas (fiebre, picazón, aumento del número de ciertos glóbulos blancos [eosinofilia], erupción cutánea)
- Diarrhea
- Secura de la piel y (o) las mucosas
- Sudoración excesiva por la noche
- Incabilidad para vaciar completamente la vejiga
- Dolor testicular
Raros(pueden ocurrir con menos frecuencia que en 1 de cada 1000 personas):
- Disminución o aumento del nivel de azúcar en la sangre
- Mareos
- Trastornos transitorios del gusto
- Cambios en la presión arterial (disminución o aumento de la presión arterial)
- Pérdida de cabello
Muy raros(pueden ocurrir con menos frecuencia que en 1 de cada 10 000 personas):
- Reacciones de hipersensibilidad graves (reacciones anafilácticas)
Debe ponerse en contacto de inmediato con un médicosi ocurre alguno de los siguientes síntomas de una reacción de hipersensibilidad grave, que puede ocurrir muy raramente con el uso de LIBREXA y requiere atención médica de inmediato:
enrojecimiento con hinchazón de la piel y las mucosas, dificultades para respirar debido a la estrechez de las vías respiratorias, caída de la presión arterial, aumento de la frecuencia cardíaca, convulsiones,
en casos graves: insuficiencia cardíaca que pone en peligro la vida.
- Al igual que con otros medicamentos de este grupo: infarto de la pituitaria después de la primera administración del medicamento en pacientes con adenoma pituitario.
Frecuencia desconocida(frecuencia que no puede determinarse a partir de los datos disponibles):
- Neumonía, enfermedades pulmonares
- Cambios en el ECG (prolongación del intervalo QT)
- Convulsiones
- Hipertensión endocraneal idiopática (aumento de la presión dentro del cráneo, caracterizado por dolor de cabeza, visión doble y otros síntomas visuales, así como zumbido o pitido en un oído o ambos)
Información especial:
La respuesta al tratamiento con LIBREXA debe controlarse mediante la determinación del nivel de hormona sexual masculina (testosterona) en la sangre 28 días después de cada inyección y antes de cada administración posterior de LIBREXA, así como mediante otras pruebas de laboratorio, como la medición de la actividad de la fosfatasa ácida y el nivel de PSA. Por ejemplo,
en la fase inicial del tratamiento, el nivel de testosterona aumenta primero y luego disminuye en un plazo de 2 semanas. Después de 2 a 4 semanas, los niveles de testosterona son comparables a los observados después de la orquiectomía bilateral y permanecen estables durante todo el período de tratamiento.
En la fase inicial del tratamiento, puede ocurrir un aumento transitorio de la actividad de la fosfatasa ácida (detectado en la prueba de laboratorio). El retorno a los valores fisiológicos o casi fisiológicos ocurre después de varias semanas.
La disminución del nivel de hormona sexual (testosterona) que ocurre después de la orquiectomía o como resultado del uso de medicamentos que inhiben las hormonas sexuales (como LIBREXA) puede causar una disminución de la densidad ósea con un mayor riesgo de fracturas (véase el punto 2 "Precauciones y advertencias"). La disminución de la densidad ósea es más notable después de la orquiectomía que después de la administración de LIBREXA.
Un absceso en el lugar de la inyección es una complicación rara. Se ha notificado un caso de absceso en el lugar de la inyección, que estaba relacionado con una absorción reducida de leuprorelina.
En tales casos, se recomienda determinar el nivel de testosterona.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 24 99
Fax: +34 91 596 24 90
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar LIBREXA
No use este medicamento después de la fecha de caducidad que se indica en el embalaje exterior y en la jeringa precargada después de EXP.
La jeringa precargada debe usarse inmediatamente después de sacarla del embalaje estéril.
No conserve a una temperatura superior a 30°C.
Conserve la jeringa precargada en el embalaje original cerrado para protegerla de la humedad.
El medicamento debe conservarse en un lugar inaccesible y fuera del alcance de los niños.
No deseche los medicamentos por el desagüe ni en los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no necesita. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del embalaje y otra información
Qué contiene LIBREXA:
El principio activo de LIBREXA es el acetato de leuprorelina.
1 implante contiene: 10,72 mg de leuprorelina (Leuprorelina), lo que equivale a 11,25 mg de acetato de leuprorelina
Los demás componentes son: copolímero de DL-lactida y glicolida (1:1) y polímero de DL-lactida.
Cómo se presenta LIBREXA y qué contiene el embalaje
Jeringa precargada de polímero MMBS (metil metacrilato, butadieno, estireno), con émbolo y aguja de acero inoxidable, colocada en una bolsa de folio PETP/Aluminio/PE que contiene un agente desecante, en una caja de cartón.
El embalaje contiene:
1 jeringa precargada con 1 implante para inyección subcutánea.
Título del responsable
LEK-AM, S.A.
Calle de la Industria, 32
28108 Alcobendas (Madrid)
España
Fabricante
AMW GmbH
Birkerfeld 11
83627 Warngau,
Alemania
Fecha de la última actualización de la hoja de instrucciones: 31.12.2024
Información destinada exclusivamente al personal médico y de enfermería:
Instrucciones de uso
Imagen 1
Sacar el aplicador del embalaje estéril
Verificar que el implante esté en la posición correcta dentro del aplicador
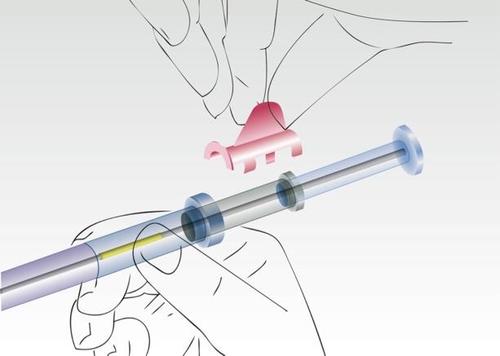
Retirar el anillo de seguridad.
Imagen 2
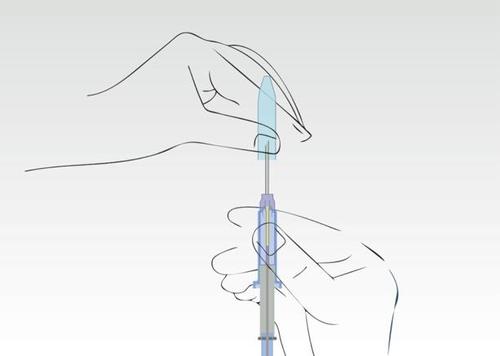
Sostener el aplicador, que se encuentra en el cilindro de la jeringa, y retirar la cubierta.
Imagen 3
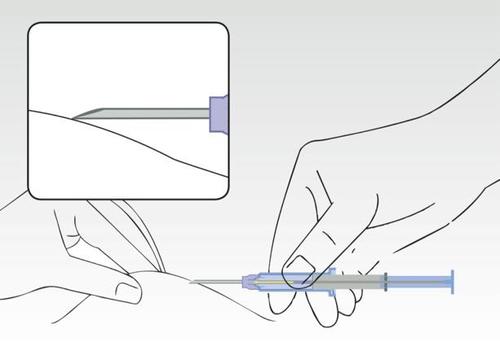
Mientras se sostiene la piel del paciente, sostener el cilindro de la jeringa y insertar la aguja en ángulo (casi paralela a la piel) con la punta de la aguja hacia arriba.
Insertar la aguja en el tejido subcutáneo (no en los músculos o en la cavidad abdominal) de la pared abdominal anterior por debajo de la línea del ombligo, hasta que el cilindro de la jeringa toque la piel del paciente.
El cilindro de la jeringa debe permanecer en contacto con la piel durante todo el proceso de aplicación.
Imagen 4
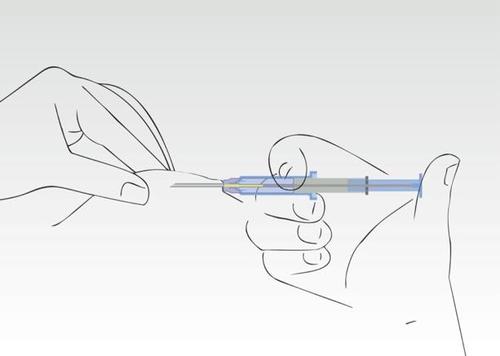
Presionar el émbolo de la jeringa. El implante se desplaza hacia el extremo de la aguja.
No se debe retirar la jeringa hacia atrás. Durante el proceso de aplicación, el cilindro de la jeringa debe permanecer en contacto con la piel del paciente.
Imagen 5
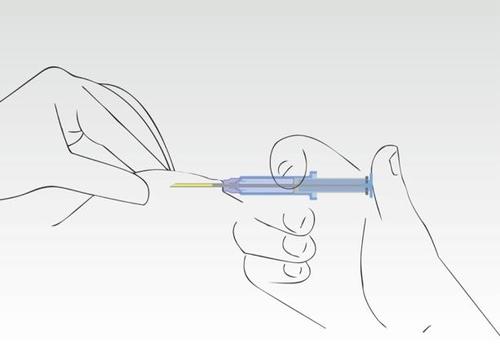
Una vez que se ha presionado el émbolo, la aguja se retrae automáticamente.
Imagen 6
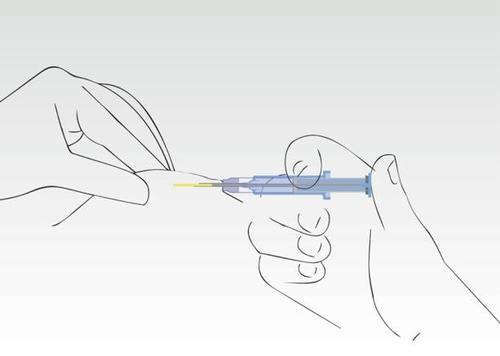
La aguja se retrae del tejido hacia el cilindro de la jeringa. El cilindro de la jeringa debe permanecer en contacto
con la piel del paciente.Por lo general, la presión del émbolo y la retracción de la aguja ocurren en un solo movimiento fluido.
Imagen 7
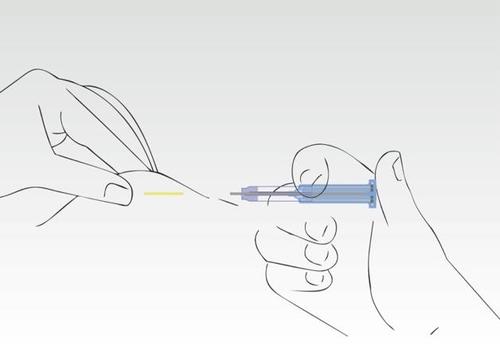
El proceso de aplicación ha terminado. La aguja se ha retirado completamente hacia el cilindro de la jeringa.
El cuerpo con el sobrenadante protege contra lesiones la punta de la aguja.
Imagen 8
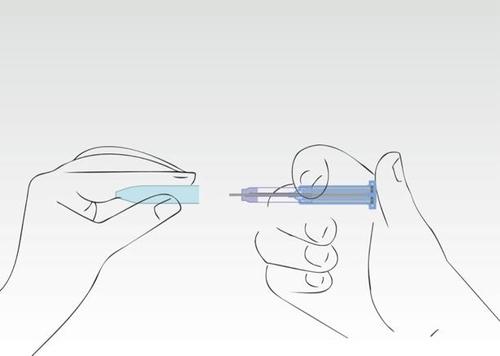
Volver a colocar la cubierta.
La jeringa debe desecharse en un contenedor designado.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorAMW GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a LibrexaForma farmacéutica: Polvo, 22,5 mgPrincipio activo: leuprorelinRequiere recetaForma farmacéutica: Polvo, 45 mgPrincipio activo: leuprorelinRequiere recetaForma farmacéutica: Polvo, 7,5 mgPrincipio activo: leuprorelinRequiere receta
Alternativas a Librexa en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Librexa en España
Alternativa a Librexa en Ucrania
Médicos online para Librexa
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Librexa – sujeta a valoración médica y normativa local.











