
Infanrix - Ipv + Iib

Consulta con un médico sobre la receta médica de Infanrix - Ipv + Iib

Cómo usar Infanrix - Ipv + Iib
Hoja de instrucciones del paquete: Información para el usuario
INFANRIX-IPV+Hib, Polvo y suspensión para preparar suspensión inyectable
Vacuna contra la difteria (D), el tétanos (T), la tos ferina (acelular, combinada) (Pa),
la poliomielitis (inactivada) (IPV) y el Haemophilus influenzae tipo b (Hib) (conjugada), adsorbida
Es importante leer atentamente el contenido de la hoja de instrucciones antes de administrar la vacuna, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico o farmacéutico.
- Esta vacuna ha sido prescrita específicamente para esta persona. No debe dársela a otros.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es la vacuna INFANRIX-IPV+Hib y para qué se utiliza
- 2. Información importante antes de administrar la vacuna INFANRIX-IPV+Hib
- 3. Cómo administrar la vacuna INFANRIX-IPV+Hib
- 4. Posibles efectos adversos
- 5. Cómo almacenar la vacuna INFANRIX-IPV+Hib
- 6. Contenido del paquete y otra información
1. Qué es la vacuna INFANRIX-IPV+Hib y para qué se utiliza
INFANRIX-IPV+Hib es una vacuna utilizada para prevenir la difteria, el tétanos, la tos ferina (coqueluche),
la poliomielitis (polio, enfermedad de Heine-Medina) y las infecciones causadas por el Haemophilus influenzae tipo b en niños.
La parte de la vacuna contra la difteria, el tétanos, la tos ferina y la polio (DTPa-IPV) es una suspensión turbia y blanca en una jeringa precargada (0,5 ml).
La parte de la vacuna contra el Hib es un polvo blanco contenido en un frasco de vidrio.
Ambas partes de la vacuna deben mezclarse antes de administrar la vacuna al niño.
- Difteria:La difteria es una enfermedad infecciosa que afecta principalmente a las vías respiratorias y, a veces, a la piel. Por lo general, causa inflamación y hinchazón en las vías respiratorias, lo que puede provocar dificultades respiratorias graves y, en algunos casos, asfixia. Las bacterias que causan la difteria también producen toxinas que pueden dañar los nervios, el corazón y, en algunos casos, causar la muerte.
- Tétanos:Las bacterias del tétanos entran en el cuerpo a través de una herida, corte o lesión en la piel. Las lesiones que corren mayor riesgo de causar el tétanos son: quemaduras, fracturas, heridas profundas o heridas contaminadas con tierra, polvo, heces de caballo o astillas de madera. Estas bacterias producen toxinas que pueden causar rigidez muscular, calambres musculares, convulsiones y, en algunos casos, la muerte. Los calambres musculares pueden ser tan intensos que causan fracturas en la columna vertebral.
- Tos ferina (coqueluche):La tos ferina es una enfermedad respiratoria muy contagiosa que causa accesos de tos intensos que pueden dificultar la respiración normal. La tos característica de esta enfermedad es muy distintiva y se describe como una tos que hace que la persona "se ahogue". La tos puede durar de 1 a 2 meses o más. Las bacterias que causan la tos ferina también pueden causar infecciones en los oídos, neumonía, convulsiones, daño cerebral y, en algunos casos, la muerte.
También pueden causar infecciones en los oídos, neumonía, convulsiones, daño cerebral y, en algunos casos, la muerte.
- Poliomielitis(enfermedad de Heine-Medina, polio): La poliomielitis es una infección viral que puede causar una variedad de síntomas. A menudo es una enfermedad leve, pero en algunos casos puede causar daños permanentes y, en algunos casos, la muerte. En su forma más grave, la poliomielitis puede causar parálisis muscular (los músculos no pueden funcionar), lo que puede incluir la parálisis de los músculos respiratorios o los músculos que permiten moverse. Las extremidades afectadas pueden quedar deformadas y doloridas.
- Haemophilus influenzaetipo b (Hib): La infección por Hib puede causar meningitis (inflamación del revestimiento que rodea el cerebro y la médula espinal) y epiglotitis (inflamación de la epiglotis, una estructura en la parte posterior de la garganta). Las complicaciones de la infección por Hib pueden incluir retraso mental, parálisis cerebral, sordera, epilepsia o ceguera parcial. La infección por Hib también puede causar infecciones en la garganta. Raramente, puede causar la muerte por asfixia.
La vacuna causa que el cuerpo produzca su propia defensa (anticuerpos) contra estas enfermedades.
La vacunación es la mejor manera de prevenir estas enfermedades. Ninguno de los componentes de la vacuna es infeccioso.
2. Información importante antes de administrar la vacuna INFANRIX-IPV+Hib
Cuándo no administrar la vacuna INFANRIX-IPV+Hib:
- Si el niño es alérgico a la vacuna INFANRIX-IPV+Hib o a cualquier otro componente de la vacuna (enumerados en el punto 6) o a la neomicina, la polimixina o el formaldehído (sustancias presentes en la vacuna en cantidades residuales). Los síntomas de alergia incluyen: erupción cutánea con picazón, dificultad para respirar, hinchazón en la cara o la lengua;
- Si el niño ha experimentado una reacción alérgica a cualquier vacuna contra la difteria, el tétanos, la tos ferina (coqueluche), la polio o las infecciones por Haemophilus influenzaetipo b;
- Si el niño ha experimentado trastornos del sistema nervioso dentro de los 7 días después de una vacuna contra la tos ferina (coqueluche);
- Si el niño tiene fiebre alta (superior a 38,0 °C). Una infección leve, como un resfriado, no debe ser una contraindicación para la vacunación, pero debe informarse al médico.
Precauciones y advertencias
Antes de comenzar a administrar la vacuna INFANRIX-IPV+Hib, debe discutirlo con su médico:
- Si el niño ha experimentado problemas de salud después de una vacuna INFANRIX-IPV+Hib o cualquier otra vacuna contra la tos ferina (coqueluche), en particular:
- fiebre alta (≥ 40,0 °C) dentro de las 48 horas después de la vacunación,
- colapso o estado similar al shock dentro de las 48 horas después de la vacunación,
- llanto persistente durante al menos 3 horas dentro de las 48 horas después de la vacunación,
- convulsiones o ataques de convulsiones con o sin fiebre dentro de los 3 días después de la vacunación,
- Si el niño padece una enfermedad cerebral no diagnosticada o progresiva, o una epilepsia no controlada. La vacuna debe administrarse después de que la enfermedad esté bajo control;
- Si el niño tiene tendencia a convulsiones febriles, o si ha habido casos de convulsiones febriles en la familia;
- Si el niño tiene tendencia a sangrar o a desarrollar moretones con facilidad.
En estos casos, el médico decidirá el momento y la forma adecuados para administrar la vacuna al niño.
Después de la administración de cada vacuna inyectable, puede ocurrir un desmayo. Por lo tanto, debe informar a su médico o enfermera si el niño ha experimentado un desmayo durante la administración de una inyección.
Uso de la vacuna INFANRIX-IPV+Hib en pacientes con trastornos de la inmunidad
En niños con problemas de salud relacionados con trastornos de la inmunidad, la respuesta a la vacunación puede ser reducida. La infección por el virus de la inmunodeficiencia humana (VIH) no es una contraindicación para la vacunación.
La vacuna INFANRIX-IPV+Hib y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que el niño está tomando actualmente o ha tomado recientemente, así como sobre cualquier vacunación que haya recibido.
En niños que están tomando medicamentos que suprimen la inmunidad, la respuesta a la vacunación puede ser reducida.
Las vacunas pediátricas diferentes deben administrarse en diferentes partes del cuerpo.
Embarazo y lactancia
Como la vacuna está destinada a niños, no hay datos adecuados sobre su uso durante el embarazo y la lactancia en humanos.
Conducción de vehículos y uso de máquinas
No se aplica.
La vacuna INFANRIX-IPV+Hib contiene para-aminobenzoato de potasio, fenilalanina, sodio y potasio
La vacuna INFANRIX-IPV+Hib contiene para-aminobenzoato de potasio. Puede causar reacciones alérgicas (reacciones de tipo retardado) y, raramente, espasmo bronquial.
Esta vacuna contiene 0,036 microgramos de fenilalanina por dosis. La fenilalanina puede ser perjudicial para los pacientes con fenilcetonuria (PKU), una enfermedad genética rara en la que la fenilalanina se acumula en el cuerpo porque el cuerpo no la elimina adecuadamente.
Esta vacuna contiene menos de 1 mmol (23 mg) de sodio por dosis, es decir, se considera "libre de sodio".
Esta vacuna contiene potasio, menos de 1 mmol (39 mg) de potasio por dosis, es decir, se considera "libre de potasio".
3. Cómo administrar la vacuna INFANRIX-IPV+Hib
El niño debe recibir un total de 3 dosis de la vacuna, con un intervalo de al menos 1 mes entre cada dosis.
La primera dosis se puede administrar a los 2 meses de edad, y el curso completo de vacunación debe completarse antes de los 6 meses de edad.
Se recomienda una dosis de refuerzo a los 2 años de edad.
Cada dosis se administra durante una visita separada. El médico o la enfermera le informará cuándo debe regresar con el niño para la próxima dosis.
Si el niño no recibe la próxima dosis de la vacuna en el plazo previsto, es importante hablar con el médico y programar otra visita.
Es importante asegurarse de que el niño haya recibido el curso completo de vacunación, que consta de 3 dosis de la vacuna, ya que de lo contrario puede no estar completamente protegido contra las enfermedades infecciosas que cubre la vacuna.
La vacuna INFANRIX-IPV+Hib se administrará como una inyección intramuscular.
La vacuna nunca debe administrarse por vía intravenosa.
4. Posibles efectos adversos
Como cualquier vacuna, la vacuna INFANRIX-IPV+Hib puede causar efectos adversos, aunque no todos los niños los experimentarán.
A continuación, se presentan los efectos adversos que pueden ocurrir después de la vacunación:
Muy frecuentes(pueden ocurrir en 1 de cada 10 dosis de la vacuna o con más frecuencia): pérdida de apetito, irritabilidad, llanto inusual, inquietud, somnolencia, dolor, enrojecimiento y hinchazón localizada (≤ 50 mm) en el lugar de la inyección, fiebre (≥ 38°C).
Frecuentes(menos de 1 de cada 10 dosis de la vacuna): vómitos, diarrea, bulto duro o hinchazón localizada (> 50 mm) en el lugar de la inyección.
No muy frecuentes(menos de 1 de cada 100 dosis de la vacuna): infección de las vías respiratorias superiores, hinchazón de los ganglios linfáticos del cuello, las axilas y las ingles, tos, neumonía, resfriado, erupción cutánea, urticaria, fiebre (> 39,5°C), fatiga, hinchazón extendida de la extremidad en la que se administró la vacuna, que puede incluir la articulación adyacente.
Raros(menos de 1 de cada 1.000 dosis de la vacuna): picazón, inflamación de la piel.
Muy raros(menos de 1 de cada 10.000 dosis de la vacuna):
- Apnea transitoria (cese de la respiración)
- En niños muy prematuros (nacidos antes o en la semana 28 de gestación), dentro de los 2-3 días después de la vacunación, pueden ocurrir intervalos más largos de lo normal entre respiraciones.
- Sangrado o moretones con facilidad
- Reacciones alérgicas. Como con otras vacunas inyectables, existe un pequeño riesgo de reacciones alérgicas (reacciones de hipersensibilidad). Esto puede reconocerse por los siguientes síntomas:
- erupción cutánea con picazón en las palmas de las manos y las plantas de los pies,
- hinchazón alrededor de los ojos y la cara,
- dificultad para respirar y tragar. Estos síntomas ocurren generalmente antes de abandonar la consulta del médico. En cada caso, debe recibir tratamiento de inmediato.
- Convulsiones (con o sin fiebre), colapso, trastornos de la conciencia o pérdida de conciencia
- Hinchazón limitada, generalmente localizada en la cabeza y el cuello (edema angioneurótico)
- Hinchazón de toda la extremidad en la que se administró la vacuna
- Ampollas en el lugar de la inyección
Si estos síntomas persisten o empeoran, debe informar a su médico.
No debe preocuparse por esta lista de posibles efectos adversos. Es posible que no ocurran efectos adversos después de la vacunación.
Notificación de efectos adversos
Si ocurren cualquier síntoma adverso, incluidos cualquier síntoma adverso no mencionado en la hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Reacciones Adversas de Medicamentos del Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas: Al. Jerozolimskie 181C, 02-222 Varsovia, tel.: 22 49-21-301, fax: 22 49-21-309
Página web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo almacenar la vacuna INFANRIX-IPV+Hib
Almacenar en la nevera (2 °C – 8 °C). No congelar.
Almacenar en el embalaje original para protegerlo de la luz.
La vacuna debe almacenarse en un lugar fuera del alcance de los niños.
No debe usar esta vacuna después de la fecha de caducidad impresa en el embalaje. La fecha de caducidad (EXP) es el último día del mes indicado.
Número de lote (Lote).
6. Contenido del paquete y otra información
Qué contiene la vacuna INFANRIX-IPV+Hib?
1 dosis de la vacuna (0,5 ml) después de la reconstitución contiene:
toxoides de la difteria
no menos de 30 UI
toxoides del tétanos
no menos de 40 UI
antígenos de la tos ferina Bordetella pertussis:
toxoides de la tos ferina
25 microgramos
hemaglutinina filamentosa
25 microgramos
pertactina
8 microgramos
policomielitis (inactivada):
tipo 1 (cepas Mahoney)
40 unidades de antígeno D
tipo 2 (cepas MEF-1)
8 unidades de antígeno D
tipo 3 (cepas Saukett)
32 unidades de antígeno D
polisacárido del Haemophilus influenzae tipo b
(fosforan de polirribosil ribitol)
unido al toxoide del tétanos como portador proteico
10 microgramos
alrededor de 25 microgramos
adsorbido en hidróxido de aluminio hidratado
0,5 miligramos de Al
producido en cultivo de células VERO
Los demás componentes son:
lactosa, cloruro de sodio (ver también el punto 2, "La vacuna INFANRIX-IPV+Hib contiene sodio"),
medio 199 (que contiene aminoácidos, incluida la fenilalanina, sales minerales, incluidas el sodio y el potasio, vitaminas, incluido el para-aminobenzoato de potasio, y otros componentes), agua para inyección.
Cómo se presenta la vacuna INFANRIX-IPV+Hib y qué contiene el paquete?
El componente liofilizado del Haemophilus influenzae tipo b (Hib) es un polvo blanco.
La suspensión (DTPa-IPV) que contiene el toxoide de la difteria, el toxoide del tétanos, los antígenos de la tos ferina y el poliovirus inactivado es una suspensión blanca y turbia.
Antes de la administración, el polvo y la suspensión se mezclan.
La vacuna INFANRIX-IPV+Hib está disponible en forma de frasco de una dosis + jeringa precargada, en paquetes de 1 o 10 unidades, con agujas incluidas o sin agujas.
No todos los tipos de paquetes pueden estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante:
GlaxoSmithKline Biologicals S.A
rue de l’Institut 89
1330 Rixensart, Bélgica
Para obtener información más detallada, debe ponerse en contacto con el representante del titular de la autorización de comercialización.
GSK Services Sp. z o.o.
ul. Rzymowskiego 53
02-697 Varsovia
Tel. +48 (22) 576 90 00
Fecha de la última actualización de la hoja de instrucciones: abril de 2023
-------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Durante el almacenamiento de la suspensión, puede formarse un sedimento blanco y un líquido transparente en la parte superior. Este es un fenómeno normal y no afecta la eficacia de la vacuna.
Antes de la reconstitución de la vacuna, la jeringa precargada que contiene la suspensión DTPa-IPV debe agitarse bien para obtener una suspensión homogénea.
La suspensión DTPa-IPV en la jeringa precargada, el polvo Hib en el frasco, así como la vacuna después de la reconstitución, deben inspeccionarse antes de la administración para detectar cualquier contaminación o aspecto anormal. En caso de observar alguna anomalía, la vacuna debe desecharse.
La vacuna debe prepararse agregando toda la suspensión DTPa-IPV al frasco que contiene el polvo Hib. La vacuna debe administrarse inmediatamente después de la reconstitución. La vacuna después de la reconstitución es más turbia que la suspensión DTPa-IPV. Después de la reconstitución de la vacuna y la aspiración de la suspensión en la jeringa, puede ocurrir una separación de la suspensión en una fase transparente y una fase gelatinosa.
No es un signo de disminución de la calidad de la vacuna.
En caso de que ocurra este fenómeno, antes de la administración, debe agitar energéticamente el contenido de la jeringa.
Si se observan cualquier otro cambio en el aspecto de la suspensión, la vacuna debe desecharse.
Las instrucciones detalladas para la preparación de la vacuna se encuentran a continuación:
- 1. Agitar la jeringa precargada que contiene la suspensión DTPa-IPV;
- 2. Colocar la aguja en la jeringa precargada con la suspensión DTPa-IPV y transferir su contenido al frasco que contiene el polvo Hib;
- 3. Sin retirar la aguja, agitar energéticamente el frasco y verificar si se ha producido la disolución;
- 4. Aspirar la mezcla de nuevo en la jeringa precargada;
- 5. Cambiar la aguja colocada por una aguja para inyección y administrar la vacuna inmediatamente;
- 6. Si la vacuna no se administra inmediatamente después de la reconstitución, antes de la administración, debe agitar energéticamente el contenido de la jeringa precargada.
Instrucciones para la jeringa precargada
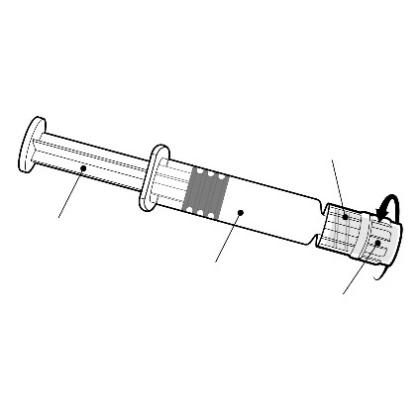
Conector
tipo Luer Lock
Debe sostener la jeringa precargada por el cuerpo, no por el émbolo.
Debe girar el conector de la jeringa precargada en el sentido contrario a las agujas del reloj para abrirlo.
Émbolo
Cuerpo
Conector
Conector de la aguja
Debe fijar la aguja a la jeringa precargada conectando el conector de la aguja al conector Luer Lock y girándolo un cuarto de vuelta en el sentido de las agujas del reloj, hasta que se sienta que la aguja está bloqueada.
Debe reconstituir la vacuna según las instrucciones anteriores.
No debe retirar el émbolo del cuerpo de la jeringa precargada. Si esto ocurre, no debe administrar la vacuna.
Eliminación
Todos los residuos del producto no utilizado o desechos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Infanrix - Ipv + IibForma farmacéutica: Suspensión, 0.5 mlPrincipio activo: diphtheria-pertussis-poliomyelitis-tetanusFabricante: Sanofi-Aventis Zrt.Requiere recetaForma farmacéutica: Suspensión, 0.5 ml (1 dosis)Principio activo: diphtheria-pertussis-poliomyelitis-tetanusFabricante: GlaxoSmithKline Biologicals S.A.Requiere recetaForma farmacéutica: Suspensión, no menos de 2 UM + no menos de 20 UM + 40 unidades antigénicas D + 8 unidades antigénicas D + 32 unidades antigénicas D/0,5 ml, 1 dosis (0,5 ml)Principio activo: diphtheria-poliomyelitis-tetanusFabricante: Sanofi Pasteur Sanofi-Aventis Zrt.Requiere receta
Alternativas a Infanrix - Ipv + Iib en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Infanrix - Ipv + Iib en Ucrania
Alternativa a Infanrix - Ipv + Iib en España
Médicos online para Infanrix - Ipv + Iib
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Infanrix - Ipv + Iib – sujeta a valoración médica y normativa local.














