
Boostrix Polio

Consulta con un médico sobre la receta médica de Boostrix Polio

Cómo usar Boostrix Polio
Hoja de instrucciones del paquete: información para el usuario
Boostrix Polio, Suspensión para inyección en jeringa precargada
Vacuna contra el tétanos, la difteria, la tos ferina (acelular, combinada) y la poliomielitis (inactivada), adsorbida, con contenido reducido de antígenos
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de administrar la vacuna, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a un médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es la vacuna Boostrix Polio y para qué se utiliza
- 2. Información importante antes de administrar la vacuna Boostrix Polio
- 3. Cómo administrar la vacuna Boostrix Polio
- 4. Posibles efectos adversos
- 5. Cómo almacenar la vacuna Boostrix Polio
- 6. Contenido del paquete y otra información
1. Qué es la vacuna Boostrix Polio y para qué se utiliza
La vacuna Boostrix Polio es una vacuna utilizada para la inmunización de refuerzo en niños a partir de 3 años, adolescentes y adultos para prevenir cuatro enfermedades: el tétanos, la difteria, la tos ferina (coqueluche) y la poliomielitis. La vacuna induce la producción de anticuerpos en el organismo contra estas enfermedades.
- Tétanos:El tétanos es una enfermedad que afecta principalmente las vías respiratorias y, a veces, la piel. Por lo general, se produce una inflamación y un edema en las vías respiratorias, lo que causa dificultades respiratorias graves y, a veces, asfixia. Las bacterias del tétanos también producen toxinas que pueden causar daños en los nervios, enfermedades cardíacas y, en algunos casos, la muerte.
- Difteria:Las bacterias de la difteria ingresan al organismo a través de heridas, cortes o abrasiones en la piel. Las lesiones que presentan un mayor riesgo de infección por difteria son: quemaduras, fracturas, heridas profundas o heridas contaminadas con tierra, polvo, heces equinas, astillas de madera. Estas bacterias producen toxinas que pueden causar rigidez muscular, calambres musculares dolorosos, convulsiones y, en algunos casos, la muerte. Los calambres musculares pueden ser tan intensos que pueden causar fracturas en la columna vertebral.
- Tos ferina (coqueluche):La tos ferina es una enfermedad altamente contagiosa. La enfermedad afecta las vías respiratorias, causando accesos de tos severos que pueden dificultar la respiración normal. La tos asociada con esta enfermedad es muy característica, se dice que las personas con tos ferina "tosen hasta el agotamiento". La tos puede durar de 1 a 2 meses o más. Las bacterias de la tos ferina también pueden causar infecciones en los oídos, bronquitis, que puede durar mucho tiempo, neumonía, convulsiones, daños cerebrales y, en algunos casos, la muerte.
- Poliomielitis:La poliomielitis es una infección viral que se caracteriza por una variedad de síntomas. A menudo es una enfermedad leve, pero en algunas personas puede causar daños permanentes o la muerte. En su forma más grave, la enfermedad puede causar parálisis muscular (los músculos no pueden funcionar), que puede ser parálisis de los músculos respiratorios o de los músculos que permiten la movilidad. Las extremidades afectadas por esta enfermedad pueden estar deformadas y doloridas.
Ninguno de los componentes de la vacuna puede causar el tétanos, la difteria, la tos ferina o la poliomielitis. La administración de la vacuna Boostrix Polio durante el embarazo ayuda a proteger al bebé contra la tos ferina durante los primeros meses de vida, antes de que reciba la vacunación primaria.
2. Información importante antes de administrar la vacuna Boostrix Polio
Cuándo no administrar la vacuna Boostrix Polio:
- Si ha habido una reacción alérgica (hipersensibilidad) a la vacuna Boostrix Polio o a cualquier componente de la vacuna (enumerado en el punto 6), así como a la neomicina, la polimixina (antibióticos) o el formaldehído. Los síntomas de hipersensibilidad incluyen: erupción cutánea picazón, dificultad para respirar, edema de la cara o la lengua.
- Si ha habido una reacción alérgica a cualquier vacuna contra el tétanos, la difteria, la tos ferina (coqueluche) o la poliomielitis.
- Si ha habido trastornos del sistema nervioso dentro de los 7 días después de la administración previa de una vacuna contra la tos ferina (coqueluche).
- Si ha habido una disminución temporal en la cantidad de plaquetas en la sangre (lo que aumenta el riesgo de sangrado o moretones) o trastornos cerebrales y nerviosos después de las vacunaciones previas contra el tétanos o la difteria.
- Si hay fiebre alta (superior a 38,0 °C). Una infección leve, como un resfriado, no debe ser una contraindicación para la vacunación, pero primero debe informar a su médico.
Precauciones y advertencias
Antes de recibir la vacuna Boostrix Polio, debe consultar a un médico o farmacéutico:
- Si ha habido problemas de salud después de la administración previa de la vacuna Boostrix Polio o cualquier otra vacuna contra la tos ferina (coqueluche), en particular:
- Fiebre alta (superior a 40 °C) dentro de las 48 horas después de la administración de la vacuna
- Colapso o estado similar al shock dentro de las 48 horas después de la administración de la vacuna
- Llanto persistente que dura al menos 3 horas dentro de las 48 horas después de la administración de la vacuna
- Convulsiones o ataques de convulsiones con o sin fiebre dentro de las 3 días después de la administración de la vacuna
- Si el niño tiene una enfermedad cerebral no diagnosticada o en curso, o una epilepsia no controlada. La vacuna debe administrarse después de que la enfermedad esté bajo control
- Si hay sangrado o moretones frecuentes
- Si hay antecedentes de convulsiones febriles o si han ocurrido en la familia
- Si hay trastornos de la inmunidad a largo plazo (incluido el virus del VIH). En estos casos, la vacuna Boostrix Polio puede administrarse, pero es posible que los pacientes no desarrollen una respuesta inmune tan buena como las personas con un sistema inmune normal.
Después de la administración de cualquier vacuna inyectable, puede ocurrir un desmayo (especialmente en adolescentes). Por lo tanto, debe informar a su médico o enfermera si ha tenido un desmayo después de una inyección anterior. Al igual que con cualquier vacuna, es posible que no se produzca una respuesta inmune protectora en todas las personas vacunadas.
Interacción con otros medicamentos
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar y las vacunas que ha recibido recientemente. La vacuna Boostrix Polio puede administrarse al mismo tiempo que otras vacunas. Cada vacuna se administrará en un lugar diferente. La vacuna Boostrix Polio puede no funcionar correctamente si se administra al mismo tiempo que medicamentos que reducen la capacidad del sistema inmune para luchar contra las infecciones.
Embarazo y lactancia
Si está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de recibir esta vacuna. No se sabe si la vacuna Boostrix Polio pasa a la leche materna. El médico discutirá con la paciente los posibles riesgos y beneficios de la administración de la vacuna Boostrix Polio durante la lactancia.
Conducción de vehículos y uso de máquinas
Es poco probable que la vacuna Boostrix Polio afecte la capacidad para conducir vehículos o operar máquinas.
Boostrix Polio contiene neomicina y polimixina
La vacuna Boostrix Polio contiene neomicina y polimixina (antibióticos). Debe informar a su médico si ha tenido reacciones alérgicas a estas sustancias anteriormente.
Boostrix Polio contiene ácido para-aminobenzoico, fenilalanina, sodio y potasio
La vacuna Boostrix Polio contiene ácido para-aminobenzoico. Puede causar reacciones alérgicas (posibles reacciones tardías) y, raramente, espasmo bronquial. La vacuna contiene 0,0298 microgramos de fenilalanina por dosis. La fenilalanina puede ser perjudicial para los pacientes con fenilcetonuria (PKU), una enfermedad genética rara en la que la fenilalanina se acumula en el organismo porque el organismo no la elimina adecuadamente. Esta vacuna contiene menos de 1 mmol (23 mg) de sodio por dosis, lo que significa que se considera "libre de sodio". Esta vacuna contiene potasio, menos de 1 mmol (39 mg) de potasio por dosis, lo que significa que se considera "libre de potasio".
3. Cómo administrar la vacuna Boostrix Polio
- La vacuna Boostrix Polio se administrará como una inyección intramuscular.
- En ningún caso se debe administrar la vacuna por vía intravenosa.
- El paciente recibirá una sola dosis de la vacuna.
- El médico determinará si el paciente ha sido vacunado previamente contra el tétanos, la difteria, la tos ferina y/o la poliomielitis.
- La vacuna Boostrix Polio puede administrarse en caso de que se sospeche una infección por tétanos debido a una herida. El médico también tomará medidas adicionales, como:
tratamiento de la herida y/o administración de antitoxina contra el tétanos para reducir el riesgo de contraer la enfermedad.
- El médico informará si es necesario administrar una dosis adicional de la vacuna.
4. Posibles efectos adversos
Al igual que con cualquier medicamento, esta vacuna puede causar efectos adversos, aunque no todos los pacientes los experimentarán. Al igual que con todas las vacunas inyectables, existe un pequeño riesgo (hasta 1 de cada 10.000 dosis de vacuna) de reacciones alérgicas (anafilácticas y anafilactoides). Esta condición se puede reconocer por los siguientes síntomas:
- Erupción cutánea que puede ser picazón o ampollas,
- Edema alrededor de los ojos y la cara,
- Dificultad para respirar y tragar,
- Caida repentina de la presión arterial y pérdida de conciencia.Estas reacciones ocurren generalmente antes de abandonar la consulta del médico. Sin embargo, en cada uno de estos casos, debe comunicarse de inmediato con un médico.
Efectos adversos que se produjeron en los estudios clínicos en niños de 4 a 8 años:
Muy frecuentes(pueden ocurrir con más frecuencia de 1 de cada 10 dosis de vacuna): dolor, enrojecimiento y hinchazón en el lugar de la inyección, somnolencia.
Frecuentes(pueden ocurrir hasta 1 de cada 10 dosis de vacuna): fiebre igual o superior a 37,5 °C (incluida fiebre superior a 39 °C), moretones, picazón y nódulo duro en el lugar de la inyección, hinchazón generalizada del brazo en el que se administró la vacuna, pérdida de apetito, irritabilidad, dolor de cabeza.
No muy frecuentes(pueden ocurrir hasta 1 de cada 100 dosis de vacuna): diarrea, náuseas, vómitos, dolor abdominal, hinchazón de los ganglios linfáticos del cuello, las axilas o las ingles (linfadenopatía), problemas para dormir, apatía, sequedad en la garganta, fatiga.
Administración concomitante con la vacuna contra el sarampión, las paperas y la rubéola (MMR) o el sarampión, las paperas, la rubéola y la varicela (MMRV) en niños de 3 a 6 años
En los estudios en los que se administró la vacuna Boostrix Polio al mismo tiempo que la vacuna MMR o MMRV, se informó regularmente de erupción cutánea y faringitis (incluyendo secreción nasal y dolor de garganta). La fiebre, la irritabilidad, la fatiga, la pérdida de apetito y los trastornos gastrointestinales (incluyendo diarrea y vómitos) se informaron con mayor frecuencia (muy frecuentes) que en los estudios en los que solo se administró la vacuna Boostrix Polio.
Efectos adversos que se produjeron en los estudios clínicos en adultos, adolescentes y niños a partir de 10 años:
Muy frecuentes(pueden ocurrir con más frecuencia de 1 de cada 10 dosis de vacuna): dolor, enrojecimiento y hinchazón en el lugar de la inyección, fatiga, dolor de cabeza.
Frecuentes(pueden ocurrir hasta 1 de cada 10 dosis de vacuna): fiebre igual o superior a 37,5 °C, moretones, picazón, nódulo duro, sensación de calor, entumecimiento en el lugar de la inyección, dolor abdominal, náuseas, vómitos.
No muy frecuentes(pueden ocurrir hasta 1 de cada 100 dosis de vacuna): fiebre superior a 39 °C, hinchazón generalizada del brazo en el que se administró la vacuna, escalofríos, dolor, mareo, dolor en las articulaciones y los músculos, picazón, herpes labial, hinchazón de los ganglios linfáticos del cuello, las axilas o las ingles (linfadenopatía), pérdida de apetito, hormigueo o entumecimiento en las manos o los pies (parestesia), somnolencia, asma.
Los siguientes efectos adversos se produjeron después de la administración de la vacuna Boostrix Polio y no son específicos de ningún grupo de edad: desmayos o pérdida de conciencia o falta de conocimiento, edema de la cara, los labios, la boca, la lengua o la garganta, que puede causar dificultad para tragar o respirar (edema angioneurótico), convulsiones (con o sin fiebre), ampollas (urticaria), debilidad inusual (astenia).
Además, se han informado los siguientes efectos adversos en los estudios clínicos de otra vacuna contra el tétanos, la difteria y la tos ferina (acelular) con contenido reducido de antígenos de GlaxoSmithKline Biologicals (Boostrix):
Efectos adversos que se produjeron en los estudios clínicos en niños de 4 a 8 años:
No muy frecuentes(pueden ocurrir hasta 1 de cada 100 dosis de vacuna): trastornos de la atención, secreción y picazón en los ojos, infección del ojo (conjuntivitis), dolor.
Efectos adversos que se produjeron en los estudios clínicos en adultos, adolescentes y niños a partir de 10 años:
Muy frecuentes(pueden ocurrir con más frecuencia de 1 de cada 10 dosis de vacuna): malestar general.
Frecuentes(pueden ocurrir hasta 1 de cada 10 dosis de vacuna): nódulo duro o absceso en el lugar de la inyección.
No muy frecuentes(pueden ocurrir hasta 1 de cada 100 dosis de vacuna): infección de las vías respiratorias superiores, dolor de garganta y dificultad para tragar (faringitis), desmayo, tos, diarrea, sudoración excesiva, erupción cutánea, rigidez en las articulaciones, rigidez muscular, síntomas similares a los de la gripe, como fiebre, dolor de garganta, secreción nasal, tos y escalofríos.
Después de la administración de vacunas contra el tétanos, se han informado muy raramente (hasta 1 de cada 10.000 dosis de vacuna) casos de neuritis, que causa dolor, debilidad y parálisis de las extremidades, a menudo afectando también el pecho y la cara (síndrome de Guillain-Barré).
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Calle de Alcalá, 181C
28071 Madrid
Teléfono: 91 822 22 00
Fax: 91 822 22 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo almacenar la vacuna Boostrix Polio
Debe almacenarse en un lugar no accesible para los niños.
No debe administrarse esta vacuna después de la fecha de caducidad indicada en el paquete de cartón y en la etiqueta de la jeringa precargada después de "EXP". La fecha de caducidad es el último día del mes indicado.
Debe almacenarse en el refrigerador (2 °C - 8 °C).
No debe congelarse. El congelamiento destruye la vacuna.
Debe almacenarse en el paquete original para protegerlo de la luz.
No debe desechar los medicamentos por el desagüe o los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene la vacuna Boostrix Polio?
- Los principios activos de la vacuna son:
Toxoides de la difteria
no menos de 2 unidades internacionales (UI) (2,5 Lf)
Toxoides del tétanos
no menos de 20 unidades internacionales (UI) (5 Lf)
Antígenos de Bordetella pertussis
Toxoides de la tos ferina
8 microgramos
Hemaglutinina filamentosa
8 microgramos
Pertactina
2,5 microgramos
Poliomielitis inactivada
tipo 1 (cepa Mahoney)
40 unidades de antígeno D
tipo 2 (cepa MEF-1)
8 unidades de antígeno D
tipo 3 (cepa Saukett)
32 unidades de antígeno D
adsorbida en hidróxido de aluminio hidratado (Al(OH))
0,3 miligramos de Al
y en fosfato de aluminio (AlPO)
0,2 miligramos de Al
producida en cultivo de células VERO
El hidróxido de aluminio y el fosfato de aluminio actúan como adyuvantes en esta vacuna. Los adyuvantes son sustancias que forman parte de algunas vacunas y tienen como función acelerar, aumentar y/o prolongar la acción protectora de la vacuna.
- Los demás componentes de la vacuna Boostrix Polio son: medio 199 (que contiene aminoácidos, incluyendo fenilalanina, sales minerales, incluyendo sodio y potasio, vitaminas, incluyendo ácido para-aminobenzoico, y otras sustancias), cloruro de sodio, agua para inyección.
Cómo se presenta la vacuna Boostrix Polio y qué contiene el paquete?
Suspensión para inyección en jeringa precargada.
La vacuna Boostrix Polio es un líquido blanco ligeramente lechoso en una jeringa precargada (0,5 ml).
La vacuna Boostrix Polio está disponible en forma de jeringa precargada de una dosis, en paquetes de 1 o 10 unidades, con agujas o sin agujas.
No todos los tipos de paquetes pueden estar disponibles en el mercado.
Titular de la autorización de comercialización y fabricante
GlaxoSmithKline Biologicals S.A.
calle del Instituto, 89
1330 Rixensart, Bélgica
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
Boostrix Polio:Alemania, Austria, Bélgica, Bulgaria, Chipre, Croacia, Dinamarca, Eslovaquia, Eslovenia, España, Estonia, Finlandia, Francia, Grecia, Hungría, Irlanda, Islandia, Italia, Letonia, Lituania, Luxemburgo, Malta, Países Bajos, Polonia, Portugal, Reino Unido, República Checa, Rumania, Suecia
Boostrix Tetra:Francia
IPV-Boostrix:Irlanda
Polio Boostrix:Italia
Boostrix IPV:Rumania
Fecha de la última revisión de la hoja de instrucciones:04/2023
Otras fuentes de información
Información detallada sobre este medicamento está disponible en el sitio web del Ministerio de Sanidad:
-------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico y de enfermería:
Antes de la administración, la vacuna debe alcanzar la temperatura ambiente. La jeringa precargada debe agitarse firmemente para obtener una suspensión turbia y blanca homogénea.
Antes de la administración, la vacuna debe evaluarse visualmente para detectar la presencia de partículas extrañas o cambios en el aspecto físico de la vacuna. Si se detectan, no debe administrarse la vacuna.
Instrucciones para la jeringa precargada
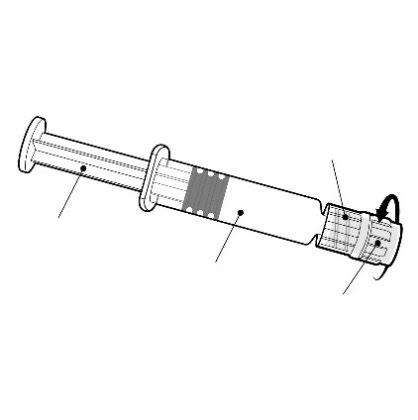
Debe sostener la jeringa precargada por el cuerpo, no por el émbolo.
Debe girar la boquilla de la jeringa precargada en el sentido contrario a las agujas del reloj para aflojarla.
Adaptador Luer Lock
Émbolo
Cuerpo
Boquilla
Debe fijar la aguja a la jeringa precargada conectando la boquilla de la aguja al adaptador Luer Lock y girándola un cuarto de vuelta en el sentido de las agujas del reloj, hasta que se sienta un bloqueo de la aguja.
No debe retirar el émbolo del cuerpo de la jeringa precargada. Si esto sucede, no debe administrarse la vacuna.
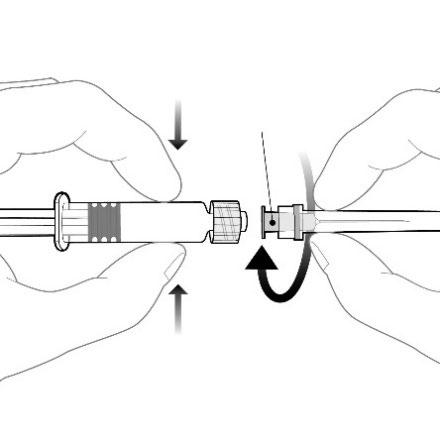
Boquilla de la aguja
Eliminación
Todos los residuos del producto o desechos deben eliminarse de acuerdo con las regulaciones locales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorGlaxoSmithKline Biologicals S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Boostrix PolioForma farmacéutica: Suspensión, 0.5 mlPrincipio activo: diphtheria-pertussis-poliomyelitis-tetanusFabricante: Sanofi-Aventis Zrt.Requiere recetaForma farmacéutica: Suspensión, 1 dosis (0.5 ml)Principio activo: diphtheria-pertussis-poliomyelitis-tetanusFabricante: GlaxoSmithKline Biologicals S.A.Requiere recetaForma farmacéutica: Polvo, 32 unidades antigénicas D + 10 mcg + no menos de 40 UI + 8 unidades antigénicas D + 40 unidades antigénicas D + no menos de 30 UI + 25 mcg + 25 mcgPrincipio activo: diphtheria-pertussis-poliomyelitis-tetanusRequiere receta
Alternativas a Boostrix Polio en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Boostrix Polio en España
Alternativa a Boostrix Polio en Ucrania
Médicos online para Boostrix Polio
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Boostrix Polio – sujeta a valoración médica y normativa local.














