

Iipnomidate

Consulta con un médico sobre la receta médica de Iipnomidate

Cómo usar Iipnomidate
Hoja de instrucciones del paquete: información para el usuario
HYPNOMIDATE, 2 mg/ml, solución para inyección
Etomidato
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o farmacéutico.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es HYPNOMIDATE y para qué se utiliza
- 2. Información importante antes de usar HYPNOMIDATE
- 3. Cómo usar HYPNOMIDATE
- 4. Posibles efectos adversos
- 5. Cómo conservar HYPNOMIDATE
- 6. Contenido del paquete y otra información
1. Qué es HYPNOMIDATE y para qué se utiliza
El principio activo de HYPNOMIDATE es etomidato.
HYPNOMIDATE está indicado para la inducción de anestesia general, así como para anestesia suplementaria en anestesia local.
HYPNOMIDATE está indicado para procedimientos diagnósticos o quirúrgicos de corta duración que requieren un despertar rápido del paciente.
HYPNOMIDATE está especialmente indicado en cirugía cardíaca y en pacientes con enfermedades cardíacas.
2. Información importante antes de usar HYPNOMIDATE
Cuándo no usar HYPNOMIDATE
Si el paciente es alérgico al principio activo o a alguno de los demás componentes de este medicamento (enumerados en el punto 6).
Si tiene alguna duda sobre si la información anterior se aplica al paciente, debe consultar a su médico o enfermera antes de usar HYPNOMIDATE.
Precauciones y advertencias
Antes de empezar a usar HYPNOMIDATE, debe discutir con su médico o enfermera si:
- el paciente tiene enfermedad hepática;
- el paciente tiene baja presión arterial, por ejemplo, debido a debilidad;
- el paciente tiene insuficiencia suprarrenal.
HYPNOMIDATE debe usarse con precaución en pacientes:
- con insuficiencia suprarrenal, como en pacientes con sepsis (infección grave de la sangre);
- con cirrosis hepática o que toman medicamentos para tratar algunas enfermedades psiquiátricas (neurolépticos), opioides (medicamentos fuertes para el dolor) o medicamentos sedantes. La dosis de etomidato debe reducirse.
- de edad avanzada.
Las dosis únicas de etomidato pueden causar una insuficiencia suprarrenal transitoria y una disminución de los niveles de cortisol en suero.
Etomidato debe usarse con precaución en pacientes críticos, incluidos aquellos con sepsis, ya que en algunos estudios se ha asociado con un mayor riesgo de muerte.
HYPNOMIDATE solo debe administrarse por un médico capacitado en intubación traqueal. Debe haber equipo de reanimación disponible en caso de depresión respiratoria o apnea.
HYPNOMIDATE y otros medicamentos
Debe informar a su médico o enfermera sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que se venden sin receta.
El efecto de HYPNOMIDATE puede aumentar con:
- medicamentos neurolépticos (utilizados para tratar enfermedades psiquiátricas);
- opioides (medicamentos fuertes para el dolor, como la morfina o el fentanilo);
- medicamentos sedantes;
- alcohol. HYPNOMIDATE puede aumentar el efecto de:
- medicamentos que reducen la presión arterial.
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de usar este medicamento.
Embarazo
HYPNOMIDATE no debe usarse en mujeres embarazadas, a menos que los beneficios potenciales del tratamiento para la madre superen el riesgo para el feto. El médico decidirá si se debe usar HYPNOMIDATE.
Si la paciente cree que puede estar embarazada, debe informar a su médico. Algunos estudios en animales han mostrado un efecto nocivo en el desarrollo de la descendencia.
Lactancia
HYPNOMIDATE se excreta en la leche materna. No se debe amamantar durante el tratamiento ni en las 24 horas siguientes a la administración de HYPNOMIDATE.
Conducción de vehículos y uso de maquinaria
HYPNOMIDATE tiene un efecto importante en la capacidad para conducir vehículos y operar maquinaria.
No se debe operar maquinaria ni conducir vehículos durante 24 horas después de la administración de este medicamento. El tiempo para recuperar la capacidad normal puede variar dependiendo de la duración del procedimiento, la dosis total administrada y otros medicamentos utilizados. Por lo tanto, el anestesista decidirá cuándo el paciente podrá conducir vehículos y operar maquinaria.
HYPNOMIDATE contiene propilenglicol
Este medicamento contiene 3626 mg de propilenglicol en 10 ml.
Antes de administrar el medicamento a un niño menor de 5 años, debe consultar a su médico o farmacéutico, especialmente si el niño está tomando otros medicamentos que contienen propilenglicol o alcohol.
Las mujeres embarazadas o en período de lactancia no deben tomar este medicamento sin el consejo de un médico. El médico puede decidir realizar pruebas adicionales en estas pacientes.
Los pacientes con trastornos hepáticos o renales no deben tomar este medicamento sin el consejo de un médico. El médico puede decidir realizar pruebas adicionales en estos pacientes.
3. Cómo usar HYPNOMIDATE
HYPNOMIDATE está indicado para administración exclusiva por un médico capacitado en intubación traqueal.
Si tiene alguna duda, debe consultar a su médico.
Cómo administrar HYPNOMIDATE
- exclusivamente por vía intravenosa, en inyección lenta;
- HYPNOMIDATE no tiene efecto analgésico, por lo que el paciente recibirá un medicamento analgésico adecuado antes de la administración de HYPNOMIDATE.
Cuánto HYPNOMIDATE administrar
El médico decidirá la dosis según:
- el tipo de procedimiento quirúrgico
- el peso corporal
- la edad
- el estado general de salud.
La dosis efectiva para inducir el sueño es de 0,3 mg/kg de peso corporal. En pacientes adultos, una ampolla suele ser suficiente para inducir el sueño durante 4-5 minutos.
El sueño puede prolongarse con dosis adicionales de HYPNOMIDATE, pero no más de 3 ampollas (30 ml).
Pacientes de edad avanzada
En pacientes de edad avanzada, se administra una dosis única de 0,15-0,2 mg/kg de peso corporal, que se ajustará individualmente según la respuesta del paciente (véase el punto 2).
Niños y adolescentes
En niños menores de 15 años, puede ser necesario aumentar la dosis para lograr un sueño tan profundo y una duración del sueño similar a la de los adultos. A veces es necesario aumentar la dosis en un 30% de la dosis habitual para adultos.
Uso de una dosis mayor que la recomendada de HYPNOMIDATE
En caso de sobredosis de etomidato administrado en forma de bolo, el sueño se vuelve más profundo y puede ocurrir hipotensión, inhibición de la función suprarrenal, depresión respiratoria o incluso paro respiratorio. En caso de paro respiratorio, es necesario tomar medidas de apoyo respiratorio. También puede ocurrir desorientación y despertar prolongado.
4. Posibles efectos adversos
Como cualquier medicamento, HYPNOMIDATE puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En los estudios clínicos, los efectos adversos más comúnmente informados fueron discinesia y dolor en las venas.
A continuación, se presentan los efectos adversos (incluidos los mencionados anteriormente) observados durante los estudios clínicos o después de la comercialización de HYPNOMIDATE.
Efectos adversos muy frecuentes (pueden ocurrir en más de 1 de cada 10 pacientes):
- discinesia (trastorno del movimiento);
- disminución de los niveles de cortisol. Efectos adversos frecuentes (pueden ocurrir en hasta 1 de cada 10 pacientes):
- convulsiones mioclónicas;
- dolor en las venas, hipotensión;
- apnea, hiperventilación, estridor;
- vómitos, náuseas;
- erupción cutánea.
Efectos adversos poco frecuentes (pueden ocurrir en hasta 1 de cada 100 pacientes):
- hipertonia, espasmos musculares involuntarios, oculoplejía;
- bradicardia, extrasístoles ventriculares, taquicardia ventricular;
- trombosis venosa, hipertensión;
- hipoventilación, hipo;
- salivación excesiva;
- eritema;
- rigidez muscular;
- dolor en el lugar de la inyección;
- complicaciones de la anestesia, recuperación retardada de la conciencia después de la anestesia, efecto analgésico insuficiente, náuseas durante los procedimientos.
Efectos adversos de frecuencia desconocida (la frecuencia no puede establecerse a partir de los datos disponibles):
- reacciones de hipersensibilidad [incluyendo shock anafiláctico (insuficiencia cardíaca repentina)], reacciones anafilácticas (reacciones alérgicas graves que causan dificultad para respirar o mareos) y reacciones pseudoanafilácticas;
- insuficiencia suprarrenal;
- convulsiones (incluyendo convulsiones tónico-clónicas);
- paro cardíaco, bloqueo completo de la conducción del impulso desde las aurículas a los ventrículos;
- shock, trombosis venosa (profunda y superficial);
- depresión respiratoria, espasmo bronquial (incluyendo la muerte);
- síndrome de Stevens-Johnson (que se manifiesta con ampollas transitorias en las membranas mucosas, principalmente en la boca y los genitales, que, al romperse, forman úlceras dolorosas que dificultan la alimentación. También puede ocurrir fiebre, dolor articular, urticaria.
- trismo.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico, farmacéutico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad:
Al. Jerozolimskie 181C, 02-222 Varsovia, tel.: + 48 22 49 21 301, fax: + 48 22 49 21 309,
sitio web: https://smz.ezdrowie.gov.pl
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar HYPNOMIDATE
El medicamento debe conservarse en un lugar donde no pueda ser visto o alcanzado por los niños.
No debe usar este medicamento después de la fecha de caducidad que figura en el cartón y la etiqueta de la ampolla. La fecha de caducidad es el último día del mes indicado.
Conservar a una temperatura inferior a 25°C.
Para uso único. Después de abrir la ampolla, cualquier resto de medicamento no utilizado debe eliminarse.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene HYPNOMIDATE?
- El principio activo de HYPNOMIDATE es etomidato. Cada ml de solución contiene 2 mg de etomidato. Cada ampolla contiene 20 mg de etomidato.
- Los demás componentes son: propilenglicol, agua para inyección.
Cómo se presenta HYPNOMIDATE y qué contiene el paquete?
HYPNOMIDATE es una solución acuosa estéril, transparente e incolora para inyección intravenosa.
Ampolla de 10 ml en un cartón.
Tamaño del paquete: 5 ampollas de 10 ml.
Título del responsable
Piramal Critical Care B.V.
Rouboslaan 32, 2252 TR, Voorschoten
Países Bajos
[email protected].
Fabricante
Piramal Critical Care B.V.
Rouboslaan 32, 2252 TR, Voorschoten
Países Bajos
Fecha de la última actualización de la hoja de instrucciones: -------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Este medicamento debe administrarse exclusivamente por médicos capacitados en intubación traqueal. Durante el uso de HYPNOMIDATE, debe haber equipo de reanimación disponible en caso de depresión respiratoria o apnea.
1. Preparación del medicamento para su uso
Antes de abrir la ampolla, debe ponerse guantes protectores.
Ampollas
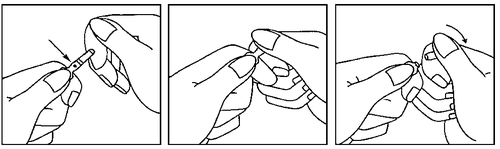
- 1. Agarrar la ampolla entre el pulgar y el dedo índice, dejando el extremo libre
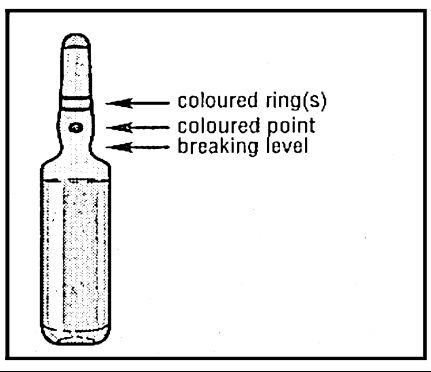
- 2. Con la otra mano, agarrar el extremo de la ampolla, aplicando el dedo índice al extremo de la ampolla y el pulgar al punto de color, paralelo al anillo de color en el extremo de la ampolla.
- 3. Sosteniendo el pulgar en ese punto, romper el extremo de la ampolla con energía, manteniendo al mismo tiempo la parte restante de la ampolla con la otra mano.
En caso de exposición accidental de la piel al medicamento, el lugar debe lavarse con agua.
No debe usarse jabón, alcohol u otros agentes de limpieza que puedan causar daño químico o mecánico a la piel.
Todo el medicamento no utilizado o sus residuos deben eliminarse de acuerdo con las regulaciones locales. No debe conservarse el medicamento no utilizado para su administración posterior.
2. Precauciones y advertencias especiales para el uso
HYPNOMIDATE debe administrarse exclusivamente por vía intravenosa.
La inducción de la anestesia con HYPNOMIDATE puede ir acompañada de una ligera y transitoria disminución de la presión arterial, relacionada con la disminución de la resistencia vascular periférica.
En pacientes debilitados, en los que la hipotensión puede ser peligrosa, deben tomarse las siguientes medidas:
- 1. El paciente que se somete a la anestesia debe estar acostado boca arriba.
- 2. Debe obtenerse acceso a una vena para asegurar un volumen de sangre circulante adecuado. HYPNOMIDATE debe inyectarse lentamente (por ejemplo, 10 ml en 1 minuto).
- 3. Si es posible, debe evitarse el uso de otros medicamentos para la inducción de la anestesia.
Durante el uso de HYPNOMIDATE, debe haber equipo de reanimación disponible en caso de depresión respiratoria o apnea.
Las dosis de etomidato utilizadas para la inducción de la anestesia pueden causar una disminución de los niveles de cortisol y aldosterona en suero. En pacientes en estado de estrés grave, especialmente con trastornos de la función suprarrenal, debe considerarse la suplementación con cortisol.
La consecuencia directa del efecto de etomidato, si se administra en infusión continua o en dosis múltiples, puede ser la supresión prolongada de la secreción de cortisol y aldosterona endógenos.
Por lo tanto, debe evitarse esta forma de administración.
En tales situaciones, la estimulación suprarrenal con ACTH (hormona adrenocorticotrópica) no produce los resultados deseados.
Etomidato debe usarse con precaución en pacientes con insuficiencia suprarrenal preexistente, como en pacientes con sepsis.
En pacientes con cirrosis hepática y en aquellos que han recibido neurolépticos, opioides o medicamentos sedantes, la dosis de etomidato debe reducirse.
Efecto de otros medicamentos en etomidato
La administración concomitante de etomidato y alfentanilo reduce el período de semivida terminal de etomidato a 29 minutos. Debe tenerse precaución al administrar etomidato y alfentanilo juntos, ya que la concentración de etomidato puede disminuir por debajo del umbral de sueño.
Efecto de etomidato en otros medicamentos
La administración concomitante de etomidato y ketamina no tiene un efecto significativo en la concentración en suero o los parámetros farmacocinéticos de ketamina o su metabolito principal, norketamina.
3. Sobredosis
En caso de sobredosis de etomidato administrado en forma de bolo, el sueño se vuelve más profundo y puede ocurrir hipotensión, inhibición de la función suprarrenal, depresión respiratoria o incluso paro respiratorio. En caso de paro respiratorio, es necesario tomar medidas de apoyo respiratorio. También puede ocurrir desorientación y despertar prolongado.
Además de las medidas de apoyo (por ejemplo, respiración), puede ser necesario administrar 50 mg - 100 mg de hidrocortisona (y no ACTH). Se recomiendan medidas de apoyo generales y una observación estricta.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorPiramal Critical Care B.V.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a IipnomidateForma farmacéutica: Emulsión, 2 mg/mlPrincipio activo: EtomidatoFabricante: B. Braun Melsungen AGNo requiere recetaForma farmacéutica: Solución, 2 mg/mlPrincipio activo: EtomidatoNo requiere recetaForma farmacéutica: Solución, 2 mg/mlPrincipio activo: EtomidatoNo requiere receta
Alternativas a Iipnomidate en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Iipnomidate en España
Médicos online para Iipnomidate
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Iipnomidate – sujeta a valoración médica y normativa local.














