
Finomel
Consulta con un médico sobre la receta médica de Finomel

Cómo usar Finomel
Hoja de instrucciones del paquete: Información para el usuario
Finomel, emulsión para infusión
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene
información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o enfermera.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Finomel y para qué se utiliza
- 2. Información importante antes de usar Finomel
- 3. Cómo usar Finomel
- 4. Posibles efectos adversos
- 5. Cómo conservar Finomel
- 6. Contenido del paquete y otra información
1. Qué es Finomel y para qué se utiliza
Finomel contiene aminoácidos (componentes utilizados para construir proteínas), glucosa (carbohidratos),
lípidos (grasas) y sales (electrolitos).
Finomel se utiliza para nutrir a adultos cuando la alimentación normal por vía oral no es
suficiente o adecuada.
2. Información importante antes de usar Finomel
Cuándo no debe usarse Finomel:
- si el paciente es alérgico a los peces, huevos, soja, proteínas de cacahuate o maíz/productos que contienen maíz (véase también el punto "Advertencias y precauciones" a continuación) o a cualquiera de los demás componentes de este medicamento (enumerados en el punto 6);
- si el paciente tiene un nivel alto de grasas en la sangre;
- si el paciente tiene enfermedades hepáticas graves;
- si el paciente tiene trastornos de coagulación de la sangre;
- si el paciente tiene una enfermedad que impide el procesamiento de aminoácidos por el organismo;
- si el paciente tiene enfermedades renales graves;
- si el paciente tiene un nivel demasiado alto de azúcar en la sangre;
- si en la sangre del paciente hay un contenido anormalmente alto de alguno de los electrolitos (sodio, potasio, magnesio, calcio y (o) fósforo);
- si el paciente tiene trastornos durante la administración de grandes volúmenes de líquido en las venas, como edema pulmonar agudo, sobrehidratación y insuficiencia cardíaca no controlada;
- si el paciente tiene cualquier trastorno agudo y grave, como trastornos postraumáticos graves, diabetes no controlada, infarto de miocardio, accidente cerebrovascular, embolia, acidosis
metabólica, sepsis grave (bacterias en la sangre), deshidratación hipotónica y coma hiperosmolar.
En cada caso, el médico decidirá la administración del medicamento en función de factores como la edad, el peso corporal y el estado clínico del paciente, incluyendo los resultados de las pruebas realizadas.
Advertencias y precauciones
Antes de iniciar el tratamiento con Finomel, debe discutir con su médico o enfermera si el paciente tiene:
- enfermedades renales graves. También debe informar a su médico si el paciente está sometido a diálisis (riñón artificial) u otros métodos de limpieza de la sangre;
- enfermedades hepáticas graves;
- trastornos de coagulación de la sangre;
- dysfunción suprarrenal (insuficiencia suprarrenal). Las glándulas suprarrenales son glándulas en forma de triángulo ubicadas en la parte superior de los riñones;
- insuficiencia cardíaca;
- enfermedad pulmonar;
- acumulación de agua en el organismo (sobrehidratación);
- falta de agua en el organismo (deshidratación);
- azúcar en la sangre no tratado (diabetes);
- infarto de miocardio o shock debido a insuficiencia cardíaca aguda;
- acidosis metabólica grave (pH de la sangre demasiado ácido);
- infección grave (sepsis).
Si se producen signos o síntomas inusuales de reacción alérgica, como fiebre, escalofríos, erupción cutánea o dificultad para respirar, debe interrumpir inmediatamente la infusión. El medicamento contiene aceite de pescado, aceite de soja y fosfatidilcolina de yema de huevo y glucosa obtenida a partir de maíz, que pueden causar reacciones de hipersensibilidad. Se han observado reacciones alérgicas cruzadas entre las proteínas de soja y cacahuate.
La dificultad para respirar también puede ser un signo de que se han formado pequeñas partículas que bloquean los vasos sanguíneos en los pulmones (depósitos en los vasos pulmonares). Si se producen dificultades para respirar, debe informar a su médico o enfermera. Ellos decidirán el curso de acción adecuado.
En caso de dolor, ardor, rigidez, hinchazón o decoloración de la piel en el sitio de infusión o fugas del líquido administrado durante la infusión, debe informar a su médico o enfermera. La administración del medicamento se interrumpirá inmediatamente y se reanudará en una vena diferente.
Existe un riesgo especial de infección o sepsis (presencia de bacterias o sus toxinas en la sangre) después de la inserción de un catéter (catéter venoso) en la vena del paciente. El médico estará atento a cualquier signo de infección. El uso de "técnica aséptica" (ausencia de microorganismos) durante la inserción y mantenimiento del catéter, así como durante la preparación del medicamento para la nutrición, puede reducir el riesgo de desarrollo de infección.
Se ha informado de la ocurrencia de síndrome de sobrecarga de grasas con el uso de medicamentos similares. La capacidad reducida o limitada del organismo para eliminar las grasas contenidas en Finomel puede provocar un "síndrome de sobrecarga de grasas" (véase el punto 4 - Posibles efectos adversos).
Si el paciente está gravemente desnutrido, de modo que necesita recibir alimento por vía intravenosa, se recomienda iniciar la nutrición parenteral lentamente y con precaución.
Pruebas de control adicionales
Antes de iniciar la infusión, debe corregir los trastornos del equilibrio hidroelectrolítico y los trastornos metabólicos del paciente. El médico puede realizar pruebas clínicas y de laboratorio durante la administración de este medicamento para controlar la eficacia y seguridad de la administración. El médico monitoreará al paciente y puede cambiar la dosis o administrar un medicamento adicional.
Niños y adolescentes
No hay experiencia con el uso de Finomel en niños y adolescentes.
Finomel y otros medicamentos
Debe informar a su médico o enfermera sobre todos los medicamentos que el paciente está tomando actualmente o recientemente, así como sobre los medicamentos que el paciente planea tomar.
Finomel contiene calcio. No debe administrarse junto con o a través del mismo tubo que el antibiótico ceftriaxona, ya que pueden formarse partículas. Si estos medicamentos se administran secuencialmente mediante el mismo dispositivo, debe limpiarse cuidadosamente.
El aceite de oliva y el aceite de soja presentes en Finomel contienen vitamina K. Por lo general, no afecta la acción de los medicamentos anticoagulantes, como la warfarina. Sin embargo, si el paciente está tomando medicamentos anticoagulantes, debe informar a su médico.
Las grasas presentes en la emulsión pueden alterar los resultados de algunas pruebas de laboratorio, si la muestra de sangre para la prueba se toma antes de que se eliminen las grasas de la circulación del paciente (se eliminan de la sangre después de 5 a 6 horas de la administración de las grasas).
Embarazo, lactancia y fertilidad
Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de usar este medicamento. No hay datos sobre el uso de Finomel durante el embarazo y la lactancia. Se puede considerar el uso de este medicamento durante el embarazo y la lactancia si el médico lo considera necesario.
Conducción de vehículos y uso de máquinas
No es relevante, ya que este medicamento se administra en el hospital.
3. Cómo usar Finomel
Este medicamento debe usarse siempre según las indicaciones de su médico. En caso de duda, debe consultar a su médico.
Este medicamento se administra en forma de infusión intravenosa (goteo) a través de un tubo pequeño directamente en una vena.
El médico determinará la dosis individualmente para cada paciente, dependiendo del peso corporal y la función del organismo. Finomel será administrado por personal médico capacitado.
Uso en niños
La seguridad y eficacia del uso de Finomel no se han establecido en niños y adolescentes menores de 18 años.
Uso de una dosis mayor que la recomendada de Finomel
Es poco probable que el paciente reciba una dosis demasiado grande de este medicamento, ya que Finomel se administra por personal médico capacitado.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Se han notificado los siguientes efectos adversos con una frecuencia desconocida:
- reacciones de hipersensibilidad (que pueden causar síntomas como hinchazón, fiebre, caída de la presión arterial, erupciones cutáneas, ampollas, enrojecimiento repentino de la piel, dolor de cabeza).
- síndrome de refeeding (enfermedad que ocurre después de recibir nutrición después de un ayuno prolongado)
- aumento del nivel de azúcar en la sangre (hiperglucemia)
- mareos
- dolor de cabeza
- inflamación de las venas (tromboflebitis)
- embolia pulmonar
- dificultad para respirar
- náuseas
- vómitos
- temperatura corporal ligeramente elevada
- niveles altos en la sangre (en suero) de compuestos derivados del hígado
- síndrome de sobrecarga de grasas
- fuga de la infusión a los tejidos circundantes (extravasación)
Notificación de efectos adversos
Si se producen cualquier efecto adverso, incluidos todos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad
Al. Jerozolimskie 181C
PL 02-222 Varsovia
Tel.: + 48 22 49 21 301
Fax: + 48 22 49 21 309
correo electrónico: [email protected]
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
Gracias a la notificación de efectos adversos, podrá recopilarse más información sobre la seguridad del medicamento.
5. Cómo conservar Finomel
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
Conservar en bolsas de protección. No congelar.
No usar este medicamento después de la fecha de caducidad indicada en la etiqueta de la bolsa y en la caja después de "Caducidad".
La fecha de caducidad es el último día del mes indicado.
No usar este medicamento si se observan partículas visibles en la solución o si la bolsa está dañada.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este comportamiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Finomel?
- Los principios activos del medicamento son g/1000 mlAlanina 10,52 Arginina 5,84 Glicina 5,23 Histidina 2,44 Isoleucina 3,05 Leucina 3,71 Lisina (en forma de clorhidrato de lisina) 3,68 Metionina 2,03 Fenilalanina 2,84 Prolina 3,45 Serina 2,54 Treonina 2,13 Triptófano 0,91 Tirosina 0,20 Valina 2,95 Octanoato de sodio trihidratado 2,85 Cloruro de potasio 2,28 Cloruro de calcio dihidratado 0,38 Sulfato de magnesio heptahidratado 1,25 Glicerofosfato de sodio monohidratado 3,01 Sulfato de cinc heptahidratado 0,012 Glucosa (en forma de glucosa monohidratada) 139,5 Aceite de soja refinado 11,40 Aceite de oliva refinado 9,50 Triglicéridos de ácidos grasos saturados de cadena media 9,50
Aceite de pescado rico en ácidos omega-3
7,60
- Los demás componentes son: ácido acético glacial, ácido clorhídrico, fosfolípidos de yema de huevo, glicerol, oleato de sodio, alfa-tocoferol, hidróxido de sodio, agua para inyección.
Cómo se presenta Finomel y qué contiene el paquete?
Las soluciones de glucosa y aminoácidos son transparentes y sin color o ligeramente amarillas y no contienen partículas sólidas. La emulsión grasa es blanca y homogénea.
Después de mezclar el contenido de las 3 cámaras, el medicamento es una emulsión blanca.
Tamaños del paquete:
4 x 1085 ml
4 x 1435 ml
4 x 1820 ml
Título de la autorización de comercialización y titular
Título de la autorización de comercialización:
Baxter Polska Sp. z o.o.
Ul. Kruczkowskiego 8
00-380 Varsovia
Titular:
Baxter SA
Boulevard René Branquart 80
7860 Lessines
Bélgica
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo bajo los siguientes nombres:
| Austria, República Checa, Alemania, Grecia, Irlanda, Polonia, España, Reino Unido | FINOMEL |
| Bélgica, Luxemburgo, Países Bajos | Omegomel |
| Dinamarca, Finlandia, Islandia, Italia, Noruega, Suecia | Finomel |
| Francia | FOSOMEL |
Fecha de la última revisión de la hoja de instrucciones:
--------------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente a profesionales de la salud:
A. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Finomel se presenta en bolsas de plástico tricámara. Cada bolsa contiene una solución estéril y apirógena al 42% de glucosa, una solución al 10% de aminoácidos con electrolitos y una emulsión grasa al 20%.
La composición de la emulsión final después de mezclar el contenido de las tres cámaras se indica en la siguiente tabla:
| Principios activos | 1085 ml | 1435 ml | 1820 ml |
| Aceite de pescado rico en ácidos omega-3 | 8,24 g | 10,92 g | 13,84 g |
| Aceite de oliva refinado | 10,30 g | 13,65 g | 17,30 g |
| Aceite de soja refinado | 12,36 g | 16,38 g | 20,76 g |
| Triglicéridos de ácidos grasos saturados de cadena media | 10,30 g | 13,65 g | 17,30 g |
| Alanina | 11,41 g | 15,09 g | 19,13 g |
| Arginina | 6,34 g | 8,38 g | 10,63 g |
| Glicina | 5,68 g | 7,51 g | 9,52 g |
| Histidina | 2,64 g | 3,50 g | 4,44 g |
| Isoleucina | 3,31 g | 4,37 g | 5,54 g |
| Leucina | 4,02 g | 5,32 g | 6,75 g |
| Lisina (en forma de clorhidrato de lisina) | 3,20 g (3,99 g) | 4,23 g (5,29 g) | 5,36 g (6,70 g) |
| Metionina | 2,20 g | 2,92 g | 3,70 g |
| Fenilalanina | 3,09 g | 4,08 g | 5,17 g |
| Prolina | 3,75 g | 4,96 g | 6,28 g |
| Serina | 2,76 g | 3,65 g | 4,62 g |
| Treonina | 2,31 g | 3,06 g | 3,88 g |
| Triptófano | 0,99 g | 1,31 g | 1,66 g |
| Tirosina | 0,22 g | 0,29 g | 0,37 g |
| Valina | 3,20 g | 4,23 g | 5,36 g |
| Octanoato de sodio trihidratado | 3,10 g | 4,10 g | 5,19 g |
| Cloruro de potasio | 2,47 g | 3,27 g | 4,14 g |
| Cloruro de calcio dihidratado | 0,41 g | 0,54 g | 0,68 g |
| Sulfato de magnesio heptahidratado | 1,36 g | 1,80 g | 2,28 g |
| Glicerofosfato de sodio monohidratado | 3,26 g | 4,32 g | 5,47 g |
| Sulfato de cinc heptahidratado | 0,013 g | 0,017 g | 0,021 g |
| Glucosa (en forma de glucosa monohidratada) | 137,8 g (151,5 g) | 181,9 g (200,0 g) | 231,0 g (254,1 g) |
B. POSOLOGÍA Y MODO DE ADMINISTRACIÓN
Posología
La posología debe determinarse individualmente, dependiendo del gasto energético, del estado clínico del paciente,
del peso corporal y de la capacidad del paciente para metabolizar los componentes del medicamento Finomel, así como de los componentes energéticos o proteicos administrados adicionalmente por vía oral/enteral. Por lo tanto, debe elegirse el tamaño de la bolsa adecuado.
La ingesta diaria media para pacientes adultos es:
- en pacientes con estado de nutrición normal o con estrés catabólico leve: 0,6 - 0,9 g de aminoácidos/kg de peso corporal/día (0,10 - 0,15 g de nitrógeno/kg de peso corporal/día);
- en pacientes con estrés metabólico moderado o grave con o sin desnutrición: 0,9 - 1,6 g de aminoácidos/kg de peso corporal/día (0,15 - 0,25 g de nitrógeno/kg de peso corporal/día);
- en pacientes en situaciones especiales (por ejemplo, con quemaduras o anabolismo significativo), la ingesta de nitrógeno puede ser aún mayor.
La dosis diaria máxima es diferente dependiendo del estado clínico del paciente y puede cambiar de un día a otro.
La velocidad de infusión debe aumentarse gradualmente durante la primera hora.
La velocidad de administración debe ajustarse teniendo en cuenta la dosis administrada, el volumen diario y la duración de la infusión.
El tiempo de infusión recomendado es de 14 a 24 horas.
El rango de dosis de 13 – 31 ml/kg de peso corporal/día corresponde a 0,7 – 1,6 g de aminoácidos/kg de peso corporal/día (lo que corresponde a 0,11 – 0,26 g de nitrógeno/kg de peso corporal/día) y 14 – 33 kcal/kg de peso corporal/día de valor energético total (11 – 27 kcal/kg de peso corporal/día de valor energético no proteico).
La velocidad máxima de infusión de glucosa es de 0,25 g/kg de peso corporal/hora, de aminoácidos 0,1 g/kg de peso corporal/hora y de grasas 0,15 g/kg de peso corporal/hora.
La velocidad de infusión no debe exceder 2,0 ml/kg de peso corporal/hora (lo que corresponde a 0,10 g de aminoácidos, 0,25 g de glucosa y 0,08 g de grasas/kg de peso corporal/hora).
La dosis diaria máxima recomendada es de 35 ml/kg de peso corporal/día y proporcionará 1,8 g de aminoácidos/kg de peso corporal/día (lo que corresponde a 0,29 g de nitrógeno/kg de peso corporal/día), 4,5 g de glucosa/kg de peso corporal/día, 1,40 g de lípidos/kg de peso corporal/día y un valor energético total de 38 kcal/kg de peso corporal/día (lo que corresponde a 30 kcal/kg de peso corporal/día de valor energético no proteico).
Niños y adolescentes
No se han realizado estudios con Finomel en niños y adolescentes.
Pacientes con trastornos renales/hepáticos
Debe tenerse cuidado al administrar Finomel a pacientes con trastornos hepáticos, incluyendo colestasis y (o) aumento de la actividad de las enzimas hepáticas. Los parámetros de la función hepática deben monitorearse estrechamente.
Modo de administración
Administración intravenosa, infusión en vena central.
Las instrucciones para la reconstitución del medicamento antes de la administración se encuentran en el punto E. Medidas de precaución especiales para la eliminación y preparación del producto para su uso.
La información sobre la mezcla con otros líquidos para infusión/sangre antes o durante la administración se encuentra en el punto C. Incompatibilidades farmacéuticas.
C. INCOMPATIBILIDADES FARMACÉUTICAS
No debe mezclarse este medicamento con otros medicamentos con los que no se haya demostrado su compatibilidad.
No debe mezclarse ni administrarse ceftriaxona simultáneamente con soluciones para infusión que contengan calcio, incluyendo Finomel.
No debe administrarse Finomel simultáneamente con sangre a través del mismo conjunto de infusión.
D. SOBREDOSIS
En caso de sobredosis, pueden ocurrir náuseas, vómitos, escalofríos, hiperglucemia y trastornos electrolíticos, así como signos de hiperolemia o acidosis. En estos casos, la infusión debe interrumpirse inmediatamente.
En caso de hiperglucemia, debe administrarse un tratamiento adecuado para la situación clínica, administrando insulina y (o) ajustando la velocidad de infusión. Además, la sobredosis puede causar sobrecarga de líquidos, trastornos electrolíticos y hiperosmolalidad.
Si los síntomas persisten después de interrumpir la infusión, puede considerarse el uso de hemodiálisis, hemofiltración o hemodiafiltración.
E. MEDIDAS DE PRECAUCIÓN ESPECIALES PARA LA ELIMINACIÓN Y PREPARACIÓN DEL PRODUCTO PARA SU USO
Abrir:
- Retirar la bolsa de protección.
- Descartar la bolsa que contiene el absorbente de oxígeno.
- Utilizar solo si la bolsa no está dañada y las soldaduras no están rotas (es decir, el contenido de las tres cámaras no se ha mezclado), las soluciones de aminoácidos y glucosa son transparentes, sin color o ligeramente amarillas, sin partículas visibles y la emulsión grasa es homogénea con apariencia lechosa.
Mezcla del contenido de las cámaras:
- Antes de romper las soldaduras, debe asegurarse de que el medicamento esté a temperatura ambiente.
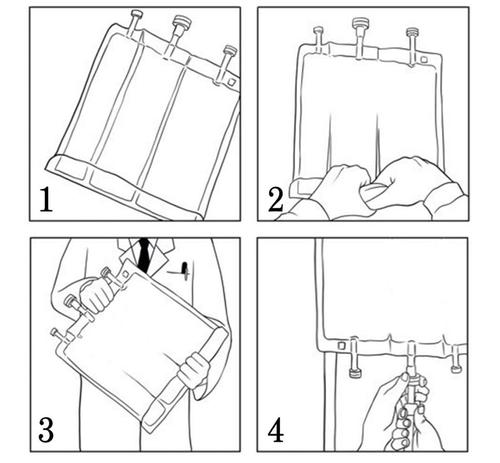
- Comenzando desde la parte superior de la bolsa (en el mango), enrollar la bolsa con ambas manos (Figura 1). Las soldaduras se disolverán desde el lado de los puertos. Continuar enrollando la bolsa hasta que las soldaduras se rompan hasta la mitad de su longitud. (Figura 2)
- Mezclar, girando la bolsa al menos 3 veces. (Figura 3)
- Después de mezclar, el medicamento tiene la forma de una emulsión homogénea con apariencia lechosa.
Después de retirar la cubierta protectora del puerto de administración de medicamentos, puede agregar componentes adicionales compatibles a través del puerto de administración de medicamentos (véase el subpunto "Adición").
Retirar la cubierta protectora del puerto de infusión y conectar el conjunto de infusión. Colgar la bolsa en el soporte de infusión y realizar la infusión utilizando la técnica estándar. (Figura 4)
Después de abrir la bolsa, el contenido debe usarse inmediatamente y no debe conservarse la bolsa abierta para la próxima infusión.
No conectar de nuevo las bolsas parcialmente utilizadas. Para evitar la posibilidad de formación de émbolos de aire, no conectar las bolsas en serie.
Adición
No debe agregar ningún componente adicional a la bolsa sin haber comprobado previamente su compatibilidad, ya que la formación de un precipitado o la separación de la emulsión grasa puede provocar la obstrucción de los vasos.
Los componentes adicionales deben agregarse en condiciones asépticas.
Finomel puede mezclarse con los siguientes componentes adicionales:
- preparados multivitamínicos
- preparados que contienen varios oligoelementos
- selenio
- cinc
- sales de sodio
- sales de potasio
- sales de magnesio
- sales de calcio
- sales de fosfato
La tabla de compatibilidad a continuación muestra la posibilidad de agregar un medicamento que contenga varios oligoelementos, como Nutryelt, y un medicamento multivitamínico, como Cernevit, así como diferentes tipos de electrolitos y oligoelementos en cantidades específicas. Al agregar electrolitos y oligoelementos clínicamente necesarios, debe tenerse en cuenta la cantidad ya presente en la bolsa.
| Componente adicional | Contenido total después de la adición para todos los tamaños de la bolsa de Finomel |
| Nutryelt (Composición de 1 ampolla: cinc 153 µmol; cobre 4,7 µmol; manganeso 1,0 µmol; flúor 50 µmol; yodo 1,0 µmol; selenio 0,9 µmol; molibdeno 0,21 µmol; cromo 0,19 µmol; hierro 18 µmol) | 2 ampollas/bolsa |
| Cernevit (Composición de 1 ampolla: vit. A (en forma de retinol palmítico) 3500 IU, vit. D3 (colecalciferol) 220 IU, vit. E (alfa-tocoferol) 11,2 IU, vit. C (ácido ascórbico) 125 mg, vit. B1 (tiamina) 3,51 mg, vit. B2 (riboflavina) 4,14 mg, vit. B6 (piridoxina) 4,53 mg, vit. B12 (cianocobalamina) 6 µg, vit. B9 (ácido fólico) 414 µg, vit. B5 (ácido pantoténico) 17,25 mg, vit. B8 (biotina) 69 µg, vit. PP (amida de ácido nicotínico) 46 mg) | 2 ampollas/bolsa |
| Sodio | 138 mmol/l |
| Potasio | 138 mmol/l |
| Magnesio | 5 mmol/l |
| Calcio | 4,6 mmol/l |
| Fosfatos (orgánicos, como glicerofosfato de sodio) o Fosfatos (inorgánicos, como fosfato de potasio) | 18,5 mmol/l
|
| Selenio | 7,6 µmol/l |
| Cinc | 0,31 mmol/l |
La compatibilidad para diferentes medicamentos puede no ser la misma y el personal médico capacitado debe realizar un control adecuado en caso de mezclar Finomel con otras soluciones para infusión.
Debe mezclarse cuidadosamente el contenido de la bolsa y comprobar visualmente la mezcla. No deben aparecer signos de separación de fases de la emulsión. La mezcla es una emulsión blanca y homogénea.
Al agregar componentes adicionales, debe evaluarse la osmolalidad final de la mezcla.
- País de registro
- Principio activo
- Requiere recetaSí
- ImportadorBaxter S.A.
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a FinomelForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere recetaForma farmacéutica: Solución, -Principio activo: combinationsNo requiere receta
Alternativas a Finomel en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Finomel en Spain
Alternativa a Finomel en Ukraine
Médicos online para Finomel
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Finomel – sujeta a valoración médica y normativa local.














