
Dipiereline Sr 3,75

Consulta con un médico sobre la receta médica de Dipiereline Sr 3,75

Cómo usar Dipiereline Sr 3,75
Hoja de instrucciones del paquete: información para el usuario
Diphereline SR 3,75
3,75 mg
Polvo y disolvente para la preparación de una suspensión de liberación prolongada para inyección
Triptorelina
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- Si tiene alguna duda, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si sus síntomas son los mismos que los suyos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Diphereline SR 3,75 y para qué se utiliza
- 2. Información importante antes de tomar Diphereline SR 3,75
- 3. Cómo tomar Diphereline SR 3,75
- 4. Posibles efectos adversos
- 5. Cómo conservar Diphereline SR 3,75
- 6. Contenido del paquete y otra información
1. Qué es Diphereline SR 3,75 y para qué se utiliza
Este medicamento contiene triptorelina. La triptorelina pertenece a un grupo de medicamentos conocidos como análogos del hormona liberador de gonadotropina (GnRH). Una de sus acciones es reducir la producción de hormonas sexuales en el cuerpo.
La administración prolongada de triptorelina, después de una estimulación inicial, provoca la inhibición de la secreción de hormonas gonadotrópicas (FSH y LH), cuyo efecto final es la inhibición de la función de los testículos y los ovarios.
También se ha descrito otro mecanismo de acción del medicamento: el efecto directo sobre los testículos y los ovarios a través de la reducción de la sensibilidad de sus receptores al hormona que aumenta la liberación de hormonas sexuales (gonadoliberina).
Diphereline SR 3,75 está indicado en:
- Cáncer de próstata Tratamiento del cáncer de próstata cuando se requiere reducir el nivel de testosterona a un nivel característico de la falta de función de las glándulas sexuales (niveles de castración). El efecto beneficioso del tratamiento es más evidente y frecuente si el paciente no ha recibido previamente ningún otro tratamiento hormonal.
- Cáncer de mama en mujeres antes y después de la menopausia, cuando se indica el tratamiento hormonal
- Desarrollo sexual prematuro de origen central (antes de los 8 años en niñas y antes de los 10 años en niños).
- Endometriosis de los órganos genitales y externos (etapa I a IV) El tratamiento no debe durar más de 6 meses (véase el punto 4.8). No se recomienda iniciar un segundo ciclo de tratamiento con triptorelina o otro análogo de GnRH.
- Leiomiomas uterinos Tratamiento de leiomiomas uterinos con fines de preparación para la cirugía o en pacientes que no son candidatas para la cirugía.
- Infertilidad en mujeres
Tratamiento de apoyo en combinación con la administración de gonadotropinas (hMG, FSH, hCG) para inducir la ovulación, en la preparación para la fecundación in vitro y el trasplante de embriones.
2. Información importante antes de tomar Diphereline SR 3,75
Cuándo no tomar Diphereline SR 3,75
- si el paciente es alérgico a la triptorelina, la gonadoliberina (GnRH), otros análogos de GnRH o cualquier otro componente de este medicamento (enumerados en el punto 6)
- si se ha producido un desarrollo sexual prematuro no gonadotrópico
- si la paciente está embarazada o en período de lactancia
Advertencias y precauciones
Antes de comenzar el tratamiento con Diphereline SR 3,75, debe discutirlo con su médico o farmacéutico.
En adultos, el tratamiento prolongado con triptorelina puede provocar debilidad ósea (osteoporosis) relacionada con un mayor riesgo de fracturas óseas. Debe informar a su médico si tiene alguno de los siguientes factores de riesgo, ya que el médico puede recomendar la administración de bisfosfonatos (medicamentos utilizados para tratar la osteoporosis) para tratar la pérdida de masa ósea.
Los factores de riesgo pueden incluir:
- osteoporosis en el paciente o en su familia cercana;
- abuso de alcohol, tabaquismo, desnutrición;
- administración a largo plazo de medicamentos que pueden provocar pérdida de masa ósea, como medicamentos utilizados para tratar la epilepsia o corticosteroides (como la hidrocortisona, el prednisolona).
Se han informado casos de depresión, incluyendo depresión grave, en pacientes que toman Diphereline SR 3,75. Si durante el tratamiento con Diphereline SR 3,75 se producen síntomas depresivos, debe informar a su médico.
Si se producen convulsiones, debe informar inmediatamente a su médico. Se han informado convulsiones en pacientes que toman triptorelina o medicamentos similares. Ocurrieron en pacientes con epilepsia previamente diagnosticada o sin ella.
Durante el tratamiento con Diphereline SR 3,75, puede revelarse un crecimiento (tumor benigno) de la glándula pituitaria, del que el paciente no era consciente. Los síntomas incluyen dolor de cabeza repentino, vómitos, trastornos visuales y parálisis de los músculos oculares.
Hombres
En el caso de medicamentos que evitan la coagulación de la sangre, en el lugar de la inyección puede producirse un moretón.
Al comienzo del tratamiento, se ha observado un aumento del nivel de testosterona en el cuerpo. Esto puede provocar un empeoramiento de los síntomas relacionados con el tumor. En tal caso, debe comunicarse con su médico. El médico puede recomendar un medicamento adicional (antagonista de los andrógenos) para prevenir el empeoramiento de estos síntomas.
Si el paciente tiene una obstrucción de las vías urinarias o compresión de la médula espinal debido a la propagación del tumor, el médico supervisará estrechamente al paciente durante las primeras semanas del tratamiento. En caso de dificultades para orinar, dolor óseo, debilidad en las extremidades inferiores o sensación de entumecimiento, debe comunicarse inmediatamente con su médico, quien evaluará el estado del paciente y iniciará el tratamiento adecuado.
La triptorelina no induce una disminución adicional del nivel de testosterona en pacientes sometidos a orquiectomía (extirpación del testículo).
Los resultados de las pruebas diagnósticas de la función gonadal de la glándula pituitaria y los órganos reproductivos, realizadas durante el tratamiento o después de la suspensión del tratamiento con Diphereline SR 3,75, pueden ser engañosos.
Debe informar a su médico si tiene enfermedades cardíacas o vasculares, incluyendo trastornos del ritmo cardíaco (arritmia) o si toma medicamentos utilizados para tratar trastornos del ritmo cardíaco. El riesgo de trastornos del ritmo cardíaco puede aumentar durante el tratamiento con Diphereline SR 3,75.
Los medicamentos que reducen el nivel de testosterona pueden provocar cambios en el ECG relacionados con trastornos del ritmo cardíaco (prolongación del intervalo QT).
Debe informar a su médico si tiene diabetes y (o) enfermedades cardíacas.
Mujeres
Leiomiomas uterinos y endometriosis
En el primer mes del tratamiento, puede producirse un sangrado vaginal. Luego, en condiciones normales, los períodos menstruales cesarán. Si después del primer mes del tratamiento se produce un sangrado, debe comunicarse con su médico.
Los períodos menstruales deben regresar después de 2-3 meses desde la última inyección. Cuando el tratamiento no se utiliza debido a la infertilidad, en el primer mes del tratamiento y después de la última inyección, debe utilizarse un método anticonceptivo no hormonal.
Si la paciente tiene leiomiomas submucosos (tumores benignos del músculo uterino que se encuentran debajo de la membrana mucosa), en el transcurso de las primeras 6-10 semanas después del inicio del tratamiento, Diphereline SR 3,75 puede provocar un sangrado cuando los leiomiomas se desintegran. En caso de un sangrado intenso o inusual, o dolor, debe comunicarse inmediatamente con su médico.
Infertilidad en mujeres
El efecto del tratamiento puede aumentar significativamente en un pequeño número de pacientes predispuestas.
El efecto del tratamiento puede variar en diferentes pacientes después de la administración de las mismas dosis, y en algunos casos, entre diferentes ciclos en la misma paciente.
La administración de gonadotropinas en combinación con este medicamento para tratar la infertilidad puede provocar un crecimiento ovárico o una hiperestimulación ovárica, que se manifiesta como dolor en la pelvis y (o) abdomen, así como dificultades para respirar. En tal caso, debe comunicarse inmediatamente con su médico.
Cáncer de mama en mujeres antes y después de la menopausia
La administración de Diphereline SR 3,75 puede ser útil en casos en los que otros métodos de tratamiento no han producido una respuesta clínica o han perdido eficacia.
Niños
En niñas con desarrollo sexual prematuro, en el primer mes del tratamiento, puede producirse un sangrado vaginal.
Debe informar a su médico si hay un tumor cerebral en curso. Esto puede afectar la decisión del médico sobre el tratamiento.
Después de la suspensión del tratamiento con Diphereline SR 3,75 mg en el paciente, aparecerán síntomas de desarrollo sexual.
En niñas, la menarquía se produjo generalmente un año después de la suspensión del tratamiento.
El médico debe descartar la posibilidad de que el desarrollo sexual prematuro sea causado por otras enfermedades.
La cantidad de minerales en los huesos disminuye durante el tratamiento, pero regresa a los valores normales después de su suspensión.
Después de la suspensión del tratamiento, puede producirse una enfermedad de la articulación de la cadera (epifisiolisis femoral), que provoca rigidez en la cadera, flacidez y (o) dolor intenso en la ingle que irradia al muslo. En tal caso, debe consultar a su médico.
Si el niño experimenta dolores de cabeza intensos o recurrentes, problemas visuales y zumbido o pitido en los oídos, debe comunicarse inmediatamente con su médico (véase el punto 4).
En caso de inquietudes relacionadas con las situaciones descritas anteriormente, debe hablar con su médico.
Diphereline SR 3,75 y otros medicamentos
Debe comunicar a su médico o farmacéutico todos los medicamentos que esté tomando actualmente o recientemente, así como cualquier medicamento que planea tomar.
Diphereline SR 3,75 puede afectar la acción de otros medicamentos utilizados para tratar trastornos del ritmo cardíaco (por ejemplo, quinidina, procaína, amiodarona, sotalol) o puede aumentar el riesgo de trastornos del ritmo cardíaco en caso de administración concomitante de otros medicamentos (por ejemplo, metadona utilizada para tratar el dolor y como parte del programa de desintoxicación en caso de adicción a drogas),
moxifloxacina (antibiótico), medicamentos antipsicóticos utilizados para tratar enfermedades mentales graves).
Embarazo y lactancia
Si la paciente está embarazada o en período de lactancia, sospecha que puede estar embarazada o planea tener un hijo, debe consultar a su médico antes de tomar este medicamento.
No debe tomar Diphereline SR 3,75 durante el embarazo y la lactancia.
No debe tomar Diphereline SR 3,75 mientras intenta quedar embarazada (a menos que Diphereline SR 3,75 sea parte del tratamiento de la infertilidad).
Conducción de vehículos y uso de maquinaria
Durante el tratamiento, pueden producirse mareos, fatiga o problemas visuales, como visión borrosa. Estos síntomas pueden ser efectos adversos del tratamiento o resultado de la enfermedad subyacente. En caso de que se produzca alguno de estos efectos adversos, no debe conducir vehículos ni operar maquinaria.
Diphereline SR 3,75 mg contiene sodio
El medicamento contiene menos de 1 mmol (23 mg) de sodio por dosis, es decir, el medicamento se considera "exento de sodio".
3. Cómo tomar Diphereline SR 3,75
El medicamento será administrado por su médico o enfermera en una dosis adecuada para usted, dependiendo de la indicación para la que se ha recetado.
Tratamiento de niños: la dosis debe ajustarse según el peso corporal.
Niños con un peso corporal superior a 30 kg: una inyección intramuscular cada 4 semanas (28 días).
Niños con un peso corporal de 20 a 30 kg: dos tercios de la dosis en una inyección intramuscular cada 4 semanas (28 días), es decir, administrar dos tercios del volumen de la suspensión preparada.
Niños con un peso corporal inferior a 20 kg: la mitad de la dosis en una inyección intramuscular cada 4 semanas (28 días), es decir, administrar la mitad del volumen de la suspensión preparada.
No debe interrumpir el tratamiento sin consultar a su médico.
Uso de una dosis mayor de la recomendada de Diphereline SR 3,75
En caso de sobredosis, se recomienda el tratamiento sintomático.
4. Posibles efectos adversos
Como cualquier medicamento, Diphereline SR 3,75 puede provocar efectos adversos, aunque no todos los pacientes los experimentarán.
En casos raros, puede producirse una reacción alérgica grave (edema angioneurótico, reacción anafiláctica). Si se desarrollan síntomas como dificultades para tragar o respirar, mareos, hinchazón de los labios, la cara, la garganta o la lengua, o erupción, debe comunicarse inmediatamente con su médico.
Hombres
Puede esperarse que muchos de los efectos adversos sean causados por el cambio en el nivel de testosterona en el cuerpo. Estos efectos incluyen: sofocos, impotencia y disminución de la libido.
Muy frecuentes- efectos adversos que ocurren en más de 1 de cada 10 pacientes
- Sofocos
- Debilidad
- Sudoración intensa
- Dolor de espalda
- Sensación de pinchazo en las extremidades inferiores
- Disminución de la libido
- Impotencia
Frecuentes- efectos adversos que ocurren en no más de 1 de cada 10 pacientes
- Náuseas, sequedad en la boca
- Dolor, moretón, enrojecimiento y hinchazón en el lugar de la inyección
- Dolor muscular y óseo, dolor en los brazos y piernas, hinchazón (acumulación de líquido en los tejidos), dolor en la parte inferior del abdomen
- Presión arterial alta
- Reacción alérgica
- Aumento de peso
- Mareos, dolor de cabeza
- Pérdida de la libido, depresión, cambios de humor
Poco frecuentes- efectos adversos que ocurren en no más de 1 de cada 100 pacientes
- Aumento del número de plaquetas
- Latido cardíaco acelerado
- Zumbido en los oídos, mareos, visión borrosa
- Dolor abdominal, estreñimiento, diarrea, vómitos
- Entumecimiento, escalofríos, somnolencia, dolor
- Cambios en los resultados de algunas pruebas (incluyendo el aumento de los valores de algunos parámetros que indican la función hepática), presión arterial alta
- Disminución de peso
- Pérdida del apetito, aumento del apetito, gota (dolor y hinchazón en las articulaciones, más comúnmente en el dedo gordo), diabetes, alto nivel de grasas en la sangre
- Dolor articular, calambres musculares, debilidad muscular, dolor muscular, hinchazón en los tobillos, pies o dedos, dolor óseo
- Entumecimiento y hormigueo
- Problemas para dormir, irritabilidad
- Aumento del tamaño de las mamas en hombres, dolor en las mamas (pecho), disminución del tamaño de los testículos, dolor en los testículos
- Dificultad para respirar
- Acné, caída del cabello, picazón, erupción, enrojecimiento de la piel, urticaria
- Frecuencia urinaria nocturna, trastornos urinarios
- Sangrado nasal
Raros- efectos adversos que ocurren en no más de 1 de cada 1000 pacientes
- Enrojecimiento o decoloración púrpura de la piel
- Sensaciones anormales en el ojo, visión borrosa o alterada
- Sensación de plenitud en el abdomen, hinchazón, trastornos del gusto
- Dolor en el pecho
- Dificultad para mantener la posición erecta
- Síntomas gripales, fiebre
- Reacción alérgica grave (anafiláctica) que puede causar mareos o dificultades para respirar, hinchazón de la cara o la garganta
- Conjuntivitis, faringitis
- Estiffness articular, hinchazón articular, estiffness musculoesquelética, artritis degenerativa
- Pérdida de memoria
- Confusión, disminución de la actividad, excitación
- Dificultad para respirar en posición supina
- Ampollas en la piel
- Presión arterial baja
Los efectos adversos informados después de la comercialización del medicamento (frecuencia desconocida):
- Malestar general, fiebre
- Convulsiones
- Presión arterial alta
- Reacción alérgica grave (anafiláctica) que causa hinchazón de la cara, la lengua y la garganta, mareos o dificultades para respirar (edema de Quincke, choque anafiláctico)
- Cambios en algunos parámetros de las pruebas sanguíneas (incluyendo el aumento de la actividad de algunas enzimas)
- Debilidad muscular
- Confusión, sensaciones anormales en el ojo y (o) trastornos visuales
- Amenorrea
- Diarrea
- En caso de tumor pituitario existente, aumento del riesgo de sangrado en la pituitaria
- Urticaria
Durante el tratamiento de la infertilidad, las gonadotropinas en combinación con Diphereline SR 3,75 pueden provocar dolor pélvico y (o) abdominal, así como dificultades para respirar. En tal caso, debe comunicarse inmediatamente con su médico.
Los síntomas por los que se justificó el tratamiento de la endometriosis (dolor pélvico, dolor menstrual) pueden empeorar al comienzo del tratamiento, pero deben mejorar en un plazo de uno a dos semanas. Esto puede ocurrir incluso si el tratamiento es eficaz. Debe informar inmediatamente a su médico.
Niños
Muy frecuentes- efectos adversos que ocurren en más de 1 de cada 10 pacientes
- En niñas, en el primer mes del tratamiento, puede producirse un sangrado vaginal
Frecuentes- efectos adversos que ocurren en no más de 1 de cada 10 pacientes
- Dolor abdominal
- Dolor, moretón, enrojecimiento y hinchazón en el lugar de la inyección
- Dolor de cabeza, sofocos
- Aumento de peso, acné
- Reacción alérgica
Poco frecuentes- efectos adversos que ocurren en no más de 1 de cada 100 pacientes
- Visión borrosa
- Vómitos, estreñimiento, náuseas
- Obesidad
- Dolor en el cuello, dolor en el pecho
- Cambios de humor, malestar
- Sangrado nasal
- Picazón, erupción o urticaria
Los efectos adversos informados después de la comercialización del medicamento (frecuencia desconocida):
- Presión arterial alta
- Convulsiones
- Visión anormal
- Reacción alérgica grave (anafiláctica) que causa hinchazón de la cara, la lengua y la garganta, mareos o dificultades para respirar (edema de Quincke, choque anafiláctico)
- Cambios en algunos parámetros de las pruebas sanguíneas, incluyendo el nivel de hormonas
- Dolor muscular
- Cambios de humor, depresión, irritabilidad
- Idiopática hipertensión intracraneal (aumento de la presión dentro del cráneo, caracterizado por dolor de cabeza, visión doble y otros trastornos visuales, así como zumbido o pitido en los oídos)
Informar de los efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe comunicarse con su médico o farmacéutico, o enfermera. Los efectos adversos pueden informarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social
Alcalá, 56
28071 Madrid
Teléfono: +34 91 596 34 00
Fax: +34 91 596 34 01
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden informarse al titular de la autorización de comercialización.
Al informar de los efectos adversos, se puede recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Diphereline SR 3,75
Debe conservar el medicamento en un lugar donde no pueda ser visto ni alcanzado por los niños.
No debe tomar este medicamento después de la fecha de caducidad impresa en el paquete. La fecha de caducidad es el último día del mes indicado.
Caducidad (VENC)
Número de lote (Lote)
Conservar a una temperatura inferior a 25°C.
6. Contenido del paquete y otra información
Qué contiene Diphereline SR 3,75?
El principio activo del medicamento es la triptorelina en forma de triptorelina acetato. Una ampolla contiene 3,75 mg de triptorelina.
Los demás componentes son:
- La ampolla de polvo contiene polímero láctico-glicólico, manitol, carmelosa sódica, polisorbato 80
- La ampolla de disolvente contiene manitol, agua para inyección
Cómo se presenta Diphereline SR 3,75 y qué contiene el paquete?
Polvo y disolvente para la preparación de una suspensión de liberación prolongada para inyección.
Ampolla de polvo y ampolla de disolvente.
Paquete que contiene 1 ampolla y 1 ampolla de disolvente con 1 jeringa (de polipropileno) y 2 agujas.
Título del responsable y fabricante
Responsable
Ipsen Pharma
65 Quai Georges Gorse
92100 Boulogne Billancourt
Francia
Fabricante
Ipsen Pharma Biotech
Parc d’Activités du Plateau de Signes
Chemin départemental n.º 402
83870 Signes
Francia
Para obtener más información sobre este medicamento, debe consultar con su representante local del responsable del medicamento:
Ipsen España, S.A.
Calle de María de Molina, 40
28006 Madrid
Teléfono: +34 91 456 83 00
Fax: +34 91 456 83 01
Fecha de la última revisión de la hoja de instrucciones:octubre de 2024
<-------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Dosis y vía de administración
Cáncer de próstata
Hay dos esquemas de dosificación posibles:
- inyección subcutánea de Diphereline 0,1 mg de liberación inmediata una vez al día durante 7 días consecutivos, y luego una inyección intramuscular de Diphereline SR 3,75 en el octavo día, cada 4 semanas.
- o inyección intramuscular de Diphereline SR 3,75 cada 4 semanas.
En pacientes con cáncer de próstata con metástasis resistentes a la castración, que no se someten a tratamiento quirúrgico y que reciben triptorelina y se califican para el tratamiento con inhibidores de la biosíntesis de andrógenos, el tratamiento con triptorelina debe continuar.
Cáncer de mama en mujeres antes y después de la menopausia, cuando se indica el tratamiento hormonal
Una inyección de Diphereline SR 3,75 cada 4 semanas. No debe interrumpir el tratamiento sin consultar a su médico.
Desarrollo sexual prematuro de origen central (antes de los 8 años en niñas y antes de los 10 años en niños)
El tratamiento de niños con triptorelina debe realizarse bajo la supervisión de un endocrinólogo pediátrico o un pediatra o endocrinólogo con experiencia en el tratamiento del desarrollo sexual prematuro de origen central.
- Niños con un peso corporal superior a 30 kg: una inyección intramuscular cada 4 semanas (28 días).
- Niños con un peso corporal de 20 a 30 kg: dos tercios de la dosis en una inyección intramuscular cada 4 semanas (28 días), es decir, administrar dos tercios del volumen de la suspensión preparada.
- Niños con un peso corporal inferior a 20 kg: la mitad de la dosis en una inyección intramuscular cada 4 semanas (28 días), es decir, administrar la mitad del volumen de la suspensión preparada.
Endometriosis
El tratamiento debe iniciarse dentro de los primeros 5 días del ciclo menstrual.
El esquema de administración del medicamento es: una inyección de Diphereline SR 3,75 cada 4 semanas.
La duración del tratamiento depende del estadio inicial de la endometriosis y de los cambios en el estado clínico de la paciente (funcionales y anatómicos) observados durante el tratamiento. En general, el tratamiento debe durar al menos 4 meses y como máximo 6 meses. No se recomienda iniciar un segundo ciclo de tratamiento con triptorelina o cualquier otro análogo de GnRH.
Leiomiomas uterinos
El tratamiento debe iniciarse dentro de los primeros 5 días del ciclo menstrual. Diphereline SR 3,75 debe administrarse cada 4 semanas. En pacientes que se someten a una operación quirúrgica, el tratamiento se realiza durante 3 meses. En pacientes que no se someten a la operación, el tratamiento se limita a 6 meses.
Infertilidad en mujeres
Se administra una ampolla de Diphereline SR 3,75 por vía intramuscular en el segundo día del ciclo. La administración de gonadotropinas debe iniciarse después de que se haya reducido la sensibilidad de la glándula pituitaria (nivel de estrógenos en suero por debajo de 50 pg/ml), generalmente alrededor de 15 días después de la inyección de Diphereline SR 3,75.
En el caso de las mujeres, el especialista debe evaluar cuidadosamente la justificación de la administración prolongada del medicamento durante más de 6 meses, para determinar si el beneficio esperado supera los posibles efectos adversos asociados con la inhibición prolongada de la producción de estrógenos, especialmente en los huesos.
Debe seguir estrictamente las indicaciones de su médico y no interrumpir el tratamiento sin consultar a su médico.
El medicamento se administra por inyección intramuscular después de la preparación inmediata.
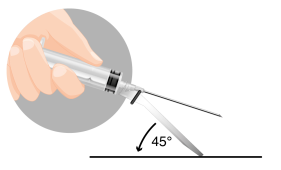
Importante: es importante que la inyección se realice estrictamente según las instrucciones de administración.
INSTRUCCIONES PARA LA RECONSTITUCIÓN DEL MEDICAMENTO
| |
| La preparación del paciente consiste en desinfectar el lugar de la inyección planificada en la nalga. El paciente debe estar preparado para la inyección antes de la reconstitución del medicamento, ya que el medicamento debe administrarse inmediatamente después de su reconstitución. | |
  | |
En el paquete hay 2 agujas:
| |
2a
|  |
2b
|  |
2c
| |
2d
| 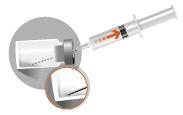 |
| 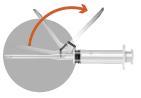 |
| 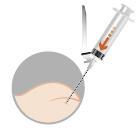 |
| 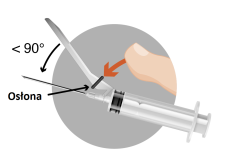 |
| Sistema A Sistema B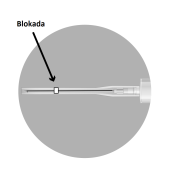 |
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorIpsen Pharma Biotech SAS
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Dipiereline Sr 3,75Forma farmacéutica: Solución, 0.1 mg/mlPrincipio activo: triptorelinaFabricante: Ferring GmbHRequiere recetaForma farmacéutica: Polvo, 3,75 mgPrincipio activo: triptorelinaFabricante: Ferring GmbHRequiere recetaForma farmacéutica: Polvo, 0,1 mgPrincipio activo: triptorelinaFabricante: Ipsen Pharma Biotech SASRequiere receta
Alternativas a Dipiereline Sr 3,75 en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Dipiereline Sr 3,75 en Ucrania
Alternativa a Dipiereline Sr 3,75 en España
Médicos online para Dipiereline Sr 3,75
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Dipiereline Sr 3,75 – sujeta a valoración médica y normativa local.











