
Decapeptil Depot

Consulta con un médico sobre la receta médica de Decapeptil Depot

Cómo usar Decapeptil Depot
Hoja de instrucciones del paquete: información para el paciente
DECAPEPTYL DEPOT,
3,75 mg, polvo y disolvente para preparar una suspensión para inyección
Triptorelina
Es importante leer detenidamente el contenido de esta hoja de instrucciones antes de tomar el medicamento, ya que contiene información importante para el paciente.
Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
En caso de dudas adicionales, debe consultar a su médico.
Este medicamento ha sido recetado exclusivamente para una persona determinada. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico. Véase el punto 4.
Índice de la hoja de instrucciones:
- 1. Qué es Decapeptyl Depot y para qué se utiliza
- 2. Información importante antes de tomar Decapeptyl Depot
- 3. Cómo tomar Decapeptyl Depot
- 4. Posibles efectos adversos
- 5. Cómo conservar Decapeptyl Depot
- 6. Contenido del paquete y otra información
1. Qué es Decapeptyl Depot y para qué se utiliza
Decapeptyl Depot contiene triptorelina (en forma de triptorelina octanoato). Una de sus acciones es
reducir la producción de hormonas sexuales por el organismo.
Decapeptyl Depot se utiliza:
En hombres:
para tratar el cáncer de próstata localmente avanzado o con metástasis,
para diagnosticar la dependencia hormonal del cáncer de próstata (evaluación de las indicaciones para el tratamiento hormonal).
En mujeres:
Para reducir los niveles de hormonas ováricas con el fin de:
reducir el tamaño de los miomas uterinos (comúnmente conocidos como fibromas), que son tumores benignos que se desarrollan a partir del músculo liso del útero (capa muscular),
tratar la endometriosis (crecimiento de tejido uterino fuera del útero).
2. Información importante antes de tomar Decapeptyl Depot
Cuándo no tomar Decapeptyl Depot
si el paciente es alérgico a la triptorelina o a alguno de los demás componentes de este medicamento (enumerados en el punto 6),
si el paciente es alérgico a la hormona liberadora de gonadotropina (GnRH) o a cualquier otro análogo de GnRH.
En mujeres:
si la paciente está embarazada,
si la paciente está amamantando.
Página 1 de 9
Advertencias y precauciones
Antes de comenzar a tomar Decapeptyl 0,1 mg, debe discutirlo con su médico.
En hombres y mujeres
Se han informado casos de depresión en pacientes que toman Decapeptyl Depot, incluidos casos de depresión grave. Si durante el tratamiento con Decapeptyl Depot aparecen síntomas depresivos, debe informar a su médico.
En hombres
Debe tener cuidado:
si el paciente tiene dolor óseo o dificultad para orinar,
si el paciente tiene tumores metastásicos en la columna vertebral o las vías urinarias,
si el paciente tiene cualquier trastorno cardiovascular, incluyendo trastornos del ritmo cardíaco (arritmia), o está tomando medicamentos para tratar estos trastornos; el riesgo de trastornos del ritmo cardíaco puede aumentar durante el tratamiento con Decapeptyl Depot.
Debe informar a su médico si alguno de los síntomas de la enfermedad empeora.
En mujeres
Debe tener cuidado:
si durante el tratamiento la paciente experimenta sangrado entre períodos menstruales (excepto en el primer mes),
si la paciente tiene un mayor riesgo de pérdida de densidad ósea.
El tratamiento con Decapeptyl Depot durante varios meses puede llevar a una pérdida de masa ósea. Por lo tanto, el tiempo de tratamiento no debe exceder los 6 meses. Después de suspender el tratamiento, la masa ósea suele recuperarse en un plazo de 6 a 9 meses. Se debe prestar especial atención a las pacientes con factores de riesgo adicionales de osteoporosis.
Durante el tratamiento
En el primer mes de tratamiento, debe usar un método anticonceptivo no hormonal. También debe usarlo desde la 4ª semana después de la última inyección hasta que vuelvan a aparecer los sangrados menstruales o hasta que se aplique otro método anticonceptivo.
Durante el tratamiento, no se producen sangrados menstruales. Después de suspender el tratamiento, los sangrados menstruales vuelven en un plazo de
- 7 - 12 semanas después de la última inyección del medicamento. Si durante el tratamiento se mantienen los sangrados menstruales regulares, debe informar a su médico.
Decapeptyl Depot y otros medicamentos
Debe informar a su médico sobre todos los medicamentos que esté tomando actualmente o recientemente, así como sobre los medicamentos que planea tomar.
Decapeptyl Depot puede interactuar con algunos medicamentos utilizados para tratar trastornos del ritmo cardíaco (por ejemplo, quinidina, procaína, amiodarona y sotalol) o puede aumentar el riesgo de trastornos del ritmo cardíaco cuando se administra junto con otros medicamentos [por ejemplo, metadona (utilizada para reducir el dolor y como parte de la desintoxicación de drogas), moxifloxacina (antibiótico), medicamentos antipsicóticos utilizados para tratar trastornos psiquiátricos graves].
Debe tener cuidado cuando se administra triptorelina junto con medicamentos que afectan la secreción de gonadotropina por la glándula pituitaria.
Embarazo y lactancia
No se debe tomar Decapeptyl Depot durante el embarazo y la lactancia (véase también "Cuándo no tomar Decapeptyl Depot").
Las mujeres en edad reproductiva deben usar métodos anticonceptivos no hormonales efectivos.
Página 2 de 9
Conducción de vehículos y uso de máquinas
La capacidad para conducir vehículos y operar máquinas puede estar alterada si se producen mareos, somnolencia y trastornos visuales, que pueden ser efectos adversos durante el tratamiento o resultado de la enfermedad subyacente.
Decapeptyl Depot contiene sodio
Decapeptyl Depot contiene menos de 1 mmol de sodio (23 mg) por dosis, lo que significa que el medicamento se considera "libre de sodio".
3. Cómo tomar Decapeptyl Depot
Por lo general, la mezcla del polvo y el disolvente, así como la inyección, la realiza personal médico especializado.
En hombres:
Se debe inyectar una dosis que contenga 3,75 mg de triptorelina cada 4 semanas. Debe seguirse el calendario de inyecciones cada 4 semanas.
Cáncer de próstata:
El tratamiento es a largo plazo.
Diagnóstico de la dependencia hormonal del cáncer de próstata:
Por lo general, es suficiente administrar el medicamento durante 3 meses para determinar la dependencia hormonal del cáncer de próstata.
En mujeres:
Se debe inyectar una dosis que contenga 3,75 mg de triptorelina cada 4 semanas. El tratamiento debe iniciarse dentro de los primeros 5 días del ciclo menstrual.
La duración del tratamiento está bajo supervisión médica.
Uso de una dosis mayor de la recomendada de Decapeptyl Depot
Es poco probable que el paciente reciba una dosis mayor de la recomendada de Decapeptyl Depot. Si el paciente recibe una dosis mayor de la recomendada de Decapeptyl Depot, debe informar a su médico de inmediato.
Suspensión del tratamiento con Decapeptyl Depot
La suspensión del tratamiento con Decapeptyl Depot debe realizarse únicamente bajo el consejo de un médico. En caso de dudas relacionadas con el tratamiento, debe consultar a su médico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
En general (todos los pacientes):
Si se produce hinchazón en la cara, los labios, la boca o la garganta, lo que puede causar dificultad para tragar o respirar, debe informar a su médico o acudir a la sala de emergencias del hospital más cercano de inmediato.
Durante el tratamiento con agonistas de LHRH, se han informado casos de crecimiento de un tumor pituitario preexistente, aunque no se han observado casos en pacientes tratados con triptorelina.
En hombres:
Página 3 de 9
Los síntomas por los que el paciente está siendo tratado (por ejemplo, obstrucción de las vías urinarias, dolor óseo, compresión de la médula espinal, síntomas musculares, hinchazón en las extremidades inferiores, debilidad, entumecimiento en los pies y las manos), pueden empeorar inicialmente debido al aumento del nivel de testosterona al comienzo del tratamiento.
Muy frecuentes– se producen en más de 1 de cada 10 pacientes tratados:
la mayoría de los efectos adversos de Decapeptyl Depot en hombres se deben a la reducción del nivel de testosterona; pueden producirse:
impotencia (trastornos de la erección),
pérdida del deseo sexual,
sofocos,
sudoración excesiva.
Frecuentes– se producen en 1 de cada 10 pacientes tratados:
mareos,
aumento de la presión arterial,
dolor óseo,
fatiga,
dolor en el lugar de la inyección.
Poco frecuentes– se producen en 1 de cada 100 pacientes tratados:
pérdida del apetito,
insomnio,
parestesias (sensación de hormigueo, picazón o entumecimiento),
náuseas,
estreñimiento,
sequedad en la boca,
pérdida de cabello,
dolor de espalda,
ginecomastia.
Frecuencia desconocida– no puede determinarse a partir de los datos disponibles:
infección del tracto respiratorio superior (resfriado),
dificultad para respirar (respiración superficial) en posición acostada,
reacciones anafilácticas,
hipersensibilidad,
sangrado nasal,
aumento del apetito,
dolor abdominal,
gotas,
diarrea,
diabetes,
vómitos,
depresión,
hinchazón abdominal,
cambios de humor,
distensión abdominal,
confusión,
acné,
reducción de la actividad,
picazón en la piel,
estado eufórico,
erupción cutánea,
ansiedad,
ampollas cutáneas,
apatía,
edema angioneurótico (hinchazón que se produce bajo la piel),
dolor de cabeza,
trastornos de la memoria,
urticaria,
trastornos del gusto,
petequias (pequeñas manchas rojas en la piel),
somnolencia,
dolor musculoesquelético,
dificultad para estar de pie,
dolor en las extremidades,
alteraciones visuales anormales,
dolor articular,
visión borrosa,
debilidad muscular,
zumbido en los oídos,
dolor muscular,
trastornos del equilibrio,
rigidez articular,
reducción de la presión arterial,
edema articular,
dificultad para respirar (respiración superficial),
rigidez musculoesquelética,
Página 4 de 9
artritis,
síntomas similares a los de la gripe,
dolor en el pecho,
fiebre,
atrofia testicular,
malestar general,
dolor testicular,
alteraciones en el ECG (prolongación del intervalo QT),
ausencia de eyaculación,
irritabilidad,
debilidad,
aumento de la actividad de algunas enzimas hepáticas,
enrojecimiento en el lugar de la inyección,
inflamación en el lugar de la inyección,
aumento del nivel de creatinina en sangre,
reacción en el lugar de la inyección,
aumento del nivel de urea en sangre,
edema,
aumento de la presión arterial,
dolor,
aumento de la temperatura corporal,
escalofríos,
aumento de peso,
reducción de peso.
En mujeres:
Al comienzo del tratamiento, los síntomas de la endometriosis, incluyendo el dolor pélvico y el dolor menstrual, pueden empeorar debido al aumento inicial y transitorio del nivel de estradiol en sangre. Estos síntomas son temporales y suelen desaparecer en un plazo de una a dos semanas.
Muy frecuentes– se producen en más de 1 de cada 10 pacientes tratadas:
dolor en los senos,
reducción del deseo sexual,
trastornos del sueño,
sofocos,
sudoración excesiva,
sangrado o manchado vaginal,
sequedad vaginal,
dolor de cabeza.
Frecuentes– se producen en 1 de cada 10 pacientes tratadas:
hiperandrogenismo,
cambios de humor,
ansiedad,
insomnio,
depresión,
estado de ánimo deprimido,
mareos,
palpitaciones,
síntomas respiratorios superiores,
náuseas,
dispepsia,
trastornos gastrointestinales,
dolor abdominal,
pérdida de cabello,
dolor articular,
dolor durante las relaciones sexuales,
trastornos mamarios,
fatiga,
debilidad,
irritabilidad,
aumento de peso,
alteraciones del peso.
Poco frecuentes– se producen en 1 de cada 100 pacientes tratadas:
parestesias (sensación de hormigueo, picazón o entumecimiento),
trastornos del equilibrio,
dolor de espalda,
dolor óseo,
Strona 5 z 9
calambres musculares,
edema,
dolor en el lugar de la inyección,
reacción en el lugar de la inyección,
aumento de la presión arterial.
Raros– se producen en 1 de cada 10 pacientes tratadas:
vómitos,
dolor muscular,
sangrado menstrual excesivo,
dolor pélvico.
Frecuencia desconocida– no puede determinarse a partir de los datos disponibles:
hipersensibilidad,
picazón en la piel
reacciones anafilácticas,
erupción cutánea
trastornos abdominales
urticaria
fiebre
malestar general,
dolor menstrual,
diarrea
sangrado entre períodos menstruales,
debilidad muscular
visión borrosa
edema angioneurótico (hinchazón que se produce bajo la piel),
visión alterada,
dificultad para respirar (respiración superficial),
ausencia de menstruación
confusión
dolor en el pecho
inflamación en el lugar de la inyección
enrojecimiento en el lugar de la inyección
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos de la Agencia de Medicamentos y Productos Sanitarios: Aleje Jerozolimskie 181C, 02-222 Varsovia, Tel: (22) 49-21-301, Fax: (22) 49-21-309 o en la dirección https://smz.ezdrowie.gov.pl/.
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Decapeptyl Depot
El medicamento debe conservarse en un lugar fuera del alcance de los niños.
No debe tomar este medicamento después de la fecha de caducidad que aparece en el paquete después de "EXP".
La fecha de caducidad es el último día del mes indicado.
Conservar en refrigerador (2°C - 8°C). Conservar en el paquete original.
No debe tirar los medicamentos por el desagüe ni por los contenedores de basura domésticos. Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Decapeptyl Depot?
- El principio activo del medicamento es triptorelina en una cantidad de 3,75 mg
- Los demás componentes son: Polvo: poli(ácido láctico y ácido glicólico) 1:1 y dicaprilato de glicerol propileno
Página 6 de 9
Disolvente: Polisorbato 80, Dextran 70, cloruro de sodio, dihidrogenofosfato de sodio dihidratado, hidróxido de sodio y agua para inyección.
Cómo se presenta Decapeptyl Depot y qué contiene el paquete?
Decapeptyl Depot es un polvo y un disolvente para preparar una suspensión para inyección.
El polvo es blanco o ligeramente amarillento.
El disolvente es un líquido transparente e incoloro.
Después de mezclar el polvo con el disolvente, debe obtenerse una suspensión homogénea, blanca o ligeramente amarillenta.
Hay una sola presentación del paquete: 1 jeringa precargada con polvo, 1 jeringa precargada con disolvente, 1 conector de polipropileno y 1 aguja para inyección, todo en una caja de cartón.
Titular de la autorización de comercialización y fabricante:
Ferring GmbH
Wittland 11
D-24109 Kiel
Alemania
Para obtener más información, debe ponerse en contacto con el representante del titular de la autorización de comercialización:
Ferring Pharmaceuticals Poland Sp. z o.o.
ul. Szamocka 8, 01-748 Varsovia
Tel.: +48 22 246 06 80, Fax: +48 22 246 06 81
Fecha de la última actualización de la hoja de instrucciones: ---------------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado:
Instrucciones para el médico sobre la preparación, el preparado y la inyección de la suspensión.
Como la preparación correcta de la suspensión es crucial para la eficacia terapéutica del producto, debe seguir estrictamente las siguientes instrucciones:

Información importante :
DECAPEPTYL Depot debe almacenarse en el paquete en el refrigerador.
DECAPEPTYL Depot debe inyectarse dentro de los 3 minutos después de la preparación.
Revisión de los componentes del kit DECAPEPTYL Depot:



Página 7 de 9
1. Preparación
Para asegurar la preparación correcta de la suspensión, debe seguir las instrucciones al pie de la letra:
Sacar el paquete
DECAPEPTYL Depot del
refrigerador.
Abrir el paquete
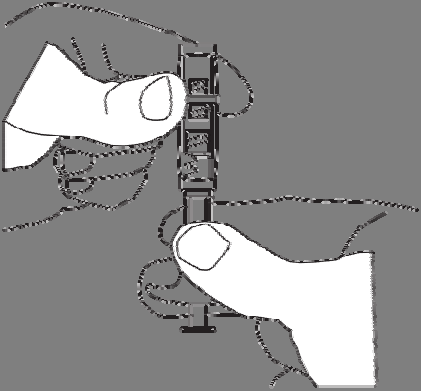
del conector y sacar el conector.
Desenroscar el tapón de la jeringa con
polvo. Sostener la jeringa con la abertura hacia arriba para evitar
verter el polvo.
Enroscar la jeringa con polvo en uno de los roscas del conector hasta que esté bien sujeto.



Siempre debe conectar primero la jeringa que contiene el polvo con
el conector, y luego
la jeringa que contiene
el disolvente.
Desenroscar el tapón de la jeringa con
disolvente.
Sostener la jeringa con la abertura hacia arriba,
para evitar derramar el líquido.
No debe tocar el rosca del conector.
No debe presionar el émbolo de la jeringa.
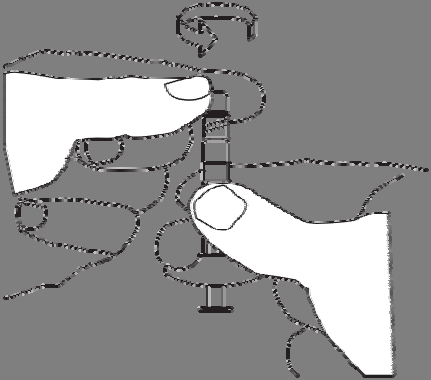







Enroscar la jeringa que contiene el disolvente en el rosca libre del conector, hasta que esté bien sujeto.

No debe presionar el émbolo de la jeringa.
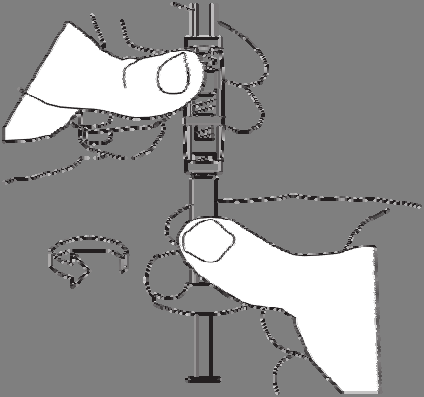
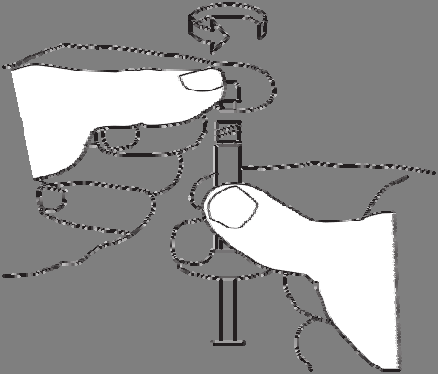


2. Preparado de la suspensión
Para preparar la suspensión, debe:
Empujar el líquido hacia la jeringa con el polvo.
Transferir lentamente la suspensión entre las dos jeringas y el conector hasta que se obtenga una suspensión homogénea, blanca o ligeramente amarillenta.
Las jeringas deben sostenerse rectas, sin doblar.
Página 8 de 9
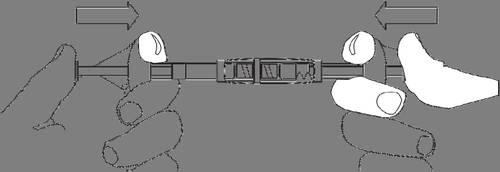
3. Inyección
Desenroscar la jeringa con la suspensión preparada para la inyección del conector.
Conectar la aguja a la jeringa.
Realizar la inyección dentro de los 3 minutos.
DECAPEPTYL Depot está destinado a un solo uso y cualquier suspensión no utilizada debe eliminarse.
Página 9 de 9
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorFerring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Decapeptil DepotForma farmacéutica: Solución, 0.1 mg/mlPrincipio activo: triptorelinaFabricante: Ferring GmbHRequiere recetaForma farmacéutica: Polvo, 0,1 mgPrincipio activo: triptorelinaFabricante: Ipsen Pharma Biotech SASRequiere recetaForma farmacéutica: Polvo, 11.25 mgPrincipio activo: triptorelinaFabricante: Ipsen Pharma Biotech SASRequiere receta
Alternativas a Decapeptil Depot en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Decapeptil Depot en Ucrania
Alternativa a Decapeptil Depot en España
Médicos online para Decapeptil Depot
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Decapeptil Depot – sujeta a valoración médica y normativa local.











