
Cosopt Pf

Consulta con un médico sobre la receta médica de Cosopt Pf

Cómo usar Cosopt Pf
HOJA DE INSTRUCCIONES PARA EL PACIENTE
Hoja de instrucciones adjunta al embalaje: información para el usuario
COSOPT PF, 20 mg/ml + 5 mg/ml, gotas oftálmicas, solución en contenedor de dosis única
Dorzolamida + Timolol
Es importante leer atentamente el contenido de esta hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es COSOPT PF y para qué se utiliza
- 2. Información importante antes de usar COSOPT PF
- 3. Cómo usar COSOPT PF
- 4. Posibles efectos adversos
- 5. Cómo conservar COSOPT PF
- 6. Contenido del embalaje y otra información
1. Qué es COSOPT PF y para qué se utiliza
COSOPT PF contiene dos medicamentos: dorzolamida y timolol.
- La dorzolamida pertenece a un grupo de medicamentos llamados "inhibidores de la anhidrasa carbónica".
- El timolol pertenece a un grupo de medicamentos llamados "inhibidores de los receptores beta-adrenérgicos" (beta-bloqueantes). Estos medicamentos reducen la presión intraocular a través de dos mecanismos diferentes.
COSOPT PF se indica para el tratamiento del glaucoma para reducir la presión intraocular elevada, cuando no es suficiente el uso de gotas oculares que contienen solo un inhibidor del receptor beta-adrenérgico.
2. Información importante antes de usar COSOPT PF
Cuándo no usar COSOPT PF
- si el paciente es alérgico al clorhidrato de dorzolamida, maleato de timolol o a cualquier otro componente de este medicamento (enumerados en el punto 6);
- si actualmente o en el pasado el paciente ha tenido trastornos respiratorios, como asma o enfermedad pulmonar obstructiva crónica (EPOC) (una enfermedad pulmonar grave que puede causar sibilancias, problemas para respirar y/o tos persistente);
- si el paciente tiene bradicardia, insuficiencia cardíaca o trastornos del ritmo cardíaco (frecuencia cardíaca irregular);
- si el paciente tiene enfermedad renal grave o trastornos graves de la función renal o cálculos renales en su historial;
- si el paciente tiene acidosis hiperclorémica (un trastorno caracterizado por un exceso de iones cloruro en la sangre).
En caso de duda sobre si se puede usar este medicamento, debe consultar a su médico o farmacéutico.
Advertencias y precauciones
Antes de comenzar a usar COSOPT PF, debe discutirlo con su médico.
Debe informar a su médico sobre todos los trastornos oculares y enfermedades actuales o pasadas:
- enfermedad cardíaca isquémica (cuyos síntomas incluyen dolor o sensación de opresión en el pecho, dificultad para respirar o sensación de ahogarse), insuficiencia cardíaca, hipotensión;
- trastornos de la frecuencia cardíaca, como la bradicardia;
- problemas respiratorios, asma o enfermedad pulmonar obstructiva crónica;
- enfermedades relacionadas con una mala circulación sanguínea (como la enfermedad de Raynaud o el síndrome de Raynaud);
- diabetes, ya que el timolol puede enmascarar los síntomas objetivos y subjetivos de la hipoglucemia (bajo nivel de azúcar en la sangre);
- hipertiroidismo, ya que el timolol puede enmascarar sus síntomas objetivos y subjetivos.
Antes de una operación, debe informar a su médico sobre el uso de COSOPT PF,
ya que el timolol puede alterar el efecto de algunos medicamentos utilizados para la anestesia.
Debe informar a su médico sobre cualquier alergia a medicamentos o reacciones anafilácticas.
Debe informar a su médico si ha experimentado debilidad muscular o si ha sido diagnosticado con miastenia (Miastenia gravis).
Si se produce irritación ocular o cualquier nuevo problema ocular, como enrojecimiento ocular o edema de los párpados, debe consultar a su médico de inmediato.
Si el paciente sospecha que COSOPT PF está causando una reacción alérgica o hipersensibilidad (por ejemplo, erupción cutánea, reacción cutánea grave o enrojecimiento y picazón ocular), debe suspender el uso de este medicamento y consultar a su médico de inmediato.
Debe informar a su médico si se produce una infección ocular, lesión ocular, después de una operación ocular o si se produce una reacción que incluya la aparición de nuevos síntomas o el empeoramiento de los síntomas existentes.
Después de la administración ocular de COSOPT PF, puede producirse un efecto sistémico.
No se han realizado estudios sobre el uso de este medicamento en pacientes que usan lentes de contacto.
Antes de usar COSOPT PF, las personas que usan lentes de contacto blandas deben consultar a su médico.
Uso en niños
La experiencia con COSOPT (forma con conservante) en lactantes y niños es limitada.
Uso en personas mayores
En los estudios realizados con COSOPT (forma con conservante),
COSOPT produjo efectos similares en personas mayores y más jóvenes.
Uso en pacientes con trastornos de la función hepática
Debe informar a su médico sobre cualquier enfermedad hepática actual o pasada.
COSOPT PF y otros medicamentos
COSOPT PF puede afectar el efecto de otros medicamentos o viceversa.
Esto incluye otros medicamentos oftálmicos para el glaucoma.
Debe informar a su médico sobre cualquier medicamento que esté tomando o planea tomar, incluyendo medicamentos para reducir la presión arterial, medicamentos cardíacos o medicamentos para la diabetes.
Debe informar a su médico o farmacéutico sobre todos los medicamentos que esté tomando actualmente o recientemente,
y cualquier medicamento que planea tomar.
Es especialmente importante en el caso de:
- tomar medicamentos para reducir la presión arterial o para trastornos cardíacos (como bloqueadores de los canales de calcio, beta-bloqueantes o digoxina);
- tomar medicamentos para trastornos del ritmo cardíaco o para restaurar un ritmo cardíaco regular (como bloqueadores de los canales de calcio, beta-bloqueantes o digoxina);
- usar otras gotas oculares que contengan beta-bloqueantes;
- tomar otros inhibidores de la anhidrasa carbónica, como el acetazolamida;
- tomar inhibidores de la monoaminooxidasa (IMAO);
- tomar medicamentos con efecto parasympaticomimético (colinérgico), que pueden usarse para trastornos de la micción.
Los medicamentos colinérgicos también se usan ocasionalmente para restaurar la motilidad (movimiento) intestinal; - tomar narcóticos, como la morfina, utilizados para el tratamiento del dolor moderado o severo;
- tomar medicamentos para la diabetes;
- tomar medicamentos antidepresivos, como la fluoxetina y la paroxetina;
- tomar quimioterápicos de la clase de los sulfonamidas;
- tomar quinidina (un medicamento utilizado para trastornos cardíacos y algunas formas de malaria).
Embarazo y lactancia
Antes de tomar cualquier medicamento, debe consultar a su médico o farmacéutico.
Uso durante el embarazo
No debe usar este medicamento durante el embarazo, a menos que su médico lo considere necesario.
Uso durante la lactancia
No debe usar este medicamento durante la lactancia.
El timolol puede pasar a la leche materna.
Antes de tomar cualquier medicamento durante la lactancia, debe consultar a su médico.
Conducción de vehículos y uso de máquinas
No se han realizado estudios sobre el efecto de COSOPT PF en la capacidad para conducir vehículos o operar máquinas.
Algunos efectos adversos asociados con el uso de COSOPT PF, como la visión borrosa, pueden afectar la capacidad para conducir vehículos o operar máquinas.
Los pacientes que se sientan mal o tengan visión borrosa no deben conducir vehículos ni operar máquinas.
3. Cómo usar COSOPT PF
Este medicamento debe usarse siempre según las indicaciones de su médico.
En caso de duda, debe consultar a su médico o farmacéutico.
Su médico determinará la dosis adecuada y la duración del tratamiento.
La dosis recomendada es de una gota en el ojo afectado (ojos afectados) por la mañana y por la noche.
Si se usan otras gotas oculares además de COSOPT PF, debe esperar al menos 10 minutos antes de administrar el siguiente medicamento.
No debe cambiar la dosis de este medicamento sin consultar a su médico.
En caso de dificultad para administrar las gotas, debe pedir ayuda a un miembro de su familia o cuidador.
No debe permitir que ninguna parte del contenedor de dosis única toque el ojo o sus alrededores.
Esto puede causar lesiones oculares y contaminación del contenedor con bacterias, lo que puede provocar infecciones oculares graves que pueden llevar a la pérdida de visión.
Para evitar la contaminación del contenedor de dosis única, debe lavarse las manos antes de usar este medicamento y evitar el contacto entre la punta del contenedor y cualquier superficie.
Un nuevo contenedor de dosis única debe abrirse justo antes de cada uso.
Cada contenedor contiene suficiente solución para administrar la dosis adecuada en ambos ojos, si su médico lo prescribe.
El contenedor abierto debe desecharse inmediatamente después de su uso, incluso si quedan restos de medicamento.
Instrucciones de uso
Abrir la bolsa de folio que contiene los contenedores de dosis única.
Debe anotar la fecha de apertura en la bolsa.
Uso del medicamento COSOPT PF
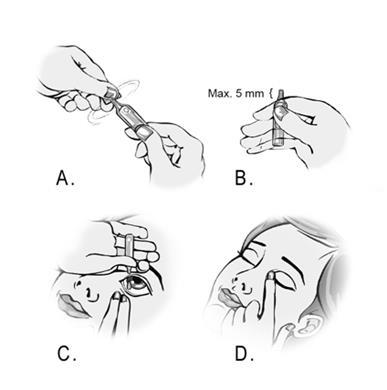
- 1. Debe lavarse las manos.
- 2. Sacar la tira de contenedores de la bolsa.
- 3. Desprender un contenedor de dosis única de la tira.
- 4. Volver a colocar la tira con los contenedores restantes en la bolsa y doblar el borde para cerrarla.
- 5. Si la solución no está en la punta del contenedor, golpee suavemente con el dedo en el contenedor cerrado mientras sostiene la punta hacia abajo para que la solución llegue a la punta.
- 6. Abrir el contenedor girando la parte superior. (Figura A).
- 7. Sostener el contenedor entre el pulgar y el índice.
Debe recordar que la punta del contenedor no debe sobresalir más de 5 mm del borde del índice.
(Figura B). - 8. Inclinar la cabeza hacia atrás o acostarse.
Colocar la mano en la frente.
El dedo índice debe estar alineado con el arco de las cejas o descansar en el puente de la nariz.
Debe mirar hacia arriba y, con la otra mano, tirar hacia abajo del párpado inferior.
No debe permitir que ninguna parte del contenedor toque el ojo o sus alrededores.
Debe dejar caer una gota en el espacio entre el párpado y el globo ocular mediante una suave compresión del contenedor.
(Figura C).
No debe parpadear mientras se administra la gota en el ojo.
Cada contenedor de dosis única contiene suficiente solución para administrar la dosis adecuada en ambos ojos, si su médico lo prescribe. - 9. Cerrar el ojo y presionar el ángulo interno del ojo con el dedo durante aproximadamente dos minutos.
Esto ayuda a prevenir que el medicamento se absorba en todo el cuerpo.
(Figura D). - 10. Limpiar cualquier exceso de solución de la piel alrededor de los ojos.
Si su médico prescribe el uso de gotas en ambos ojos, debe repetir los pasos anteriores para el segundo ojo.
Para evitar la contaminación de la solución sin conservantes, después de administrar el medicamento en el ojo (ojos), el contenedor de dosis única debe desecharse inmediatamente, incluso si queda algo de solución.
Los contenedores restantes deben conservarse en la bolsa de folio; pueden usarse durante 15 días después de abrir la bolsa.
Si después de 15 días desde la apertura de la bolsa quedan contenedores, debe desecharlos de manera segura para el medio ambiente y abrir una nueva bolsa.
Es importante que las gotas oculares se usen de manera continua según las indicaciones de su médico.
En caso de dudas sobre la administración del medicamento, debe consultar a su médico, farmacéutico o enfermera.
Uso de una dosis mayor de la recomendada de COSOPT PF
En caso de administrar demasiadas gotas o ingerir el contenido de un contenedor, pueden producirse mareos, dificultad para respirar o sensación de frecuencia cardíaca lenta, entre otros síntomas.
Debe consultar a su médico de inmediato.
Olvido de una dosis de COSOPT PF
COSOPT PF debe usarse según las indicaciones de su médico.
En caso de olvidar una dosis, debe administrarla lo antes posible.
Si la próxima dosis está próxima, no debe administrar la dosis olvidada y debe continuar con el esquema de dosificación regular.
No debe usar una dosis doble para compensar la dosis olvidada.
Suspensión del uso de COSOPT PF
Antes de suspender el uso de este medicamento, debe consultar a su médico.
En caso de dudas adicionales sobre el uso de este medicamento, debe consultar a su médico o farmacéutico.
4. Posibles efectos adversos
Como cualquier medicamento, COSOPT PF puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los efectos adversos pueden incluir:
Si se produce alguno de los siguientes efectos adversos, debe suspender el uso de este medicamento y buscar ayuda médica de inmediato, ya que pueden ser síntomas de una reacción al medicamento.
Reacciones alérgicas generalizadas, incluyendo edema subcutáneo, que pueden ocurrir en la cara y las extremidades, y causar dificultad para respirar y tragar, disnea, urticaria, erupción cutánea y picazón, erupción local y generalizada, picazón y reacción alérgica grave y potencialmente mortal.
Por lo general, el tratamiento con gotas oculares puede continuar, a menos que los efectos adversos sean graves.
En caso de inquietud, debe consultar a su médico o farmacéutico.
No debe suspender el tratamiento con COSOPT PF sin consultar a su médico
Durante los estudios clínicos o después de la comercialización del medicamento, se han informado los siguientes efectos adversos asociados con COSOPT PF o con alguno de sus componentes activos:
Muy frecuentes (pueden ocurrir en más de 1 de cada 10 personas)
Sensación de ardor y picores en el ojo, cambio en la percepción del sabor
Frecuentes (pueden ocurrir en hasta 1 de cada 10 personas)
Enrojecimiento de los globos oculares y la piel alrededor del ojo (ojos), lagrimeo o picazón en el ojo (ojos), úlceras corneales (daño a la capa frontal del globo ocular), edema y/o irritación de los globos oculares y la piel alrededor del ojo (ojos), sensación de cuerpo extraño en el ojo, disminución de la sensibilidad corneal (no percibir un cuerpo extraño en el ojo y no sentir dolor), dolor ocular, ojos secos, visión borrosa, dolor de cabeza, sinusitis (sensación de tensión o congestión nasal), náuseas, debilidad y sensación de fatiga.
Poco frecuentes (pueden ocurrir en hasta 1 de cada 100 personas)
Mareos, depresión, inflamación de la iris, trastornos de la visión, incluyendo cambios en la refracción (en algunos casos debido a la suspensión de medicamentos que reducen la pupila), bradicardia, síncope, disnea, náuseas y vómitos, y cálculos renales.
Raros (pueden ocurrir en hasta 1 de cada 1000 personas)
Lupus eritematoso sistémico (enfermedad autoinmune que puede causar inflamación de los órganos internos) , hormigueo o entumecimiento de las manos o los pies, insomnio, pesadillas, pérdida de memoria, empeoramiento de los síntomas de la miastenia (trastorno muscular), disminución de la libido, accidente cerebrovascular, miopía transitoria que puede revertirse después de suspender el medicamento, desprendimiento de la capa corioidea (capa que contiene vasos sanguíneos debajo de la retina) después de una operación de filtración, lo que puede causar trastornos de la visión, ptosis (párpados caídos), visión doble, formación de costras en los párpados, edema corneal (con síntomas subjetivos de trastornos de la visión), presión ocular baja, tinnitus, hipotensión, trastornos del ritmo cardíaco, cambios en el ritmo o la frecuencia cardíaca, insuficiencia cardíaca congestiva (enfermedad cardíaca caracterizada por dificultad para respirar y edema en los pies y las piernas debido a la acumulación de líquido), edema (acumulación de líquido), isquemia cerebral (disminución del flujo sanguíneo al cerebro), dolor en el pecho, taquicardia (latido cardíaco rápido o irregular), infarto de miocardio, enfermedad de Raynaud, edema de manos y pies o manos y pies frías, y debilidad en la circulación de las extremidades superiores e inferiores, calambres musculares en las piernas y/o dolor en las piernas al caminar (claudicación intermitente), disnea, insuficiencia respiratoria, rinitis (inflamación de la mucosa nasal), epistaxis, broncoespasmo, tos, irritación de la garganta, sequedad bucal, diarrea, dermatitis de contacto, alopecia, erupción cutánea plateada (erupción cutánea similar a la psoriasis), enfermedad de Peyronie (enfermedad que puede causar curvatura del pene), reacciones alérgicas, como erupción cutánea, urticaria, picazón, en casos raros, también puede ocurrir edema de los labios, los párpados y la boca, sibilancia o reacciones cutáneas graves (síndrome de Stevens-Johnson, necrólisis epidérmica tóxica).
Al igual que otros medicamentos administrados localmente en los ojos, el timolol se absorbe en la circulación sanguínea, lo que puede causar efectos adversos similares a los observados con la administración oral de beta-bloqueantes.
Los efectos adversos ocurren con menos frecuencia después de la administración de gotas oculares que con la administración oral o parenteral de estos medicamentos.
Entre los efectos adversos adicionales informados, se incluyen reacciones típicas de la clase terapéutica de los beta-bloqueantes utilizados en trastornos oculares:
Desconocida (frecuencia no puede determinarse a partir de los datos disponibles)
Hipoglucemia, insuficiencia cardíaca, trastornos del ritmo cardíaco, dolor abdominal, vómitos, dolor muscular no relacionado con el ejercicio, trastornos de la función sexual, alucinaciones, sensación de cuerpo extraño en el ojo (sensación de que hay algo en el ojo), taquicardia y hipertensión arterial.
Notificación de efectos adversos
Si se producen efectos adversos, incluidos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico.
Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos del Ministerio de Sanidad, Consumo y Bienestar Social,
Calle de Alcalá, 56, 28071 Madrid, teléfono: +34 91 596 34 00, fax: +34 91 596 34 01,
Sitio web: https://www.aemps.gob.es/
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos permite recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar COSOPT PF
Este medicamento debe conservarse fuera del alcance y la vista de los niños.
No debe usar COSOPT PF en bolsas de folio no abiertas después de la fecha de caducidad (seis dígitos después de "EXP") impresa en el embalaje.
La primera parte de la fecha es el mes y la última parte es el año.
La fecha de caducidad es el último día del mes indicado.
No debe conservar a temperaturas superiores a 25°C.
Debe conservar en la bolsa de folio original para protegerlo de la luz.
COSOPT PF puede usarse durante 15 días después de abrir la bolsa.
Después de este tiempo, debe desechar cualquier contenedor de dosis única no utilizado.
El contenedor de dosis única abierto debe desecharse inmediatamente después de su uso, incluso si queda algo de medicamento.
No debe tirar los medicamentos por el desagüe ni a los contenedores de basura domésticos.
Debe preguntar a su farmacéutico cómo eliminar los medicamentos que ya no se utilizan.
Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del embalaje y otra información
Qué contiene COSOPT PF?
- Los principios activos de COSOPT PF son la dorzolamida y el timolol.
En cada mililitro de solución, hay 20 mg de dorzolamida (22,26 mg de clorhidrato de dorzolamida) y 5 mg de timolol (6,83 mg de maleato de timolol).
- Los demás componentes son hidroxietilcelulosa, manitol, citrato de sodio, hidróxido de sodio y agua para inyección.
Cómo es COSOPT PF y qué contiene el embalaje?
COSOPT PF es una solución transparente, incolora o casi incolora, ligeramente viscosa.
Cada bolsa de folio contiene 15 o 10 contenedores de dosis única de polietileno de baja densidad que contienen 0,2 ml de solución.
Tamaños del embalaje:
30 x 0,2 ml (2 bolsas con 15 contenedores de dosis única o 3 bolsas con 10 contenedores de dosis única)
60 x 0,2 ml (4 bolsas con 15 contenedores de dosis única o 6 bolsas con 10 contenedores de dosis única)
120 x 0,2 ml (8 bolsas con 15 contenedores de dosis única o 12 bolsas con 10 contenedores de dosis única)
No todos los tamaños del embalaje pueden estar disponibles.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Santen Oy
Niittyhaankatu 20
33720 Tampere
Finlandia
Fabricante
Fareva Mirabel
Route de Marsat, Riom;
63963 Clermont-Ferrand, Cedex 9
Francia
Santen Oy
Kelloportinkatu 1
33100 Tampere
Finlandia
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) bajo los siguientes nombres:
Cosopt
Finlandia, Francia, Lituania, Portugal, Suecia
Cosopt sin conservante
Eslovenia
Cosopt sin conservantes
Países Bajos
Cosopt libre de conservantes
Rumania
Cosopt Libre
Eslovaquia
Cosopt libre de conservantes
República Checa
Cosopt monodosis
Italia
Cosopt PF
Bulgaria, Letonia, Polonia
Cosopt PF "sin conservante"
Grecia
Cosopt sin conservante
Irlanda, Reino Unido (Irlanda del Norte)
Cosopt-S
Alemania
Cosopt sin
Austria
Cosopt sin conservante
Dinamarca
Cosopt dosis única
Bélgica, Luxemburgo
Cosopt Uno
Hungría
Fecha de la última revisión de la hoja de instrucciones: 09/2023
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorLaboratories Merck Sharp & Dohme – Chibret Santen Oy
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Cosopt PfForma farmacéutica: Gotas, 50 mcg/ml + 5 mg/mlPrincipio activo: timolol, combinationsFabricante: Pharmaselect International Beteiligungs GmbHNo requiere recetaForma farmacéutica: Gotas, (0.3 mg + 5 mg)/mlPrincipio activo: timolol, combinationsRequiere recetaForma farmacéutica: Gotas, 0.3 mg/ml + 5 mg/mlPrincipio activo: timolol, combinationsFabricante: Genetic S.p.ARequiere receta
Alternativas a Cosopt Pf en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Cosopt Pf en Spain
Alternativa a Cosopt Pf en Ukraine
Médicos online para Cosopt Pf
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Cosopt Pf – sujeta a valoración médica y normativa local.














