
Cluvot 250 i.m.

Consulta con un médico sobre la receta médica de Cluvot 250 i.m.

Cómo usar Cluvot 250 i.m.
Hoja de instrucciones del paquete: información para el paciente
Cluvot 250 j.m.
Polvo y disolvente para la preparación de una solución para inyección / infusión
Factor de coagulación sanguínea humano XIII
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o farmacéutico.
- Este medicamento ha sido recetado específicamente para usted. No debe dárselo a otros. El medicamento puede ser perjudicial para otra persona, incluso si los síntomas de su enfermedad son los mismos.
- Si el paciente experimenta algún efecto adverso, incluidos todos los efectos adversos no mencionados en esta hoja de instrucciones, debe informar a su médico o farmacéutico. Véase el punto 4.
Índice de la hoja de instrucciones
- 1. Qué es Cluvot y para qué se utiliza
- 2. Información importante antes de usar Cluvot
- 3. Cómo usar Cluvot
- 4. Posibles efectos adversos
- 5. Cómo almacenar Cluvot
- 6. Contenido del paquete y otra información
1. Qué es Cluvot y para qué se utiliza
Qué es Cluvot
Cluvot es un medicamento que se presenta en forma de polvo blanco y disolvente. La solución preparada debe
ser administrada por inyección intravenosa.
Cluvot es un factor de coagulación sanguínea humano XIII (F XIII) producido a partir de plasma humano (la parte líquida de la sangre) y desempeña un papel importante en el proceso de hemostasia (deteniendo el sangrado).
Para qué se utiliza Cluvot
Cluvot está indicado para su uso en adultos, niños y adolescentes.
- para el tratamiento profiláctico de la deficiencia congénita de factor XIII y
- en el manejo perioperatorio para el tratamiento de sangrados durante procedimientos quirúrgicos en pacientes con deficiencia congénita de factor XIII.
2. Información importante antes de usar Cluvot
Cuándo no usar Cluvot:
- si el paciente es alérgico al principio activo o a alguno de los demás componentes de este medicamento (enumerados en el punto 6).
Debe informar a su médico si tiene sensibilidad a algún medicamento o alimento.
Advertencias y precauciones:
- si después de la administración de factor XIII de coagulación sanguínea han ocurrido reacciones alérgicas en el pasado. Como medida de precaución, se pueden administrar medicamentos antihistamínicos y corticosteroides si así lo decide el médico.
- cuando aparezcan síntomas alérgicos o reacciones de anafilaxia (síntomas alérgicos graves pueden causar dificultad para respirar o mareos). La administración de Cluvot debe interrumpirse de inmediato (es decir, detener la inyección o infusión). En caso de shock anafiláctico, se debe aplicar un tratamiento de acuerdo con los estándares médicos vigentes.
- si ha habido trombosis reciente (coágulo de sangre). Debe monitorearse cuidadosamente al paciente debido al efecto estabilizador de la fibrina de F XIII.
- la formación de inhibidores (anticuerpos que neutralizan) es una complicación conocida del tratamiento y significa que el tratamiento deja de ser efectivo. Si el sangrado no se controla con el medicamento Cluvot, debe informar a su médico de inmediato. El paciente debe ser monitoreado cuidadosamente para detectar el desarrollo de inhibidores.
El médico siempre debe considerar los beneficios del tratamiento en relación con el riesgo de complicaciones.
Seguridad contra los virus
Cuando los medicamentos se producen a partir de sangre o plasma humano, se realizan varias medidas para proteger al paciente contra la transmisión de agentes infecciosos. Estos métodos incluyen:
- selección adecuada de donantes de sangre y plasma para excluir el riesgo de transmisión de agentes infecciosos
- pruebas de cada donación y pool de plasma para detectar marcadores virales / infecciones.
- incorporación de etapas en el proceso de fabricación de productos sanguíneos o de plasma que pueden inactivar o eliminar los virus.
A pesar de la aplicación de los métodos mencionados, no se puede excluir completamente la posibilidad de transmisión de agentes infecciosos después de la administración de un producto medicinal derivado de sangre o plasma humano. Este riesgo también se aplica a virus y agentes infecciosos desconocidos o recién descubiertos. Las medidas de seguridad adoptadas son efectivas contra los virus con envoltura, como el virus de la inmunodeficiencia humana (VIH, el virus que causa el SIDA), el virus de la hepatitis B (VHB, que causa la hepatitis B) y el virus de la hepatitis C (VHC, que causa la hepatitis C), así como contra los virus sin envoltura, como el virus de la hepatitis A (VHA, que causa la hepatitis A) y el parvovirus B19. En pacientes que reciben productos derivados de plasma humano de manera repetida, se debe considerar la vacunación contra la hepatitis A y B. Se recomienda registrar cada vez que se administre Cluvot, la fecha de administración, el número de lote y el volumen administrado en la documentación del paciente.
Cluvot y otros medicamentos
- Debe informar a su médico o farmacéutico sobre la ingesta de otros medicamentos, incluidos aquellos que se pueden obtener sin receta.
- No se conocen interacciones entre el concentrado de factor XIII de coagulación sanguínea y otros productos medicinales.
- Cluvot no debe mezclarse con otros productos medicinales, disolventes o diluyentes, excepto aquellos mencionados en el punto 6, y debe administrarse mediante conjuntos de infusión separados.
Embarazo y lactancia
- Si la paciente está embarazada o en período de lactancia, o si cree que puede estar embarazada o planea tener un hijo, debe consultar a su médico o farmacéutico antes de usar este medicamento.
- Los datos limitados sobre el uso clínico de Cluvot en el embarazo no han mostrado efectos negativos en el embarazo y el desarrollo embrionario y postnatal. En caso de necesidad, puede considerarse el uso de Cluvot durante el embarazo.
- No se conoce el grado de transferencia de Cluvot a la leche materna, pero considerando su gran masa molecular, es poco probable que se excrete en la leche materna, y debido a su naturaleza proteica, la absorción de moléculas intactas por el lactante también es poco probable. Por lo tanto, Cluvot puede usarse durante la lactancia.
- No hay datos sobre el efecto de Cluvot en la fertilidad.
Conducción de vehículos y uso de máquinas
No se han realizado estudios sobre el efecto en la capacidad para conducir vehículos y usar máquinas.
Información importante sobre algunos componentes de Cluvot
Cluvot contiene sodio.
Es importante tener en cuenta que Cluvot contiene sodio. Esto es importante para pacientes con dieta controlada de bajo sodio. Cluvot contiene de 124,4 a 195,4 mg (5,41 a 8,50 mmol) de sodio por dosis (40 j.m. / kg de peso corporal - con un peso corporal promedio de 70 kg), si se administra la dosis recomendada (2800 j.m. = 44,8 ml)
3. Cómo usar Cluvot
- Cluvot generalmente es administrado por un médico.
- Cluvot está indicado exclusivamente para administración intravenosa.
Dosis
El médico debe calcular la dosis adecuada y decidir con qué frecuencia debe administrarse Cluvot al paciente, considerando el progreso del tratamiento.
Recomendaciones más detalladas, véase el punto: "Información destinada exclusivamente al personal médico
o trabajadores de la salud".
Sobredosis
No se han registrado casos de sobredosis y no se espera que ocurran en caso de administración del medicamento por personal médico.
4. Posibles efectos adversos
Como cualquier medicamento, este medicamento puede causar efectos adversos, aunque no todos los pacientes los experimentarán.
Los siguientes efectos adversos se han observado con poca frecuencia(en más de 1 de cada 10,000 pacientes y menos de 1 de cada 1,000)
- Reacciones alérgicas como urticaria generalizada (erupción cutánea con picazón), erupción, hipotensión (que puede causar mareo o sensación de desmayo), dificultad para respirar.
- Aumento de la temperatura corporal
Los siguientes efectos adversos se han observado con mucha poca frecuencia(en menos de 1 de cada 10,000 pacientes):
- Formación de inhibidores de FXIII.
Si aparecen reacciones alérgicas, la administración del medicamento Cluvot debe interrumpirse de inmediato y debe iniciarse un tratamiento adecuado. Debe aplicarse el tratamiento estándar para el shock anafiláctico.
Efectos adversos en niños y adolescentes
Se espera que los efectos adversos en niños sean los mismos que en adultos.
Notificación de efectos adversos
Si ocurren algún efecto adverso, incluidos todos los efectos adversos no mencionados en la hoja de instrucciones, debe informar a su médico o farmacéutico. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Efectos Adversos de Medicamentos del Registro de Medicamentos, Dispositivos Médicos y Productos Biocidas Al. Jerozolimskie 181C, 02-222 Varsovia Tel.: +48 22 49 21 301 Fax: +48 22 49 21 309 Sitio web: https://smz.ezdrowie.gov.pl Los efectos adversos también pueden notificarse al titular de la responsabilidad. La notificación de efectos adversos permitirá recopilar más información sobre la seguridad del medicamento.
5. Cómo almacenar Cluvot
- Conservar en refrigerador (2 °C - 8 °C).
- No congelar.
- Conservar en el embalaje exterior para protegerlo de la luz.
- Cluvot no contiene conservantes. El medicamento debe usarse inmediatamente después de la reconstitución. Si no se usa de inmediato, el almacenamiento a temperatura ambiente no debe exceder las 4 horas. No almacenar en refrigerador ni congelar la solución después de la reconstitución.
- El medicamento debe almacenarse en un lugar fuera del alcance de los niños.
- No usar Cluvot después de la fecha de caducidad indicada en la etiqueta y el embalaje exterior después de la abreviatura EXP.
- El número de lote del producto medicinal está en el embalaje exterior y la etiqueta después de la abreviatura: Lote.
6. Contenido del paquete y otra información
Qué contiene Cluvot Sustancia activa:
Concentrado de factor XIII de coagulación sanguínea humano (FXIII) que contiene 250 j.m. por vial.
Excipientes:
Albumina humana, glucosa monohidratada, cloruro de sodio, hidróxido de sodio (en pequeñas cantidades para ajustar el pH).
Disolvente:Agua para inyección
Cómo se presenta Cluvot y qué contiene el paquete
Cluvot se presenta en forma de polvo blanco y disolvente adjunto, que es agua para inyección. La solución preparada debe ser incolora, clara o ligeramente opalescente. Al observarla a la luz, no debe ser turbia ni contener restos (coágulos / partículas).
Tamaños de los paquetes
Un paquete de 250 j.m. contiene:
1 vial con polvo
1 vial con 4 ml de agua para inyección
1 sistema de transferencia 20/20 con filtro (Mix2Vial)
Conjunto para administración (embalaje interior):
1 jeringa de un solo uso de 5 ml
1 conjunto para punción
2 algodones empapados en alcohol
1 parche no estéril
Titular de la responsabilidad y Fabricante
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburgo
Alemania
Fecha de la última actualización de la hoja de instrucciones:agosto 2021
----------------------------------------------------------------------------------------------------------------------
Información destinada exclusivamente al personal médico especializado: Dosis
1 ml equivale aproximadamente a 62,5 j.m., y 100 j.m. es equivalente a aproximadamente 1,6 ml.
Importante:
La cantidad necesaria para la administración y la frecuencia de administración deben adaptarse siempre a la eficacia clínica en cada paciente.
Dosis
La dosis debe determinarse individualmente en función del peso corporal, los resultados de las pruebas de laboratorio y el estado clínico del paciente.
Esquema de dosificación de rutina para la profilaxis
- 40 unidades internacionales (j.m.) por kilogramo de peso corporal.
- La velocidad de infusión no debe ser superior a 4 ml por minuto
Dosis posteriores
- La dosis debe determinarse en función del nivel actual de actividad de FXIII, y las dosis deben administrarse a intervalos de 28 días (4 semanas) para mantener la actividad mínima de F XIII en un nivel de aproximadamente 5 a 20%.
- El ajuste de la dosis recomendado de +/- 5 j.m. por kg de peso corporal debe calcularse en función del nivel mínimo de actividad de F XIII, como se muestra en la tabla 1, y del estado clínico del paciente.
- El ajuste de la dosis debe realizarse en función de una prueba específica y sensible utilizada para determinar el nivel de F XIII. Los ejemplos de ajuste utilizando la prueba de actividad Berichrom se presentan en la tabla 1 siguiente.
Tabla 1: Ajuste de la dosis utilizando la prueba de actividad Berichrom
La actividad se expresa en unidades y se determina utilizando la prueba de actividad Berichrom, que se refiere al Estándar Internacional actual para el factor XIII de coagulación sanguínea. Por lo tanto, la unidad equivale a la Unidad Internacional.
Profilaxis preoperatoria.
| Nivel mínimo de actividad del factor XIII (%) | Cambio en la dosis |
| Un nivel mínimo por debajo de 5% | Aumento de 5 unidades por kg. |
| Nivel mínimo de 5% a 20% | Sin cambios |
| Dos niveles mínimos por encima de 20% | Disminución de 5 unidades por kg. |
| Un nivel mínimo por encima de 25% | Disminución de 5 unidades por kg. |
Después de la última dosis administrada en la profilaxis de rutina, en caso de un procedimiento quirúrgico planeado:
- Entre el día 21 y el día 28 después de la última dosis, se debe administrar al paciente una dosis completa justo antes del procedimiento quirúrgico, y la siguiente dosis de profilaxis se debe administrar 28 días después.
- Entre el día 8 y el día 21 después de la última dosis, se puede administrar una dosis adicional (completa o parcial) antes del procedimiento quirúrgico. La dosis debe basarse en el nivel de actividad de FXIII del paciente, su estado clínico y debe determinarse de acuerdo con el período de semivida del producto medicinal Cluvot.
- Dentro de los 7 días después de la última dosis, es posible que no se necesite una dosis adicional.
El ajuste de la dosis puede ser diferente al de la dosis recomendada y debe determinarse individualmente en función del nivel de actividad de F XIII y del estado clínico del paciente. Todos los pacientes deben ser monitoreados cuidadosamente durante y después del procedimiento quirúrgico.
Por lo tanto, se recomienda monitorear el aumento del nivel de actividad de F XIII en función de una prueba del factor XIII. En caso de procedimientos quirúrgicos graves y sangrados importantes, el objetivo debe ser alcanzar valores cercanos a los normales (personas sanas: 70%-140%).
Niños y adolescentes
La dosis y la forma de administración en niños y adolescentes se basan en el peso corporal y, en general, no difieren de las pautas para adultos. La dosis y / o la frecuencia de administración para cada paciente deben determinarse siempre en función de la eficacia clínica y del nivel de actividad de FXIII.
Pacientes de edad avanzada
La dosis y la forma de administración en pacientes de edad avanzada (> 65 años) no se han documentado en estudios clínicos.
Forma de administración
Pautas generales
La solución debe ser clara o ligeramente opalescente. Después de la filtración / extracción del contenido del vial (véase a continuación), el producto después de la reconstitución antes de la administración debe someterse a una evaluación visual; debe comprobarse si hay alguna contaminación o cambio de color.
No se deben usar soluciones turbias ni aquellas que contengan coágulos o partículas.
La reconstitución y la extracción del vial deben realizarse en condiciones asépticas.
Reconstitución
Llevar el disolvente a temperatura ambiente. Retirar las tapas de plástico de los viales que contienen el polvo y el disolvente y limpiar los tapones con una solución aséptica. Después de que se sequen, abrir el sistema que contiene el conector Mix2Vial.
1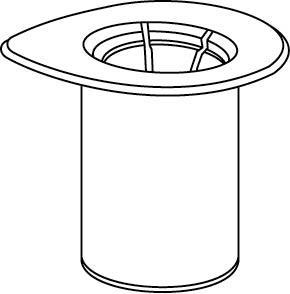 |
|
2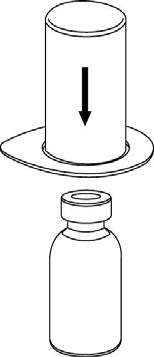 |
|
3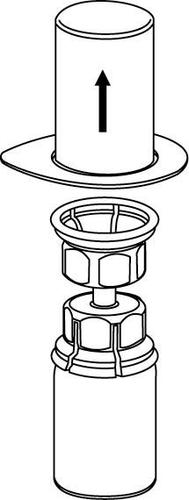 |
|
4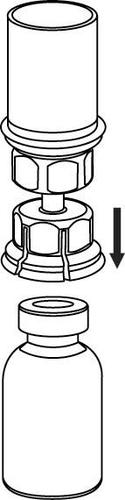 |
|
5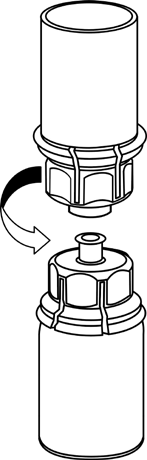 |
|
6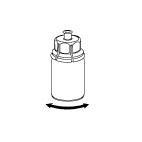 |
|
7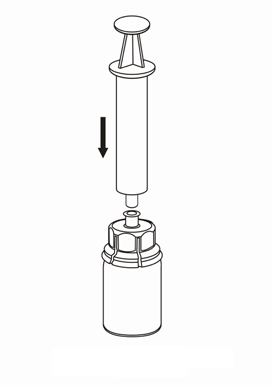 |
|
Extracción y forma de administración
8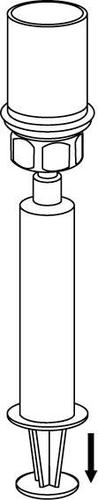 |
|
9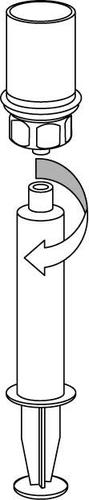 |
|
Debe tener cuidado para que la sangre no entre en la jeringa llena de producto medicinal, ya que existe el riesgo de que la sangre se coagule en la jeringa y que los coágulos de fibrina se administren al paciente.
La solución después de la reconstitución debe administrarse en conjuntos de inyección / infusión separados (suministrados con el producto), en una inyección intravenosa lenta, con una velocidad no superior a 4 ml por minuto.
Todo producto medicinal no utilizado y sus residuos deben eliminarse de acuerdo con los requisitos locales.
- País de registro
- Principio activo
- Requiere recetaSí
- Fabricante
- ImportadorCSL Behring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a Cluvot 250 i.m.Forma farmacéutica: Polvo, 1250 UIPrincipio activo: coagulation factor XIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 1000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere recetaForma farmacéutica: Polvo, 2000 UIPrincipio activo: factor de coagulación VIIIFabricante: CSL Behring GmbHRequiere receta
Alternativas a Cluvot 250 i.m. en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Cluvot 250 i.m. en Hiszpania
Médicos online para Cluvot 250 i.m.
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Cluvot 250 i.m. – sujeta a valoración médica y normativa local.














