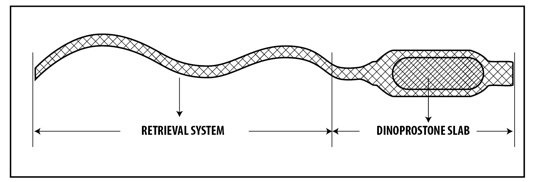
Cómo usar Cervidil
Hoja de instrucciones del paquete: información para el paciente
Cervidil, 10 mg, sistema terapéutico vaginal
Dinoprostona
Es importante leer atentamente el contenido de la hoja de instrucciones antes de usar el medicamento, ya que contiene información importante para el paciente.
- Debe conservar esta hoja de instrucciones para poder volver a leerla si es necesario.
- En caso de dudas, debe consultar a su médico o enfermera.
- Si el paciente experimenta algún efecto adverso, incluidos aquellos no mencionados en esta hoja de instrucciones, debe informar a su médico o enfermera. Véase el punto 4.
- Cervidil debe usarse solo bajo la supervisión de un profesional de la salud calificado.
Índice de la hoja de instrucciones:
- 1. Qué es Cervidil y para qué se utiliza
- 2. Información importante antes de usar Cervidil
- 3. Cómo usar Cervidil
- 4. Posibles efectos adversos
- 5. Cómo conservar Cervidil
- 6. Contenido del paquete y otra información
1. Qué es Cervidil y para qué se utiliza
Cervidil contiene la sustancia activa dinoprostona 10 mg y se utiliza para facilitar el inicio del parto, siempre y cuando se hayan completado 37 semanas de embarazo. La dinoprostona relaja la parte del canal de parto llamada cuello uterino, para permitir que el bebé pase. Puede haber varias razones por las que la paciente necesite ayuda para iniciar este proceso. Debe preguntar a su médico si desea obtener más información.
2. Información importante antes de usar Cervidil
Cuándo no usar Cervidil
El medicamento Cervidil no se administrará:
- si el tamaño de la cabeza del bebé puede causar problemas durante el parto
- si el bebé no está en la posición correcta en el útero para un parto vaginal
- si el estado de salud del bebé es insatisfactorio y/o si el bebé está en peligro
- si la paciente ha tenido una operación o una rotura del cuello uterino en el pasado
- si la paciente tiene una infección pélvica no tratada (infección del útero, ovarios, trompas de Falopio y/o cuello uterino)
- si la placenta cubre el canal de parto
- si la paciente tiene sangrado vaginal inexplicado durante el embarazo actual
- si la paciente ha tenido operaciones en el útero, incluyendo cesáreas
- si la paciente es alérgica a la dinoprostona o a cualquier otro componente de este medicamento (enumerado en el punto 6).
El médico o la enfermera no administrará Cervidil o lo retirará si ya ha sido administrado:
- después de que haya comenzado el parto
- si la paciente requiere la administración de un medicamento, como la oxitocina, para ayudar a avanzar el parto
- si las contracciones son demasiado fuertes o prolongadas
- si el bebé está en peligro
- si la paciente experimenta efectos adversos (véase el punto 4. Posibles efectos adversos).
La experiencia con Cervidil en pacientes con membranas rotas es limitada. Si Cervidil ya ha sido administrado, el médico o la enfermera lo retirará cuando se rompan las membranas o se planee una rotura artificial por el médico o la enfermera.
Advertencias y precauciones
Antes de comenzar a usar Cervidil, debe informar a su médico o enfermera si alguna de las siguientes situaciones se aplica a la paciente:
- si la paciente tiene asma (dificultad para respirar) o glaucoma (enfermedad de los ojos)
- si la paciente ha tenido contracciones demasiado fuertes o prolongadas en un embarazo anterior
- si la paciente tiene una enfermedad pulmonar, hepática o renal
- si la paciente tiene más de un hijo
- si la paciente ha tenido más de tres partos a término
- si la paciente está tomando un medicamento para el dolor o la inflamación que contenga un medicamento antiinflamatorio no esteroideo (AINE), como la aspirina
- si la paciente tiene 35 o más años, si ha habido complicaciones durante el embarazo, como diabetes, presión arterial alta y niveles bajos de hormonas tiroideas (hipotiroidismo), o si el embarazo ha durado más de 40 semanas debido al aumento del riesgo de desarrollar coagulación intravascular diseminada, una enfermedad rara que afecta la coagulación de la sangre.
Niños y adolescentes
No se ha estudiado el uso de Cervidil en niños y adolescentes menores de 18 años.
Cervidil y otros medicamentos
Debe informar a su médico o enfermera sobre todos los medicamentos que la paciente esté tomando actualmente o recientemente, así como sobre cualquier medicamento que la paciente planea tomar. Cervidil puede hacer que la paciente sea más sensible a los medicamentos que estimulan las contracciones uterinas, que se utilizan para fortalecer las contracciones. No se recomienda administrar estos medicamentos junto con Cervidil.
Embarazo y lactancia
Cervidil se utiliza para facilitar el inicio del parto a término. No se debe usar Cervidil en otros momentos del embarazo. No se ha estudiado el uso de Cervidil durante la lactancia. Cervidil puede pasar a la leche materna, pero se supone que las cantidades y el tiempo de paso son limitados y no deberían ser un obstáculo para la lactancia. No se ha observado ningún efecto en los recién nacidos lactados.
Conducción de vehículos y uso de máquinas
No se aplica, ya que Cervidil se utiliza solo en relación con el parto.
3. Cómo usar Cervidil
Cervidil se administrará a la paciente por personal médico capacitado en un hospital o clínica equipados con dispositivos para monitorear el estado de la paciente y su bebé. El médico o la enfermera colocará un sistema terapéutico vaginal (un inserto vaginal) en la vagina de la paciente cerca del cuello uterino. La paciente no lo hará sola. Antes de colocar el inserto en la vagina, el médico o la enfermera pueden cubrir el inserto con una pequeña cantidad de gel lubricante. Se dejará una tira de la cinta fuera de la vagina para facilitar la extracción del inserto cuando sea necesario. La paciente estará acostada durante este procedimiento y deberá permanecer acostada durante aproximadamente 20-30 minutos después de la colocación del inserto de Cervidil. Después de la colocación en la vagina, el inserto absorbe la humedad, lo que permite la liberación lenta de dinoprostona. Mientras el inserto esté en la vagina ayudando a iniciar el parto, la paciente será examinada regularmente, incluyendo:
- la dilatación del cuello uterino,
- las contracciones uterinas,
- el dolor del parto y el estado de salud del bebé.
Dependiendo del progreso del parto, el médico o la enfermera decidirá cuánto tiempo debe permanecer Cervidil en la vagina. Cervidil puede permanecer en la vagina durante un máximo de 24 horas. Al retirar el inserto de la vagina, estará aumentado de 2 a 3 veces su tamaño original y será elástico.
Uso de Cervidil durante más tiempo del recomendado
Si Cervidil se usa durante más tiempo del recomendado, puede provocar contracciones uterinas más fuertes o poner en peligro al bebé. En este caso, se retirará inmediatamente el inserto de Cervidil.
4. Posibles efectos adversos
Como cualquier medicamento, Cervidil puede causar efectos adversos, aunque no todos los pacientes los experimentarán. Frecuentes:pueden ocurrir en hasta 1 de cada 10 pacientes:
- Contracciones uterinas más fuertes con o sin efecto en el bebé
- El estado de salud del bebé puede estar en peligro y/o el pulso del bebé puede ser más rápido o más lento de lo normal
- Cambio en la coloración de las aguas fetales
Poco frecuentes:pueden ocurrir en hasta 1 de cada 100 pacientes:
- Dolor de cabeza
- Presión arterial baja
- Dificultad para respirar en el recién nacido después del nacimiento
- Niveles altos de bilirrubina en el recién nacido, un producto de descomposición de las células sanguíneas, que puede causar ictericia en la piel y los ojos
- Picazón
- Sangrado vaginal excesivo después del parto
- Separación de la placenta de la pared uterina antes del nacimiento del bebé
- Estado general debilitado del recién nacido inmediatamente después del nacimiento
- Progreso lento del parto
- Infección de las membranas que recubren el interior del útero
- La útero de la madre no se contrae después del parto debido a la falta de contracciones uterinas normales
- Sensación de ardor en la zona genital
- Fiebre
Frecuencia desconocida: la frecuencia no puede determinarse a partir de los datos disponibles
- Muerte fetal, parto de un feto muerto y muerte del recién nacido; especialmente después de eventos graves, como la rotura del útero.
- Coagulación intravascular diseminada - una enfermedad rara que afecta la coagulación de la sangre. Puede causar la formación de coágulos y aumentar el riesgo de sangrado.
- El líquido amniótico que rodea al bebé durante el embarazo puede entrar en la circulación sanguínea de la madre durante el parto y bloquear los vasos sanguíneos, lo que puede provocar un estado llamado síndrome de anafilaxia amniótica, que puede incluir síntomas como dificultad para respirar, presión arterial baja, ansiedad y escalofríos; trastornos de coagulación graves, convulsiones, coma, sangrado y líquido en los pulmones, peligro para la vida del feto, como una frecuencia cardíaca lenta.
- Reacciones de hipersensibilidad y reacciones alérgicas graves (anafilaxia), que pueden incluir: dificultad para respirar, respiración superficial, pulso débil y rápido, mareo, picazón, enrojecimiento de la piel y erupción cutánea.
- Dolor abdominal
- Náuseas
- Vómitos
- Diarrhea
- Picazón en la zona genital
- Rotura del músculo uterino
Notificación de efectos adversos
Si ocurren cualquier efecto adverso, incluidos aquellos no mencionados en la hoja de instrucciones, debe informar a su médico o enfermera. Los efectos adversos pueden notificarse directamente al Departamento de Vigilancia de Medicamentos de la Agencia Reguladora de Medicamentos:
Calle Jerozolimskie 181C, 02-222 Varsovia
Tel: +48 22 49 21 301
Fax: +48 22 49 21 309
Sitio web: https://smz.ezdrowie.gov.pl.
Los efectos adversos también pueden notificarse al titular de la autorización de comercialización.
La notificación de efectos adversos puede ayudar a recopilar más información sobre la seguridad del medicamento.
5. Cómo conservar Cervidil
El medicamento debe conservarse en un lugar donde no pueda ser visto ni alcanzado por los niños.
No use este medicamento después de la fecha de caducidad que aparece en el paquete de aluminio y en la caja de cartón después de "EXP". La fecha de caducidad es el último día del mes indicado.
El número de lote está después de "Lote".
Conservar en congelador (entre -10°C y -25°C). Conservar en el embalaje original para protegerlo de la humedad.
No deseche los medicamentos por el desagüe ni en los contenedores de basura domésticos. Después de su uso, el médico o la enfermera eliminará el producto completo como residuo clínico. Este procedimiento ayudará a proteger el medio ambiente.
6. Contenido del paquete y otra información
Qué contiene Cervidil
- La sustancia activa del medicamento es dinoprostona. Cada sistema terapéutico vaginal contiene 10 mg de dinoprostona, que se libera a una velocidad de aproximadamente 0,3 mg por hora durante 24 horas. Los demás componentes son:
- Polímero hidrogel que contiene: macrogol 8000, 1,2,6-hexanotriol, 4,4'-diisocianato de ciclohexilometano, cloruro de hierro
- Hilo de poliéster
Cómo se presenta Cervidil y qué contiene el paquete
El sistema terapéutico vaginal es un pequeño inserto vaginal de plástico rectangular, colocado en un aplicador de tejido para facilitar la extracción del inserto de la vagina. El inserto de plástico es un polímero hidrogel que se hincha en presencia de humedad y libera dinoprostona. El aplicador tiene una tira larga que permite al médico o la enfermera retirar el inserto de la vagina cuando sea necesario. Cada sistema terapéutico vaginal se coloca individualmente en una bolsa de plástico sellada producida con una cinta laminada de aluminio/poliéster y se empaqueta en una caja de cartón. El paquete contiene 5 sistemas terapéuticos vaginales.
Titular de la autorización de comercialización y fabricante
Titular de la autorización de comercialización
Ferring GmbH
Wittland 11
D-24109 Kiel
Alemania
Fabricantes
Ferring GmbH
Wittland 11
D-24109 Kiel
Alemania
Este medicamento está autorizado en los estados miembros del Espacio Económico Europeo y en el Reino Unido (Irlanda del Norte) con los siguientes nombres:
Austria
PROPESS 10 mg sistema de liberación vaginal
Bélgica
PROPESS 10 mg dispositivo para uso vaginal, PROPESS 10 mg sistema de difusión, PROPESS 10 mg sistema de liberación de principio activo vaginal
Bulgaria
ПРОПЕС 10 mg вагинален лекарствен систем / PROPESS 10 mg sistema de liberación vaginal
Croacia
Propess 10 mg sistema para administración vaginal
Chipre
Propess
Dinamarca
Propess, inserto vaginal
Estonia
Finlandia
Propess
Propess 10 mg preparado de liberación prolongada para administración vaginal
Francia
PROPESS 10 mg, sistema de difusión vaginal
Grecia
PROPESS 10 mg σύστημα ενδοκολπικής χορήγησης
Eslovaquia
Cervidil
Eslovenia
Propess 10 mg sistema de liberación vaginal
España
PROPESS 10 mg sistema de liberación vaginal
Hungría
Propess 10mg hüvelyben alkalmazott gyógyszerleadó rendszer
Irlanda
Propess 10 mg sistema de liberación vaginal
Italia
PROPESS 10 mg – Dispositivo vaginal
Letonia
Propess
Lituania
Propess
Luxemburgo
PROPESS 10 mg système de diffusion vaginal
Malta
Propess
Países Bajos
Propess, sistema de administración vaginal 10 mg
Polonia
Cervidil
Portugal
PROPESS 10 mg, Sistema de libertação vaginal
Reino Unido
PROPESS 10 mg sistema de liberación vaginal
República Checa
CERVIDIL
Rumania
PROPESS 10 mg/24 ore sistem cu cedare vaginală
Suecia
Propess 10 mg inserto vaginal
Fecha de la última revisión de la hoja de instrucciones: 09/2021
--------------------------------------------------------------------------------------------------------------------------------Información destinada solo al personal médico:
INSTRUCCIONES DE USO
Introducción
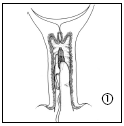
- 1. Para retirar Cervidil de su paquete, primero debe romper la bolsa a lo largo de la parte superior. No debe usar tijeras ni instrumentos afilados para cortar la bolsa, ya que esto puede dañar el producto. Debe agarrar el aplicador para retirar suavemente el producto de la bolsa. Sosteniendo el sistema terapéutico vaginal entre el dedo índice y el dedo medio, introdúzcalo en la vagina. Si es necesario, puede usar una pequeña cantidad de lubricante soluble en agua.
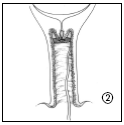
- 2. Cervidil se coloca transversalmente, alto en el fondo de la vagina.
- 3. Debe dejar una parte de la tira (aproximadamente 2 cm) sobresaliendo de la vagina para facilitar la extracción del sistema terapéutico vaginal cuando sea necesario. Si es necesario, la tira se puede acortar más.
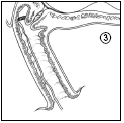
- 4. Debe asegurarse de que la paciente esté acostada o sentada durante 20-30 minutos después de la colocación del inserto, para permitir que se hinche.
Retirada
Cervidil se puede retirar rápidamente y con facilidad tirando suavemente de la tira del aplicador. Después de la retirada, debe asegurarse de que todo el producto (sistema terapéutico y aplicador) haya sido retirado de la vagina.
- País de registro
- Principio activo
- Requiere recetaNo
- Fabricante
- ImportadorFerring GmbH
- Esta información ha sido traducida con IA y es solo orientativa. No constituye asesoramiento médico. Consulta siempre con un médico antes de tomar cualquier medicamento.
- Alternativas a CervidilForma farmacéutica: Gel, 0.5 mg/3 gPrincipio activo: DinoprostonaNo requiere recetaForma farmacéutica: Gel, 500 mcg/3 gPrincipio activo: DinoprostonaNo requiere recetaForma farmacéutica: Comprimidos, 25 mcgPrincipio activo: MisoprostolRequiere receta
Alternativas a Cervidil en otros países
Las mejores alternativas con el mismo principio activo y efecto terapéutico.
Alternativa a Cervidil en Украина
Alternativa a Cervidil en Испания
Médicos online para Cervidil
Consulta sobre dosis, efectos secundarios, interacciones, contraindicaciones y renovación de la receta de Cervidil – sujeta a valoración médica y normativa local.